La retención renal de sodio y agua, con la consiguiente expansión y redistribución del volumen de líquido extracelular, constituye una de las principales características fisiopatológicas de la insuficiencia cardiaca. No obstante, la detección, monitorización y manejo de la congestión continúa representando un verdadero desafío para el clínico. En el presente documento se revisa la literatura histórica y contemporánea acerca de los métodos disponibles para evaluar la congestión desde una perspectiva clínica e integradora, y se discuten aspectos farmacológicos y principios fisiopatológicos fundamentales para el uso óptimo de la terapia con diuréticos.
Renal sodium and water retention with resulting extracellular volume expansion and redistribution are hallmark features of heart failure syndromes. However, congestion assessment, monitoring, and treatment represent a real challenge in daily clinical practice. This document reviewed historical and contemporary evidence of available methods for determining volume status and discuss pharmacological aspects and pathophysiological principles that underlie diuretic use.
La pertinencia de esta revisión se fundamenta en:
- -
Congestión como fenómeno fisiopatológico clave responsable en gran medida de las manifestaciones clínicas y morbimortalidad asociada con la insuficiencia cardiaca.
- -
Escaso rendimiento diagnóstico de los síntomas y signos clásicos en la valoración de la congestión.
- -
Escaso entendimiento de la complejidad fisiopatológica de la congestión, hecho que explica la gran variabilidad fenotípica al respecto.
- -
Abordaje terapéutico en gran medida empírico. En este sentido, y desde una vertiente fisiopatológica y clínica, proponemos una revisión detallada y actualizada de los diferentes agentes y estrategias terapéuticas utilizadas.
- -
El papel cada vez más prevalente del síndrome cardiorrenal.
La insuficiencia cardiaca (IC) constituye un problema creciente de salud pública. La incidencia, prevalencia y morbimortalidad asociada a este síndrome es elevada y constituye el paradigma del paciente crónico que sufre frecuentes descompensaciones1. La mayoría de estas descompensaciones se deben al desarrollo de síntomas atribuibles a congestión2. En este escenario, los diuréticos son el pilar fundamental del tratamiento3. No obstante, existe gran incertidumbre sobre cómo, cuánto y donde administrarlos.
El objetivo de este documento es profundizar en aspectos clínicos, fisiopatológicos y farmacológicos desde una perspectiva integradora que contribuya a mejorar el entendimiento de la congestión y la optimización de su tratamiento.
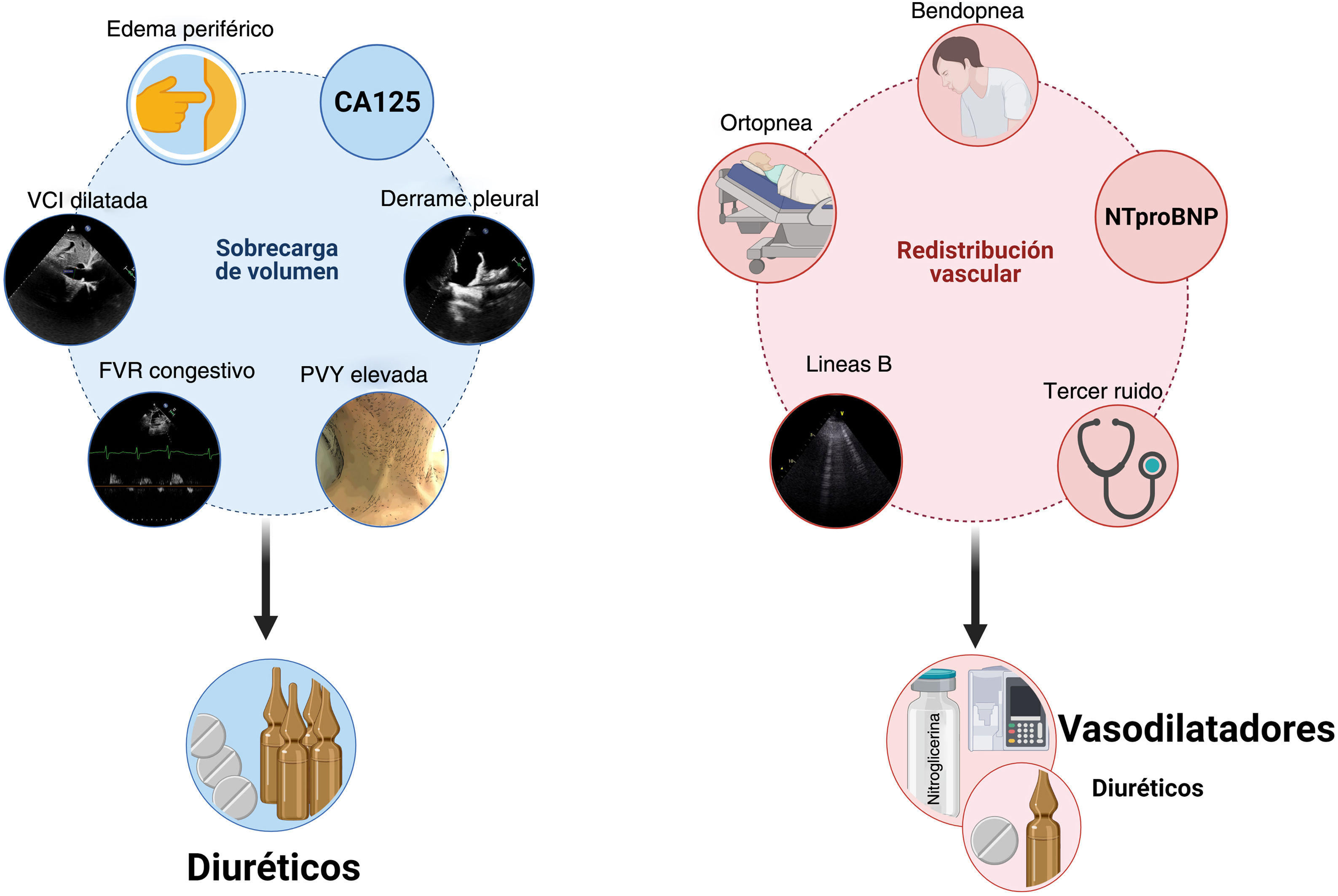
Diagnóstico y caracterización de la congestión en ICLa congestión en IC se define como el acúmulo de líquido en el compartimento intravascular y extravacular como resultado del aumento de las presiones de llenado. No obstante, congestión no es sinónimo de sobrecarga de volumen4. El concepto redistribución vascular sugiere que el aumento en el tono venoso (por activación neurohormonal, isquemia miocárdica, episodios hipertensivos, cambios de medicación, etc.) puede precipitar una rápida redistribución de líquido desde un reservorio venoso periférico (p. ej., lecho esplácnico) a la circulación cardiopulmonar central, aumentando la presión hidrostática intravascular sin aumento del volumen de agua corporal5. En este escenario, la terapia vasodilatadora podría ser más apropiada que la intervención diurética agresiva (fig. 1). Por el contrario, la sobrecarga de volumen es un fenómeno más larvado que resulta de la avidez de sodio y agua en el túbulo renal, y del desequilibrio entre las presiones hidrostática y oncótica del compartimiento intravascular e intersticial6. Si bien la mayoría de los pacientes con IC descompensada presentan una combinación de ambas, identificar el fenotipo predominante puede determinar la estrategia terapéutica más adecuada (fig. 1). Es de resaltar que los tradicionales síntomas y signos para evaluar la congestión ofrecen una rentabilidad diagnóstica muy limitada para la caracterización y cuantificación de su severidad7,8.
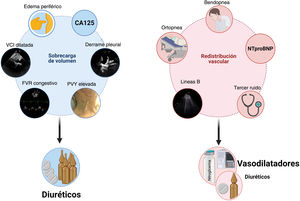
Integración de métodos clínicos, biomarcadores y técnicas de imagen para distinguir entre congestión debida a sobrecarga de volumen vs. redistribución vascular.
CA125: antígeno carbohidrato 125; FVR: flujo venoso renal; NTproBNP: fragmento N-terminal del péptido natriurético tipo B; PVY: presión venosa yugular; VCI: vena cava inferior.
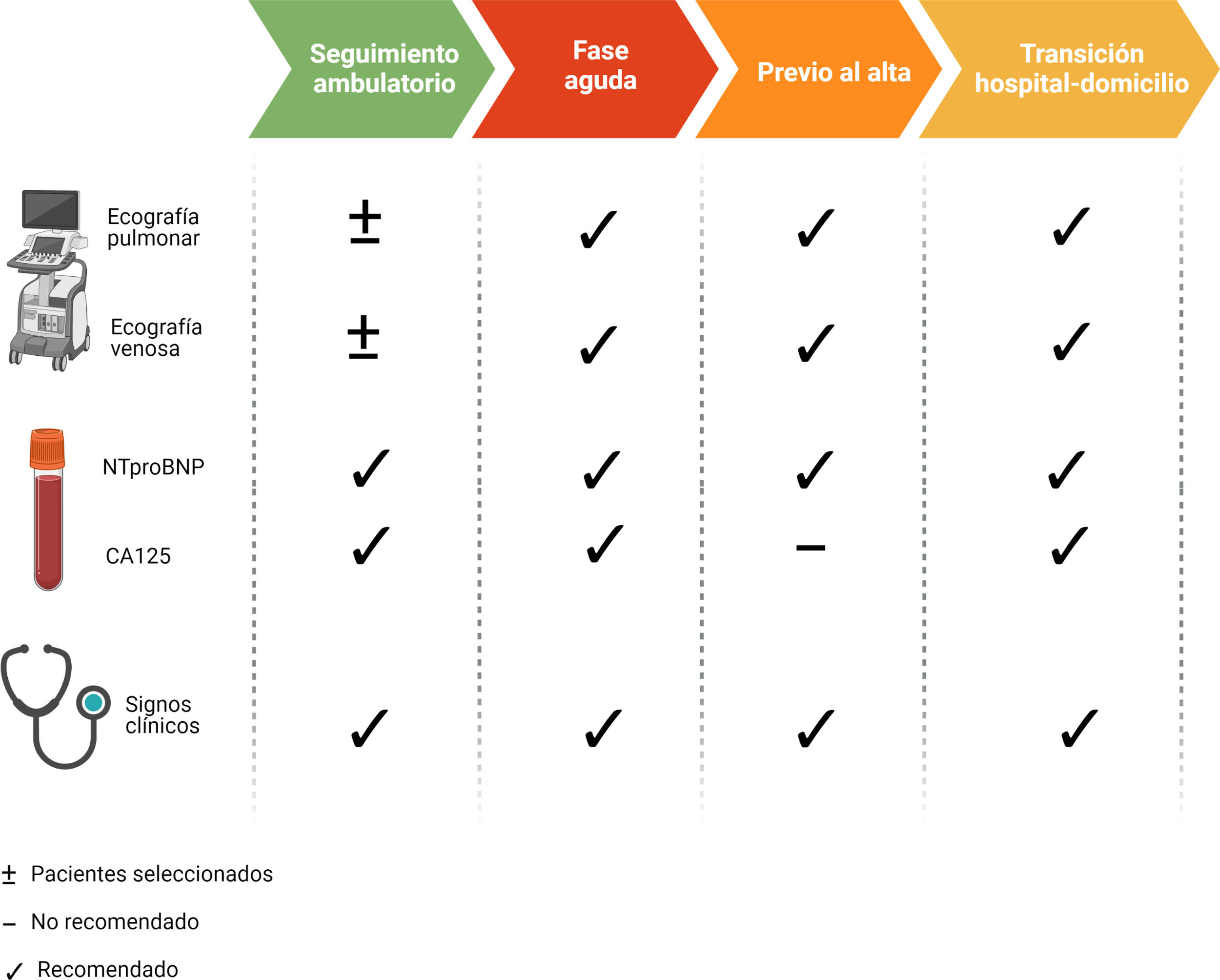
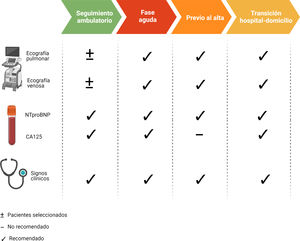
El cateterismo derecho es el método más específico para evaluar el grado de congestión intravascular. No obstante, fuera del ámbito de los cuidados críticos cardiológicos o con fines específicos como la evaluación hemodinámica previa al implante de dispositivos de asistencia ventricular o pre-trasplante cardiaco, la medición invasiva de presiones no se utiliza de forma rutinaria9. Del mismo modo, a pesar de que la monitorización remota de la presión arterial pulmonar a través de un dispositivo inalámbrico implantado en la arteria pulmonar ha mostrado resultados clínicos muy prometedores en pacientes seleccionados10,11, el coste de estos dispositivos es la principal limitación para su uso. Por ello, es necesario integrar parámetros clínicos, biomarcadores y técnicas de imagen (tabla 1).
Métodos clínicos, ecográficos y biomarcadores para evaluar la congestión en pacientes con insuficiencia cardíaca: evidencias y limitaciones
| Correlación con presiones invasivas | Valor diagnóstico | Valor pronóstico | Monitorización | Limitaciones | Ventajas | |
|---|---|---|---|---|---|---|
| Signos y síntomas | ||||||
| Presión venosa yugular > 12 mmHg | Alta113 | Alto113 | Sí114 | Sí | Experiencia del observador - Hábito corporal / obesidad | Buena sensibilidad y especificidad115 |
| Ortopnea | Alta113 | Moderado115 | Evidencia limitada28 | -- | Puede ser de origen no cardíaco | Evaluación rápida |
| Bendopnea | Evidencia limitada116 | Moderado117 | Sí118 | No | Hábito corporal / obesidad | Evaluación rápida |
| Tercer ruido cardiaco | -- | Bajo119 | Sí120 | No | Baja concordancia entre observadores121 | Valor pronóstico120 |
| Crepitantes | Baja122 | Bajo117 | -- | Utilidad limitada | Baja especificidad y sensibilidad115 | Evaluación rápida |
| Edema periférico | Baja122 | Moderado117 | Evidencia limitada28 | Utilidad limitada | Puede ser de origen no cardíaco115 | Evaluación rápida |
| Biomarcadores | ||||||
| NTproBNP | Moderado123 | Moderado/bajo115,124 | Sí125 | Sí126 | Interacción con edad, función renal127 | Evidencia sólida |
| CA125 | Alta128–130 | Alto19,131 | Sí132 | Sí20 | Vida media larga / Puede ser de origen no cardíaco | Bajo coste / disponibilidad |
| Ecografía | ||||||
| Ecografía pulmonar | Moderada133 | Alto24,26 | Si25,134,135 | Si27 | Puede ser de origen no cardíaco / disponibilidad | Alta sensibilidad / reproducible |
| Vena cava inferior | Moderada136,137 | Moderado131,138,139 | Si140 | Si141 | Disponibilidad / Hábito corporal / obesidad | Evaluación rápida |
| Ecografía Doppler renal | Moderada34,142 | Evidencia limitada | Sí34,143,144 | Sí143,145 | Disponibilidad / Hábito corporal / Experiencia del observador | Reproducible |
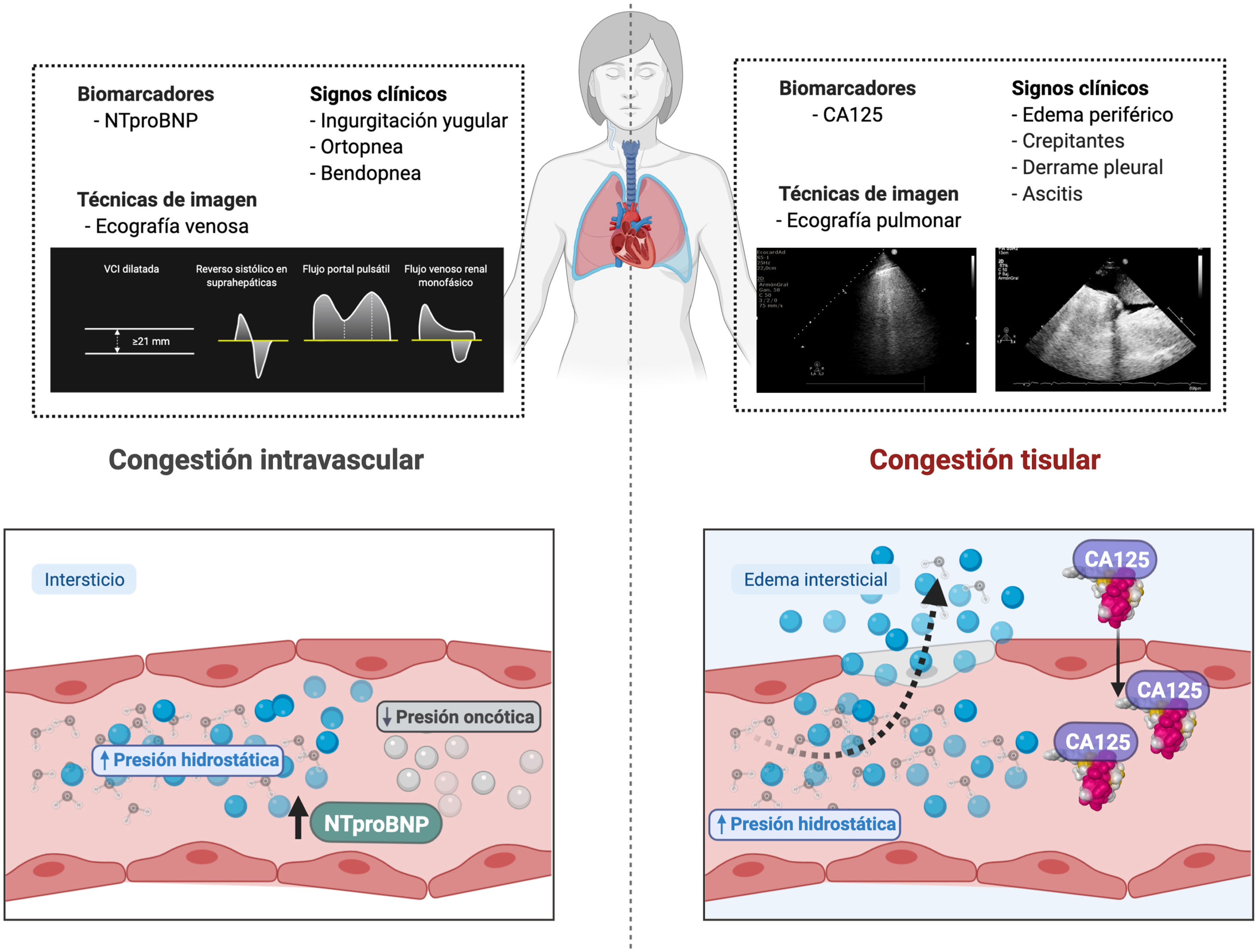
La distención venosa yugular, la ortopnea y la bendopnea son variables clínicas asociadas al incremento en la presión venosa central y que proporcionan un aceptable rendimiento diagnóstico12. Así mismo, la presencia de niveles elevados de los péptidos natriuréticos en un contexto clínico apropiado sugiere aumento en las presiones de llenado izquierdas13,14. Con respecto a las técnicas de imagen, la ecografía venosa ha surgido como una herramienta útil y no invasiva. Mas allá de la medición del diámetro de la vena cava inferior como parámetro indirecto de la presión venosa central, el análisis de las ondas venosas mediante Doppler en la vena porta, las venas hepáticas y las venas intrarrenales aporta información adicional sobre la distensibilidad del sistema venoso en respuesta a la congestión venosa15 (fig. 2).
Valoración multiparamétrica de la congestión. La figura muestra los signos clínicos, biomarcadores y técnicas de imagen que se han establecido como marcadores de congestión. Algunos son más indicativos de congestión tisular, mientras que otros lo son de congestión intravascular.CA125: antígeno carbohidrato; NTproBNP: fragmento N-terminal del péptido natriurético tipo B.
La mayoría de los síntomas y signos empleados para evaluar la congestión intersticial tienen una especificidad moderada y poca sensibilidad para identificar la congestión tisular. Por ello, es fundamental integrar la información clínica con biomarcadores y técnicas de imagen (fig. 2).
Antígeno carbohidrato 125 (CA125)El antígeno carbohidrato 125 (CA125) es una glicoproteína sintetizada por las células del epitelio celómico en sitios como la pleura, pericardio y peritoneo16. Aunque tradicionalmente se ha empleado para la monitorización y estratificación del riesgo en el cáncer de ovario, se han identificado concentraciones plasmáticas elevadas de CA125 en otras entidades relacionadas con estados hidrópicos, tales como la IC17. A pesar de que el mecanismo fisiopatológico vinculado a la IC no es del todo conocido, una de las teorías más aceptadas sugiere la activación de las células mesoteliales en respuesta al aumento en la presión hidrostática, estrés mecánico y citoquinas inflamatorias18. Evidencia reciente ha demostrado la asociación de CA125 con parámetros clínicos de congestión sistémica, y la correlación positiva con diversos biomarcadores subrogados de inflamación y congestión19. Dos ensayos clínicos que han evaluado una estrategia guiada por las concentraciones plasmáticas de CA125 frente a una estrategia convencional (guiada por síntomas y signos) en pacientes con IC aguda congestiva han mostrado resultados prometedores que sugieren la utilidad de este biomarcador para optimizar la intensidad del tratamiento depletivo20,21.
Ecografía pulmonarLa ecografía pulmonar ha surgido como una herramienta muy útil para la evaluación de la congestión intersticial pulmonar. La cantidad de agua en los pulmones corresponde al grado de ecogenicidad encontrado en la ecografía22. En el caso de edema pulmonar intersticial, el haz de ultrasonido se refleja en los tabiques interlobares edematosos y produce artefactos de reverberación llamados líneas B23. El número de líneas B es indicativo del grado de congestión intersticial pulmonar. En pacientes con disnea, ≥ 3 líneas B en al menos dos zonas por hemitórax (de 6-8 zonas evaluadas en total) identifica a pacientes con IC aguda con mayor sensibilidad (94-97%) y especificidad (96-97%) que el examen físico y la radiografía de tórax24. Así mismo, mayor número de líneas B en el momento del alta tras una hospitalización por IC aguda o en pacientes ambulatorios con IC crónica identifica a aquellos con mayor riesgo de reingreso por IC y muerte25,26. Un ensayo clínico reciente ha mostrado además que el tratamiento diurético guiado por ecografía pulmonar puede reducir el número de descompensaciones en pacientes con IC27.
Adicionalmente, teniendo en cuenta el carácter dinámico y la relevancia pronóstica de la congestión residual28, la integración de parámetros clínicos, biomarcadores y técnicas de imagen durante el curso evolutivo (Material suplementario 1) aportan información relevante a la hora de tomar decisiones terapéuticas29.
Impacto de la congestión en el filtrado glomerularEl aumento en la presión venosa central se trasmite hacia el sistema venoso renal y, por tanto, influye en el filtrado glomerular (FG)30,31. La presión de filtración renal (de la cual procede la presión hidrostática del capilar glomerular) depende de la presión de perfusión renal (PPR) y del flujo sanguíneo renal (FSR). A su vez, la PPR depende de la presión arterial media (PAM) y de la presión venosa renal (PVR), y el FSR de la presión arterial renal (PAR), PVR y resistencias vasculares intrarrenales (RVR)32:
- •
PPR = PAM – PVR
- •
FSR = PAR – PVR / RVR
En pacientes con IC crónica, el FSR y el FG se mantienen casi constantes dentro de un rango relativamente amplio de PPR (80-180mmHg). Esto se debe a los mecanismos de autorregulación renal y retroalimentación túbuloglomerular que modifican las resistencias pre- y posglomerulares con la finalidad de mantener la presión de filtración33. Sin embargo, en el contexto de una IC aguda, los mecanismos de autorregulación se alteran y la presión de filtración depende en gran medida del equilibrio entre la PAM y la PVR33. Por tanto, el aumento en la PVR (poscarga intrarrenal) puede reducir de forma significativa el FSR. Así mismo, al ser el riñón un órgano encapsulado, el incremento en la PVR produce compresión mecánica sobre el intersticio y compartimiento intratubular, lo que reduce aún más el gradiente de presión hidrostática transcapilar glomerular y, por consiguiente, supone un mecanismo adicional mediante el cual la hipertensión venosa renal puede comprometer el FG34. Así mismo, la congestión venosa renal produce inflamación, estrés oxidativo e isquemia renal, produciendo daño tubular intrínseco34.
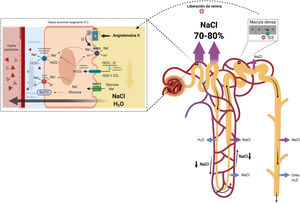
Impacto de la congestión en la reabsorción de sodio y aguaEn condiciones fisiológicas, los cambios en la tasa de filtración glomerular se equilibran con cambios equivalentes en la reabsorción tubular (equilibrio glomerulotubular)35. Así pues, dependiendo de la fracción de filtración (FF), los cambios en la presión hidrostática y oncótica en el intersticio renal y los capilares peritubulares determinarán la reabsorción de Na+y agua en el túbulo proximal. Es importante destacar que el equilibrio glomerulotubular no está influenciado por la activación neurohumoral, sino por las fuerzas de Starling que operan localmente en la microcirculación de la nefrona proximal36. La congestión venosa renal provoca un aumento en la presión hidrostática en la luz tubular, en el intersticio y a nivel de los capilares peritubulares37. No obstante, el aumento en la presión hidrostática estimula el drenaje linfático en el intersticio renal (lo que se traduce en una reducción de la presión oncótica intersticial) mientras que los capilares peritubulares son prácticamente impermeables a las proteínas plasmáticas (la presión oncótica peritubular permanece alta)38. Por tanto, el gradiente de presión coloidosmótica resultante entre el intersticio y capilar peritubular estimula la reabsorción de Na+ y agua de forma directa. Así mismo, el aumento en la reabsorción de sodio a nivel proximal reduce el flujo de sodio y cloro hacia la mácula densa que, junto a la reducción del FSR, incrementa aún más la activación neurohormonal generando un círculo vicioso.
Tratamiento de la congestiónEn condiciones fisiológicas, la homeostasis del volumen extracelular se mantiene constante como resultado del estrecho control de diversos mecanismos contrarreguladores que determinan la tasa de reabsorción/excreción de sodio y agua en el túbulo renal. Desde un punto de vista cuantitativo, un filtrado glomerular normal (125mL/min/1.73m2) aporta aproximadamente 25.000 mmol de Na+/día al túbulo renal. Aun así, más del 99% del sodio filtrado se reabsorbe y sólo una pequeña cantidad se elimina finalmente en la orina (aproximadamente 100 mmol/L/día). Así pues, mínimos cambios en la relación entre el Na+ filtrado y la fracción que se reabsorbe en el túbulo renal pueden ejercer una profunda influencia acumulativa en el balance neto de Na+.
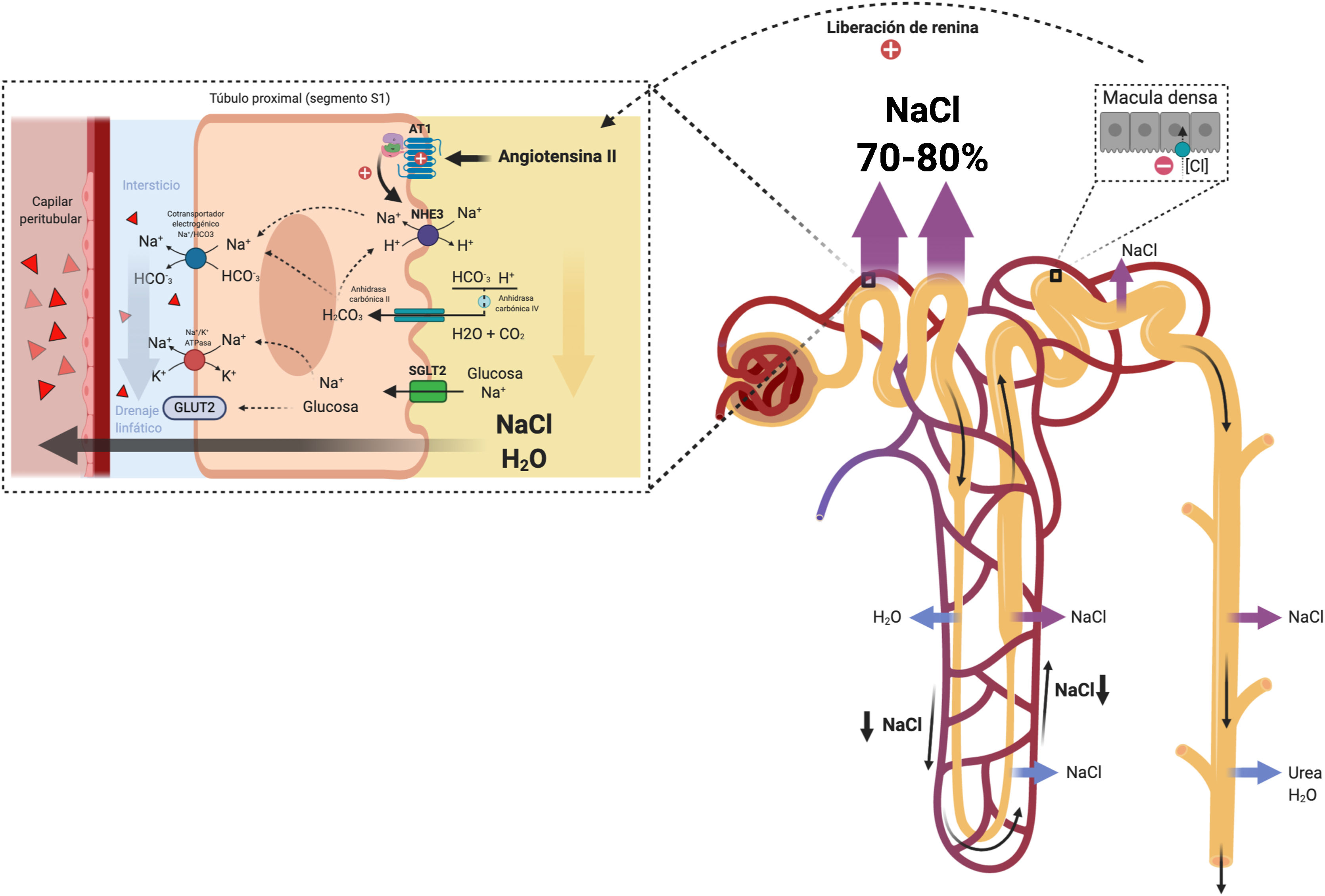
1. Diuréticos proximalesLa función principal del túbulo proximal renal es la reabsorción casi isosmótica de aproximadamente el 70% del ultrafiltrado glomerular. Esto incluye la reabsorción del 65-75% del Na+ filtrado39. La reabsorción de Na+ en el túbulo proximal se produce a través de mecanismos paracelulares y transcelulares mediados fundamentalmente por el equilibrio glomerulotubular y por influencia neurohumoral35.
En pacientes con IC descompensada, la activación neurohumoral ejerce efectos directos sobre el transporte epitelial en el túbulo proximal mediante la estimulación de cotransportadores involucrados en la reabsorción transcelular de Na+ (isoforma 3 del intercambiador de Na+/H+ [NHE3], cotransportador electrogénico Na+/HCO3- y Na-K-ATPase)40 (fig. 3). Así mismo, la reducción en el FSR produce un incremento en la fracción de filtración y, por tanto, un aumento en la reabsorción proximal de Na+ mediada por el equilibrio glomerulotubular. Todos estos mecanismos establecen un círculo vicioso que potencia la reabsorción de Na+ en el túbulo proximal, favorece la activación del eje renina-angiotensina-aldosterona y contribuye a la resistencia de los diuréticos que actúan más distalmente en la nefrona (fig. 4).
Túbulo proximal. La activación neurohormonal y los cambios hemodinámicos intraglomerulares y peritubulares facilitan la reabsorción de Na y agua en el túbulo proximal. Adicionalmente, el incremento en el flujo linfático lava las proteínas intersticiales y disminuye la presión oncótica en el intersticio renal promoviendo aún más la reabsorción pasiva de Na.
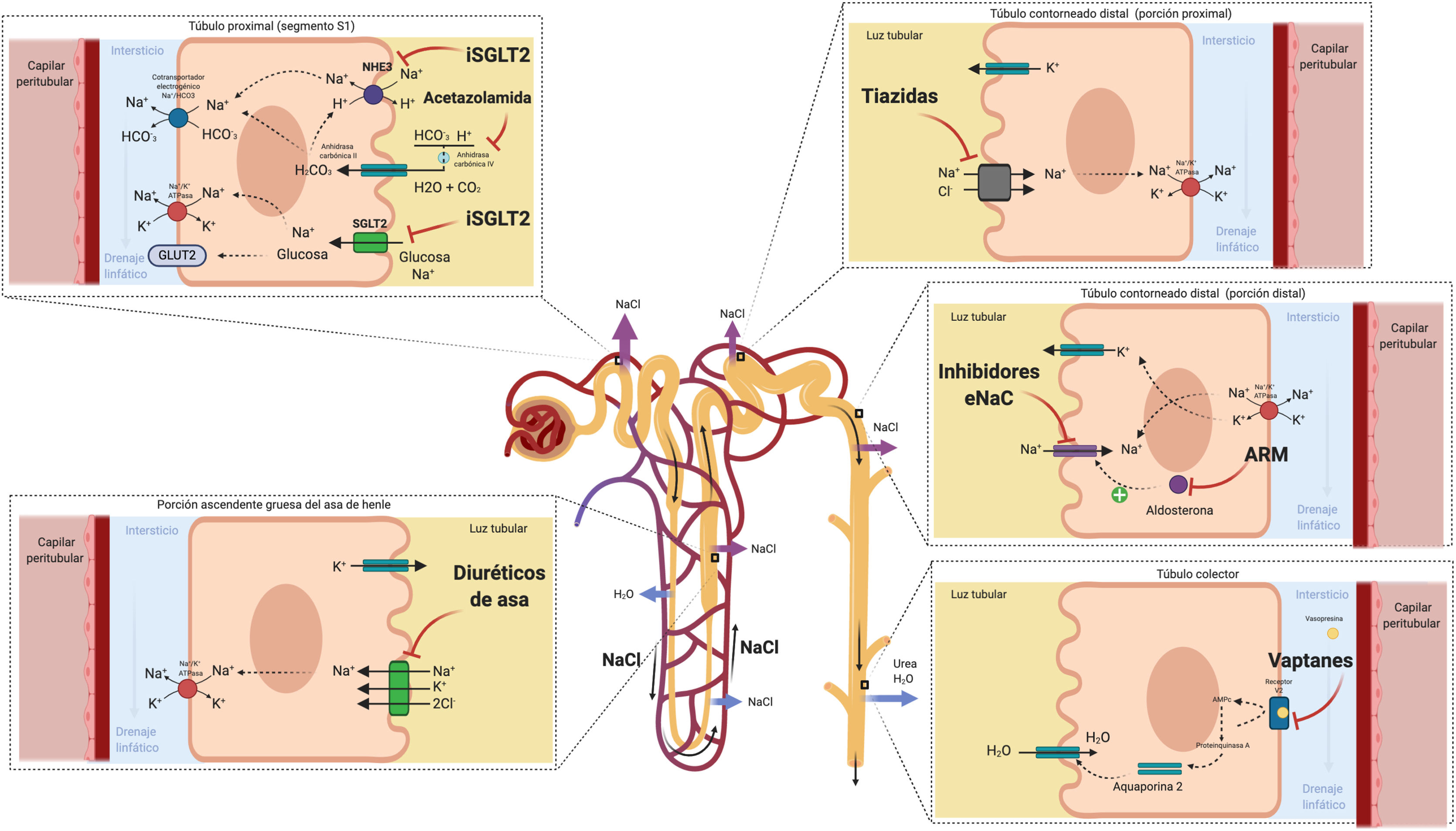
La acetazolamida actúa inhibiendo la anhidrasa carbónica y, por tanto, bloquea la reabsorción de bicarbonato y Na+ en el túbulo proximal41. Si bien la capacidad diurética y natriurética de la acetazolamida por sí sola es pobre, podría ejercer un papel como «potenciador» de la eficacia diurética si se utiliza en combinación con diuréticos que actúan más distalmente en el túbulo renal al aumentar el flujo tubular de Na+. Este concepto está respaldado por pequeños estudios observacionales42–44 y por un pequeño estudio aleatorizado que incluyó a 24 pacientes con congestión refractaria en quienes la administración de acetazolamida se asoció a una mejoría en la excreción fraccional de Na+45.
Así, hasta que la evidencia sea más sólida, se recomienda la acetazolamida como un fármaco de segunda línea. Dado que puede producir acidosis metabólica, se recomienda evaluación periódica de la función renal, electrolitos séricos y pH sanguíneo.
Inhibidores del cotransportador sodio-glucosa tipo 2Los inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT2) son fármacos hipoglucemiantes que han demostrado de forma consistente reducir las hospitalizaciones por IC en pacientes con diabetes mellitus tipo 246, en pacientes estables con IC y fracción de eyección deprimida (diabéticos y no diabéticos)47, y en pacientes diabéticos con un episodio reciente de IC independientemente de la fracción de eyección48.
El cotransportador SGLT2 se localiza en el segmento S1 del túbulo contorneado proximal de la nefrona y reabsorbe aproximadamente el 90% de la glucosa filtrada. La reabsorción tubular de glucosa está acoplada a la reabsorción de Na+ (una molécula de Na+ por cada molécula de glucosa) siguiendo un gradiente electroquímico de mayor concentración en la luz tubular y menor concentración en el interior de la célula epitelial tubular. Por otro lado, el contransportador SGLT2 está ubicado adyacente al intercambiador renal de Na+/hidrógeno (NHE3), que es en gran parte el responsable de la reabsorción de Na+ en el túbulo proximal. La inhibición del SGLT2 parece ejercer una reacción cruzada con el intercambiador NHE3 potenciando la natriuresis por un mecanismo independiente a la inhibición de la reabsorción de glucosa49. Si bien el efecto natriurético de la inhibición SGLT2 parece ser débil en monoterapia, evidencia reciente sugiere un efecto sinérgico cuando se combina con diuréticos de asa al aumentar el flujo de Na+ al asa gruesa de Henle50. Por otro lado, la liberación de renina mediada por los diuréticos de asa produce una regulación al alza del cotransportador SGLT2, potenciando la salida Na+ del túbulo proximal tras su inhibición49. Otro aspecto interesante deriva de su potencial capacidad de producir un incremento significativo en la excreción de agua libre de electrolitos mediado principalmente por un efecto osmótico51–53. Este efecto podría favorecer la descongestión del intersticio sin asociar cambios relevantes en el volumen intravascular.
2. Diuréticos de asaA pesar de que solo un tercio del volumen filtrado por el glomérulo llega al asa de Henle, este segmento es especialmente importante para el mantenimiento de la homeostasis del volumen extracelular y concentración de la orina.
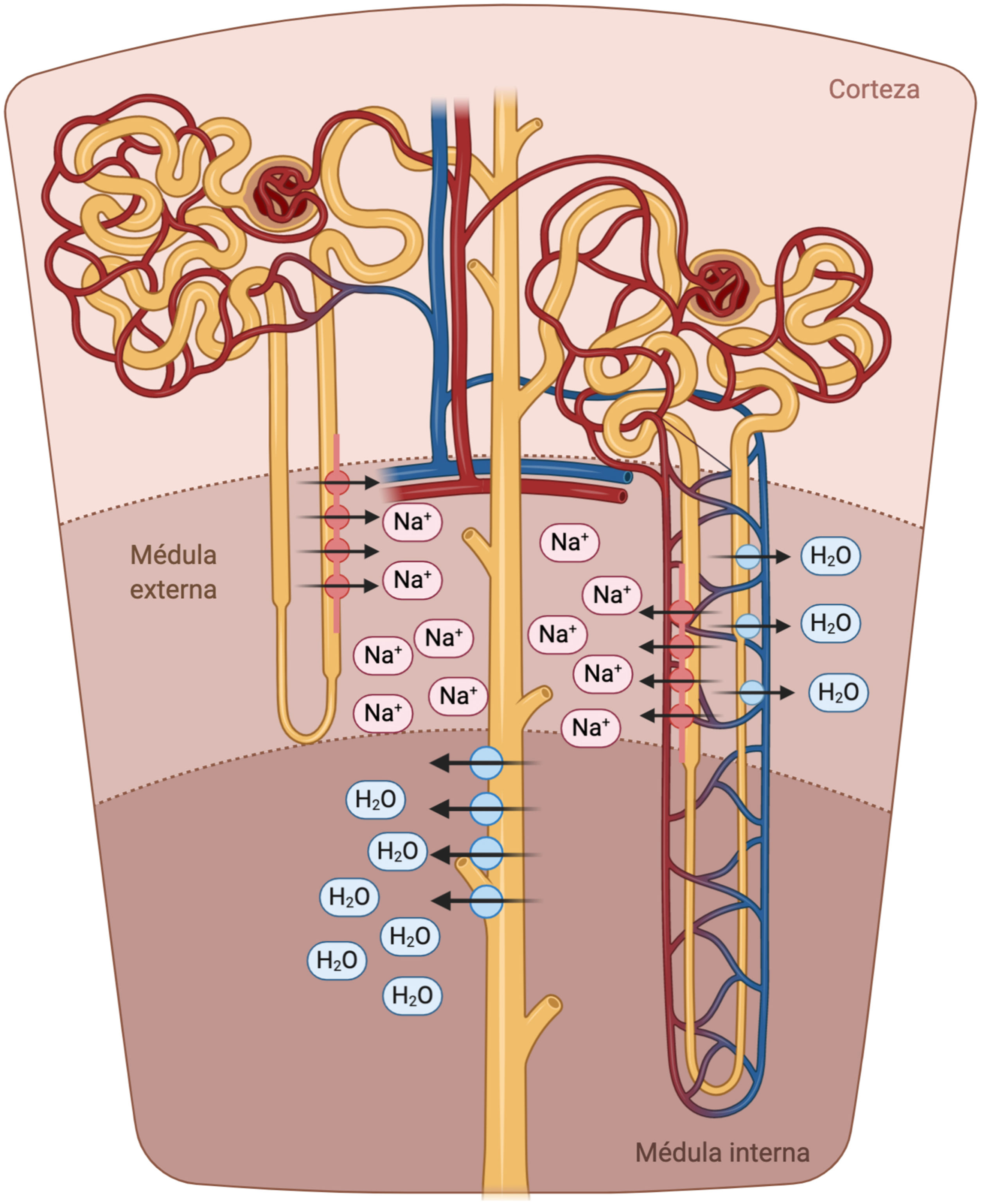
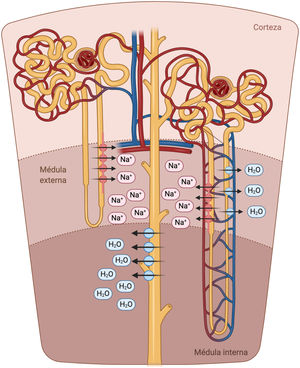
La porción descendente del asa de Henle es extremadamente permeable al agua y menos permeable a los iones; la tonicidad del líquido tubular aumenta progresivamente a medida que el asa de Henle desciende desde la corteza renal hacia la parte interna de la médula54. El asa de Henle se vuelve impermeable al agua en su porción ascendente y el elevado flujo tubular de NaCl en este segmento del túbulo renal activa el cotransportador Na+/K+/2Cl- (NKCC2) en la porción gruesa, lo que diluye el líquido luminal y genera el gradiente osmótico necesario en el intersticio de la médula externa para la reabsorción de agua dependiente de vasopresina en el túbulo colector55 (fig. 5).
Asa de Henle. La porción descendente del asa de Henle es extremadamente permeable al agua. Por el contrario, la parte ascendente gruesa es impermeable al agua y el elevado flujo tubular de NaCl en este segmento del túbulo renal activa el cotransportador Na+/K+/2Cl- (NKCC2) en la porción gruesa, lo que diluye el líquido luminal y genera el gradiente osmótico necesario en el intersticio de la médula renal para la reabsorción de agua dependiente de vasopresina en el túbulo colector.
En pacientes con IC, la natriuresis y la excreción de agua libre se ven comprometidos por múltiples factores56. El asa de Henle está implicada fundamentalmente en tres de ellos. En primer lugar, el incremento en la reabsorción de agua y NaCl en el túbulo proximal disminuye el volumen tubular que llega al asa de Henle. Este punto es especialmente importante dado que el cotransportador NKCC2 requiere necesariamente de concentraciones adecuadas de cloro (Cl) para la reabsorción de Na+ y potasio57. En segundo lugar, la activación neurohormonal produce una regulación al alza del cotransportador NKCC2, lo que aumenta la reabsorción activa de Na+ en la porción gruesa del asa de Henle y, por tanto, la tonicidad del intersticio medular58. En tercer lugar, la hipoperfusión de la vasa recta como resultado de la vasoconstricción y congestión venosa intrarrenal reduce el lavado de solutos de la médula renal, lo que afecta la capacidad de los riñones para diluir la orina y excretar agua libre59.
Teniendo en cuenta estas consideraciones, los diuréticos de asa son la piedra angular en el tratamiento de la congestión dado que ejercen un potente efecto inhibidor sobre el cotransportador NKCC2. En consecuencia, aumentan el flujo tubular de NaCl que llega a la nefrona distal y, por tanto, interfieren con la generación del gradiente osmótico en el intersticio medular renal, disminuyendo la reabsorción de agua libre en el túbulo colector (lo que resulta en la producción de una orina hipotónica). No obstante, a pesar de su elevada eficacia diurética y natriurética, existen una serie de consideraciones farmacocinéticas y farmacodinámicas que es necesario tener en cuenta.
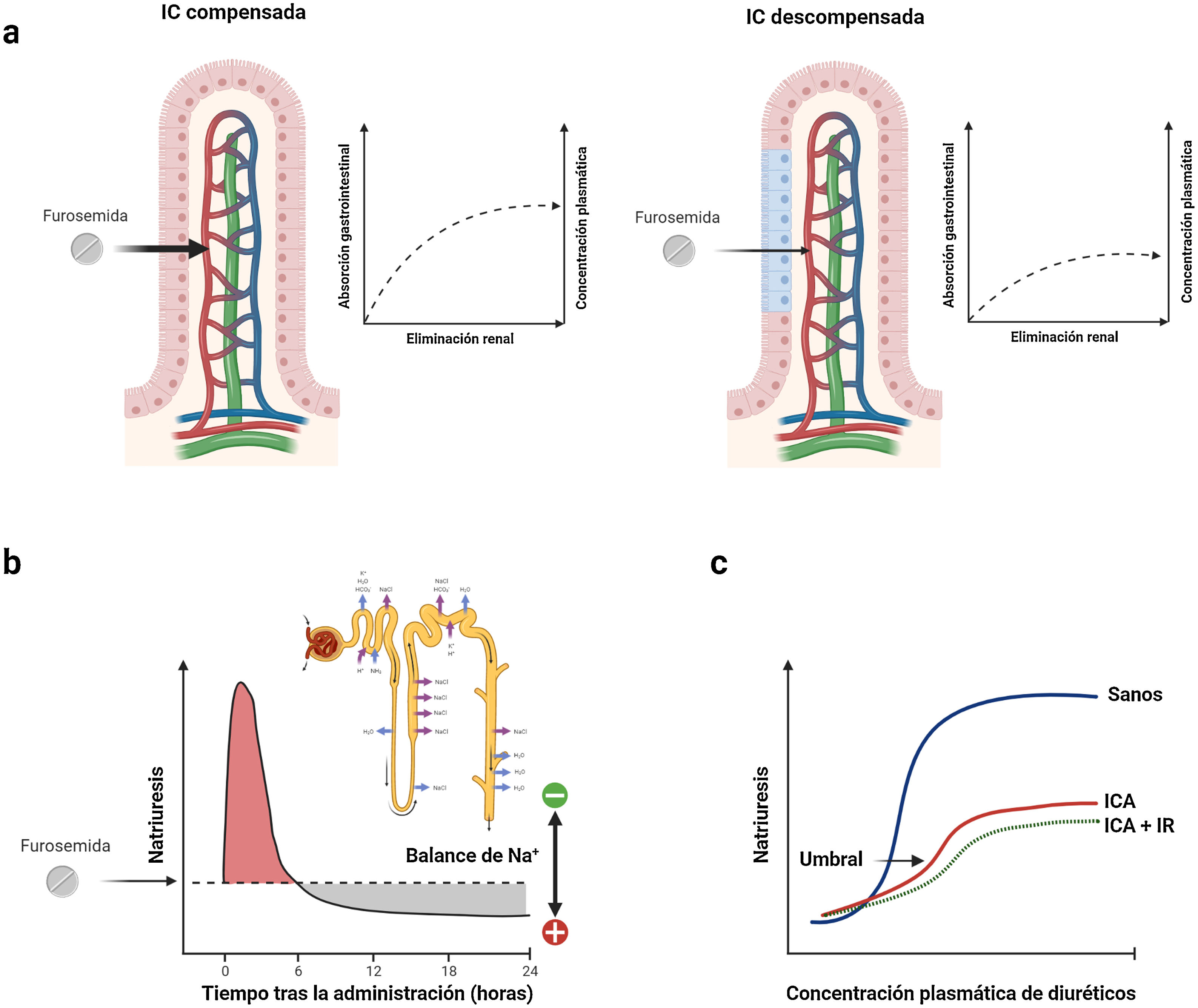
1. Absorción gastrointestinal y biodisponibilidad de la presentación oralLos diuréticos de asa se absorben relativamente rápido desde el tracto gastrointestinal (inicio de acción 30-60min). Sin embargo, la biodisponibilidad individual de la furosemida oral varía entre el 10 y el 100% (biodisponibilidad media del 50%)60. Esta variación se ha atribuido a las diferencias en el vaciamiento gástrico y el flujo sanguíneo, así como al impacto de la congestión venosa y el edema intestinal61 (fig. 6a). Por el contrario, la absorción y biodisponibilidad de la torasemida es más estable (> 80%) y se ve menos influenciada por la congestión intestinal62. No obstante, hay que tener en cuenta la bioequivalencia de dosis (40mg de furosemida equivalen a 20mg de torasemida).
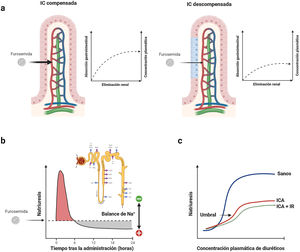
Características farmacocinéticas y farmacodinámicas de la furosemida. a) Cinética dependiente de la absorción. La furosemida presenta una propiedad farmacocinética única donde la tasa de eliminación del fármaco es significativamente más rápida que su tasa de absorción. Por lo tanto, los niveles plasmáticos dependen en gran medida de las tasas de absorción, y cualquier deterioro en este último proceso conduce a reducciones significativas en la vida media de este agente. b) Retención de sodio postdiurético. Los diuréticos de asa se caracterizan por tener semividas cortas. Por lo tanto, la natriuresis inicial generalmente disminuye progresivamente en las 3 a 6h siguientes a su administración. Durante este tiempo, la nefrona reabsorbe ávidamente sodio pudiendo generar un balance positivo. c) Umbral natriurético. La dosis administrada debe exceder un cierto umbral para ser efectiva. Así pues, no es de extrañar que una dosis empíricamente seleccionada pueda ser ineficaz. Este punto también se ve influenciado en gran medida por la errática biodisponibilidad de la furosemida oral.
Los diuréticos de asa se caracterizan por tener semividas relativamente cortas. La natriuresis inicial generalmente disminuye progresivamente en las 3 a 6h siguientes a su administración63. Tras este tiempo, la nefrona reabsorbe ávidamente el sodio, dando como resultado una «retención de sodio postdiurético»64 (fig. 6b). En este sentido, posologías que mantengan concentraciones plasmáticas estables serían más recomendables en pacientes con mayor grado de congestión.
3. Umbral natriuréticoLa dosis administrada debe exceder cierto umbral para ser efectiva. Aunque la mayoría de las personas sanas responderán a 20mg de furosemida vía oral, el umbral de natriuresis se desplaza hacia arriba y hacia la derecha en los pacientes con IC descompensada, más aún si presentan disfunción renal58,65 (fig. 6c).
4. Fenómeno de frenado y remodelado estructural de la nefronaUna característica que complica la efectividad de la terapia diurética deriva de la estructura propia de la nefrona. La excreción de sodio durante el tratamiento con diuréticos refleja un equilibrio entre la inhibición de la reabsorción en el sitio primario de acción y la estimulación de la reabsorción en otros puntos de la nefrona («fenómeno de frenado»)66. Aunque este proceso es fisiológico, los mismos mecanismos contribuyen a la resistencia diurética. Por otro lado, el tratamiento crónico con diuréticos de asa se asocia con fenómenos de remodelado e hipertrofia del túbulo contorneado distal y colector, lo que aumenta la capacidad de la nefrona distal para reabsorber sodio y agua.
5. Vía de administraciónLa vía óptima de administración de la furosemida no está bien establecida. Administrar la furosemida en perfusión ofrece la teórica ventaja de evitar el pico de reabsorción de sodio y disminuir los cambios bruscos en el volumen intravascular67. Aunque esta estrategia no ha evidenciado disminuir rehospitalizaciones ni mortalidad, un metaanálisis que incluyó un total de 923 pacientes de 12 estudios, observó una mayor reducción del peso utilizando la furosemida en perfusión, sin asociarse con trastornos iónicos o deterioro de la función renal68.
6. Administración de furosemida junto con suero salino hipertónicoEl fundamento de administrar la furosemida junto a suero salino reside en su capacidad osmótica, que favorece que el agua libre del espacio intersticial pase al compartimento intravascular. Esto contribuye a la expansión de volumen plasmástico y contrarresta el efecto deletéreo de la depleción intravascular ocasionada por los diuréticos. Ensayos clínicos69–71 y estudios observacionales72–74 en pacientes refractarios han demostrado su efectividad en resolver los datos congestivos, preservar la función renal e incluso en disminuir eventos adversos en el seguimiento. No obstante, existe una amplia heterogeneidad en la forma de preparación y la dosis de furosemida empleada en los distintos trabajos (tabla 2).
Forma de administración furosemida intravenosa y suero salino hipertónico
| Autores | n | Año | Dosis furosemida | Preparación |
| Paterna S. et al.57 | 1.771 | 2011 | 500-1.000 mg/12 h | 150 mL NaCl (1,4-4,6%) en 30 min |
| Tuttolmondo A. et al.58 | 150 | 2011 | 125-1.000 mg/12 h | 150 mL NaCl (1,4-4,6) en 60 min |
| Issa V. et al.59 | 32 | 2011 | 120 mg/24 h | 100 mL NaCl (7.5%) en 1 hora |
| Lafrenière G. et al.61 | 47 | 2012 | 250 mg/12 h | 150 mL NaCl (3%) en 1 hora |
| Torres M. et al.62 | 51 | 2019 | 125 mg/24h | 100 mL NaCl (2,4%) en 30-60 min |
*n: número de pacientes; min: minutos
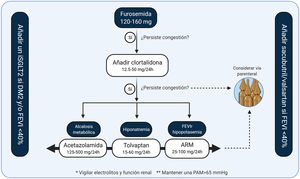
El documento de consenso en el uso de diuréticos en pacientes con IC y congestión de la Asociación Europea de Insuficiencia Cardiaca3 posiciona al diurético de asa como primera línea de tratamiento. Además, en el paciente que ingresa por IC y presenta una natriuresis inicial disminuida o una diuresis insuficiente, recomienda doblar la dosis de diurético de ASA hasta alcanzar dosis elevadas de furosemida (400-600mg). Esta recomendación se basa en ensayos clínicos que han evaluado estrategias diuréticas en IC aguda, en los que dosis altas de furosemida se asociaron a una mayor resolución de la congestión sin asociarse a eventos adversos en el seguimiento68,68,75,76. (Material suplementario 2)
El estudio CARRESS-HF evaluó la ultrafiltración veno-venosa vs. un protocolo estandarizado de tratamiento farmacológico en pacientes con IC aguda y deterioro de la función renal77. Este protocolo recomendaba perfusión de furosemida (10-20mg/h, precedida de bolo) y añadir una tiazida si el paciente continuaba congestivo y su diuresis diaria era inferior a 3 litros. Tras evaluar a 188 pacientes, el tratamiento farmacológico se mostró igual de efectivo que la ultrafiltración veno-venosa en resolver la congestión, además de producir un menor deterioro de la función renal.
El estudio DOSE-AHF comparó dosis altas de furosemida intravenosa (2,5 veces el diurético oral basal) vs. dosis bajas (misma dosis de diurético oral) en 308 pacientes con IC aguda75. El grupo de dosis altas obtuvo una mayor resolución de los datos congestivos a pesar de un mayor porcentaje de empeoramiento de la función renal. No obstante, un análisis post-hoc mostró que este deterioro se asoció a menos eventos adversos78.
3. Diuréticos del túbulo distal1. TiazidasLos diuréticos tiazídicos ejercen su mecanismo en la parte inicial del túbulo contorneado distal, inhibiendo el cotransportador sodio-cloro. Aunque prácticamente el 90% de la reabsorción de sodio en el paciente con IC se produce a nivel más proximal66, en el paciente tratado de forma crónica con diuréticos de asa se produce un mayor aporte de sodio y una mayor avidez para su reabsorción de en la nefrona distal.
El uso aislado de tiazidas es poco eficaz para generar natriuresis en el paciente con IC; sin embargo, su adición al tratamiento con diuréticos de asa genera un importante aumento de la excreción fraccional de sodio66. Además, los diuréticos tiazídicos mantienen su efecto natriurético incluso en presencia de insuficiencia renal avanzada79. Estudios observacionales han mostrado mejoría de los signos clínicos de congestión como tratamiento adicional a la furosemida en pacientes con IC avanzada80,81; sin embargo, las alteraciones hidroelectrolíticas y renales son relativamente frecuentes y pueden ser importantes (alcalosis metabólica, hipopotasemia, hiponatremia, hipomagnesemia e insuficiencia renal), con lo que estos fármacos se deben usar bajo un estricto control y seguimiento. La hiponatremia se produce dado que la natriuresis distal es mayor que el volumen urinario excretado, produciendo una orina hipertónica. Esta misma alcalosis metabólica hipoclorémica inducida por diuréticos de asa y/o tiazídicos puede generar resistencia a los mismos, por mecanismos como la depleción de cloro, la reducción de su concentración luminal tubular renal y la activación de la renina82.
Los diuréticos tiazídicos más usados en nuestro medio son la clortalidona y la hidroclorotiazida. La clortalidona tiene una vida media más larga (45-60 horas frente a 6-15 horas)3. Hay que destacar que el efecto natriurético de la hidroclorotiazida se consigue con dosis aproximadamente 1,5-2 veces superiores a las de la clortalidona83.
No se han realizado ensayos clínicos aleatorizados que hayan demostrado el beneficio de las tiazidas en IC. La clorotiazida intravenosa y la metazolona han mostrado una eficacia similar al tolvaptán en un ensayo clínico sobre 60 pacientes con IC y congestión refractaria a diuréticos, mejorando la eficiencia diurética y generando rápida pérdida de peso84.
Dada la experiencia de uso de estos fármacos y su potencia natriurética en combinación con diuréticos de asa, suelen ser el tratamiento de primera elección en el paciente con congestión refractaria a dosis altas de diurético de asa.
2. Antagonistas del receptor mineralcorticoideLa activación neurohormonal deletérea en la IC conlleva un estado de hiperaldosteronismo, que además se exacerba durante el tratamiento deplectivo. A nivel renal la aldosterona promueve la reabsorción de sodio induciendo la expresión de canales epiteliales de sodio en la nefrona distal66.
Los antagonistas del receptor mineralocortidoide (ARM) actúan a nivel renal en la nefrona distal, inhibiendo los efectos de la aldosterona y por tanto modulando la actividad y expresión de canales de sodio y potasio.
La espironolactona y la eplerenona son los dos fármacos más empleados. Ambos han demostrado reducir el riesgo de muerte y rehospitalización por IC85, y tienen una indicación clase I en las Guías de Práctica Clínica para el tratamiento de la IC con fracción de eyección reducida9. Sin embargo, las dosis utilizadas en RALES o EMPHASIS-HF (dosis medias diarias de 26mg de espironolactona y 40mg de eplerenona, respectivamente)85, tienen escaso efecto diurético. En pacientes con IC y fracción de eyección conservada sí se ha observado disminución de signos físicos de congestión con espironolactona a dosis bajas (25mg/día)86.
La espironolactona a dosis ≥ 100mg/día es capaz de inducir natriuresis, mejorar los signos de congestión y reducir las necesidades de diuréticos de asa en pacientes con IC y congestión refractaria87. El principal ensayo clínico que ha evaluado el potencial beneficio de usar dosis elevadas de ARM fue el ensayo ATHENA-HF, que aleatorizó a 360 pacientes con IC aguda a recibir espironolactona a dosis de 100mg al día vs. placebo (o 25mg/dia) durante 96 horas88. No se observaron diferencias en niveles de NT-proBNP (objetivo primario), ni en un objetivo combinado de muerte y eventos de descompensación de IC. Tampoco se observaron diferencias en objetivos secundarios subrogados de eficacia diurética. Es de destacar que el fármaco se usó durante un periodo de tiempo corto. Un subestudio farmacocinético comprobó que a las 48h muchos pacientes que recibían el fármaco de novo no habían alcanzado adecuados niveles farmacológicos89.
El principal efecto secundario de estos fármacos es la hiperpotasemia89. Sin embargo, por ello pueden ser una opción especialmente atractiva en presencia de hipopotasemia90.
4. Diuréticos con efecto sobre el túbulo colectorLos antagonistas de la vasopresina (AVP) ejercen su mecanismo de acción en el túbulo colector renal, contrarrestando la acción de la hormona antidiurética. En la IC existen niveles inapropiadamente elevados de arginina vasopresina que, a nivel renal, a través de la estimulación de receptores V2, promueven la expresión de canales de acuaporina-2, generando reabsorción de agua libre y por tanto contribuyendo a la sobrecarga hídrica y a la hiponatremia dilucional66.
El fármaco más empleado es el tolvaptán, un antagonista del receptor V2 que inhibe la expresión de canales de acuaporina-2 y, por tanto, induce la excreción de agua libre. Al inducir acuaresis pero no natriuresis se aumenta la osmolalidad del plasma, siendo eficaz para la corrección de la hiponatremia dilucional en la IC.
El tratamiento con tolvaptán ha demostrado a corto plazo mejorar signos físicos de congestión e inducir pérdidas de volumen en el paciente con IC aguda91. A corto plazo puede generar una eficacia diurética comparable a las tiazidas administrado de forma concomitante a diuréticos de asa84. El ensayo clínico EVEREST aleatorizó a 4.133 pacientes con IC con fracción de eyección reducida hospitalizados por descompensación de IC a recibir tolvaptán o placebo. El tratamiento con tolvaptán, aunque mejoró la disnea y los signos de congestión, no tuvo ningún efecto sobre la morbimortalidad92. Un análisis post-hoc mostró un posible beneficio en reducción de eventos en pacientes con mayor grado de hiponatremia (Na < 130 mEq/L)93,94.
La dosis de tolvaptán recomendada es de 30mg/día; sin embargo, un estudio de postcomercialización en Japón, que comprendió a 3.349 pacientes con IC aguda y resistencia al tratamiento diurético, mostró que dosis bajas de tolvaptán (7,5mg diarios), fueron igual de eficaces y más seguras que dosis superiores95. No producen descenso significativo de la presión arterial, alteraciones hidroelecrolíticas o empeoramiento de la función renal, incluso ésta puede mejorar tras su administración91. Sin embargo, dosis altas se han asociado a toxicidad hepática, por lo que la función hepática deber ser periódicamente evaluada. Actualmente su alto coste es una limitación para su uso.
5. Ultrafiltración intra y extracorpóreaLa ultrafiltración extracorpórea es un método de extracción fundamentalmente de agua que se indica en pacientes con refractariedad a pesar de tratamiento diurético intensivo9. Aunque los ensayos clínicos aleatorizados muestran resultados heterogéneos y no definitivos96–100, parece útil contemplar esta opción terapéutica en pacientes refractarios101. Como alternativa a la modalidad anterior, surge la diálisis peritoneal continua ambulatoria como método de ultrafiltración extracorpóreo potencialmente útil a largo plazo y en ambiente ambulatorio. En este sentido, hay diversos grupos que apuntan a una llamativa mejoría sintomática y a una reducción de hospitalizaciones en pacientes con IC refractaria102–105.
6. Sacubitril/ValsartánLos péptidos natriuréticos (PN) mejoran la PPR al reducir las resistencias vasculares preglomerulares, aumentan la superficie de filtración al relajar las células mesangiales, y estimulan la diuresis y natriuresis por mecanismos glomerulares directos (equilibrio glomerulotubular) y mediados por la activación del GMPc106. No obstante, su función biológica se ve comprometida en pacientes con IC debido a la degradación mediada por la actividad de neprilisina. Sacubitril/valsartán combina los beneficios derivados de la inhibición del sistema renina-angiotensina-aldosterona con la reducción de la degradación de los PN como resultado de la inhibición de la neprilisina. Esta combinación ha demostrado disminuir la morbimortalidad cardiovascular107,108, reducir el remodelado cardiaco adverso109 y enlentecer la progresión del daño renal en pacientes con IC con fracción de eyección reducida110. Adicionalmente, el tratamiento con sacubitril/valsartán se asocia con una mayor reducción de los signos clínicos de congestión111 y menor necesidad de intensificar el tratamiento diurético ambulatorio112. Por tanto, es una interesante opción terapéutica para el mantenimiento de la euvolemia en este subgrupo de pacientes.
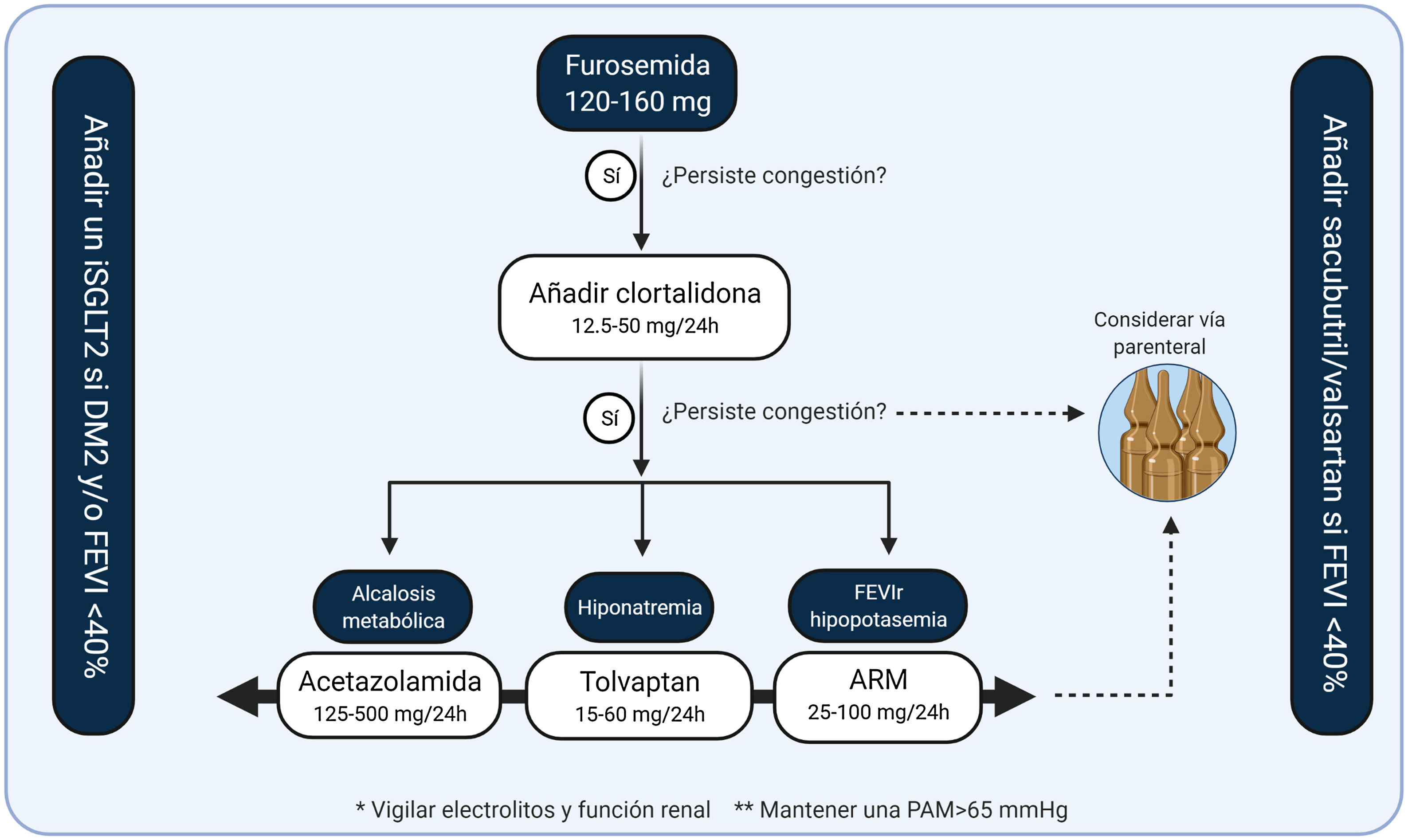
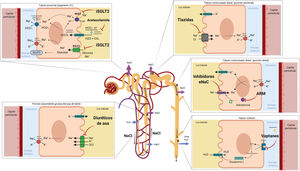
Esquema terapéutico para el manejo de la congestión en ICEn ausencia de estrategias de contrastada evidencia que hayan demostrado la idoneidad de la estrategia diurética óptima, proponemos el siguiente esquema diagnóstico/terapéutico
- 1.
Cuantificación multiparamétrica de la congestión utilizando parámetros clínicos habituales, técnicas de imagen no invasivas y biomarcadores.
- 2.
Identificación del perfil de congestión del paciente con IC. Perfiles de predominio de congestión intravascular y de localización únicamente pulmonar requerirán estrategias diuréticas menos agresivas. Por el contrario, fenotipos de congestión de predominio sistémico y extravascular requerirán estrategias más agresivas.
- 3.
El primer escalón en el tratamiento diurético son los diuréticos de asa. En caso de persistencia/refractariedad a dosis altas de éstos proponemos el algoritmo de la fig. 7.
ninguna
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
| Dosis máxima diaria ficha técnica¥ | 1.500 mg |
| Dosis máxima diaria Posicionamiento Europeo3 | 400-600 mg |
| Dosis máxima empleada ensayos clínicos:DRAIN dosis baja55DRAIN dosis alta55Metaanálisis furosemida en perfusión56DOSE-AHF dosis bajas63DOSE-AHF dosis alta63ROSE-AHF64 | 125 mg250 mg358 mg*773 mg*329 mg600 mg* |