El incremento en el número de pacientes en lista de espera de trasplante renal ha llevado a intentar aumentar el número de posibles donantes incorporando candidatos que anteriormente no se habrían considerado óptimos, incluyendo entre estos a los donantes de pacientes de asistolia (DA) y aquellos con criterios «expandidos» (DCE). Los receptores de injertos de DA controlada (DAc) sufren más función retrasada del injerto, pero presentan una evolución a largo plazo equiparable a los de donantes de muerte encefálica, lo que ha permitido un aumento en el número de trasplantes de DAc en distintos países en los últimos años. De forma paralela, el uso de DAc con criterios expandidos (DAc/DCE) se ha incrementado en los últimos años en diferentes países, permitiendo acortar la lista de espera del trasplante renal. El uso de estos injertos, aunque se relaciona con una mayor frecuencia de función retrasada del injerto, ofrece supervivencias del injerto a largo plazo similares o solo ligeramente inferiores a las de los donantes de muerte encefálica con criterios expandidos. Distintos estudios han observado que los receptores de injertos DAc/DCE tienen peor función renal que los DAc/estándar y que los donantes de muerte encefálica/DCE. La mortalidad asociada al trasplante de injertos de DAc/DCE se relaciona principalmente con la elevada edad del receptor. Los pacientes que reciben un trasplante renal de DAc/≥ 60 años presentan mejor supervivencia que los que continúan en la lista de espera, aunque este hecho no se ha demostrado en los receptores de DAc/> 65 años. La utilización de este tipo de órganos debe llevar pareja la optimización de los tiempos quirúrgicos y el menor tiempo de isquemia fría posible.
The increase in the number of patients on the kidney transplant waiting list has led to an attempt to increase the number of potential donors by incorporating candidates that previously would not have been considered optimal, including donors after cardiac death (DCD) and those with “expanded” criteria (ECD). Recipients of controlled DCD (cDCD) grafts suffer more delayed graft function (DGF), but have a long-term evolution comparable to those of brain-dead donors, which has allowed an increase in the number of cDCD transplants in different countries in recent years. In parallel, the use of cDCD with expanded criteria (cDCD/ECD) has increased in recent years in different countries, allowing the waiting list for kidney transplantation to be shortened. The use of these grafts, although associated with a higher frequency of DGF, offers similar or only slightly lower long-term graft survival than those of brain death donors with expanded criteria. Different studies have observed that cDCD/ECD graft recipients have worse kidney function than cDCD/standard and brain death/ECD. Mortality associated with cDCD/ECD graft transplantation mostly relates to the recipient age. Patients who receive a cDCD/≥60 graft have better survival than those who continue on the waiting list, although this fact has not been demonstrated in recipients of cDCD/>65 years. The use of this type of organ should be accompanied by the optimization of surgical times and the shortest possible cold ischemia.
El incremento en el número de pacientes integrantes de la lista de espera de trasplante renal, a pesar de las altas tasas de donación en distintos países, ha llevado a intentar aumentar el número de posibles donantes incorporando candidatos que anteriormente no se habrían considerado óptimos. Entre estos potenciales donantes se incluyen los donantes de pacientes de asistolia (DA), donantes con criterios «expandidos» (DCE), donantes con fracaso renal agudo, donantes diabéticos o con infección víricas, etc.1. Los DCE se definieron en 2002 por Port et al. a partir de los datos del registro estadounidense de trasplantes (SRTR), como aquellos donantes de pacientes fallecidos que tenían un riesgo de más de 1,7 veces de pérdida del injerto renal. Estos donantes eran todos los pacientes con edad ≥ 60 años y aquellos ≥ 50 años con al menos dos de las siguientes características: creatinina final > 1,5 mg/dL, hipertensión arterial y/o accidente cerebrovascular (ACV) como causa de fallecimiento2. Estudios posteriores han validado esta definición encontrando que, en general, los donantes de muerte encefálica (DME) con criterios expandidos aumentaban el riesgo subsiguiente de pérdida del injerto en el rango previsto de 1,7 veces3. A pesar de los años trascurridos tras su definición, la validez del uso de estos criterios se ha confirmado también en una población actual de receptores de trasplante renal mediante un estudio prospectivo4. La incorporación de los criterios KDRI en los donantes de EE. UU. ha permitido «medir» la «calidad» del potencial donante de una manera más gradual mediante una variable continua que solventa algunas de las desventajas de usar una definición dicotómica, como es DCE, sobre la calidad del donante5. Aunque sí se ha confirmado su relación con el riesgo de fallo del injerto (HR 1,03 [IC 95%; 1,01–1,05]; p = 0,014) en población española, el uso de los criterios KDRI no se ha generalizado en nuestro entorno y su extrapolación no parece aconsejable dadas las diferencias en las estrategias de aprovechamiento de órganos entre EE. UU. y los países europeos6,7.
Utilizar los injertos renales de los donantes DCE o de donantes con valores elevados de KDRI se ha demostrado beneficioso para los receptores de un trasplante renal, siendo especialmente beneficioso si se realiza una adecuada selección del receptor. En este sentido Merion et al. demostraron que recibir un injerto de un donante DCE disminuía la mortalidad del receptor un 17% respecto de seguir en lista de espera de trasplante o recibir un trasplante de un donante convencional posteriormente. El riesgo de muerte disminuía ya a partir del octavo mes con respecto a seguir en lista de espera y era especialmente beneficioso en receptores mayores de 40 años, diabéticos y en organizaciones con tiempos de espera medios prolongados8. De forma similar, Massie et al. demostraron en 184.277 pacientes del SRTR que recibir un injerto de un donante con valores elevados de KDRI, incluso por encima de 90, también mejoraba la supervivencia de los pacientes9. El beneficio de recibir un trasplante renal se ha demostrado favorable inclusive recibiendo un injerto de un donante mayor de 75 años10.
De forma paralela, en los últimos años se ha asistido a un incremento significativo del número de donantes en asistolia, principalmente controlada Maastricht III, en distintos países. En Reino Unido, el porcentaje de donantes en asistolia, mayoritariamente controlada (DAc), se multiplicó por seis entre 2004 y 2013; en Holanda un 43% de los trasplantes renales realizados entre 2000 y 2017 procedían de DAc11,12. De forma similar, en España la DAc supuso en 2018 un 24% del total de los trasplantes realizados y un 26% de los trasplantes de donantes fallecidos13. Este aumento se debe a la evidencia de que los injertos de DAc, a pesar del riesgo inherente a haber sufrido la isquemia caliente relacionada, presentan la misma supervivencia del injerto a largo plazo que los injertos de DME. Así, en el estudio de Reino Unido y en el estudio del registro holandés los receptores de injertos de DAc sufrían una mayor tasa de función retrasada del injerto (FRI) de forma significativa (49% vs. 24%, p < 0,0001 en el estudio británico; 42 vs. 17%, p < 0,0001 en el holandés) y un ligero aumento en la frecuencia de «no función primaria» (NFP) (4 vs. 3%, p = 0,02 en el estudio británico; 10 vs. 8%, p = 0,0001 en el holandés), pero tenían la misma supervivencia del injerto (en el estudio británico, a tres años HR 1,18, IC 95%; 0,95-1,47, p = 0,13) y del paciente (a tres años HR 0,98, IC 95%; 0,75-1,30, p = 0,93) que los donantes convencionales12,14. Un metaanálisis reciente de 12 estudios que incluían 6.008 trasplantes de DA y 13.129 de DME no detectó diferencias significativas en la supervivencia del injerto a uno, tres, cinco y 10 años15. De forma significativa, utilizar DA también ha demostrado que disminuye la mortalidad un 56% comparado con aquellos que continuaban en lista de espera, aunque recibieran posteriormente un injerto convencional de DME16.
Tanto los injertos de DCE como los de DA son descartados para el trasplante en mayor proporción que los injertos de donantes convencionales. Así, en el estudio de Marrero et al., el riesgo de descartar riñones de DA fue de 2,5 veces mayor, y el riesgo de desechar injertos de donantes por encima de 50 años fue de más de tres veces17. Cuando concurren ambas situaciones de forma conjunta, hasta el 51% de los riñones de DA/DCE son descartados18. A pesar de ello, tanto el porcentaje de DA como de DCE y la edad de los donantes se han ido aumentando en los últimos años. En Reino Unido, entre 2001 y 2012, un 20% de donantes fue DAc y, de ellos, más de un 40% cumplían criterios DCE y eran mayores de 60 años en 201311. En España, la evolución ha sido similar, siendo más del 50% de los donantes en asistolia mayores 60 años en la actualidad19. A pesar de que estos resultados han permitido acortar la lista de espera20, la combinación de ambos factores (DA y DCE) en el mismo donante podría condicionar los resultados del trasplante, el objetivo de esta revisión es resumir la experiencia previa publicada con el uso de DAc con DCE y/o de edad elevada y las variables que pueden contribuir a condicionar el curso de estos trasplantes.
Donación en asistolia controlada con donantes con criterios expandidosLos estudios más relevantes analizando los resultados de utilizar injertos de DAc/DCE se realizaron a partir de datos del SRTR (tabla 1). Singh et al. analizaron 67.816 trasplantes de donante fallecido, incluyendo 562 de asistolia con criterios expandidos (DA/DCE) realizados entre 2000 y 2009. De forma esperable, los autores encontraron una mayor frecuencia de NFP (2,9 vs. 0,9%) y de FRI (53,3 vs. 39,6%) al usar injertos DCE comparado con injertos estándar en el grupo de receptores de DA. Este aumento del riesgo se observaba también en los receptores de DME, tanto en NFP (1,5 vs. 0,7%) como en FRI (30,5 vs. 21,3%), de tal manera que el aumento del riesgo de NFP y FRI al usar injertos DCE era solo ligeramente mayor en receptores de DA, sin encontrar que la interacción DA/DCE fuera significativamente peor que DME/DCE21. En relación con los resultados a largo plazo, los hallazgos fueron similares. Recibir un injerto DA/DCE aumentaba el riesgo tanto de pérdida del injerto censurando por muerte comparado con injertos DME/DCE, pero ese aumento del riesgo no era desproporcionadamente mayor que el sufrido por los que recibían un injerto DA/estándar con respecto a los que recibían un injerto DME/estándar. Los resultados de este análisis eran similares si, en vez de usar los criterios expandidos, se usaba la clasificación de los donantes de acuerdo con los quintiles de KDRI21.
Estudios que comparan los resultados de los trasplantes de donantes de asistolia controlada con criterios expandidos, mayores de 60 años o mayores de 65 años
| Autores | País | diseño de estudio | n | Resultados | Conclusiones | |
|---|---|---|---|---|---|---|
| Singh, 201321 | EE.UU. | Registro de receptores de trasplante «SRTR» | 67.816(5.402 DA) | DCE/DA vs. DCE/DME | + NFP + FRI- supervivencia del injerto*∼ supervivencia del paciente | DCE/DA ligeramente inferiores a DCS/DA pero resultados aceptables.*El ligero aumento del riesgo de pérdida del injerto asociado a DA no se incrementa de forma significativa con DCE. |
| Nagaraja, 201522 | Reino Unido | Retrospectivo unicéntrico | 359(112 DAc) | DCE/DAc vs. DCS/DAc | = NFP = FRI = supervivencia injerto = supervivencia paciente- eGFR 2 años | DCE/DAc supervivencia similar a DCS/DAc y DCE/DME y eGFR inferior a los 2 años. |
| DCE/DAc vs. DCE/DME | + FRI = supervivencia injerto- eGFR 2 años | |||||
| Locke, 200725 | EE.UU. | Registro multicéntrico | 78.174(2.562 DA) | ≥ 60/DAc vs. ≥ 60/DME | + FRI- supervivencia del injerto | Receptores de DAc < 50 años tienen una supervivencia del injerto a largo plazo como los DCS/DME.Receptores de DAc > 50 años tienen una supervivencia del injerto a 5 años comparable a DCE/DME. |
| Favi, 201826 | Reino Unido | Observacional unicéntrico | 152(12 DAc) | ≥ 60/DAc vs. < 60/DAc | = NFP + FRI- supervivencia del injerto- supervivencia del paciente- eGFR a los 5 años. | Los receptores de injertos de ≥ 60/DAc tienen más FRI y peor supervivencia de pacientes y del injerto que los de < 60/DAc.Los receptores de injertos de ≥ 60/DAc tienen más FRI, pero la misma supervivencia de paciente y de injerto que los ≥ 60/DME.Los receptores de injertos de ≥60/DAc tienen peor función renal. |
| ≥ 60/DAc vs. ≥ 60/DME | = NFP + FRI = supervivencia del injerto = supervivencia del paciente- eGFR a los 5 años | |||||
| Pérez-Sáez, 201928 | España | Retrospectivo multicéntrico español «GEODAS» | 561 DAc | >65/DAc vs. ≤ 65/DAc | = FRI = NFP = supervivencia del injerto- supervivencia del paciente (pero relacionado con la edad del receptor)- eGFR el 1er año | Los resultados de >65/DAc son similares a los obtenidos con ≤ 65/DAc.La peor supervivencia del paciente de los receptores de tratamiento de donantes ≥ 65 años DAc se debe a la mayor edad del receptor. |
| Peters-Sengers, 201730 | Holanda | Registro Holandés de Trasplante | 3.597(1.434 DAc) | ≥ 65/DAc vs. < 65/DAc | = NFP = FRI = supervivencia del injerto a 5 años- supervivencia del paciente- eGFR | Los receptores de donantes ≥ 65 años DAc tienen resultados similares en supervivencia del injerto y del receptor a los de donantes ≥ 65 años DME.Los receptores añosos de donantes ≥ 65 años DAc presentan una supervivencia del injerto similar, pero una mayor mortalidad que los receptores añosos de donantes < 65/DAc.Los receptores > 65 años de donantes ≥ 65/DAc presentan menor eGFR.La supervivencia del receptor añoso de un trasplante de donante ≥ 65/DAc es similar a la de los pacientes añosos que continuaban en lista de espera en diálisis. |
| ≥ 65/DAc vs. ≥ 65/DME | + NFP + FRI = supervivencia del injerto a 5 años∼ supervivencia del paciente- eGFR | |||||
| Buxeda, 202029 | España | Retrospectivo Unicéntrico | 213(87 DAc) | ≥ 65/DAc vs. < 65/DAc | = NFP = FRI = supervivencia injerto- supervivencia paciente a 3 años≈ eGFR a 3 años | Los resultados de tratamiento de donantes ≥ 65 años DAc tienen resultados similares a los de donantes ≥ 65 años DME y a los de < 65 años/DAc.La peor supervivencia del paciente a 3 años de los receptores de tx de donantes ≥ 65 años DAc se debe a la mayor edad del receptor. |
| ≥ 65/DAc vs. ≥ 65/DME | = NFP = FRI = supervivencia injerto = supervivencia paciente≈ eGFR a 3 años | |||||
DCE: donantes con criterios expandidos; DAc: donantes de asistolia controlada; DME: donantes de muerte encefálica; FRI: función retrasada del injerto.
Estudios posteriores han detectado hallazgos similares en distintas poblaciones. Así, Nagaraja et al. han reportado que, aunque sufran con mayor frecuencia FRI (72 vs. 35%, p < 0,001), la evolución de los injertos DAc/DCE es similar a la de los injertos de DME/DCE, con una supervivencia del injerto a dos años similar (81 vs. 79%, p = 0,77) (tabla 1)22. De forma llamativa, siempre que se utilizan injertos DCE, sumado al efecto de la asistolia, la función renal es peor. Nagaraja et al. encontraron que el filtrado glomerular estimado al segundo año era significativamente peor en el grupo de receptores de trasplantes DA/DCE (33 mL/min) que en el grupo con DA/criterios estándar (54 mL/min) y con DME/DCE (47 mL/min, p = 0,007)22.
A pesar de los datos aceptables de supervivencia tanto de injerto como de pacientes obtenidos con los riñones DA/DCE, no se conoce con precisión si el recibir un órgano con estas características ofrece ventajas en cuanto a la supervivencia del paciente comparado con seguir en lista de espera en diálisis. El único estudio que ha analizado este aspecto observó una reducción del riesgo al recibir un injerto renal con estas características, pero sin alcanzar la significación estadística (HR 0,61, IC 95%; 0,31-1,19, p = 0,15), por lo que no se puede confirmar que recibir un riñón de DA/DCE mejore la supervivencia del paciente16.
Donación en asistolia con donantes mayores de 60 añosAunque el resto de los criterios que definen DCE (hipertensión, creatinina final y muerte por ACV) también se relacionan con la supervivencia del injerto de DA y se ha demostrado que, a mayor número de criterios, peor evolución del trasplante23,24, el factor que más influye en la evolución de los injertos de DA es la edad del donante. De hecho, Locke et al. observaron con datos del SRTR que la edad del donante era la única de estas variables que afectaba a la supervivencia del injerto, incrementando el riesgo de pérdida del injerto un 78% con DA ≥ 60 años y un 48% con DA entre 50 y 59 años (tabla 1)25. Los estudios del registro británico también han demostrado que, a medida que el donante tiene más edad, la supervivencia del injerto se reduce. El riesgo de pérdida del injerto ajustado en DA entre 40-59 años era 1,73 (IC 95%; 1,20-2,49) y, por encima de 60 años era 2,76 (IC 95%; 1,87-4,08), siendo este efecto de la edad del donante solo ligeramente superior, sin significación estadística, al que aparecía en los DME (40-59 años HR 1,60, IC 95%; 1,22-2,01; ≥ 60 años HR 2,16, IC 95%; 1,63-2,86)14.
Estudios a más largo plazo han descrito hallazgos similares. En un estudio unicéntrico británico, los injertos de DAc por encima de 60 años presentaban más NFP (12,5% vs. 1,4%, p = 0,021), más FRI (70 vs. 47,2%, p = 0,029) y peor supervivencia tanto del injerto (63 vs. 83%; p = 0,001) como del paciente (66 vs. 85%; p = 0,014) a cinco años comparado con los donantes DAc por debajo de 60 años (tabla 1). A su vez, en el grupo de donantes ≥ 60 años, recibir un injerto DAc se asociaba con mayor tasa de FRI (70 vs. 37,5%, p = 0,007) e igual supervivencia del injerto (63 vs. 69%, p = 0,518) y del paciente (66 vs. 67%, p = 0,394). Como se ha referido previamente, también en este estudio se confirmó que los donantes DAc/≥ 60 tenían peor función renal que los de muerte encefálica (34 mL/min vs. 41 mL/min, p = 0,029)26.
A pesar de que los receptores de DA/≥ 60 años tienen más FRI, peor función renal y una menor supervivencia del injerto que con DA más jóvenes, está demostrado que los pacientes en lista de espera que reciben un injerto de DAc ≥ 60 años tiene una mayor supervivencia que seguir en la lista de espera, aunque reciban un trasplante posteriormente. El análisis del registro norteamericano SRTR llevado a cabo recientemente ha observado que los receptores de un injerto renal de DAc ≥ 60 años tienen un riesgo de muerte un 48% menor (HR 0,52, IC 95%; 0,46-0,55, p < 0,001) que los que seguían en lista de espera (mortalidad a tres años 12,2 vs. 22,0%; mortalidad a seis años 29,8 vs. 36,8%, p = 0,003)27.
Donación en asistolia controlada con donantes mayores de 65 añosLos datos sobre la influencia en la evolución del trasplante de los donantes en asistolia controlada por encima de 65 años son también escasos. De 561 trasplantes de DAc incluidos en la cohorte del estudio GEODAS, 135 habían recibido un injerto renal de donante > 65 años (tabla 1). En este estudio, los injertos de donantes DAc > 65 años no sufrían más NFP (3,7 vs. 3,1%, p = 0,71) ni más FRI (55,4 vs. 46,7%, p = 0,09), pero sí tenían peor función renal (49 mL/min vs. 58 mL/min, p < 0,001) y una mayor mortalidad al primer año (6,9 vs. 1,9%, p = 0,004). A pesar de esta peor función renal, estos injertos de DAc por encima de 65 años presentaban la misma supervivencia del injerto censurando por la muerte del paciente. Tras llevar a cabo un análisis multivariante se demostró que la peor supervivencia del paciente que recibía un injerto DAc > 65 años estaba relacionada exclusivamente con la edad elevada de los receptores, un hallazgo consistente con lo descrito previamente por otros autores26,28. Hallazgos similares han sido confirmados en el estudio retrospectivo llevado a cabo en el Hospital del Mar de Barcelona en 87 receptores de DAc (46 ≥ 65 años vs. 41 < 65 años) (tabla 1)29.
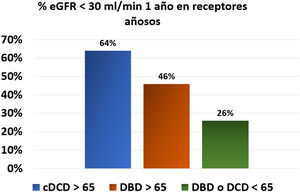
Con relación a lo anteriormente expuesto, los estudios del registro holandés aportaron información relevante sobre los resultados de este tipo de donantes (tabla 1). Este estudio no encontró diferencias significativas (HR 1,57, IC 95%; 0,79-3,11, p = 0,20) en la supervivencia del injerto entre los riñones de DAc > 65 años y los de DME < 65 años, mientras que el riesgo de fallecimiento del receptor sí era significativamente mayor, con una supervivencia del paciente a cinco años de 51% en DA ≥ 65 años, de 55% en DME ≥ 65 años y de 69% en donantes < 65 años tanto DA como DME. Además, la función renal al año era peor en el grupo que recibía injertos de DAc ≥ 65 años. Así, un 64% de los injertos de DAc ≥ 65 años tenían un filtrado glomerular estimado menor de 30 mL/min, por solo un 46% en los injertos de muerte encefálica ≥ 65 años y un 26% si los donantes tenían < 65 años (fig. 1)30. Comparando la evolución de los receptores mayores de 65 años que entraban en lista de espera, no se encontraron diferencias significativas en la mortalidad a cinco años de los pacientes que continuaron en diálisis (60%) o si recibían un injerto DAc ≥ 65 años (65%) o DME ≥ 65 años (61%), lo que no permite concluir que los receptores > 65 años mejoren su supervivencia recibiendo un trasplante de un donante ≥ 65 años (tanto DAc o DME)30. El análisis de los datos del hospital Addenbrooke de Cambridge sugiere también que la mortalidad de los pacientes trasplantados por encima de 65 años, que recibían predominantemente injertos de DAc (63%) con una edad media de 67 años, era similar (11%) a si seguían en lista de espera (8%)20.
Porcentaje de pacientes con filtrado glomerular estimado < 30 mL/min al año postrasplante en función de las características del donante en el registro holandés30.
No hay datos concluyentes sobre el papel que ejercen los cambios hemodinámicos que ocurren en la fase agónica en los resultados de los DAc. Peters-Sengers et al. demostraron que una mayor duración de la fase agónica incrementaba el riesgo de FRI. Un aumento de siete a 20 minutos en el periodo de presión arterial (PA) sistólica < 80 mmHg se asoció a 2,19 veces más riesgo de FRI31. Otros parámetros del donante, como la duración de la isquemia caliente, la hipotensión antes de la extracción o la pendiente de la saturación de oxígeno, se han relacionado con la evolución inicial y/o a largo plazo del injerto32,33. Un tiempo de isquemia caliente funcional prolongado (FWIT) está fuertemente relacionado con una peor supervivencia del injerto. En la práctica actual, FWIT > 60 minutos se aplica como contraindicación para la extracción renal en la mayoría de los centros, pero el límite superior estricto de FWIT sigue siendo controvertido. Varias experiencias en centros con alto volumen de trasplante DA con excelentes resultados sugieren que se podría aumentar el tiempo límite superior hasta 2-4 horas para la DA renal34–36.
Quizá el factor modificable en la DAc que puede tener mayor influencia en los resultados es el tiempo de isquemia fría (TIF)12,14. Datos del estudio GEODAS confirmaron que una isquemia fría mayor de 14 horas aumentaba el riesgo de NFP (OR 4,4, IC 95%; 1,3-14,4) y de FRI (1,6, IC 95%; 1,1-2,3) de forma independiente a otras variables37. A largo plazo, un TIF prolongada influye en la pérdida del injerto renal, pero principalmente en los receptores de DAc y no en los de DME. Con los datos del registro británico, Summers et al. describieron que el riesgo de pérdida del injerto era mayor en los que tenían un TIF entre 12 y 18 horas (HR 1,53, IC 95%; 1,03–2,30) comparados con los que tenían menos de 12 horas y aun mayor en los que tenían una isquemia mayor de 24 horas (HR 2,36, IC 95%; 1,39–4,02), pero solo en los DAc se detectaba este efecto de forma relevante14. Aunque no se detectó que hubiera una interacción entre el efecto de la isquemia fría y la edad del donante o los criterios expandidos, parece razonable intentar acortar los tiempos de isquemia para optimizar los resultados de los injertos de DAc/DCE. De hecho, y a pesar del aumento en la edad y el KDRI de los donantes a lo largo de los años, la mejoría observada en la última década en los resultados del trasplante de DA en el registro holandés se ha relacionado con la reducción progresiva en el TIF medio de 20 a 15 horas38.
De acuerdo con los medios de preservación in situ antes de la extracción, según los datos del estudio GEODAS, en España se realizó laparotomía rápida con preservación estática en frío en un 61%, canulación antemortem y perfusión fría en un 16% y, en el resto, perfusión normotérmica con oxigenación extracorpórea37. Las posibles ventajas de la perfusión normotérmica con oxigenación extracorpórea serían, por un lado, limitar el daño isquémico restaurando los sustratos de energía de las células y, por otro lado, permitir que el procedimiento de extracción se pueda realizar sin tanta urgencia, lo que reduce las lesiones quirúrgicas en el riñón frecuentes en la cirugía rápida39. En el contexto de la DA no controlada, la perfusión normotérmica con oxigenación extracorpórea se ha demostrado que mejora la supervivencia de los injertos renales disminuyendo el riesgo de no función primaria más de cuatro veces40,41. Aunque en DAc no hay estudios comparativos, los estudios publicados apuntan a que la tasa de FRI es menor si se usa perfusión regional normotérmica (18-40%) que con extracción super-rápida (48,5% en el registro británico y > 60% en el holandés)11,30,39. La experiencia del Hospital Marqués de Valdecilla en 27 DAc con perfusión regional normotérmica ha sido favorable con una tasa de FRI baja (27%), una evolución de la función renal indistinguible de la de un grupo de trasplantes de donantes de muerte encefálica y sin diferencias en la supervivencia del injerto a un año entre DAc con preservación con perfusión regional normotérmica 92 vs. 97% con muerte encefálica (p = 0,315)42. El uso de perfusión regional normotérmica con dispositivos de oxigenación podría minimizar el daño isquémico antes de la recuperación del riñón y aumentar la disponibilidad de riñones obtenidos de DAc con FWIT prolongado.
En el periodo de 2012 a 2017, se utilizó en España la máquina de perfusión en aproximadamente un 12% de los riñones de DAc como método de preservación ex situ, siendo el resto de los injertos preservados en frío. El uso de uno u otro método de preservación no modificó el porcentaje de órganos utilizados finalmente para el trasplante19. No hay evidencia sobre si hay que utilizar o no la máquina de perfusión en los injertos de DA, lo que justifica las diferencias en cuanto su utilización (un 25% en Reino Unido y un 70% en EE. UU.)43. Numerosos estudios, realizados tanto con injertos de donantes en muerte encefálica como en asistolia, han comparado la evolución postrasplante de los órganos preservados en frío o con máquina de perfusión, con resultados muchas veces discordantes incluso en estudios randomizados44–46. De forma conjunta, casi todos los estudios han observado que el uso de la máquina de perfusión reduce la tasa de FRI (OR 0,56, IC 95%; 0,36-0,86, p = 0,008), pero no disminuye la frecuencia de NFP, ni mejora la supervivencia del injerto o del paciente ni la función renal47. Un metaanálisis recientemente publicado reafirma estas conclusiones en el grupo de estudios de trasplante de DA. Así, en estos trasplantes, el uso de máquina de perfusión como método de preservación redujo la frecuencia de FRI un 25% (RR 0,75, IC 95%; 0,64-0,87, p = 0,0002), siendo necesario poner en máquina de perfusión a 7,3 injertos para evitar un episodio de FRI. Sin embargo, no se observó que el uso de la máquina de perfusión redujera la no función primaria ni que mejorara la supervivencia del injerto ni del paciente a largo plazo48. Aunque muchos de los estudios incluidos eran randomizados, una crítica a los mismos ha sido que el análisis de los datos no se hizo por intención de tratar, con lo que injertos potencialmente peores, randomizados al grupo de máquina de perfusión, pero que finalmente se mantenían en frío, se incluían en el análisis final dentro de este último grupo, empeorando los resultados de la perfusión en frío. Un estudio prospectivo multicéntrico randomizado británico reciente, analizado por intención de tratar, por el contrario, no ha demostrado ventajas en FRI con la máquina de perfusión en injertos de DAc (FRI en frío 62,8 vs. 58.8% en máquina, p = 0,69)43.
Algunos estudios apoyan la idea de que la máquina de perfusión limita el daño inducido por la isquemia fría prolongada49, lo que podría ser especialmente interesante para los injertos renales de DA/DCE. Analizando este punto de forma específica, Cantafio et al. reportaron que, comparado con el mantenimiento en frío, la preservación en máquina de perfusión reducía la tasa de FRI específicamente cuando los donantes en asistolia eran mayores de 60 años (OR 0,76, p = 0,02) y mejoraba la supervivencia del injerto a tres meses en los mayores de 50 años (OR 0,61, p = 0,02)50. De forma parecida, a partir de datos del registro estadounidense de trasplantes SRTR, Sandal et al. observaron que, aunque el uso de la máquina de perfusión no reducía la FRI en DA/DCE, sí aumentaba la supervivencia a largo plazo en este grupo de trasplantados51.
El uso de máquina de perfusión se ha implementado también como criterio para decidir si se utiliza o no el órgano en gran número de centros. Los criterios para no aceptar un potencial injerto renal son tener un flujo bajo (< 80 mL/min) o un índice de resistencia elevado (> 0,4 mmHg/mL/min). Estos dos parámetros se relacionan con las características del donante, de forma que, en donantes con criterios expandidos, los valores de flujo son más bajos y los de índice de resistencia son más elevados52. A pesar de que sea la práctica habitual, no se ha demostrado que se pueda establecer un punto de corte absoluto que permita decidir si se utiliza o se desecha un órgano basándose exclusivamente en estos parámetros53. En el estudio de Jochmans et al. el índice de resistencia final fue un factor de riesgo independiente, como variable continua, de no función primaria, FRI y peor supervivencia al primer año, pero con un valor predictivo bajo sobre la evolución del injerto con un AUC-ROC para FRI de solo 0,5854.
Otras características que pueden influir en la evolución de los trasplantes de DAc/DCE son si el receptor es un retrasplante, el número de incompatibilidades o la histología preimplante del órgano. El uso de injertos de DAc en pacientes que ya habían sido previamente trasplantados se asocia a una tasa mayor de no función primaria (3 vs. 7%) y a una peor supervivencia del injerto renal (HR 2,74, IC 95%; 1,96–3,82), aunque no se ha analizado cómo influiría si, además, el donante tuviera criterios expandidos23. Por otro lado, la histología preimplante se utiliza con frecuencia en muchos centros para seleccionar o desechar órganos para el trasplante o, incluso, para poner trasplantes dobles55, aunque la correlación de los datos histológicos con la evolución postrasplante es pobre56. En Reino Unido se está llevando a cabo el estudio prospectivo randomizado llamado «PITHIA», en potenciales donantes por encima de 60 años, incluyendo DAc, para analizar si el estudio histológico preimplante incrementa el número y mejora la evolución postrasplante de los injertos de donantes añosos57.
Por último, con relación a la inmunosupresión a emplear en los trasplantes de DAc/DCE, las guías británicas recomiendan utilizar inducción en todos los receptores de injertos de DA. Esta recomendación se basa en el mayor riesgo de rechazo que presentan asociado a la FRI58. Con respecto a cuál sería la mejor terapia de inducción en trasplantes de DAc/DCE, el estudio GEODAS ha observado que la inducción con basiliximab aumenta el riesgo de FRI un 47% comparada con la inducción con timoglobulina37. Datos similares han sido aportados en el estudio británico antes mencionado, en que la inducción con timoglobulina se asoció con menor pérdida del injerto comparado con la inducción con basiliximab (HR 0,503, IC 95%; 0,269-0,940, p = 0,031), independientemente de otras variables como la edad del donante26.
Aunque de forma habitual en muchos centros se retrasa el inicio de los anticalcineurínicos o se reduce su dosis para evitar o acortar la duración de la FRI, los beneficios de esta estrategia no se han confirmado en distintos estudios, por lo que las guías británicas solo mencionan esta opción terapéutica58. En un estudio realizado en nuestro centro no encontramos diferencias en la tasa de FRI ni en la evolución de la función renal entre los pacientes con introducción retrasada o inicial del tacrolimus (27 vs. 23%, p = 0,795)59. De forma interesante, el evitar anticalcineurínicos utilizando belatacept sí se ha demostrado ventajoso en este grupo de pacientes. En el estudio BENEFIT-EXT, el uso de belatacept en trasplantes de DA se demostró especialmente beneficioso comparado con ciclosporina, con una mayor supervivencia del injerto y una menor frecuencia de FRI (83% con ciclosporina, 47% en el grupo de belatacept a dosis baja) y con una mejor función renal tanto con DA como con DCE60. La generalización del uso de belatacept en estos pacientes se ha visto limitada por la ausencia de estudios comparativos con tacrolimus y por las limitaciones para su prescripción, por lo que no se puede hacer una recomendación definitiva para su uso en trasplantes de DAc/DCE.
Para concluir, el uso de donantes en asistolia con criterios expandidos se ha incrementado en los últimos años en diferentes países, permitiendo acortar la lista de espera del trasplante renal. El uso de estos injertos, aunque se relaciona con una mayor frecuencia de FRI, ofrece supervivencias del injerto a largo plazo similares o solo ligeramente inferiores a las de los donantes de muerte encefálica con criterios expandidos. Distintos estudios han observado que los receptores de injertos DAc/DCE tienen peor función renal que los DAc/estándar y que los donantes de muerte encefálica/DCE. La mortalidad asociada al trasplante de injertos de DAc/DCE se relaciona principalmente con la elevada edad del receptor. Los pacientes que reciben un trasplante renal de DAc/≥ 60 años presentan mejor supervivencia que los que continúan en la lista de espera, aunque este hecho no se ha demostrado en los receptores de DAc/> 65 años. La utilización de este tipo de órganos debe llevar pareja la optimización de los tiempos quirúrgicos y del tiempo de isquemia fría.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesEsta revisión se expuso parcialmente en una reunión del grupo Prometeo en 2019.