La enfermedad renal crónica (ERC) se asocia a una elevada morbilidad, carga y consumo de recursos, y constituye un importante desafío para los sistemas sanitarios. El objetivo de este trabajo fue analizar los modelos asistenciales de atención a estos pacientes y consensuar los factores clave que deben implementarse para un modelo óptimo de atención en la ERC, a través de una visión multidisciplinar e integradora.
Materiales y métodosSe conformó un panel multidisciplinar de profesionales con experiencia en el ámbito de la ERC, integrado por un comité asesor (CA) de 15 expertos y un panel adicional de 44 también especialistas. Se identificaron los retos y las áreas de mejora a lo largo de todo el proceso asistencial, a través de la revisión de la evidencia científica y entrevistas individuales al CA. Se consensuaron los factores clave para un modelo óptimo de atención en la ERC que fueron valorados utilizando la metodología de consenso RAND Corporation y Universidad de California en Los Ángeles (RAND/UCLA) (Delphi adaptado), valorando su adecuación y necesidad.
ResultadosSe identificaron 38 factores clave para un modelo óptimo de atención al paciente con ERC, estructurados en cuatro retos: 1) desarrollo de modelos de gestión de la ERC y aumento de la visibilidad de la enfermedad, 2) prevención, optimización del cribado, diagnóstico precoz y registro de la ERC en todos los niveles asistenciales, 3) seguimiento integral, multidisciplinar y coordinado, asegurando la optimización terapéutica y la continuidad asistencial, y 4) refuerzo de la formación en ERC a los profesionales sanitarios y pacientes. Un total de 35 factores clave fueron valorados por el panel como adecuados y claramente necesarios, y de estos, 14 fueron considerados altamente prioritarios.
ConclusionesExiste un consenso sobre la necesidad de priorizar la atención de la ERC tanto a nivel institucional como social, avanzando hacia modelos óptimos de atención en ERC basados en la prevención y detección precoz de la enfermedad, así como en el seguimiento integral y coordinado de los pacientes y la formación y concienciación a todos los niveles. Los factores clave identificados constituyen una hoja de ruta implantable en las distintas comunidades autónomas (CCAA) que puede contribuir a una mejora significativa en la atención a estos pacientes.
Chronic kidney disease (CKD) is associated with high morbidity, burden, and resource utilization, and represents a major challenge for healthcare systems. The purpose of this study was to analyse the care patterns for these patients and to reach a consensus on the key factors that should be implemented for an optimal care model in CKD, through a multidisciplinary and integrative vision.
Materials and MethodsA multidisciplinary panel of professionals with experience in the field of CKD was formed, composed of an advisory committee of 15 experts and an additional panel of 44 experts. Challenges and areas for improvement across the continuum of care were identified through review of scientific evidence and individual interviews with the advisory committee. Key factors for an optimal model of care in CKD were agreed and assessed using the Rand/UCLA consensus methodology (adapted Delphi), evaluating their appropriateness and necessity.
Results38 key factors were identified for an optimal CKD patient care model, organised into four challenges: 1) Development of CKD management models and increased visibility of the disease, 2) Prevention, optimisation of screening, early diagnosis and registration of CKD at all levels of care, 3) Comprehensive, multidisciplinary and coordinated monitoring, ensuring therapeutic optimisation and continuity of care, and 4) Reinforcement of CKD training for health care professionals and patients. 35 key factors were assessed by the panel as adequate and clearly necessary, and of these, 14 were considered highly imperative.
ConclusionsThere is consensus on the need to prioritise CKD care at both institutional and societal levels, moving towards optimal models of CKD care based on prevention and early detection of the disease, as well as comprehensive and coordinated patient monitoring and training and awareness-raising at all levels. The key factors identified constitute a roadmap that can be implemented in the different Autonomous Communities and contribute to a significant improvement in the patient's care.
La enfermedad renal crónica (ERC) es un importante problema de salud pública a nivel mundial, por su elevada prevalencia, incidencia, carga sociosanitaria y costes económicos crecientes1. En España se ha estimado una prevalencia de la ERC, en cualquiera de sus estadios, de 14,42 a 15,1% para la población general3, que podría incrementarse hasta más de 18% en el año 20404.
La ERC se asocia a un aumento de la morbimortalidad desde estadios iniciales de la enfermedad, así como a una elevada fragilidad, incremento de las hospitalizaciones y disminución de la calidad de vida de las personas que la padecen3,5,6, siendo factor multiplicador de otras patologías crónicas (como la enfermedad cardiovascular)1,7. Además, se ha puesto de manifiesto el elevado consumo de recursos y carga económica relacionada a la ERC, que se incrementa con la progresión de esta8–10 y la presencia de comorbilidades10. En estadios avanzados de la ERC, el tratamiento renal sustitutivo (TRS) representa entre 2,5 y 3% del presupuesto del Sistema Nacional de Salud (SNS), a pesar de afectar a menos de 1% de la población11. A pesar de ello, la ERC sigue siendo una patología infradiagnosticada12,13 y desconocida por la sociedad, probablemente por la falta de síntomas hasta estadios avanzados de esta14.
La ERC se integra, generalmente, en el marco de modelos de atención dirigidos a las enfermedades crónicas. En España, se cuenta con un documento marco específico de ERC, dentro de la Estrategia de Abordaje a la Cronicidad en el SNS11, desarrollado en 2015. Se han creado y desarrollado Unidades de Enfermedad Renal Crónica Avanzada (ERCA)15 y Unidades Cardiorenales16 a través de estándares definidos, como modelos funcionales multidisciplinares y especializados. Por otra parte, en 2022 se actualizó el documento de información y consenso para la detección y abordaje de la ERC, firmado por 10 sociedades científicas (SSCC), con base en las recomendaciones y conocimientos actuales5. Cabe destacar que la implementación de modelos, procesos, programas y unidades en la ERC presenta una elevada heterogeneidad en las comunidades autónomas (CCAA), posiblemente asociado a las diferencias en la organización de la asistencia y a la disponibilidad de recursos.
En este contexto, el proyecto intERCede surge con el objetivo principal de conocer los modelos asistenciales de atención al paciente con ERC en todas las fases de la enfermedad y consensuar, por un panel de expertos multidisciplinar, los factores clave para un modelo óptimo de atención, definiendo una hoja de ruta para todos los agentes decisores e implicados en el abordaje de esta patología.
El consenso que se presenta en este artículo ha sido avalado por las siguientes SSCC: Sociedad Española de Nefrología (S.E.N.), Sociedad Española de Médicos de Atención Primaria (SEMERGEN), Sociedad Española de Médicos Generales y de Familia (SEMG), Sociedad Española de Medicina de Familia y Comunitaria (semFYC), Sociedad Española de Directivos de Atención Primaria (SEDAP), Sociedad Española de Medicina Interna (SEMI), Sociedad Española de Endocrinología y Nutrición (SEEN), Fundación Red de Grupos de Estudio de la Diabetes en Atención Primaria de la Salud (redGDPS) y la Sociedad Española de Directivos de la Salud (SEDISA).
Material y métodosSe trata de un estudio con metodología RAND Corporation y Universidad de California en Los Ángeles con Delphi adaptado (Delphi-RAND/UCLA) a través de dos rondas de valoración individual llevadas a cabo por un panel multidisciplinar de expertos durante las que se valoraron la adecuación (primera ronda) y la necesidad (segunda ronda) de los factores claves identificados para un modelo óptimo de atención en ERC.
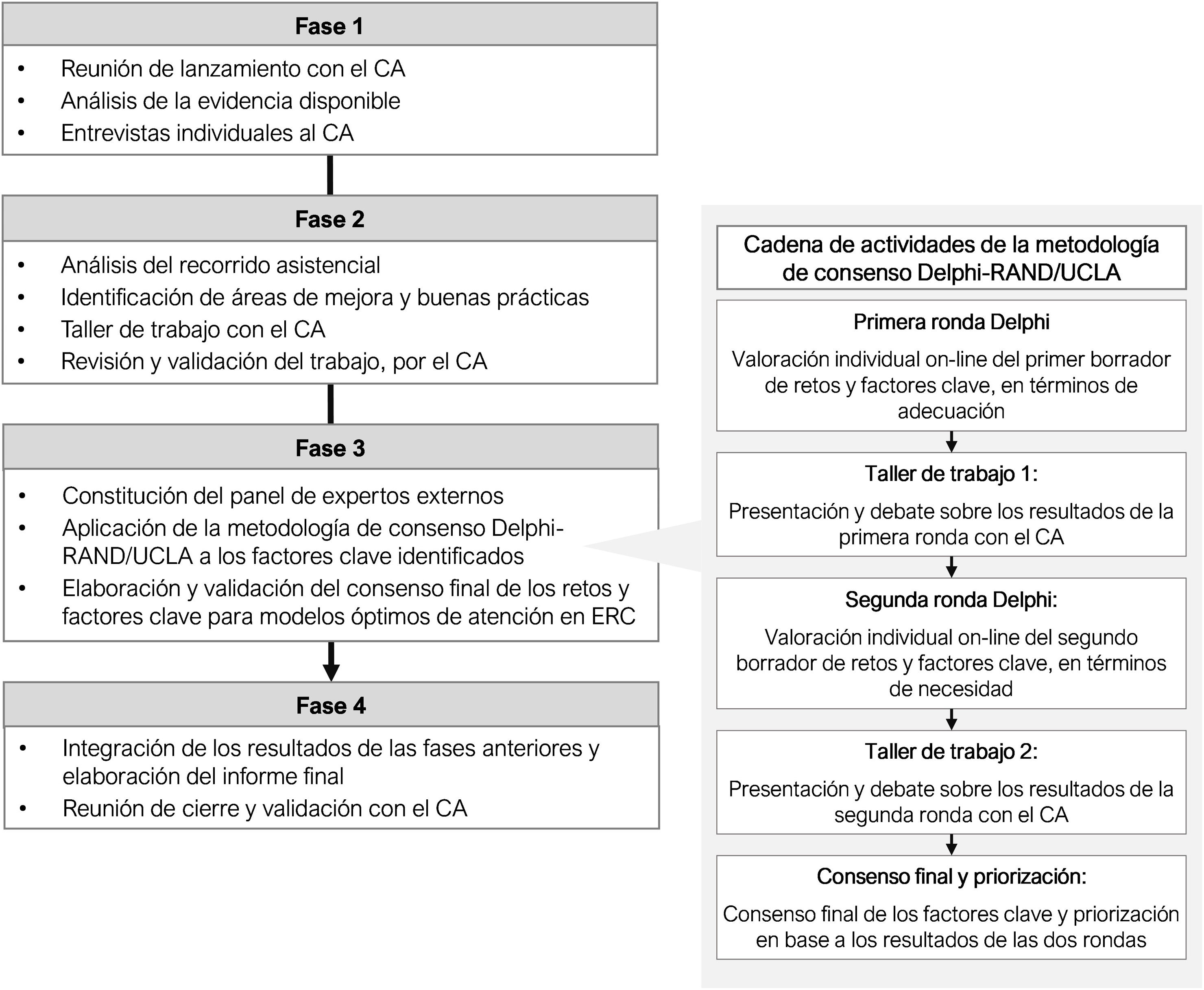
La metodología se desarrolló en cuatro fases de trabajo (fig. 1).
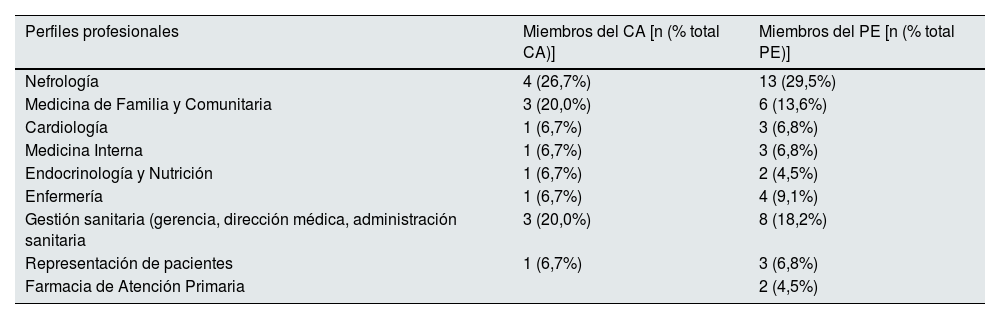
En primer lugar, se definió un comité asesor (CA) multidisciplinar, constituido por 15 profesionales (tabla 1) con amplia experiencia y conocimiento en el campo de la ERC. También se contó con la colaboración de un asesor metodológico externo para la coordinación y dinamización del proyecto.
Perfiles profesionales que formaron parte del comité asesor del proyecto
| Perfiles profesionales | Miembros del CA [n (% total CA)] | Miembros del PE [n (% total PE)] |
|---|---|---|
| Nefrología | 4 (26,7%) | 13 (29,5%) |
| Medicina de Familia y Comunitaria | 3 (20,0%) | 6 (13,6%) |
| Cardiología | 1 (6,7%) | 3 (6,8%) |
| Medicina Interna | 1 (6,7%) | 3 (6,8%) |
| Endocrinología y Nutrición | 1 (6,7%) | 2 (4,5%) |
| Enfermería | 1 (6,7%) | 4 (9,1%) |
| Gestión sanitaria (gerencia, dirección médica, administración sanitaria | 3 (20,0%) | 8 (18,2%) |
| Representación de pacientes | 1 (6,7%) | 3 (6,8%) |
| Farmacia de Atención Primaria | 2 (4,5%) |
CA: comité asesor; PE: panel de expertos.
Durante las dos primeras fases se realizó un diagnóstico de la atención a la ERC en España y se analizó el recorrido asistencial del paciente con ERC. Para ello, se incluyó una revisión narrativa de la bibliografía, así como entrevistas semiestructuradas individuales al CA y un taller de trabajo. Como resultado, se obtuvo una propuesta preliminar de los retos y factores clave para un modelo óptimo de atención en ERC, que fue presentado en formato de cuestionario estructurado para su valoración en la fase 3.
Para la valoración de estos retos y factores clave identificados, se constituyó un panel multidisciplinar adicional de 44 expertos (tabla 1). En conjunto, el panel Delphi (CA y panel de expertos) estuvo conformado por 59 especialistas con representación de diferentes modelos asistenciales y áreas geográficas, todos ellos con experiencia y conocimiento en ERC desde su perfil y ámbito profesional.
Para el consenso y priorización de la propuesta de factores clave se realizaron dos rondas de valoración a través del cuestionario estructurado mediante una plataforma online, utilizando la metodología de consenso RAND/UCLA17 (Delphi adaptado) (fig. 1, derecha). Ambas se realizaron en enero y marzo de 2023, respectivamente.
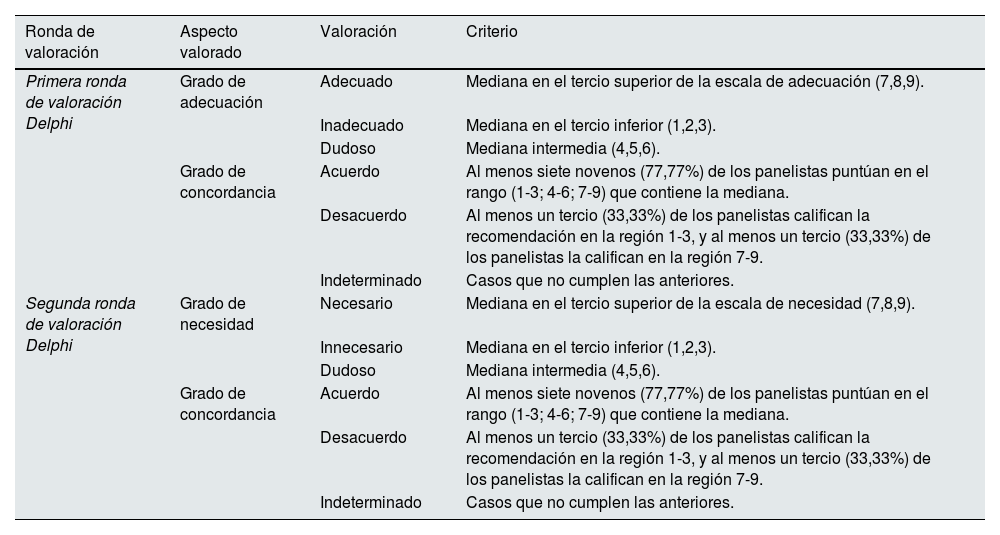
Durante las rondas de valoración individuales para determinar la adecuación y necesidad de los factores clave, se empleó la escala ordinal de tipo Likert de 1 a 9 puntos. Las categorías de respuesta se describieron mediante calificadores lingüísticos en tres regiones (1-3: inadecuado o innecesario; 4-6: opinión ni a favor ni en contra, dudoso; 7-9: adecuado o necesario). En ambas, los expertos pudieron aportar comentarios y observaciones. No estaba permitido intercambiar información entre panelistas, y los factores clave no puntuados se analizaron como casos perdidos a efectos estadísticos. Los datos obtenidos en las dos rondas se analizaron estadísticamente (a través de Microsoft Excel) para medir el grado de adecuación, de necesidad y de concordancia, empleando las siguientes métricas: frecuencia, mediana, rango intercuartílico, promedio y desviación estándar.
Durante la primera ronda, el panel Delphi valoró la adecuación de la propuesta preliminar de retos y factores determinantes. La aplicación del elemento clave se consideró adecuado cuando el beneficio para la salud que se espera obtener de su uso supera con un gran margen a las posibles consecuencias negativas o riesgos que se puedan producir. Cada factor se analizó y clasificó de acuerdo con el grado de adecuación y de concordancia de las respuestas (tabla 2). Tras ello, se realizó un taller de trabajo con el CA, en el que se debatieron especialmente los elementos clave con consenso indeterminado, y aquellos que presentaban propuestas de ajustes de redacción o mayor disparidad.
Metodología adaptada de RAND/UCLA utilizada para la valoración de los factores clave: grado de educación, necesidad y concordancia
| Ronda de valoración | Aspecto valorado | Valoración | Criterio |
|---|---|---|---|
| Primera ronda de valoración Delphi | Grado de adecuación | Adecuado | Mediana en el tercio superior de la escala de adecuación (7,8,9). |
| Inadecuado | Mediana en el tercio inferior (1,2,3). | ||
| Dudoso | Mediana intermedia (4,5,6). | ||
| Grado de concordancia | Acuerdo | Al menos siete novenos (77,77%) de los panelistas puntúan en el rango (1-3; 4-6; 7-9) que contiene la mediana. | |
| Desacuerdo | Al menos un tercio (33,33%) de los panelistas califican la recomendación en la región 1-3, y al menos un tercio (33,33%) de los panelistas la califican en la región 7-9. | ||
| Indeterminado | Casos que no cumplen las anteriores. | ||
| Segunda ronda de valoración Delphi | Grado de necesidad | Necesario | Mediana en el tercio superior de la escala de necesidad (7,8,9). |
| Innecesario | Mediana en el tercio inferior (1,2,3). | ||
| Dudoso | Mediana intermedia (4,5,6). | ||
| Grado de concordancia | Acuerdo | Al menos siete novenos (77,77%) de los panelistas puntúan en el rango (1-3; 4-6; 7-9) que contiene la mediana. | |
| Desacuerdo | Al menos un tercio (33,33%) de los panelistas califican la recomendación en la región 1-3, y al menos un tercio (33,33%) de los panelistas la califican en la región 7-9. | ||
| Indeterminado | Casos que no cumplen las anteriores. |
En la segunda ronda, se evaluó la necesidad de la propuesta de factores clave ajustada tras el consenso y valoración de los resultados obtenidos después del taller de trabajo. Se consideró necesario un elemento clave cuando cumplía los siguientes cuatro criterios: apropiado, sería inadecuado o mala práctica no llevarlo a cabo, existe una posibilidad razonable de que este favorezca al paciente, y la magnitud del beneficio esperado no es pequeña. Cada uno se analizó y clasificó de acuerdo con el grado de necesidad y el de concordancia de las respuestas (tabla 2). Tras esta ronda, se realizó otro taller de trabajo con el CA, en el que se debatieron los factores determinantes con necesidad dudosa, y aquellos en los que se habían aportado consideraciones.
Finalmente, se obtuvo el listado definitivo de retos y factores clave para un modelo óptimo de atención al paciente con ERC. Se consideraron como prioritarios los que obtuvieron un promedio de ocho o mayor tanto en términos de adecuación como de necesidad. Los resultados se integraron en un informe final.
En este proyecto no se recopilaron datos de pacientes, por lo que no fue necesaria ninguna revisión o aprobación por parte de los comités éticos (CEIm) de los hospitales participantes.
ResultadosA partir del análisis de los patrones de atención actuales y la determinación de las principales rutas del paciente, el CA identificó una serie de características mínimas para los modelos óptimos de atención en ERC: 1) prevención de la enfermedad y cribado periódico a los pacientes con factores de riesgo; 2) diagnóstico precoz y el registro adecuado del mismo desde todos los niveles asistenciales; 3) seguimiento integral e individualizado; 4) proactividad, integración y coordinación entre ámbitos, especialidades y niveles asistenciales; 5) refuerzo de la formación y concienciación de pacientes y profesionales sanitarios en todo el recorrido asistencial; 6) evaluación de resultados en salud y de la calidad de vida, experiencia y perspectiva de la persona; 7) desarrollo de sistemas de información que faciliten las distintas etapas del proceso asistencial.
Considerando estas características, además del análisis de las principales áreas de mejora y buenas prácticas asistenciales, se establecieron los principales retos y factores clave para avanzar en el desarrollo de modelos óptimos de atención en ERC.
En la primera ronda Delphi, se valoraron un total de siete retos y 68 factores clave inicialmente identificados. De estos 68, 59 fueron valorados como adecuados y con acuerdo, mientras nueve obtuvieron un consenso indeterminado. Tras las deliberaciones del CA durante el taller de trabajo, y con base en las consideraciones aclaratorias y observaciones de mejora realizadas por los panelistas, se identificaron sinergias entre distintos factores clave, integrándolos en aquellos más precisos y evitando la dispersión de la información (Figura suplementaria 1). Ninguno fue eliminado. Además, se realizaron cambios de redacción sobre la propuesta inicial para garantizar una valoración precisa y alineada con una comprensión clara. Como resultado, se obtuvo un listado final de 38 elementos clave, estructurados en cuatro retos (tabla 3), los cuales fueron sometidos a una segunda ronda de valoración.
Retos para alcanzar el modelo óptimo de atención al paciente con ERC
| Retos para un modelo óptimo de atención en ERC | Número de factores clave incluidos |
|---|---|
| 1) Desarrollo de modelos de gestión de la ERC y aumento de la visibilidad de la enfermedad | 12 |
| 2) Prevención, optimización del cribado, diagnóstico precoz y registro de la ERC en todos los niveles asistenciales. | 5 |
| 3) Seguimiento integral, multidisciplinar y coordinado, asegurando la optimización terapéutica y la continuidad asistencial. | 15 |
| 4) Refuerzo de la formación en ERC a los profesionales sanitarios y pacientes. | 6 |
El reto 1 surgió a raíz de considerar la insuficiente visibilidad y priorización de la ERC a todos los niveles y en los modelos y herramientas específicas de macro, meso y microgestión. Los retos 2 y 3 surgieron de la descripción del recorrido asistencial y del margen de mejora existente actualmente en cuanto a la prevención, cribado y detección precoz de la ERC, así como de la necesidad de garantizar un abordaje integral e individualizado del paciente y la coordinación entre los distintos profesionales implicados. Por último, el reto 4 surgió de la necesidad de formación de los profesionales de la salud y de los propios pacientes y familiares/cuidadores, como aspectos clave necesarios para optimizar el modelo asistencial.
Tras la segunda ronda de valoración, de los 38 factores clave, 35 fueron considerados adecuados y claramente necesarios, mientras tres fueron tomados como adecuados, pero no claramente necesarios. La puntuación y calificación final obtenida por cada uno de los elementos clave se detalla en la Tabla suplementaria 1. En los casos en los que el factor era resultado de la integración de dos o más, la adecuación se calculó como el promedio de la adecuación de los aspectos clave unificados. La puntación media de los retos en términos de necesidad fue de 8, a excepción del segundo reto, que obtuvo la puntuación más alta con un promedio de necesidad de 9.
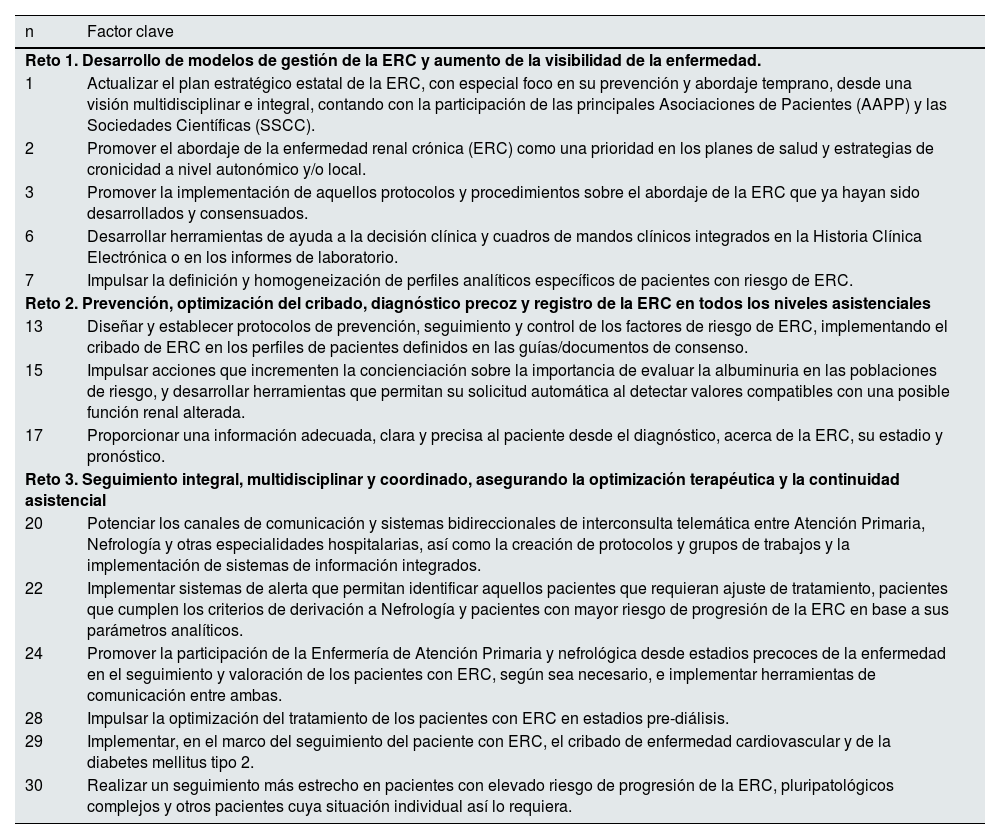
Como resultado final se detectaron un total de 14 factores clave que se consideraron altamente prioritarios (tabla 4). En la figura suplementaria 2 se representa una matriz de priorización de todos los elementos clave en función del promedio de adecuación y de necesidad. Ninguno de los factores del reto 4 fueron considerados como prioritarios.
Factores clave prioritarios según reto
| n | Factor clave |
|---|---|
| Reto 1. Desarrollo de modelos de gestión de la ERC y aumento de la visibilidad de la enfermedad. | |
| 1 | Actualizar el plan estratégico estatal de la ERC, con especial foco en su prevención y abordaje temprano, desde una visión multidisciplinar e integral, contando con la participación de las principales Asociaciones de Pacientes (AAPP) y las Sociedades Científicas (SSCC). |
| 2 | Promover el abordaje de la enfermedad renal crónica (ERC) como una prioridad en los planes de salud y estrategias de cronicidad a nivel autonómico y/o local. |
| 3 | Promover la implementación de aquellos protocolos y procedimientos sobre el abordaje de la ERC que ya hayan sido desarrollados y consensuados. |
| 6 | Desarrollar herramientas de ayuda a la decisión clínica y cuadros de mandos clínicos integrados en la Historia Clínica Electrónica o en los informes de laboratorio. |
| 7 | Impulsar la definición y homogeneización de perfiles analíticos específicos de pacientes con riesgo de ERC. |
| Reto 2. Prevención, optimización del cribado, diagnóstico precoz y registro de la ERC en todos los niveles asistenciales | |
| 13 | Diseñar y establecer protocolos de prevención, seguimiento y control de los factores de riesgo de ERC, implementando el cribado de ERC en los perfiles de pacientes definidos en las guías/documentos de consenso. |
| 15 | Impulsar acciones que incrementen la concienciación sobre la importancia de evaluar la albuminuria en las poblaciones de riesgo, y desarrollar herramientas que permitan su solicitud automática al detectar valores compatibles con una posible función renal alterada. |
| 17 | Proporcionar una información adecuada, clara y precisa al paciente desde el diagnóstico, acerca de la ERC, su estadio y pronóstico. |
| Reto 3. Seguimiento integral, multidisciplinar y coordinado, asegurando la optimización terapéutica y la continuidad asistencial | |
| 20 | Potenciar los canales de comunicación y sistemas bidireccionales de interconsulta telemática entre Atención Primaria, Nefrología y otras especialidades hospitalarias, así como la creación de protocolos y grupos de trabajos y la implementación de sistemas de información integrados. |
| 22 | Implementar sistemas de alerta que permitan identificar aquellos pacientes que requieran ajuste de tratamiento, pacientes que cumplen los criterios de derivación a Nefrología y pacientes con mayor riesgo de progresión de la ERC en base a sus parámetros analíticos. |
| 24 | Promover la participación de la Enfermería de Atención Primaria y nefrológica desde estadios precoces de la enfermedad en el seguimiento y valoración de los pacientes con ERC, según sea necesario, e implementar herramientas de comunicación entre ambas. |
| 28 | Impulsar la optimización del tratamiento de los pacientes con ERC en estadios pre-diálisis. |
| 29 | Implementar, en el marco del seguimiento del paciente con ERC, el cribado de enfermedad cardiovascular y de la diabetes mellitus tipo 2. |
| 30 | Realizar un seguimiento más estrecho en pacientes con elevado riesgo de progresión de la ERC, pluripatológicos complejos y otros pacientes cuya situación individual así lo requiera. |
El estudio realizado permitió identificar diversos aspectos para avanzar hacia modelos óptimos de atención en ERC con un alto nivel de acuerdo y unanimidad (Tabla suplementaria 1). Se demostró el consenso existente sobre la necesidad de priorización de la ERC a nivel social y de las autoridades sanitarias, así como de fomentar un cambio de paradigma hacia su prevención y abordaje precoz, garantizando un seguimiento integral, multidisciplinar y coordinado durante todo el proceso de enfermedad y la formación y concienciación de profesionales, pacientes y familiares/cuidadores. Hasta la fecha y tras revisión de la literatura científica, este es el primer trabajo que identifica los retos y factores clave para avanzar en el desarrollo e implementación de modelos óptimos de atención en ERC a nivel nacional.
Las 38 recomendaciones o factores clave propuestos pretenden servir como base para, atendiendo a los modelos locales y los recursos disponibles, avanzar en el desarrollo de modelos óptimos en ERC adaptados en todo el territorio nacional e incrementar así la calidad de la atención.
La discusión se estructura por retos y se centra especialmente en aquellos factores clave prioritarios, ya que son los que marcan el inicio más inmediato de la hoja de ruta. Una vez implementados los elementos esenciales, los demás básicos identificados deberían ir incorporándose de manera progresiva.
Reto 1. Desarrollo de modelos de gestión de la enfermedad renal crónica y aumento de la visibilidad de la enfermedadSe obtuvo un claro consenso en relación con la necesidad de desarrollar líneas de planificación o modelos específicos de gestión en ERC a todos los niveles clave para la implementación de estrategias que permitan lograr mejores resultados para los pacientes y mitigar la carga y morbimortalidad asociada a la enfermedad5,9,18. Se consideró de elevada importancia disponer de un plan estratégico nacional actualizado y específico de la ERC, para una gestión eficiente y coordinada de los recursos. A pesar de que las políticas nacionales en ERC han sido reconocidas como elementos esenciales en los sistemas sanitarios7,19, solo un tercio de los países a nivel mundial las ha adoptado7.
Actualmente, hay fármacos nefroprotectores20 que han demostrado que retrasan la progresión de la enfermedad renal y su morbimortalidad asociada, por lo que este consenso identifica la prevención y abordaje temprano de la ERC como elementos centrales de las políticas sanitarias.
Los resultados del estudio realzan la necesidad de implementar los protocolos consensuados, como estrategia para reforzar la calidad asistencial21. No obstante, las tasas de cumplimiento de las recomendaciones establecidas para el seguimiento de los factores de riesgo en ERC son inferiores a la deseadas22. Además, se alcanzó una unanimidad en cuanto a la evaluación de resultados mediante la implementación de indicadores y objetivos, especialmente en estadios precoces de la enfermedad. En España, han sido varios los intentos de implantar indicadores de calidad en Nefrología como método de gestión para mejorar los resultados de los pacientes23. Sin embargo, la falta de apoyo institucional junto a la escasa sintomatología hasta fases avanzadas del proceso de la patología, han dificultado la puesta en marcha de este tipo de iniciativas.
Se debe seguir trabajando de manera prioritaria en el desarrollo de sistemas de ayuda a la decisión clínica y en la definición estandarizada de perfiles analíticos específicos para pacientes con riesgo de ERC. Este tipo de herramientas todavía tienen un desarrollo insuficiente y poco homogéneo a nivel nacional24.
Con el objetivo de lograr una visión integral, debería implicarse a las asociaciones de pacientes (AAPP) y familiares en la formulación y evaluación de los planes, estrategias y protocolos, en línea con las tendencias observadas a nivel europeo21, si bien en España el rol del paciente en este ámbito se encuentra en fases muy tempranas.
Reto 2. Prevención, optimización del cribado, diagnóstico precoz y registro de la enfermedad renal crónica en todos los niveles asistencialesLa prevención de la ERC, la realización del cribado en los pacientes con factores de riesgo y la detección precoz de la enfermedad fueron reconocidas como prioridades más acuciantes a abordar, dada la falta de implementación sistemática del cribado de ERC y el infradiagnóstico y retraso diagnóstico existente2,12–14.
La accesibilidad de las pruebas de cribado en el SNS y la disponibilidad de intervenciones terapéuticas eficaces para retrasar la progresión de la ERC y reducir el riesgo cardiovascular25, junto con los argumentos ya descritos, suponen conclusiones clave para impulsar de manera definitiva la detección temprana de la ERC en España y el cambio de paradigma hacia la prevención primaria y secundaria. Estudios recientes han demostrado que la detección de ERC es coste-efectiva en pacientes de riesgo26, incluso a nivel poblacional a través de la detección de albuminuria27.
Sin embargo, actualmente, la detección de la ERC mediante la estimación del filtrado glomerular y la realización del cociente albúmina/creatinina (ACR) en orina es aproximadamente de 50% en las situaciones más favorables28,29, lo que recalca la necesidad de fomentar la búsqueda activa de la enfermedad a través de una mayor concienciación y el desarrollo de herramientas que permitan la solicitud automática de albuminuria. Todo ello, para facilitar la detección temprana de la ERC, pues se ha observado que retrasar un año el diagnóstico de la ERC en estadio III incrementa el riesgo de progresión en 40%30.
Por otra parte, estudios recientes en España muestran que, aunque el uso de fármacos antidiabéticos con beneficios cardiorrenales demostrados ha aumentado con el paso de los años, su utilización sigue siendo insuficiente31.
La situación descrita influye negativamente en el pronóstico de los pacientes, en su calidad de vida, así como en la carga y costes asociados, que se acentúan a medida que progresa la ERC8–10,32,33.
La implementación sistemática del cribado debe complementarse con el registro o codificación del diagnóstico de ERC en todos los niveles asistenciales, como ya se incluía en el Documento Marco de ERC de 201511. El registro del diagnóstico de la ERC se considera un aspecto fundamental para reducir el riesgo de progresión y minimizar los resultados clínicos adversos30. Nuevas evidencias en vida real han demostrado que la prevalencia de la ERC en estadio III no diagnosticada/registrada es de 62-96%, manteniéndose elevada incluso en pacientes con comorbilidades con alto riesgo de progresión de la enfermedad13.
Es decir, a pesar de que se cuenta con recursos eficaces para la prevención, detección y tratamiento temprano de la ERC, no se han adoptado medidas globales en este ámbito.
Asimismo, durante el estudio se destacó la importancia de proporcionar una información adecuada, clara y precisa al paciente desde el diagnóstico, teniendo en cuenta su estado emocional. Según el manifiesto de las personas con enfermedades renales presentado en 2015, los pacientes con ERC deben recibir una información y asesoramiento que les ayude realmente a tomar decisiones compartidas en este momento clave de sus vidas34. El asesoramiento a sujetos de riesgo sobre la sintomatología y progresión de la ERC podría contribuir a detectar la ERC en fases más iniciales y mejorar su pronóstico, como sugieren los resultados de la encuesta europea realizada en 202335.
Por último, es destacable que, aunque 21% de los factores clave priorizados se encuentran dentro del reto 2, un análisis del conjunto completo de los factores prioritarios reveló que 64% de ellos están directamente relacionados o contienen en cierta medida la importancia del diagnóstico y abordaje precoz de la ERC. Esto refuerza la urgencia de priorizar intervenciones asociadas con la prevención, optimización del cribado y diagnóstico precoz de la ERC.
Reto 3. Seguimiento integral, multidisciplinar y coordinado, asegurando la optimización terapéutica y la continuidad asistencialDistintos estudios demuestran los beneficios de los modelos multidisciplinares de atención al paciente con ERC, incluyendo un mayor coste-efectividad y coordinación en la atención36,37. Se obtuvo consenso sobre la importancia de incorporar una visión holística en estos modelos, incluyendo prestaciones como el soporte nutricional, psicológico, sociosanitario y comunitario individualizado, que posicione la reducción de los síntomas y del impacto de la enfermedad en la vida diaria como parte clave del abordaje, pues son los aspectos más priorizados por los pacientes según diferentes estudios38,39.
Se consideró prioritario garantizar una comunicación fluida y bidireccional entre Atención Primaria y Nefrología. La necesidad de optimizar el proceso de derivación a Nefrología se ha evidenciado en diferentes estudios40–42. En este sentido, los panelistas coinciden en que el desarrollo de sistemas de interconsulta telemática y canales de comunicación eficientes contribuiría a optimizar la coordinación y derivación adecuada entre niveles asistenciales, especialidades y recursos.
El manejo temprano y el tratamiento farmacológico de los pacientes se consideró un aspecto de especial importancia para mejorar el abordaje de esta patología, retrasar la progresión desde fases tempranas, reducir los costes y mejorar los resultados en salud de los pacientes43. Dada la elevada prevalencia de comorbilidades en los pacientes con ERC10 así como su impacto en el incremento de las hospitalizaciones y mortalidad14, se consideró esencial la optimización y conciliación del tratamiento y la definición de objetivos terapéuticos. Estos aspectos son especialmente relevantes en estadios precoces de la ERC (I-III), pues la variabilidad existente en el abordaje terapéutico y seguimiento de los pacientes tiene implicaciones sustanciales en su pronóstico44.
Para ello, el desarrollo de sistemas de alerta en la historia clínica que faciliten la prevención de la nefrotoxicidad, la derivación o la identificación de pacientes en riesgo de progresión ha sido valorado como una herramienta favorable para optimizar el seguimiento de estos a lo largo del proceso asistencial, si bien se destaca la importancia de garantizar que los sistemas sean sólidos y equilibrados45.
Reto 4. Refuerzo de la formación en enfermedad renal crónica a los profesionales sanitarios y pacientesSe reconoció de manera unánime la importancia de la formación continua de los profesionales de la salud y de los propios pacientes y familiares o cuidadores, como parte integral del abordaje de la ERC. El hecho de que ningún factor clave resultase prioritario en este reto podría deberse a que, en el contexto actual, se considera necesario enfocar los esfuerzos en otros elementos que necesitarían en mayor medida de un avance y desarrollo prioritario. Además, los resultados son coherentes con la composición del panel Delphi, haciendo referencia a la existencia de un posible sesgo en este sentido.
La formación continua, completa y adaptada de las personas con ERC en el momento emocional más adecuado es un aspecto clave para lograr un mayor control sobre su salud, así como para poder participar en la toma de decisiones compartida34,46. Las barreras para una educación eficaz del paciente con ERC incluyen la insuficiente concienciación y la escasez de personal y tiempo para reforzar la formación47. Se identifica, además, limitada evidencia sobre la formación en toma de decisiones compartida de los profesionales sanitarios que atienden a sujetos con ERC48.
Se han desarrollado diferentes iniciativas en España para apoyar el empoderamiento y formación de los pacientes con ERC, impulsadas tanto desde las AAPP como desde el entorno sanitario y las SSCC. De la misma manera, las CCAA están desarrollando distintas acciones para reforzar la formación en ERC de los profesionales sanitarios. La creciente capacidad y acceso a la tecnología brindan nuevas oportunidades para mejorar la educación y concienciación en ERC de todas las partes interesadas49.
Como principales limitaciones del estudio, habría sido deseable la participación de un panel de expertos más amplio para alcanzar mayor representación de las distintas especialidades, así como la inclusión de otros profesionales como trabajo social y psicología y de un mayor número y diversidad de pacientes, de diferente complejidad y circunstancias, así como de sus cuidadores.
ConclusionesLos resultados del proyecto muestran que existe consenso sobre la necesidad de priorizar la atención de la ERC tanto a nivel institucional como social, así como de fomentar un cambio de paradigma hacia su prevención y abordaje precoz, garantizando un seguimiento integral, multidisciplinar y coordinado durante todo el proceso de la enfermedad y la formación y concienciación de profesionales, pacientes y familiares/cuidadores.
Por primera vez, el presente trabajo aporta una hoja de ruta para avanzar hacia la definición de modelos óptimos de atención en ERC bajo una perspectiva multidisciplinar, a través de iniciativas y actuaciones potencialmente implantables a corto plazo en las distintas áreas sanitarias de España.
AgradecimientosLos autores agradecen a todas las personas que han colaborado en el desarrollo del proyecto intERCede y en la elaboración de este artículo. Los autores cumplen con los criterios de autoría recomendados por el Comité Internacional de Editores de Revistas Médicas (ICMJE) y no recibieron pagos relacionados con el desarrollo de este manuscrito.
Ascendo Sanidad&Farma ha proporcionado asistencia editorial en la redacción del mismo, que fue contratado y financiado por Boehringer Ingelheim (BI) España. BI tuvo la oportunidad de revisar el manuscrito para verificar su exactitud médica y científica, así como posibles consideraciones de propiedad intelectual.
FinanciaciónEste proyecto Delphi intERCede ha sido coordinado por Ascendo Sanidad&Farma, con el apoyo y la financiación de Boehringer Ingelheim (BI) España. BI no influyó en las opiniones de los expertos participantes ni en el consenso final.
Conflicto de interesesJosé Luis Górriz ha recibido honorarios por conferencias de AstraZeneca, Menarini, Boehringer-Ingelheim, Lillly, Bayer y Novo Nordisk. Ha participado en advisory boards de Menarini, Boehringer-Ingelheim, AstraZeneca y Bayer.
Roberto Alcázar Arroyo ha recibido honorarios por actividades de formación continuada de AstraZeneca, Boehringer-Ingelheim, Lilly, Bayer, Vifor-cls y Novo Nordisk. Ha participado en advisory boards de Boehringer-Ingelheim, AstraZeneca y Bayer.
Patricia Arribas ha recibido honorarios por parte de Boehringer-Ingelheim.
Sara Artola ha recibido honorarios por conferencias de AstraZeneca, Menarini, MSD, Sanofi, Boehringer-Ingelheim, Lillly, Bayer, Almirall y Novo Nordisk. Ha participado en advisory boards de Menarini, MSD, AstraZeneca y Alter.
Sergio Cinza-Sanjurjo ha recibido honorarios por conferencias de AstraZeneca, Boehringer-Ingelheim, Lillly y Bayer. Ha participado en advisory boards de Boehringer-Ingelheim y Bayer. Ha recibido financiación para investigación de AstraZeneca, Boehringer-Ingelheim y Bayer.
Rafael de la Espriella ha recibido honorarios por conferencias de AstraZeneca, Boehringer-Ingelheim, Lillly, Bayer, Novartis, Pfizer, Daiichi Sankyo, y Novo Nordisk. Ha participado en advisory boards de Boehringer-Ingelheim, AstraZeneca, Pfizer y Bayer.
Javier Escalada ha recibido honorarios por conferencias de AstraZeneca, Boehringer-Ingelheim, Esteve, Lillly y Novo Nordisk. Ha participado en advisory boards de AstraZeneca, Boehringer-Ingelheim, Lilly y Novo Nordisk.
Lisardo García-Matarín ha recibido honorarios por conferencias AstraZeneca, Boehringer-Ingelheim, Lilly, Chiesi, GlaxoSmithKline, Bial, Menarini, Teva, Novartis, Pfizer, Sanofi Aventis, FAES, Novo Nordisk y Vifor Pharma. Ha participado en advisory boards de Boehringer-Ingelheim, AstraZeneca, Daiichi Sankyo y GlaxoSmithKline.
Juan Carlos Julián declara que su entidad, la Federación Nacional de Asociaciones ALCER, recibe o ha recibido en los últimos tres años ingresos en compensación por su participación en consejos asesores para las compañías Astellas Pharma Europe LTD, Astrazeneca, Bristol-Myers Squibb, Bayer Hispania, Boehringer-Ingelheim, Ipsen Pharma, GlaxoSmithKline, Hansa Biopharma AB, Novartis Inc., Novartis Farmacéutica, Pfizer Ltd., y Travere Therapeutics. La Federación Nacional de Asociaciones ALCER recibe o ha recibido en los últimos tres años aportaciones económicas por colaboraciones empresariales en el marco de la Ley de Mecenazgo española, por parte de las compañías Astellas, Astrazeneca, Baxter, Bayer, Bristol-Myers Squibb, Bayer Hispania, Boehringer-Ingelheim, Chiesi, CSL Vifor, Deiters, Diaverum, Fresenius Medical Care, GlaxoSmithKline, Hansa Biopharma, Ipsen, Novartis, Pfizer y Sanofi.
José Pablo Miramontes González ha recibido honorarios por conferencias de Boehringer-Ingelheim, Lillly y Novo Nordisk. Ha participado en advisory boards de Novo Nordisk.
Félix Rubial ha recibido honorarios por ponencias de Astellas, AstraZeneca, Boehringer-Ingelheim, Pfizer y Sandoz.
Mercedes Salgueira ha recibido honorarios por conferencias y participación en advisory boards de AstraZeneca, Vifor, GlaxoSmithKline, Amgen y Boehringer-Ingelheim.
María José Soler ha recibido honorarios por conferencias de AstraZeneca, Boehringer-Ingelheim, Lilly, Bayer, Vifor, ICU Medical, Fresenius, Travere Therapeutics y Novo Nordisk. Ha participado en advisory boards de Novo Nordisk, Menarini, Boehringer-Ingelheim, AstraZeneca, Mundipharma, Vifor, ICU Medical, GE Healthcare, Travere Therapeutics y Bayer.
José Luis Trillo Mata ha recibido honorarios por conferencias de AstraZeneca, Boehringer-Ingelheim, Lillly y Novo Nordisk. Ha participado en advisory boards de Boehringer-Ingelheim, AstraZeneca y Bayer.