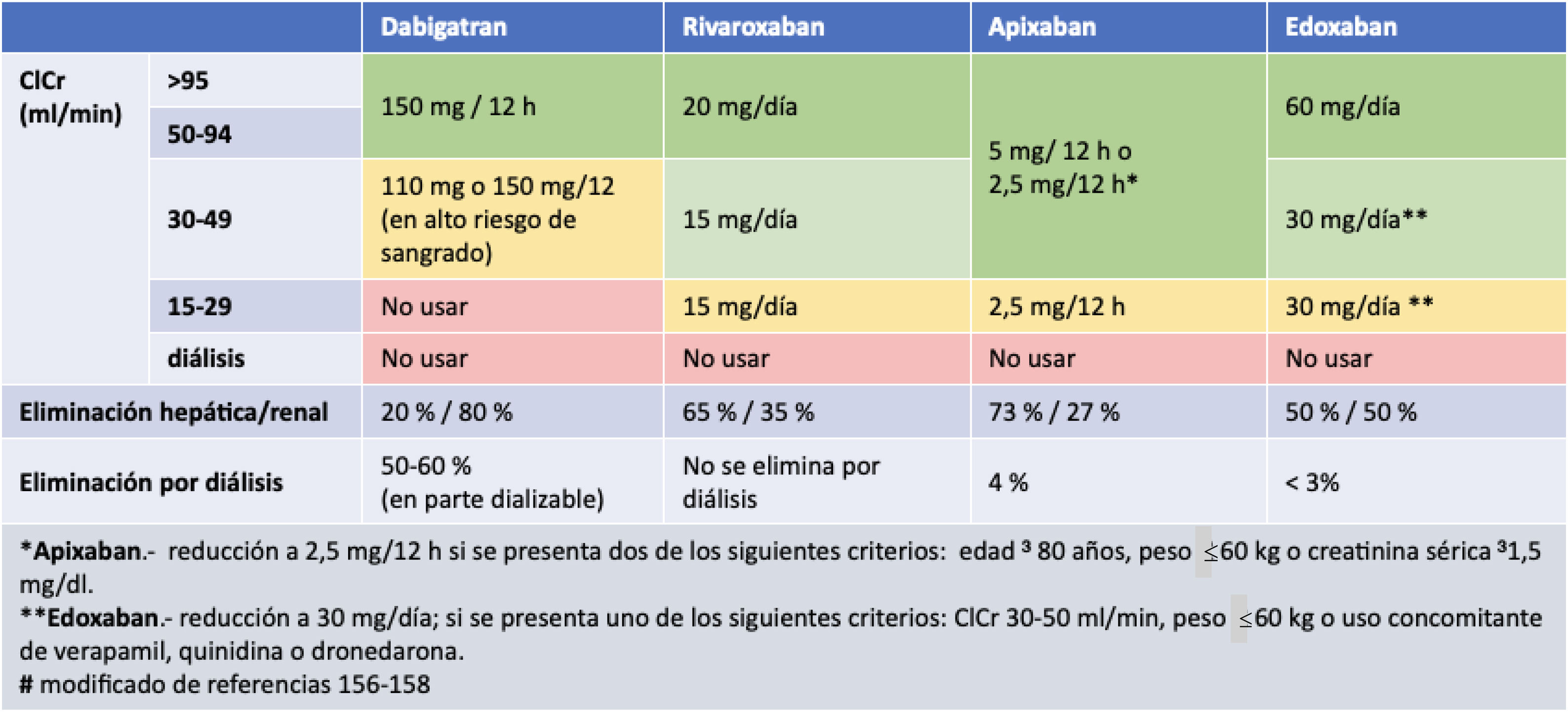
La enfermedad renal crónica (ERC) es un importante problema de salud pública a nivel mundial afectando a más del 10% de la población española. Se asocia a elevada comorbilidad, mal pronóstico, así como a un gran consumo de recursos en el sistema sanitario. Desde la publicación del último documento de consenso sobre ERC publicado hace siete años, han sido escasas las evidencias y los ensayos clínicos que hayan mostrado nuevas estrategias en el diagnóstico y tratamiento de la ERC, con excepción de los nuevos ensayos en la enfermedad renal diabética. Esta situación ha condicionado que no se hayan actualizado las guías internacionales específicas de ERC. Esta rigidez y actitud conservadora de las guías no debe impedir la publicación de actualizaciones en el conocimiento en algunos aspectos, que pueden ser clave en la detección y manejo del paciente con ERC. En este documento, elaborado en conjunto por diez sociedades científicas, se muestra una actualización sobre conceptos, aclaraciones, criterios diagnósticos, estrategias de remisión y nuevas opciones terapéuticas.
Se han revisado las evidencias y los principales estudios publicados en estos aspectos de la ERC, considerándose más bien un documento de información sobre esta patología. El documento incluye una actualización sobre la detección de la ERC, factores de riesgo, cribado, definición de progresión renal, actualización en los criterios de remisión con nuevas sugerencias en la población anciana, monitorización y estrategias de prevención de la ERC, manejo de comorbilidades asociadas, especialmente en diabetes mellitus, funciones del médico de Atención Primaria en el manejo de la ERC y qué no hacer en Nefrología.
El objetivo del documento es que sirva de ayuda en el manejo multidisciplinar del paciente con ERC basado en las recomendaciones y conocimientos actuales.
Chronic kidney disease (CKD) is a major public health problem worldwide that affects more than 10% of the Spanish population. CKD is associated with high comorbidity rates, poor prognosis and major consumption of health system resources. Since the publication of the last consensus document on CKD seven years ago, little evidence has emerged and few clinical trials on new diagnostic and treatment strategies in CKD have been conducted, apart from new trials in diabetic kidney disease. Therefore, CKD international guidelines have not been recently updated. The rigidity and conservative attitude of the guidelines should not prevent the publication of updates in knowledge about certain matters that may be key in detecting CKD and managing patients with this disease. This document, also prepared by 10 scientific societies, provides an update on concepts, clarifications, diagnostic criteria, remission strategies and new treatment options.
The evidence and the main studies published on these aspects of CKD have been reviewed. This should be considered more as an information document on CKD. It includes an update on CKD detection, risk factors and screening; a definition of renal progression; an update of remission criteria with new suggestions in the older population; CKD monitoring and prevention strategies; management of associated comorbidities, particularly in diabetes mellitus; roles of the Primary Care physician in CKD management; and what not to do in Nephrology.
The aim of the document is to serve as an aid in the multidisciplinary management of the patient with CKD based on current recommendations and knowledge.
La enfermedad renal crónica (ERC) es un importante problema de salud pública a nivel mundial por lo que su detección precoz se considera como una prioridad sanitaria de primer orden para establecer estrategias de prevención de la progresión a estadios más avanzados de la enfermedad y de sus complicaciones1–3.
En España, los resultados del Estudio de Nutrición y Riesgo Cardiovascular (ENRICA)4 muestran una prevalencia de ERC en cualquiera de sus estadios del 15,1% para población general, similar al 14,4% de población atendida en asistencia primaria del estudio IBERICAN (Identificación de la poBlación Española de RIesgo CArdiovascular y reNal)5. Ambos estudios evidencian aumentos de prevalencia con la edad y con la enfermedad cardiovascular. Estos datos actuales difieren del 9,24% obtenido en el ya antiguo estudio EPIRCE (Epidemiología de la Insuficiencia Renal Crónica en España)6. Ello se debe en parte a diferencias metodológicas sustanciales existentes entre los estudios, pero podría también indicar cambios evolutivos en el tiempo. Todos estos datos epidemiológicos apoyan el hecho del importante problema de salud que supone la ERC.
La importancia epidemiológica de la ERC se relaciona no sólo con su elevada prevalencia sino también por la significativa disminución en la calidad de vida, elevada morbimortalidad y coste sanitario y social que ello supone. En este escenario, la Atención Primaria (AP) es un pilar fundamental no solo en la detección precoz de la ERC, sino también en el manejo de los factores de progresión e incluso en el manejo de los estadios iniciales de sus complicaciones y, en este sentido, este documento va dirigido a la colaboración multidisciplinar para la detección y manejo de la ERC.
Han pasado siete años desde la publicación del anterior documento de consenso en el que participaron diez sociedades científicas, y ha sido una verdadera referencia para el manejo del paciente renal. Desde entonces hasta ahora, nuestra guía de referencia KDIGO (Kidney Disease Improving Global Outcomes)7, publicada en 2012, no ha sufrido ninguna actualización en este campo. Pese a ello, hemos considerado oportuno actualizar sus contenidos en áreas específicas con base en la misma estructura del documento publicado en 2014. La metodología empleada se fundamenta en la revisión crítica de los principales estudios, guías clínicas sobre ERC, las nuevas guías KDIGO sobre temas específicos y escasos ensayos clínicos aleatorizados en pacientes con ERC, para poder proporcionar algunas recomendaciones o sugerencias basadas en la mejor evidencia disponible, así como para informar de nuevos aspectos que han cobrado protagonismo en la ERC.
Enfermedad renal crónica: definición y diagnósticoLa organización internacional KDIGO define a la ERC por la presencia de alteraciones de estructura o función renal durante un periodo superior a tres meses, con consecuencias para la salud independientemente de la causa7 puestas de manifiesto mediante distintos criterios (tabla 1):
- a)
El descenso del filtrado glomerular (FG) (< 60 mL/min/1,73 m2), ya sea medido con marcadores exógenos (FGm) o estimado mediante ecuaciones a partir de marcadores endógenos (FGe).
- b)
La presencia de lesión o daño renal, referido a la existencia de alteraciones estructurales o funcionales del riñón detectadas directamente en la biopsia renal o indirectamente, por la presencia de albuminuria, proteinuria, alteraciones en el sedimento urinario, en pruebas de imagen, hidroelectrolíticas o de otro tipo de origen tubular o historia de trasplante renal.
Criterios diagnósticos de enfermedad renal crónica (cualquiera de los siguientes si persisten por un periodo > 3 meses)
| Descenso del FG | FG < 60 mL/min/1,73 m2 |
|---|---|
| Marcadores de lesión o daño renal | Albuminuria (ACR > 30 mg/g; EAU: > 30 mg/24 h)Proteinuria (PR/CR > 150 mg/g; EPU > 150 mg/24 h)Alteraciones histológicas en la biopsia renalAlteraciones en el sedimento urinarioAlteraciones estructurales detectadas por técnicas de imagenTrastornos hidroelectrolíticos o de otro tipo de origen tubularHistoria de trasplante renal |
FG: filtrado glomerular; ACR: cociente albúmina/creatinina en una muestra de orina al azar; EAU: excreción de albúmina en orina de 24 h; PR/CR: cociente proteína/creatinina en una muestra de orina al azar; EPU: excreción de proteína en orina de 24 h.
Se debe destacar que un solo criterio de los dos es suficiente para diagnosticar ERC, y subrayar que la presencia de marcadores de lesión renal es imprescindible para catalogar a un paciente con ERC si su FG es > 60 mL/min/1,73 m28.
En los últimos años ha surgido un importante debate acerca de si el criterio de descenso del FG < 60 mL/min/1,73 m2 debe variar en función de la edad de los pacientes, habiendo autores que abogan a que este sea modificado en los mayores de 65 años (< 45 mL/min/1,73 m2) y en los de menos de 40 años (< 75 mL/min/1,73 m2) ya que el intervalo de FG asociado a un aumento de mortalidad es distinto a diferentes edades9,10. La utilización de umbrales de FG distintos según la edad como criterio diagnóstico de ERC produce la disminución global de la prevalencia de ERC, evita su sobrediagnóstico en población anciana sin otros criterios de ERC y baja probabilidad de progresión de la ERC y permite la detección más temprana de la misma en población joven.
Evaluación de la función renal: filtrado glomerularEl FG es el mejor índice para valorar la función renal7 y corresponde al volumen de plasma del que una substancia es totalmente eliminada por el riñón por unidad de tiempo. El valor del FG varía en relación con la edad, el sexo y la masa corporal, situándose clásicamente alrededor de 125 mL/min/1,73 m2 en individuos adultos jóvenes7, aunque estudios recientes11 lo sitúan en torno a los 106 mL/min/1,73 m2. La valoración del FG permite la identificación y clasificación en estadios de la ERC, así como monitorizar su progresión. Su disminución se asocia con mayor morbimortalidad cardiovascular y progresión hacia ERC terminal.
La medida del FG (FGm) requiere la administración de substancias exógenas (inulina, 57Cr-EDTA, 99mTc-DTPA, iotalamato, iohexol, etc.) y su determinación posterior en sangre y/u orina. Se trata de técnicas laboriosas, costosas y precisan metodología no siempre disponible en los laboratorios, por lo que su uso se relega a situaciones clínicas que requieran un conocimiento más exacto del FG (especialmente el ajuste de dosis de fármacos de elevada toxicidad y eliminación renal).
La concentración sérica de creatinina (marcador endógeno procedente del metabolismo muscular) es la prueba habitualmente utilizada para valorar la función renal. Sin embargo, las distintas fuentes de variabilidad biológica (edad, sexo, masa muscular, tipo de dieta, etc.) que afectan su concentración sérica, la falta de sensibilidad (es necesaria la pérdida del 50% o más de la función renal para que la concentración de creatinina se eleve por encima del límite superior de referencia) y su relación no lineal con el FG determinan que su medida aislada sea considerada como poco sensible, especialmente en determinados grupos de población como mujeres y ancianos.
Otros factores no relacionados con la presencia de enfermedad renal pueden modificar la concentración sérica de creatinina y dificultar su interpretación. Así, se producen aumentos en la concentración sérica de creatinina en pacientes en tratamiento con algunos fármacos (p. ej., fibratos, rilpivirina, dolutegravir, cobicistat) que producen una reducción, moderada y generalmente reversible, del FG o interferencias en su medición; tras el consumo reciente de carne o pescado (con un pico entre las 2-4 horas tras ingesta) o con la toma de suplementos con creatina, entre otros12. Por el contrario, en la enfermedad hepática grave (en la que se produce una disminución de la síntesis de creatinina), durante el embarazo (hemodilución) o la malnutrición (disminución de masa muscular) se produce una disminución de la concentración de creatinina sérica12.
En los últimos años se ha introducido la medida de un nuevo marcador endógeno, la cistatina C, una proteína de bajo peso molecular producida por todas las células nucleadas y menos influenciada que la creatinina por la edad, el género, la masa muscular o la dieta, aunque no exenta de otras fuentes de variabilidad. Así, alteraciones de la función tiroidea, administración de corticosteroides, hábito tabáquico, inflamación, obesidad o diabetes mellitus (DM), entre otros, pueden causar cambios en la concentración sérica de cistatina no relacionados con alteraciones de la función renal12.
Para evaluar la función renal, la medida de la concentración sérica de creatinina y/o cistatina C deben acompañarse de una ecuación de estimación del FG o filtrado glomerular estimado (FGe). Estas ecuaciones incluyen variables que determinan fisiológicamente su concentración sérica. Se han desarrollado múltiples ecuaciones de estimación del FG. Las diferencias fundamentales entre ellas radican en el «patrón oro» utilizado para su derivación, las características de la población a partir de la cual se han desarrollado, las magnitudes incluidas (creatinina, cistatina C o ambas), la utilización o no de métodos de medida estandarizados y el grado de concordancia con respecto al valor del FGm.
Las ecuaciones desarrolladas por el grupo Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) han mostrado su superioridad cuando son aplicadas en la población adulta y siguen siendo las recomendadas actualmente7,12–14. Existen distintas ecuaciones desarrolladas por este grupo en función de si utilizan la medida de la concentración sérica de creatinina (CKD-EPIcreatinina), cistatina (CKD-EPIcistatina) o ambas (CKD-EPIcreatinina+cistatina) (tabla 2).
Ecuaciones de estimación del FG en individuos adultos (solo validas para métodos de medida de creatinina y cistatina C estandarizados)
| CKD-EPIcreatinina | ||
| Mujeres | Crea ≤ 0,7 mg/dL | 144 x (Crea/0,7) – 0,329 x 0,993edad |
| Crea > 0,7 mg/dL | 144 x (Crea/0,7) – 1,209 x 0,993edad | |
| Hombres | Crea ≤ 0,9 mg/dL | 141 x (Crea/0,9) – 0,411 x 0,993edad |
| Crea > 0,9 mg/dL | 141 x (Crea/0,9) – 1,209 x 0,993edad | |
| CKD-EPIcistatina | ||
| Mujeres | Cis ≤ 0,8 mg/L | 133 x (Cis/0,8) – 0,499 x 0,996edad x 0,932 |
| Cis > 0,8 mg/L | 133 x (Cis/0,8) –1,328 x 0,996edad x 0,932 | |
| Hombres | Cis ≤ 0,8 mg/L | 133 x (Cis/0,8) – 0,499 x 0,996edad |
| Cis > 0,8 mg/L | 133 x (Cis/0,8) –1,328 x 0,996edad | |
| CKD-EPIcreatinina–cistatina | ||
| Mujeres | Crea ≤ 0,7 mg/dL y Cis ≤ 0,8 mg/L | 130 x (Crea/0,7) – 0,248 x (Cis/0,8) – 0,375 x 0,995edad |
| Crea ≤ 0,7 mg/dL y Cis > 0,8 mg/L | 130 x (Crea/0,7) – 0,248 x (Cis/0,8) – 0,711 x 0,995edad | |
| Crea > 0,7 mg/dL y Cis ≤ 0,8 mg/L | 130 x (Crea/0,7) – 0,601 x (Cis/0,8) – 0,375 x 0,995edad | |
| Crea > 0,7 mg/dL y Cis > 0,8 mg/L | 130 x (Crea/0,7) – 0,601 x (Cis/0,8) – 0,711 x 0,995edad | |
| Hombres | Crea ≤ 0,9 mg/dL y Cis ≤ 0,8 mg/L | 135 x (Crea/0,9) – 0,207 x (Cis/0,8) – 0,375 x 0,995edad |
| Crea ≤ 0,9 mg/dL y Cis > 0,8 mg/L | 135 x (Crea/0,9) – 0,207 x (Cis/0,8) – 0,711 x 0,995edad | |
| Crea > 0,9 mg/dL y Cis ≤ 0,8 mg/L | 135 x (Crea/0,9) – 0,601 x (Cis/0,8) – 0,375 x 0,995edad | |
| Crea > 0,9 mg/dL y Cis > 0,8 mg/L | 135 x (Crea/0,9) – 0,207 x (Cis/0,8) – 0,711 x 0,995edad |
Crea: concentración sérica de creatinina (mg/dL); Cis: concentración sérica de cistatina C (mg/L); edad (en años).
No deben utilizarse coeficientes raciales en las ecuaciones de estimación del FG
La ecuación CKD-EPIcreatinina presenta mayor exactitud en la estimación del FGm (especialmente entre valores de 60 y 90 mL/min/1,73 m2) que la ecuación de Modification of Diet in Renal Disease (MDRD) así como mayor capacidad para predecir mortalidad global, mortalidad cardiovascular o el riesgo de presentar un fracaso renal y es la propuesta como de primera elección en las guías KDIGO sobre ERC.
En los últimos años se han publicado diversas ecuaciones de estimación del FG en la población general, entre las que cabe destacar la de Lund-Malmö revisada15, la ecuación CAPA (que incluye cistatina C)16, la ecuación Full Age Spectrum (FAS)17, o más recientemente la ecuación publicada por el European Kidney Function Consortium (EKFC)18. Sin embargo, ninguna de ellas ha sido globalmente superior (en términos de sesgo, precisión y exactitud) a la ecuación de CKD-EPI-creatinina.
En determinadas situaciones clínicas la valoración de la función renal mediante la medida de la concentración sérica de creatinina y ecuaciones que la incluyen es inadecuada (tabla 3). En estos casos, la estimación del FG, puede presentar mayor incertidumbre y las estrategias propuestas incluyen: a) la determinación de la concentración sérica de cistatina C y una ecuación de estimación basada en la misma (CKD-EPI-cistatina) cuando haya estudios que respalden su uso en ese grupo de población; b) la medida del aclaramiento de creatinina, teniendo en cuenta la sobreestimación sobre el valor del FG especialmente para valores de FG < 60 mL/min/1,73m2 y los problemas asociados a la recogida en orina de 24 horas; o c) la medida del FG mediante un marcador exógeno.
Limitaciones en el uso de ecuaciones de estimación del FG basadas en la concentración sérica de creatinina
| Peso corporal extremo: IMC < 19 kg/m2 o > 35 kg/m2 |
| Dietas especiales (vegetarianos estrictos, suplementos de creatinina o creatina) o malnutrición |
| Alteraciones de la masa muscular (amputaciones, pérdida de masa muscular, enfermedades musculares o parálisis) |
| Enfermedad hepática grave, edema generalizado o ascitis |
| Embarazo |
| Insuficiencia renal aguda o deterioro agudo de la función renal en pacientes con ERC |
| Pacientes en diálisis |
| Ajuste de dosis de fármacos de elevada toxicidad y de eliminación renal |
IMC: índice de masa corporal; FG: filtrado glomerular; ERC: enfermedad renal crónica.
La ecuación (CKD-EPIcreatinina+cistatina) que incluye la concentración sérica de creatinina y cistatina C, es la que muestra mejor exactitud diagnóstica, siendo su principal indicación la confirmación de ERC en individuos con FGe entre 45-59 mL/min/1,73 m2, sin albuminuria ni otros marcadores de lesión renal. También se ha sugerido como alternativa al FGm en > de 65 años con un FG < 45 mL/min/1,73 m2 al tratarse de pacientes con frecuente disminución de masa muscular y elevado consumo de fármacos19.
Con relación al ajuste de dosis de fármacos, debe tenerse en cuenta que la ecuación de Cockcroft-Gault (C&G), utilizada clásicamente con este fin, presenta limitaciones importantes: sobreestima el FGm (al haber utilizado el aclaramiento de creatinina en su desarrollo), no ha sido reformulada para valores de creatinina obtenidos por procedimientos estandarizados y no puede ser re-expresada para los métodos actuales de medición. El FGe obtenido a partir de CKD-EPIcreatinina correlaciona mejor que el obtenido por C&G para valores inferiores a 60 mL/min/1,73 m2, que son los pacientes mayoritariamente susceptibles de necesidad de ajuste de dosis y están disponibles en los informes de los laboratorios clínicos, al contrario que C&G20,21. En aquellos pacientes con limitaciones para el uso de ecuaciones de estimación del FG, debe considerarse la valoración de la función renal mediante la utilización de un marcador exógeno22 y, en su defecto y necesidad de ajustar fármacos especialmente tóxicos en pacientes con desviaciones importantes de la superficie corporal, no se debería estandarizar el FGe a 1,73m2 (FGe x SC/1,73m2)19,23.
En cualquier caso, a pesar de todas las limitaciones mencionadas sobre el FGe, se debe tener en cuenta que toda determinación biológica está sujeta a errores y mejoras, pero es ampliamente aceptado que la definición uniforme de ERC con los métodos disponibles hasta ahora ha servido adecuadamente a pacientes y profesionales desde su implantación en el año 200224.
Evaluación de la lesión o daño renalAlbuminuria/proteinuriaLa presencia de concentraciones elevadas de proteínas o albúmina en orina constituye, junto al FG, la base del diagnóstico y clasificación actual en estadios de la ERC7.
Los adultos sanos eliminan menos de 150 mg de proteínas y menos de 30 mg de albúmina en la orina cada día. Distintos estudios han mostrado la importancia de la proteinuria en la patogenia de la progresión de la ERC, así como la relación de la albuminuria con el pronóstico renal y con la mortalidad en diversas poblaciones de modo independiente del FG y otros factores de riesgo clásicos de enfermedad cardiovascular. De hecho, la albuminuria puede ser un marcador más precoz de ERC que la reducción del FG, y también se considera que es un signo no sólo de lesión renal sino de «daño sistémico» (disfunción endotelial generalizada, remodelado arterial y riesgo cardiovascular elevado), más allá del riñón25,26. Por otra parte, la disminución de la proteinuria/albuminuria está claramente asociada con una progresión más lenta de la ERC27 y es por ello que su reducción es también un objetivo terapéutico.
Determinadas situaciones, como la presencia de fiebre, estrés, ingesta elevada de proteínas, insuficiencia cardiaca o la realización de ejercicio físico intenso previo a su obtención, pueden producir elevación de la proteinuria que se resuelve después de la desaparición del factor causante. Así mismo, la presencia de infecciones del tracto urinario o la menstruación pueden ocasionar resultados falsamente positivos. Por ello, es recomendable evitar la recolección de orina para valoración de albuminuria/proteinuria en estas circunstancias. El tabaquismo y la obesidad también se han asociado a la presencia de albuminuria y hasta un 25% de individuos de más de 80 años la presentan.
La ERC se clasifica en 3 categorías de albuminuria (A1-A3) en función del valor y sus equivalencias en proteinuria e incluso en tiras reactivas. No obstante, las guías recomiendan realizar la estratificación con base en el cociente albúmina/creatinina en orina. La tabla 4 muestra los valores para cada una de las categorías en función del tipo de muestra utilizada para valorar la proteinuria (orina de 24 horas o muestra de orina) y la magnitud utilizada (albúmina o proteínas en orina).
Categorías de albuminuria/proteinuria
| A1 Normal a incremento leve | A2 Incremento moderado | A3 Incremento grave | |
|---|---|---|---|
| ACR | |||
| mg/g | < 30 | 30-300 | > 300 |
| mg/mmol | < 3 | 3-30 | > 30 |
| PR/CR | |||
| mg/g | < 150 | 150-500 | > 500 |
| mg/mmol | < 15 | 15-50 | > 50 |
| EAU (mg/24 h) | < 30 | 30-300 | > 300 |
| EPU (mg/24 h) | < 150 | 150-500 | > 500 |
| Tira reactiva | Negativa a indicios | Indicios a 1 + | ≥ 1 + |
ACR: cociente albúmina/creatinina en orina (en una muestra de orina); PR/CR: cociente proteína/creatinina en orina (en una muestra de orina); EAU: excreción de albúmina en orina/24 h; EPU: excreción de proteínas en orina/24 h. En caso de ACR, para convertir mg/mmol a mg/g, multiplicar por 8.84
En individuos adultos, la mayoría de las guías recomiendan que la valoración de la proteinuria se realice mediante la determinación del cociente albúmina/creatinina en muestra de orina (ACR), preferentemente la primera orina de la mañana7,13,25. La concentración de proteína o albúmina en orina siempre debe ser referida a la concentración de creatinina urinaria para minimizar el efecto del grado de hidratación (concentración de la orina). Este resultado se aproxima a la determinación en orina de 24 horas si no existe una gran desviación de la superficie corporal1. La albuminuria es un marcador más sensible que la proteinuria en el contexto de ERC debida a DM, hipertensión arterial (HTA) o enfermedad glomerular, todas ellas etiologías responsables de la mayoría de ERC en el adulto.
Para considerar la presencia de albuminuria significativa son necesarios dos valores elevados en tres muestras obtenidas durante al menos tres meses. En el caso de pacientes con ERC diagnosticada y albuminuria (ACR > 300 mg/g o > 30 mg/mmol) se podría realizar la monitorización a partir del cociente proteínas/creatinina en orina (PR/CR). También se recomienda la utilización de PR/CR en orina en los pacientes con sospecha de patología intersticial renal (enfermedades renales hereditarias especialmente en niños, síndrome de Sjögren, nefrotoxicidad por antiretrovirales -tenofovir-, etc.), ya que en estas situaciones la proteinuria se produce fundamentalmente a expensas de proteínas tubulares de bajo peso molecular, diferentes a la albúmina28. La existencia de una disociación importante entre el cociente ACR y PR/CR debe hacer pensar también en la posibilidad de la presencia de cadenas ligeras libres en la orina (proteinuria de Bence-Jones) o inmunoglobulinas (como en el síndrome nefrótico impuro).
Alteraciones en el sedimento urinarioDiferentes elementos como células, cilindros, cristales y microorganismos pueden aparecer en el sedimento urinario en una amplia variedad de patologías renales y del tracto urinario. Algunos de ellos, como los hematíes dismórficos y/o cilindros hemáticos (glomerulonefritis proliferativas, vasculitis), cilindros leucocitarios (pielonefritis o nefritis intersticiales), lipídicos (patologías proteinúricas), células tubulares renales o cilindros granulares y céreos son indicadores de la presencia de lesión renal7.
El porcentaje de hematíes dismórficos a tener en cuenta para considerar el diagnóstico de hematuria de causa glomerular no está bien establecido, y su valor como hallazgo aislado (sin otras alteraciones sugestivas de patología renal como proteinuria o insuficiencia renal) es limitado.
Imágenes radiológicas patológicasLa ecografía es una técnica esencial en la evaluación del paciente con patología renal, tanto aguda como crónica, y para la realización de la biopsia renal.
La ecografía renal permite identificar anormalidades estructurales que indican la presencia de lesión renal, así como descartar patología obstructiva de la vía urinaria. La presencia de quistes simples o una litiasis caliciar única sin repercusión no son criterio de ERC (sí la poliquistosis autosómica dominante, riñones displásicos, hidronefrosis, litiasis coraliformes, nefrocalcinosis, cicatrices corticales, etc.).
Alteraciones histológicasLa evidencia de anomalías en el parénquima renal,independientemente del valor del FG o de la presencia de otros marcadores de lesión renal, son consideradas criterio de ERC.
La indicación de biopsia forma parte del ámbito del especialista en nefrología y es imprescindible para la caracterización de patologías glomerulares primarias o de otras patologías sistémicas con afectación renal, enfermedades vasculares, tubulointersticiales, quísticas y congénitas.
Alteraciones en la función tubularAlteraciones de electrolitos y otros solutos pueden ser resultado de trastornos en los mecanismos de reabsorción y secreción tubular renal. Estos síndromes son poco frecuentes pero patognomónicos de enfermedad renal. Destacamos la acidosis tubular renal, la diabetes insípida nefrogénica, pérdidas urinarias de sodio, potasio o magnesio, síndrome de Fanconi, cistinuria, etc. A menudo se trata de enfermedades genéticas, aunque también pueden ser adquiridas debido a drogas o tóxicos.
Historia de trasplante renalLos trasplantados renales se consideran que tienen ERC, independientemente del valor de su FG o de la presencia de marcadores de lesión renal.
Enfermedad renal crónica: estadiaje y cribadoSi bien la definición de ERC ha permanecido constante desde su descripción inicial en 200229, sí se han producido algunos cambios en su estadiaje, aceptados de modo universal, pero ninguno desde la publicación del Documento de Consenso en 201413.
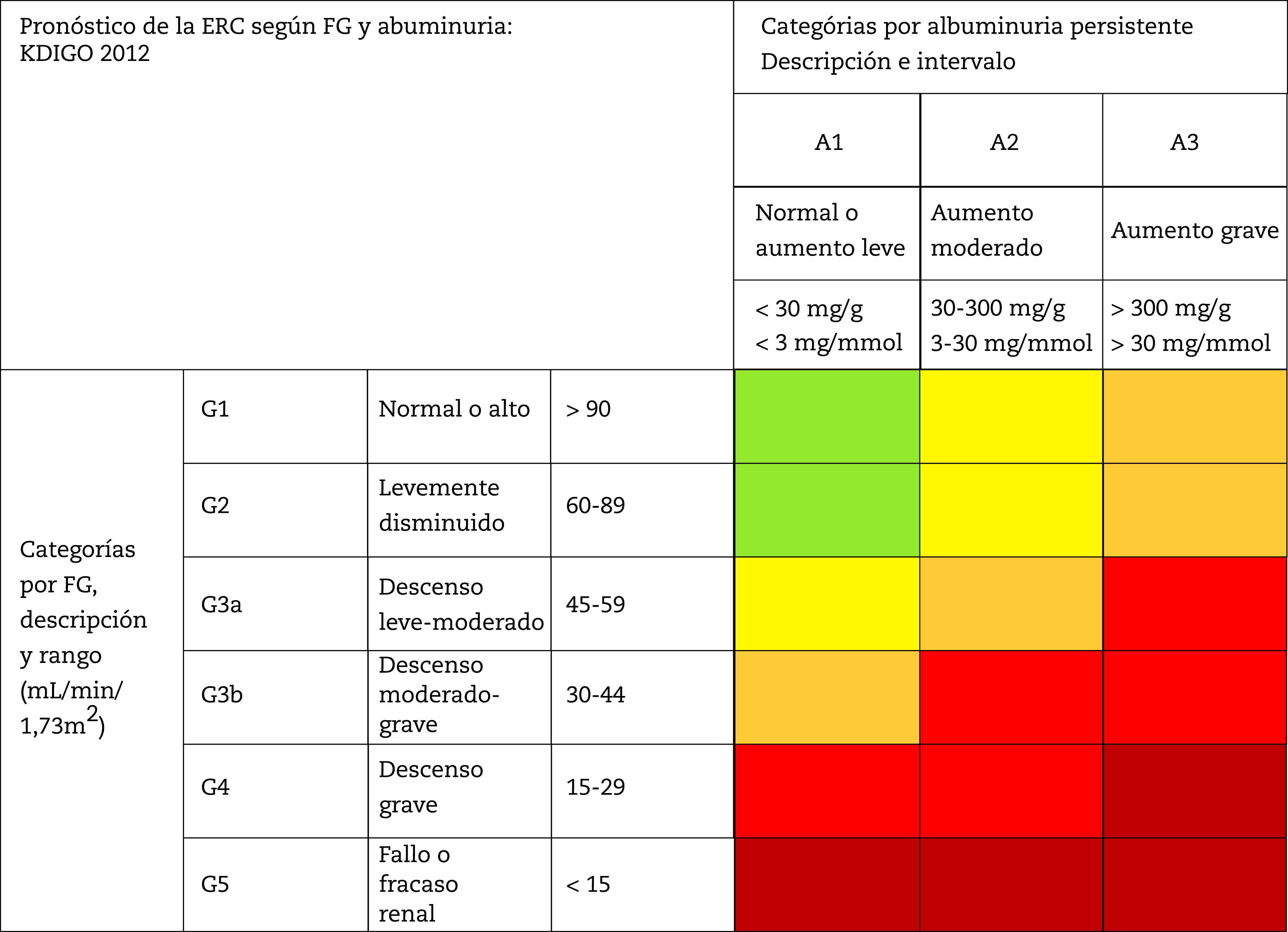
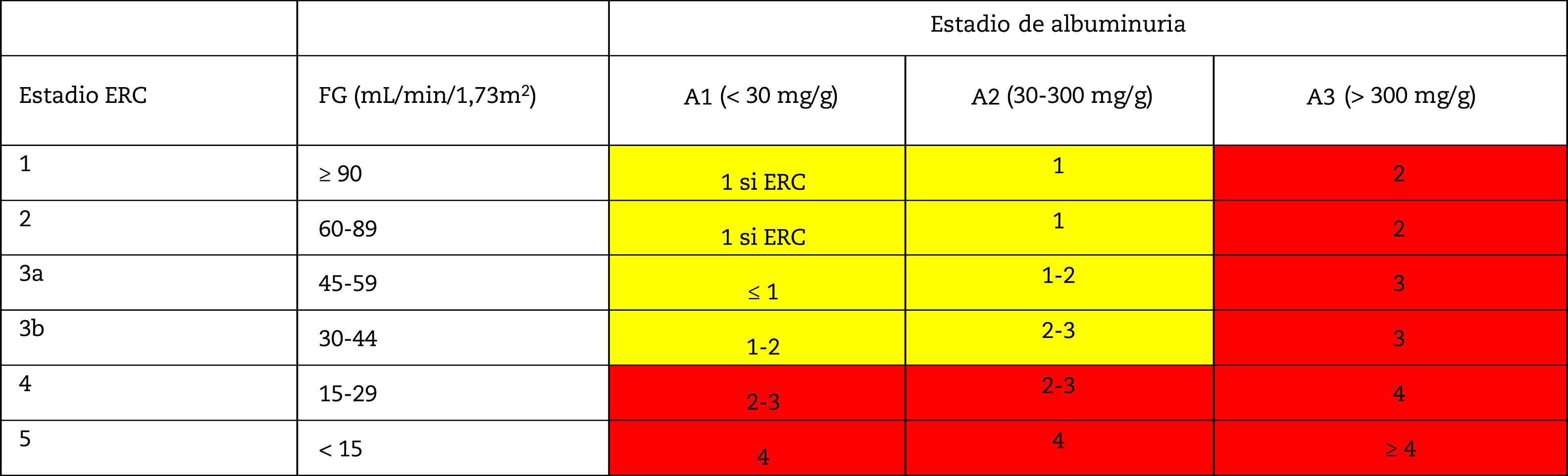
Esta clasificación contempla una división de seis categorías de riesgo en función del FG (G1-G5) que se complementan con tres categorías de riesgo según el cociente ACR (A1-A3) (tabla 4). La disminución del FG al igual que el aumento del cociente ACR se asocian a un aumento de eventos adversos (mortalidad global, mortalidad cardiovascular, fracaso renal tratado con diálisis o trasplante, fracaso renal agudo y progresión de la enfermedad renal) (tabla 5). La coexistencia de una disminución del FG y un cociente ACR aumentado multiplica el riesgo. Por otra parte, cuando un paciente inicia diálisis se estratifica en la categoría G5D y, si es trasplantado, en estadios G1T a G5T según su FG. Cabe destacar que tanto en las guias KDIGO7 como en otros estudios realizados en nuestro país4, más del 80% de los sujetos con ERC (80,6%; 12,2% del total de la muestra) se correspondieron con situaciones de riesgo moderado de complicaciones cardiorrenales, lo que establece un importante margen para la prevención tanto cardiovascular como renal.
Estadiaje y pronóstico de la ERC por filtrado glomerular y albuminuria
FG: filtrado glomerular; ERC: enfermedad renal crónica.
Nota: Los colores muestran el riesgo relativo ajustado para cinco eventos (mortalidad global, mortalidad cardiovascular, fracaso renal tratado con diálisis o trasplante, fracaso renal agudo y progresión de la enfermedad renal) a partir de un metanálisis de cohortes de población general. El riesgo menor corresponde al color verde (categoría «bajo riesgo» y, si no hay datos de lesión renal, no se puede catalogar siquiera como ERC), seguido del color amarillo (riesgo «moderadamente aumentado»), naranja («alto riesgo») y rojo («muy alto riesgo»), que expresan riesgos crecientes para los eventos mencionados (adaptado de referencia 7).
Finalmente es importante subrayar la necesidad de tener en cuenta que, a pesar de que el diagnóstico y estadiaje de la ERC es independiente de la causa, es importante tenerla en cuenta desde el punto diagnóstico y pronóstico. Por ello las guías internacionales recomiendan especialmente tener en cuenta el concepto causa, grado, albuminuria (CGA)7,8. En este sentido se enfatiza que patologías como la obstrucción urinaria, síndromes nefríticos y/o glomerulonefritis/vasculitis, la enfermedad vascular renal, el mieloma u otras enfermedades sistémicas con afectación renal pueden tener tratamientos específicos.
En un documento de reciente publicación de KDIGO sobre unificación de nomenclatura sobre función renal y ERC, se prefiere evitar el término enfermedad renal terminal al ser un término paciente-sensible y con connotaciones estigmatizantes24. En este mismo documento se insiste en que no se debe usar albuminuria o proteinuria como equivalentes de función renal disminuida, ya que no son marcadores de función renal sino sólo marcadores de lesión renal estructural24.
Estos cambios, entre otros, son discutidos en un artículo editorial de la revista de la Sociedad Española de Nefrología que aglutina una nueva iniciativa internacional sobre unificación de nomenclatura nefrológica en español desarrollada por diferentes sociedades30.
Factores de riesgo y cribado de la ERCEl modelo conceptual continuo ya clásico de la ERC7,13 incluye factores de riesgo para cada una de sus fases y clasifica factores de susceptibilidad, iniciadores, de progresión y de estadio final (tabla 6). Obviamente, algunos factores de riesgo pueden ser a la vez de susceptibilidad, iniciadores y de progresión, como por ejemplo la HTA o la DM. Además, se han descrito múltiples causas mono o poligénicas de ERC, así como importantes asociaciones patofisiológicas con el desarrollo y progresión de la ERC gracias al rápido desarrollo de técnicas como los Genomic Wide Association Studies (GWAS) o estudios epigenéticos.
Factores de riesgo de ERC
| Factores de susceptibilidad: incrementan la posibilidad de daño renal |
| Edad avanzada |
| Historia familiar de ERC |
| Masa renal disminuida |
| Bajo peso al nacer |
| Raza negra y otras minorías étnicas (afrocaribeños y asiáticos) |
| Hipertensión arterial |
| Diabetes |
| Obesidad |
| Nivel socioeconómico bajo |
| Factores iniciadores: inician directamente el daño renal |
| Insuficiencia renal aguda* |
| Enfermedades autoinmunes |
| Infecciones sistémicas (incluyendo VHB, VHC, VIH, SARS-CoV-2) |
| Infecciones urinarias |
| Litiasis renal |
| Obstrucción de las vías urinarias bajas |
| Fármacos nefrotóxicos, incluyendo AINEs y antirretrovirales |
| Hipertensión arterial |
| Diabetes |
| Factores de progresión: empeoran el daño renal y aceleran el deterioro funcional renal |
| Proteinuria persistente |
| Hipertensión arterial mal controlada |
| Diabetes mellitus mal controlada |
| Enfermedad cardiovascular asociada con tabaquismo |
| Obesidad |
| Dislipemia |
| Raza negra o asiática |
| Tratamiento crónico con AINEs |
| Obstrucción del tracto urinario |
| Acidosis metabólica |
| FRA y nefrotoxicidad |
| Ingresos hospitalarios por insuficiencia cardiaca |
| Factores de estadio final: incrementan la morbimortalidad en situación de fallo renal |
| Dosis baja de diálisis (Kt/V)** |
| Acceso vascular temporal para diálisis |
| Anemia |
| Hipoalbuminemia |
| Derivación tardía a nefrología |
| Calcificación vascular |
VHB: virus de hepatitis B; VHC: virus de hepatitis C; VIH: virus de inmunodeficiencia humana; SARS-CoV-2: coronavirus 2 del síndrome respiratorio agudo severo; ERC: enfermedad renal crónica; AINES: antiinflamatorios no esteroideos; FRA: fracaso renal agudo.
Actualmente, el cribado de ERC en poblaciones de riesgo debe hacerse mediante la evaluación del FG y de la albuminuria al menos una vez al año. Ambas intervenciones diagnósticas se han mostrado coste-efectivas1. El diagnóstico no debe basarse en una ÚNICA determinación de FG y/o albuminuria y SIEMPRE debe confirmarse.
Recomendamos el cribado de ERC especialmente en pacientes con:
- •
HTA
- •
DM tipo 2 (DM-2)
- •
Enfermedad Cardiovascular establecida
- •
Mayores de 60 años
- •
Obesos (índice de masa corporal [IMC] > 30-35 kg/m2).
- •
DM tipo 1 (DM-1) con más de cinco años de evolución.
- •
Familiares de primer grado de pacientes con enfermedad renal o con enfermedades renales hereditarias.
- •
Enfermedades obstructivas del tracto urinario o con alteraciones estructurales del mismo.
- •
Pacientes en tratamiento prolongado con fármacos nefrotóxicos (incluyendo inhibidores de la calcineurina –ciclosporina, tacrolimus–, litio, antiretrovirales y antiinflamatorios no esteroideos).
- •
Sujetos con otros factores de riesgo de enfermedad cardiovascular (fumadores, dislipemia, síndrome metabólico).
- •
Pacientes con infecciones crónicas, enfermedades autoinmunes y neoplasias que pueden estar asociadas a ERC.
- •
Pacientes con antecedentes de daño renal agudo.
Ha adquirido una especial relevancia en los últimos años el antecedente de daño renal agudo (Acute Kidney Injury o AKI, por sus siglas en inglés) como factor de riesgo para desarrollar una ERC posterior y/o necesidad de tratamiento renal sustitutivo. Se ha acuñado recientemente incluso el término intermedio (AKD o Acute Kidney Disease), poco extendido, referido a la alteración de la función renal de menos de tres meses de duración para definir el curso de la enfermedad renal después de un AKI31.
Definición de progresión de la ERCLa tasa media de disminución anual del FG es muy variable siendo mayor en pacientes con proteinuria importante, DM o HTA no óptimamente controladas.
Puntos clave a considerar:- a)
Tasa de progresión renal normal: descenso de 0,7-1 mL/min/1,73 m2/año a partir de los 40 años7.
- b)
Se puede considerar que un paciente presenta progresión renal si presenta un descenso confirmado del FG > 5 mL/min/1,73 m2/año o > 10 mL/min/1,73 m2 en cinco años7,32 (descartados criterios de deterioros funcionales y agudos de la función renal). Existe debate acerca de si esta tasa de progresión relacionada con la edad es normal o patológica. Además, debe considerarse también la variabilidad biológica intraindividual de la concentración de creatinina sérica (± 5%). Algunas guías recomiendan como significativo un descenso > 5 mL/min/1,73m2 en seis meses confirmado en al menos tres determinaciones para considerar una derivación a nefrología33.
- c)
Se define la progresión en base a la presencia de cualquiera de los siguientes puntos7:
- •
Descenso confirmado en el FG:
- -
Descenso confirmado del FG > 5 mL/min/1,73 m2/año o > 10 mL/min/1,73 m2 en cinco años.
- -
Porcentaje de cambio respecto a la situación basal (> 25% de deterioro en el FG), descartados factores funcionales.
- -
Progresión acelerada de la ERC: disminución de más del 25% del FG o un descenso sostenido del FG ≥ 15 mL/min/1,73m2 en un año, tal y como también consideran algunas guías34.
- •
Aumento en el cociente ACR:
- -
Incremento de más del 50% en el cociente ACR respecto a la situación basal.
- •
Progresión a una categoría superior o más grave deterioro en la función renal o de albuminuria.
- d)
Para la valoración de la progresión renal se recomienda la estimación del FG basal y la albuminuria (cociente ACR en orina), así como identificar aquellos factores de progresión renal; ello indicará la frecuencia de determinación de sucesivos controles analíticos.
- e)
Para analizar la tasa de progresión renal se deben considerar dos aspectos34:
- •
Realizar al menos tres determinaciones de FG en un período de no menos de 90 días.
- •
Ante un nuevo hallazgo de reducción del FG se deben descartar causas de deterioro agudo (diarrea, vómitos, depleción por diuréticos) o inicio de tratamiento con fármacos que afectan a la hemodinámica glomerular (antiinflamatorios no esteroideos o AINE), inhibidores del sistema renina-angiotensina-aldosterona (iSRAA) o inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2).
- f)
En pacientes con un nuevo hallazgo de una disminución de FG (por primera vez), recomendamos repetir la estimación del FG en un periodo no inferior a tres meses para descartar deterioro renal agudo funcional. Si la situación clínica lo indica, podría repetirse en un periodo menor (p. ej., en estos casos algunas guías aconsejan la repetición del FG en un periodo inferior a dos semanas34).
- g)
Regresión:
- •
Además del término progresión, deberá considerarse el término regresión. Este aspecto ya se había considerado en estudios en pacientes con DM hace más de dos décadas35. Su definición se ha establecido a partir de los recientes ensayos clínicos de seguridad cardiovascular (CardioVascular Outcomes Trials) con iSGLT2 o agonistas de receptor del GLP-1 (AR-GLP1). Se ha definido como reducción en la albuminuria desde macro a micro o normoalbuminuria o desde micro a normoalbuminuria, al menos en dos determinaciones consecutivas separadas al menos cuatro semanas36. Algunos tratamientos de la DM han demostrado posibilidad de regresión de la albuminuria36,37. En individuos con cociente ACR basal≥300 mg/g, una disminución del 30% en el cociente ACR durante dos años confiere una reducción absoluta de más del 1% en el riesgo a 10 años de necesidad de tratamiento sustitutivo renal (TSR)38. Los cambios en la albuminuria a corto plazo (1-3 años) proporcionan, pues, información sobre el riesgo a largo plazo de necesidad de TSR.
- •
Aunque no se ha definido remisión en relación con cambios en el FG en los recientes estudios, algunos autores han considerado remisión a la normalización de la tasa de deterioro renal≤1 mL/min/año durante el periodo de observación, similar a la tasa fisiológica de progresión en el envejecimiento39. Algunos tratamientos de la DM han demostrado posibilidad de regresión de la albuminuria36,37.
Los factores predictores de progresión renal se muestran en la tabla 734,40-53.
Factores predictores de progresión de la ERC34,40-53
| Proteinuria41,42 |
| Hipertensión arterial43,44 |
| Diabetes mellitus45 |
| Enfermedad cardiovascular46 |
| Tabaquismo47 |
| Obesidad48 |
| Raza negra o asiática49 |
| Tratamiento crónico con AINEs50 |
| Obstrucción del tracto urinario34 |
| Acidosis metabólica51 |
| FRA y nefrotoxicidad52 |
| Ingresos hospitalarios por insuficiencia cardiaca53 |
ERC: enfermedad renal crónica; AINES: antiinflamatorios no esteroideos; FRA: fracaso renal agudo.
En un reciente análisis de 264.296 pacientes con FG < 30 mL/min/1,73m2 los factores más relevantes en la progresión de la enfermedad renal con necesidad de fueron el FG bajo, DM, raza negra, sexo varón, PA sistólica≥140 mmHg y la albuminuria54. A partir de este análisis se ha construido una calculadora para estimar el riesgo de inicio de TSR, eventos cardiovasculares y muerte: http://ckdpcrisk.org/lowgfrevents/.
FragilidadLa fragilidad se define como un síndrome biológico consistente en disminución de la reserva y de la resistencia a estresores, resultante de la acumulación de déficits de múltiples sistemas fisiológicos, que acaba causando vulnerabilidad55.
La prevalencia de fragilidad en ERC es mayor que en otras patologías cardiovasculares, aumentando progresivamente al reducirse el FG, particularmente a partir de FG < 45 mL/min/1,73m2; es un factor de riesgo independiente para hospitalización y mortalidad por cualquier causa, especialmente en pacientes en diálisis, en los que alcanza prevalencias de hasta el 73% (utilizando preferentemente fenotipos de Fried) frente a un 7% en estadio G1-G456,57.
Existen distintas escalas para valorar la fragilidad, que aportan resultados diferentes. Una de las más utilizadas y recomendadas es el cuestionario FRAIL de cinco ítems (tabla 8). Esta escala evalúa la fragilidad de acuerdo con la expresión fenotípica mediante la combinación de cinco condiciones, cada una valorada en un punto. Los pacientes se clasifican según su estado de salud como: frágiles (3-5 puntos), pre-frágiles (1-2 puntos) y robustos (0 puntos).58 Este cuestionario de fácil y rápida aplicación ha sido validado en múltiples escenarios geriátricos, aunque pierde capacidad discriminativa en poblaciones con altas prevalencias de fragilidad, como es el caso de los pacientes en hemodiálisis.
Cuestionario FRAIL
| 1. Fatiga: ¿Se siente cansado la mayor parte del tiempo? (Sí, No) |
| 2. Resistencia: ¿Puede subir un piso de escaleras sin hacer pausas sin ayuda? (Sí, No) |
| 3. Deambulación: ¿es capaz de caminar 100 m (una manzana) sin hacer pausas sin ayuda? (Sí, No) |
| 4. Enfermedades: (más de cinco) artritis, diabetes, angina/infarto, hipertensión, ACV, asma, bronquitis crónica, depresión/ansiedad, demencia, úlceras en piernas. (Sí, No) |
| 5. Pérdida de peso: ¿pérdida de peso > 5% en los últimos 6 meses? (Sí, No) |
| Valoración del resultado:1 a 2 = prefrágil3 o más = frágil |
En pacientes con ERC, la herramienta más utilizadas son los Fenotipos de Fried55 (tabla 9).
Fenotipos de Fried
| 1. Pérdida no intencional de peso mayor de 4,5 k g59 o 5% del peso corporal en el año previo |
| 2. Baja energía o agotamiento, en función de la respuesta a determinadas preguntas («siento que todo lo que hago es un esfuerzo», «siento que no puedo seguir haciendo las cosas») al menos 3-4 días a la semana |
| 3. Debilidad muscular. Disminución de la fuerza muscular de presión (medida con dinamómetro) < 20% ajustado de acuerdo a sexo e índice de masa corporal |
| 4. Actividad física reducida, medida en función de calculadoras de consumo de calorías semanales o escalas de actividad física; por ejemplo, Calcumed o PASE (Abizanda P, 2013; Schuit AJ, 1997; García FJ, 2011) |
| 5. Lentitud. Medida en función del test de velocidad de la marcha (metros/segundo) < 20%, ajustado de acuerdo a sexo y altura |
| Fragilidad = 3 o más criteriosValoración del resultado:ningún criterio: robusto;1-2 criterios: prefrágil;3-5 criterios: frágil. |
En resumen, se recomienda la evaluación de la fragilidad en pacientes con ERC, como medida de las reservas fisiológicas, para evaluar el pronóstico y ayudar a la toma de decisiones terapéuticas, incluidas las terapias sustitutivas. La herramienta óptima para su evaluación en pacientes con ERC no está establecida, aunque los fenotipos de Fried es la más utilizada en pacientes con ERC55 (tabla9) y el cuestionario FRAIL puede ayudar a detectar la fragilidad en pacientes en diálisis.
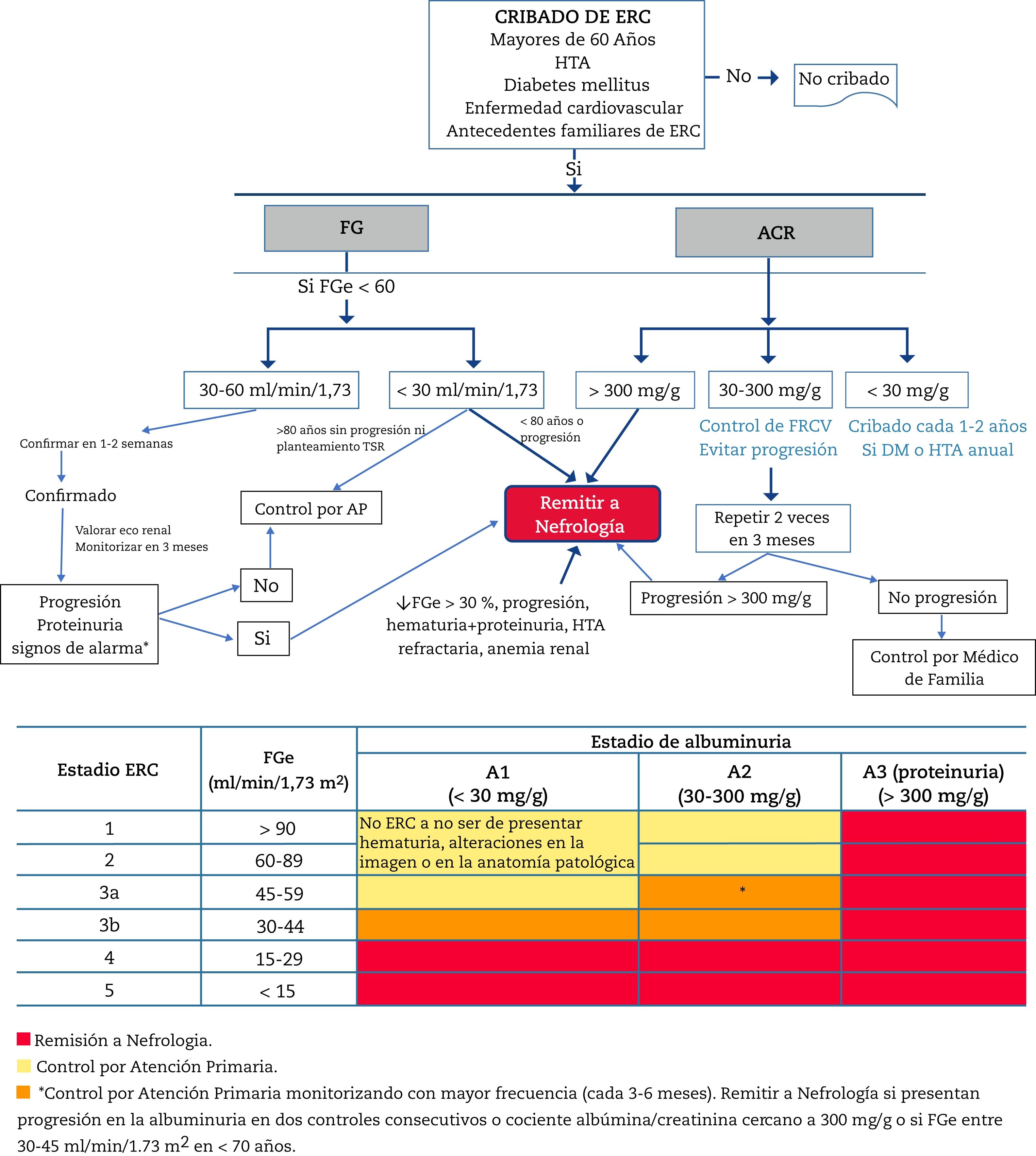
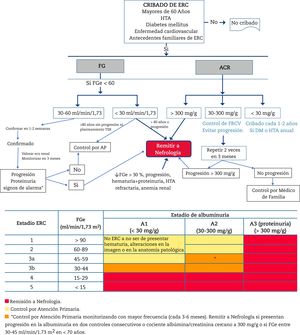
Criterios de derivación a NefrologíaLa derivación a Nefrología (fig. 1) se hará teniendo en cuenta el estadio de ERC, la velocidad de progresión de la ERC, el grado de albuminuria, la presencia de signos de alarma, la comorbilidad asociada y la situación funcional del paciente34,60,61. La ERC es una patología generalmente paucisintomática (muchas veces asintomática hasta estadios muy avanzados) y muy dependiente del seguimiento de los resultados de laboratorio. Es más elevado el riesgo de acontecimientos cardiovasculares que de progresión a diálisis54. En muchos casos, la progresión renal es lenta sin requerir especiales medidas, salvo el control de los factores de riesgo cardiovascular y evitar la nefrotoxicidad. Por ello, se deben crear unos circuitos adecuados que se inicien por una consulta virtual (telemática) entre el médico que va a remitir al paciente y el Servicio de Nefrología para una primera valoración, ya que en muchos casos este canal puede solucionar la consulta, o aclarar dudas sobre el seguimiento de pacientes con edad avanzada, disminución del FG y escasa progresión. De esta forma se puede evitar desplazamiento del paciente y la familia, así como pruebas innecesarias o repetidas.
Algoritmo de diagnóstico y atención compartida entre Atención Primaria y Nefrología.
ERC: enfermedad renal crónica; HTA: hipertensión arterial; FG: filtrado glomerular estimado; ACR: cociente albúmina/creatinina en orina; TSR: tratamiento sustitutivo renal; FRCV: factores de riesgo cardiovascular; DM: diabetes mellitus.
En líneas generales, se deberían remitir al especialista en Nefrología a los pacientes con albuminuria>300 mg/g, albuminuria en cualquier grado acompañada de microhematuria glomerular (no urológica) o aquellos con ERC G4 o G5 (FG < 30 mL/min/1,73 m2) (excepto>80 años sin progresión renal, albuminuria < 300 mg/g, sin signos de alarma y sin planteamiento de TSR) (ver debajo).
Según filtrado glomerular- •
Todos los pacientes con FG < 30 mL/min/1,73 m2, excepto los pacientes > 80 años sin progresión renal o con progresión muy lenta.
- •
Pacientes > 80 años y con FG < 20 mL/min/1,73 m2: se deberá valorar previamente la evolución de la función renal y de la albuminuria en los últimos años. Si la función renal se mantiene estable o con mínima progresión y sin anemia renal, se pueden manejar conjuntamente mediante consulta telemática o directamente por el médico de familia con consulta telemática ocasional a Nefrología. Si se precisa, se realizará una única valoración con presencia física y posteriormente se pactarán las sucesivas visitas con el médico de familia.
- •
Los pacientes < 70 años con FG entre 30-45 mL/min/1,73 m2 deberán monitorizarse con mayor frecuencia (cada 3-6 meses), remitiéndose a Nefrología en caso de progresión de la función renal y/o albuminuria en dos controles consecutivos, especialmente con cociente ACR > 300 mg/g una vez hayan recibido bloqueo del SRAA así como control óptimo de la presión arterial (PA) y de la glucemia en caso de pacientes con DM, y siempre descartando deterioro renal funcional (depleción, diurético, hipotensión, AINE, etc.).
- •
Ante cualquier deterioro en el FG que cumpla criterios de remisión, antes de remitir a Nefrología, siempre se deberá chequear la presencia de factores funcionales que pueden influir en el FG: AINES, exceso de control de la presión arterial, situaciones de depleción por diuréticos, diarrea, etc.
- •
Se recomienda que el paciente candidato a recibir TSR se remita a Nefrología al menos un año antes del inicio de dicho tratamiento. Los pacientes candidatos a TSR son aquellos que reunan alguna de las siguientes características:
- ∘
Mayores de 80 años con un FG < 20 mL/min/1,73 m2.
- ∘
Entre 70-80 años con un FG < 30 mL/min/1,73 m2
- ∘
En < 70 años con un FG < 45 mL/min/1,73 m2, especialmente si se acompañan de albuminuria.
- ∘
Estos criterios pueden variar si se presenta progresión renal o deterioro renal acelerado (progresión del FG de > 5 mL/min/año durante dos años consecutivos).
- ∘
El objetivo es evitar que un paciente candidato a TSR requiera diálisis no programada (precisaría de la implantación de un catéter central). Si se realiza una diálisis programada, se puede escoger la técnica de diálisis que mejor se adapte a sus necesidades (diálisis peritoneal, hemodiálisis en centro o hemodiálisis domiciliaria) y pueda plantearse incluso el trasplante renal anticipado.
- •
ACR > 300 mg/g: Se remitirán aquellos pacientes con un cociente ACR > 300 mg/g, aproximadamente equivalente a albuminuria > 300 mg/24 horas, especialmente sin causa aparente (DM, HTA…) y con control óptimo de PA (incluyendo bloqueo del SRAA). En ancianos >80 años, y especialmente nonagenarios, se valorará la progresión de la albuminuria y se remitirán solo si la albuminuria > 300 mg/g se acompaña de disminución del FG. Si la función renal está preservada, se actuará sobre los factores de progresión renal (PA, HbA1c, obesidad) y solo se remitirá en caso de progresión renal.
- •
ACR 30-300 mg/g: Los pacientes con cociente ACR en orina entre 30-300 mg/g y ERC G3b (FG: 30-45 mL/min/1,73 m2) presentan mayor probabilidad de progresión62. En estos pacientes se realizará una monitorización más frecuente por parte de su médico de familia. Se remitirán a Nefrología en caso de progresión de la albuminuria durante su evolución (> 300 mg/g). Es importante tener en cuenta la variabilidad de la albuminuria y los factores que pueden influir en ello, tal y como se ha referido antes. Por ello ante unos valores de albuminuria con criterios de remisión se deberá repetir la determinación para confirmación y descartar causas que pueden influir en la aparición de albuminuria de forma transitoria.
- •
Deterioro agudo en la función renal o daño renal agudo:
- ∘
Aumento de la concentración sérica de creatinina >30% o descenso del FG > 30% en menos de un mes.
- ∘
AKI: aumento de la concentración sérica de creatinina ≥ 50% en siete días o un aumento de la creatinina ≥ 0,3 mg/dL (≥ 26,5 μmol/L) en 48 horas o por la presencia de oliguria.
- ∘
En ambos casos, una vez descartados factores exógenos (exceso de control de la PA, diarrea, vómitos, depleción por diuréticos, AINE, inicio de tratamiento con iSRAA o iSGLT2).
- •
Pacientes que presenten progresión renal (> 5 mL/min/año) especialmente si es acelerada (descenso del FG > 30% o > 15 mL/min/año) o si se necesita clarificación diagnóstica (DM de poca duración, hematuria no urológica inexplicada, enfermedades autoinmunes).
- •
ERC e HTA (> 130/80 mmHg) refractaria al tratamiento con tres fármacos a plenas dosis, uno de ellos diurético.
- •
Sospecha de estenosis de arteria renal.
- •
Alteraciones en concentración sérica de potasio (> 5,5 mEq/L o < 3,5 mEq/L sin recibir diuréticos).
- •
Anemia: Hb < 10,0 g/dL con ERC a pesar de corregir ferropenia (índice de saturación de transferrina [ISAT]) > 20% y ferritina > 100 ng/mL)63.
- •
Presencia de signos de alarma:
- ∘
Presencia de hematuria no urológica, especialmente si está asociada con albuminuria. En el caso de que el paciente presente hematuria glomerular (no de causa urológica –descartar litiasis renal, infección urinaria, neoplasia de vías urinarias u otras lesiones de vía urinaria). La importancia relativa de la albuminuria será mayor cuanto mayor sea el deterioro de la función renal asociado y, especialmente, si se acompaña de hematuria glomerular. En el caso de detectar microhematuria sin albuminuria se deberá descartar neoplasia de vías en poblaciones de riesgo mediante citología urinaria y ecografía renal y de vías urinarias34.
La derivación a Nefrología se hará teniendo en cuenta los criterios y comentarios anteriores, y además se remitirá a todo paciente con aumento de la albuminuria a pesar de un tratamiento adecuado. En todos los anteriores casos, el seguimiento posterior será pactado entre el médico de familia y Nefrología. La caída del FG tras iniciar un iSGLT2 (al igual que los iSRAA) no debe ser un motivo de derivación a Nefrología ni de retirar el tratamiento si la función renal permanece estable o si la caída del FG es ≤ 30%. En primer lugar, se deberá descartar causas funcionales (depleción, exceso de dosis de diuréticos o PA baja antes del inicio). Si tras descartar estas causas o bien realizar ajuste de la dosis de diuréticos persiste una caída del FG > 30% sobre la cifra basal, se remitirá a Nefrología64–66.
Pacientes octogenarios o nonagenarios- •
Se realizará consulta telemática para un manejo conjunto. En dicha consulta se valorará la fragilidad y, si no es un anciano frágil, se considerará si precisa visita en presencia física.
- •
En ancianos frágiles o con escasa expectativa de vida (< 1 año) con ERC G4-G5 y que no sean subsidiarios de TSR, se pactarán las actuaciones tanto diagnósticas como terapéuticas. Si es preciso, se establecerá la atención por parte de cuidados paliativos renales (de forma conjunta)67.
- •
Se informará a los médicos de familia acerca de la posibilidad de episodios de agudización, en la mayoría de los casos de causa prerrenal (exceso de diuréticos, exceso de control de la PA, comorbilidades agudas asociadas) que pueden justificar un deterioro renal que se puede solucionar sin asistencia de Nefrología.
Existe un score para calcular el riesgo de necesidad de inicio de TSR a cinco años en pacientes > 65 años y FG < 60 mL/min/1,73m2 (Kidney Failure risk equation o «KFRE»: http://ckdpcrisk.org/kidneyfailurerisk/). El resultado de la ecuación al aplicar dichas variables indica que se debe remitir el paciente a Nefrología con un índice entre el 3-5%. Esta ecuación está recomendada por el Grupo Europeo de Trabajo de buenas practicas clínicas renales en pacientes con FG < 45 mL/min/1,73m219. Esta ecuación sobreestima el porcentaje de pacientes que deben remitirse a Nefrología, especialmente en mayores de 80 años, comparado con los criterios de la S.E.N. Igualmente existen otras opciones, como la de la aplicación para dispositivos móviles Nefroconsultor, desarrollada en nuestro país, que en este caso tiene mayor coincidencia con los criterios de la S.E.N. y proporciona además recomendaciones según el estadio de ERC. Acceso a la aplicación:
https://www.senefro.org/modules.php?name=apps&op=detalle&id=6
Indicaciones de solicitud de ecografía renal en Atención PrimariaBien sea para su seguimiento por el médico de familia o para su derivación a Nefrología, se considera pertinente la solicitud de ecografía en el estudio diagnóstico de la ERC. Sus indicaciones son34:
- -
ERC acelerada o progresiva.
- -
Hematuria macroscópica (o microscópica persistente).
- -
Sintomatología de obstrucción del tracto urinario.
- -
ERC con proteinuria.
- -
Edad >20 años e historia familiar de riñones poliquísticos.
- -
ERC G4 o G5.
- -
Infecciones urinarias de repetición con participación renal.
Si en la valoración por Nefrología se considera la realización de una biopsia renal, este servicio solicitará la ecografía.
Monitorizacion y seguimiento de pacientes con ERCLa frecuencia de monitorización y visitas de los pacientes con ERC se muestra en la tabla 10. Dependerá de la causa de la ERC, de las trayectorias del FG/creatinina y albuminuria (fácilmente visibles en aplicaciones informáticas de los sistemas de salud), de la presencia de comorbilidades, de enfermedades intercurrentes agudas u hospitalizaciones, especialmente insuficiencia cardiaca, y de los cambios realizados en el tratamiento. En este sentido cabe recordar que en algunas situaciones se deberá monitorizar tras la introducción de algunos fármacos como iSRAA, iSGLT2, aumento de dosis de diuréticos, tras sospecha de deterioro renal por AINE, ajuste de anticoagulantes orales de acción directa (ACOD) o tras la aparición de hipoglucemias inesperadas en caso de diabéticos.
En los pacientes que hayan presentado fracaso renal agudo con hospitalización se requerirá monitorización de la función renal al menos hasta dos años después, incluso aunque la función renal haya retornado a su situación basal34.
En cualquier caso, es necesario individualizar estos criterios generales.
En cada revisión por su médico de familia se recomienda:
- •
Controlar la PA y ajustar el tratamiento. Objetivo de PA < 140/90 mmHg (utilizando automedida de la PA en domicilio). Intentar conseguir cifras de PA sistólica de 130/80 mmHg si se tolera, en pacientes con cociente ACR > 30 mg/g y especialmente en aquellos con cifras > 300 mg/g. Evitar reducir la PA por debajo de 120 mmHg de PA sistólica, especialmente en pacientes de edad avanzada, si hay síntomas de hipotensión ortostática o si hay neuropatía autonómica68. El tratamiento deberá individualizarse de acuerdo con la tolerabilidad e impacto sobre la función renal y electrolitos69.
- •
Vigilar presencia de anemia renal: Si ERC G3-G5 y Hb < 10,0 g/dL (una vez descartada ferropenia: IST > 20% y ferritina > 100 ng/mL), estimar remisión o adelantar revisión en Nefrología para valorar tratamiento con factores estimulantes de la eritropoyesis en relación a protocolos establecidos63.
- •
Revisar la medicación, ajustando la dosis según el FG (antidiabéticos orales de eliminación renal, anticoagulantes de acción directa). En ERC G3-G5, evitar la utilización de AINE y contrastes yodados no imprescindibles.
- •
Revisar hábitos dietéticos, recomendando ejercicio físico adecuado para cada edad y situación clínica, conseguir el peso ideal, así como el abandono del tabaquismo y orientando al paciente sobre el tipo de dieta a seguir según el FG:
- ∘
ERC 1-3: Sólo se recomienda restricción moderada de sodio en caso de HTA o sobrecarga hidrosalina7.
- ∘
ERC 4-5: Recomendaciones dietéticas para restricción moderada de sodio, potasio, fósforo y proteínas (0,8 g/kg/día).
- •
Pruebas de laboratorio en cada revisión a partir de ERC G3* (en cursiva lo mínimo aconsejable):
- ∘
Hemograma.
- ∘
Concentración sérica de glucosa, creatinina, urea, sodio, potasio, calcio, fosfato, albúmina, colesterol, triglicéridos y urato. FGe mediante CKD-EPI-creatinina.
- ∘
Cociente ACR, en primera orina de la mañana.
- ∘
Sedimento de orina.
- •
Revisar criterios de derivación a nefrología en el chequeo de los pacientes.
*Se procurará compaginar la solicitud de pruebas de laboratorio con otras especialidades o con Atención Primaria para no repetirlas.
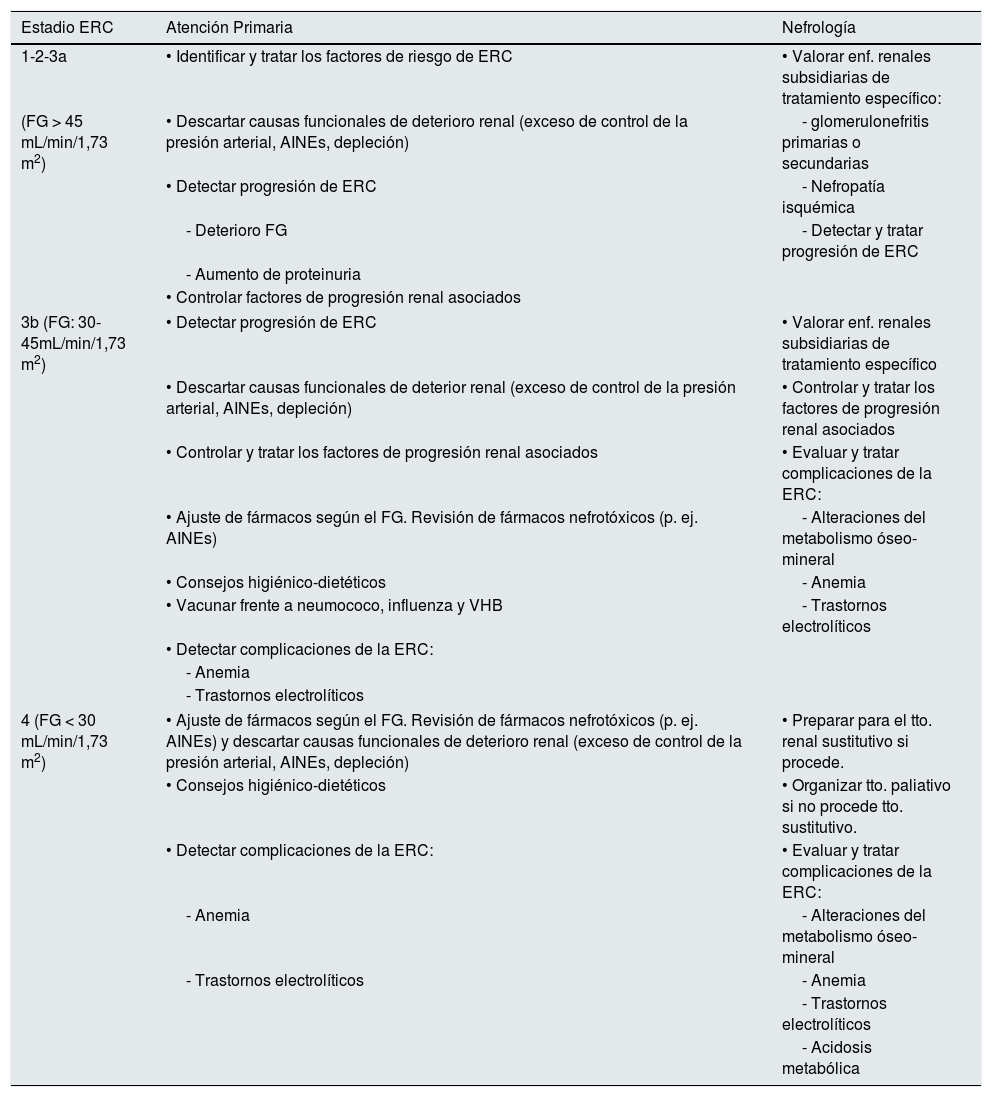
En la tabla 11 se muestran los objetivos en la monitorización y seguimiento de pacientes con ERC según estadios.
Objetivos por especialidad en el seguimiento del paciente con ERC
| Estadio ERC | Atención Primaria | Nefrología |
|---|---|---|
| 1-2-3a | • Identificar y tratar los factores de riesgo de ERC | • Valorar enf. renales subsidiarias de tratamiento específico: |
| (FG > 45 mL/min/1,73 m2) | • Descartar causas funcionales de deterioro renal (exceso de control de la presión arterial, AINEs, depleción) | - glomerulonefritis primarias o secundarias |
| • Detectar progresión de ERC | - Nefropatía isquémica | |
| - Deterioro FG | - Detectar y tratar progresión de ERC | |
| - Aumento de proteinuria | ||
| • Controlar factores de progresión renal asociados | ||
| 3b (FG: 30-45mL/min/1,73 m2) | • Detectar progresión de ERC | • Valorar enf. renales subsidiarias de tratamiento específico |
| • Descartar causas funcionales de deterior renal (exceso de control de la presión arterial, AINEs, depleción) | • Controlar y tratar los factores de progresión renal asociados | |
| • Controlar y tratar los factores de progresión renal asociados | • Evaluar y tratar complicaciones de la ERC: | |
| • Ajuste de fármacos según el FG. Revisión de fármacos nefrotóxicos (p. ej. AINEs) | - Alteraciones del metabolismo óseo-mineral | |
| • Consejos higiénico-dietéticos | - Anemia | |
| • Vacunar frente a neumococo, influenza y VHB | - Trastornos electrolíticos | |
| • Detectar complicaciones de la ERC: | ||
| - Anemia | ||
| - Trastornos electrolíticos | ||
| 4 (FG < 30 mL/min/1,73 m2) | • Ajuste de fármacos según el FG. Revisión de fármacos nefrotóxicos (p. ej. AINEs) y descartar causas funcionales de deterioro renal (exceso de control de la presión arterial, AINEs, depleción) | • Preparar para el tto. renal sustitutivo si procede. |
| • Consejos higiénico-dietéticos | • Organizar tto. paliativo si no procede tto. sustitutivo. | |
| • Detectar complicaciones de la ERC: | • Evaluar y tratar complicaciones de la ERC: | |
| - Anemia | - Alteraciones del metabolismo óseo-mineral | |
| - Trastornos electrolíticos | - Anemia | |
| - Trastornos electrolíticos | ||
| - Acidosis metabólica | ||
ERC: enfermedad renal crónica; AINES: antiinflamatorios no esteroideos; FG: filtrado glomerular; tto.: tratamiento.
Una vez que el paciente es diagnosticado de ERC, lo más importante es evitar que esta evolucione, y para ello tendremos que actuar sobre los factores de progresión renal y conocer que existen fármacos usados en la práctica diaria que pueden favorecer la nefrotoxicidad y progresión renal (tabla 7).
Evitar nefrotóxicosEvitar el uso innecesario de AINE, por el riesgo de deterioro de la función renal, así como otros fármacos potencialmente nefrotóxicos (aminoglucósidos, algunos antivirales –aciclovir, cidofovir). Se puede consultar el listado de fármacos para ajustar dosis en el siguiente link: https://www.nefrologiaaldia.org/es-articulo-ajuste-farmacos-enfermedad-renal-cronica-325
Minimizar el uso de contrastes intravenosos y conocer los factores de riesgo para su aparición- •
La nefropatía inducida por contraste (deterioro en la función renal >30% de la creatinina o aumento absoluto 0,5 mg/dL respecto a la basal que ocurre durante los primeros tres días tras la administración de contraste y que no se debe a ningún otro mecanismo) se presenta con más frecuencia en pacientes con edad avanzada, insuficiencia cardiaca, DM, ERC especialmente con FG < 30 mL/min/1,73m2, insuficiencia renal aguda previa, deshidratación, infarto agudo de miocardio, shock, elevado volumen de contraste, anemia, hipotensión, uso de nefrotóxicos y altas dosis de diuréticos. La detección de estos factores de riesgo es clave para la prevención. Se debe verificar la necesidad de la administración de contraste y valorar en dicha situación clínica si las posibles alternativas de diagnóstico de imagen sin utilización de contraste intravenoso son suficientes para la ayuda diagnóstica. Si la administración de contraste es imprescindible se administrará la mínima dosis necesaria, evitando a ser posible, las administraciones repetidas.
- •
El mejor tratamiento es la prevención, evitando situaciones de riesgo. Se recomienda la suspensión de diuréticos al menos 4-6 días antes de la administración de contraste, así como una correcta hidratación mediante fluidoterapia intravenosa e hidratación oral.
- •
Algunos fármacos pueden ser potencialmente tóxicos tras la administración de contraste, como por ejemplo la metformina. La metformina no debe administrarse en pacientes con FG < 30 mL/min/1,73 m2 de acuerdo con las recomendaciones de la ficha técnica. Aunque ha existido controversia, según el consenso del Colegio Americano de Nefrología y la National Kidney Foundation, sobre el mantenimiento del tratamiento con metformina en el momento del estudio con contraste o antes del mismo en pacientes con FGe entre 30-59 mL/min/1,73 m2, la toma de decisiones para suspender la metformina en estos casos se deberá individualizar según situaciones clínicas valorando los factores de riesgo para presentar acidosis láctica y nivel del FGe dentro de dicho rango70. Igualmente existen dudas acerca del posible efecto coadyuvante en la nefrotoxicidad por contraste en pacientes que reciben iSGLT271,72. Aunque no hay recomendaciones establecidas, es recomendable tener en cuenta esta posibilidad, especialmente en pacientes en los que coincidan múltiples factores de riesgo para la nefrotoxicidad, sobre todo cuando se ha recibido AINE.
Algunos fármacos pueden alterar la hemodinámica glomerular favoreciendo la hipoperfusión renal y potenciando la posible nefrotoxicidad de otros medicamentos. Estos fármacos son en su gran mayoría cardio y nefroprotectores, por lo que no se deben suspender (iSGLT2, iSRAA, incluyendo antagonistas del receptor de mineralcorticoides [ARM] como la espironolactona o la eplerenona), pero se deberá prestar especial atención para evitar que el exceso de dosis o la potenciación por diversas circunstancias, generalmente de carácter funcional (depleción brusca de volumen, exceso de dosis de diuréticos, exceso de control de la PA o administración de AINE), ya que pueden favorecer la aparición de hipotensión, lesión renal aguda o hiperpotasemia, así como posible nefrotoxicidad de otros fármacos, al presentarse una disminución en el FG de carácter funcional.
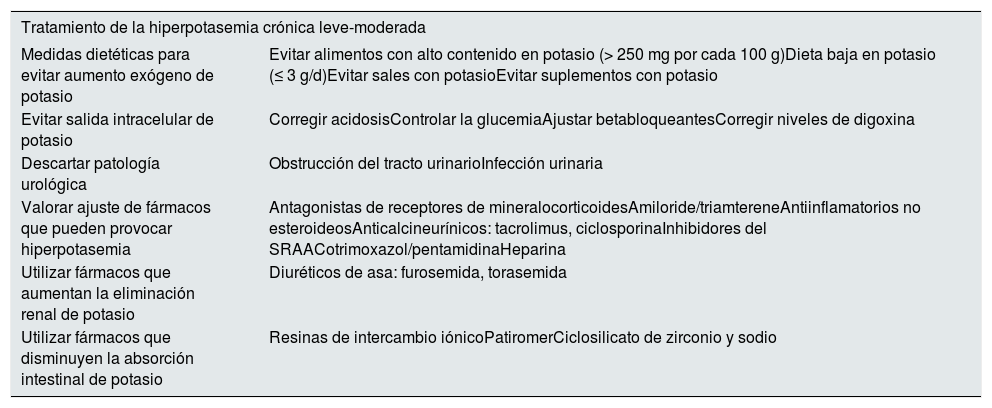
Medidas higiénico-dietéticas. Actitudes y estilo de vidaLa ERC se va a ver influenciada tanto en su aparición, como en su evolución y pronóstico, por la presencia de diversos factores de riesgo muy frecuentes en la población general73. Las recomendaciones en este sentido son las siguientes:
- •
Ejercicio físico: se recomienda 30-60 minutos de ejercicio moderado, 4 a 7 días por semana (minimo de 150 min/semana), con ejercicios aeróbicos y/o de fuerza, de una intensidad moderada, para evitar sedentarismo y con programas individualizados a las características del paciente e instauración paulatina en tiempo e intensidad74.
- •
Dieta: de tipo mediterránea, con alimentos ricos en fibra, evitar grasas saturadas y trans e individualizar según factores de riesgo existentes, dieta hiposódica en caso de HTA y/o insuficiencia cardiaca 6 g de sal (equivale a 2,4 g de sodio)75. Existe controversia en relación a la restricción de potasio en la ERC, especialmente en pacientes que no presenten hiperpotasemia, ya que algunos estudios han mostrado que dietas con moderado o alto contenido en potasio pueden disminuir el daño renal76, pero lo importante es establecer estrategias para evitar la hiperpotasemia grave. En fases avanzadas de la ERC (G4-G5) se darán recomendaciones dietéticas sobre el contenido de sodio, fósforo, potasio y proteínas. En pacientes con ERC G4-G5 no en diálisis se recomienda restricción proteica de 0,8 g/kg/día (al menos la mitad deben ser proteínas animales de alto valor biológico)77. En pacientes con ERC en hemodiálisis la ingesta proteica puede aumentar hasta 1,2 g/kg de peso para favorecer un adecuado balance proteico y evitar el desgaste calórico-energético y lograr un adecuado estado nutricional78,79.
- •
Se recomienda evitar ingesta de alcohol por encima de 12-14 gramos/día (aproximadamente 300 cc de cerveza o 150 cc de vino), y evitar el tabaquismo por sus efectos deletéreos cardiovasculares y renales80–83. Se deberá preguntar por el consumo de tabaco en todas las consultas que realicemos, y en los pacientes fumadores se realizará un consejo empático, firme y motivado para dejar de fumar utilizando Intervención Mínima Sistematizada, técnicas cognitivo-conductuales o tratamiento farmacológico (bupropion a dosis más bajas de la habitual –150 mg/24 h– en fases avanzadas de la enfermedad, o vareniclina a dosis habituales o a mitad de dosis (1 mg/24 h) en pacientes con función renal disminuida (ERC G4 y G5).
Confirmar el diagnóstico de HTA y detectar si reúne criterios de HTA de difícil control o resistente84 utilizando tanto la PA en consulta, automedida de la PA en domicilio (AMPA) o monitorización ambulatoria de la presión arterial (MAPA). Esta última evita sobretratamiento y ayuda a optimizar el control de la PA como factor de progresión renal y cardiovascular85,86.
Los objetivos de PA son diferentes según guías87, existiendo heterogeneidad de recomendaciones en la ERC:
- •
ACC (American College of Cardiology 2017): < 130/80 mmHg, independientemente del grado de proteinuria88.
- •
Guias NICE (National Institute for Health and Care Excellence): < 140/90 mmHg, en presencia de proteinuria < 1 g/día. Si proteinuria > 1 g/día: 130/80 mmHg34.
- •
KDIGO 2021: PA sistólica < 120 mmHg, usando iSRAA si FG < 60 mL/min/1,73 m2 o cociente ACR > 30 mg/g89.
- •
ESC/ESH 2018 (European Society of Cardiology/European Society of Hypertension): PA sistólica < 140 mmHg independientemente del nivel de proteinuria69.
Las evidencias disponibles no muestran un claro consenso sobre el objetivo de PA más adecuado en los pacientes con ERC. Por este motivo las recomendaciones de las guías tampoco son coincidentes y la estrategia de control de PA en el paciente con ERC tendrá que establecerse de forma individualizada, considerando el riesgo cardiovascular global, la proyección de descenso del FG y la presencia de otras comorbilidades. Además, los objetivos de control pueden ir cambiando a medida que el paciente envejece, se hace frágil o desarrolla una ERC más severa87.
El consenso es mucho mayor sobre el uso de antihipertensivos y se recomiendan como fármacos de primera elección aquellos que bloqueen las acciones del SRAA, bien inhibidores de la enzima de conversión de la angiotensina, antagonistas de los receptores de la angiotensina. Asimismo, se aconseja la utilización de combinaciones de fármacos antihipertensivos para alcanzar los objetivos de control. Dicha combinación debe incluir un diurético, tiazídico o de asa, según la severidad de la ERC69,88.
Detección y manejo de la hiperglucemia en la ERCObjetivos de manejo- •
¿Cómo valorar el control metabólico?
Utilización de la hemoglobina glicosilada A1c (HbA1c) para valorar el control metabólico en el paciente con ERC con FG hasta 30 mL/min/1,73 m290–95. A partir de esa cifra la fiabilidad de la HbA1c es menor y hay que tenerlo en cuenta96. En estas situaciones la monitorización continua de glucosa (MCG) puede ser útil en aquellos pacientes en quienes la hemoglobina A1c no es concordante con los niveles de glucosa en sangre medidos directamente o con los síntomas clínicos97.
- •
Objetivos de control glucémico
Para la HbA1c los objetivos individualizados apropiados pueden variar desde tan bajo como < 6,5% a tan alto como < 8%, dependiendo de factores del paciente (severidad de la ERC, complicaciones macrovasculares, comorbilidades, expectativa de vida, reconocimiento de hipoglucemia, tratamientos de riesgo de hipoglucemia)96. No hay evidencias que indiquen cuál es el nivel óptimo de HbA1c para los pacientes en diálisis. Los niveles de HbA1c >6,5% se han asociado a incremento en las complicaciones microvasculares98. Es un objetivo estricto a considerar si no existe riesgo de hipoglucemia, especialmente en jóvenes y DM-2 con larga expectativa de vida.
Fármacos antidiabéticos99La reciente guía KDIGO 202096 recomienda que el manejo glucémico para pacientes con DM-2 y ERC debe incluir terapia de estilo de vida, tratamiento de primera línea con metformina y un iSGLT-2, y terapia farmacológica adicional, según sea necesario para el control glucémico. En general, los agonistas del receptor del péptido similar al glucagón tipo 1 (AR GLP-1) son los fármacos adicionales preferidos debido a su beneficio demostrado en reducción de eventos cardiovasculares, particularmente entre las personas con ECV aterosclerótica prevalente y también por su potencial para prevenir la aparición de macroalbuminuria y posiblemente, asociarse a una caída más lenta del FG, además de poder contribuir a la reducción de peso.
- •
Metformina
En pacientes con DM-2, ERC y FG ≥30 mL/min/1,73 m2, se recomienda utilizar metformina como tratamiento de primera línea para la hiperglucemia (junto a los iSGLT2), con ajuste según función renal con igual pauta en pacientes trasplantados de riñón:
- ∘
No ajuste con FG > 45 mL/min/1,73m2.
- ∘
Reducir a la mitad con FG entre 30 y 45 mL/min/1,73 m2.
- ∘
Suspender metformina si FG < 30 mL/min/1,73 m2.
Es recomendable monitorizar la aparición de deficiencia de vitamina B12 cuando los pacientes son tratados con metformina durante más de cuatro años. Igualmente es recomendable advertir a los pacientes con cifras de FGe entre 30-40 mL/min/1,73m2 la importancia de contactar con su médico de familia cuando presenten complicaciones agudas (diarrea, hipotensión, vómitos, etc.) ya que puede producirse deterioro funcional en la función renal y pueden presentarse complicaciones derivadas del acumulo de metformina en insuficiencia renal.
- •
Inhibidores de SGLT2
El tratamiento con iSGLT2 se acompaña de importantes beneficios cardiovasculares y renales en pacientes con DM-2 y diferentes rangos de función renal y albuminuria, demostrados en los estudios EMPA-REG OUTCOME, CANVAS, DECLARE y CREDENCE36,37,100,101. Los beneficios fueron desproporcionados en relación con la reducción en la HbA1c y no parecen depender de la reducción de glucosa.
Con base en ello, el KDIGO Work Group96 consideró que para la mayoría de los pacientes con DM-2, ERC y FG ≥ 30 mL/min/1,73 m2 elegiría el tratamiento con un iSGLT2, independientemente de la etapa de ERC o el nivel de control glucémico. La elección de un iSGLT2 debería priorizar a los fármacos con beneficios renales o cardiovasculares documentados, teniendo en cuenta el FG, ya que el grado de función renal influye en la eficacia antihiperglucémica, pero no en el beneficio cardiovascular y renal.
Si el paciente no requiere reducción adicional de glucemia puede aumentar el riesgo de hipoglucemia (por ejemplo, aquellos tratados con insulina o sulfonilureas y que actualmente se encuentran en objetivos glucémicos), por lo que puede ser necesario suspender o reducir la dosis de un antihiperglucémico distinto de metformina para facilitar la adición de un iSGLT2.
Deberá considerarse la posibilidad de efectos secundarios y ajustar tratamientos concomitantes (antecedente de infecciones genitales candidiásicas recidivantes o si hay episodios de depleción o exceso de dosis de diuréticos o especialmente en pacientes con situaciones o factores de riesgo para presentar cetoacidosis diabética)102.
Como se ha mencionado, la caída reversible del FG con el comienzo del iSGLT2 no es per se una indicación para suspender el tratamiento ya que está asociada al efecto hemodinámico reduciendo la hipertensión intraglomerular66.
Una vez que se inicia un iSGLT2, es razonable continuar con él incluso si el FG cae por debajo de 30 mL/min/1,73 m2, a menos que los cambios reversibles en el FG sean síntomas urémicos precipitantes u otras complicaciones de la ERC.
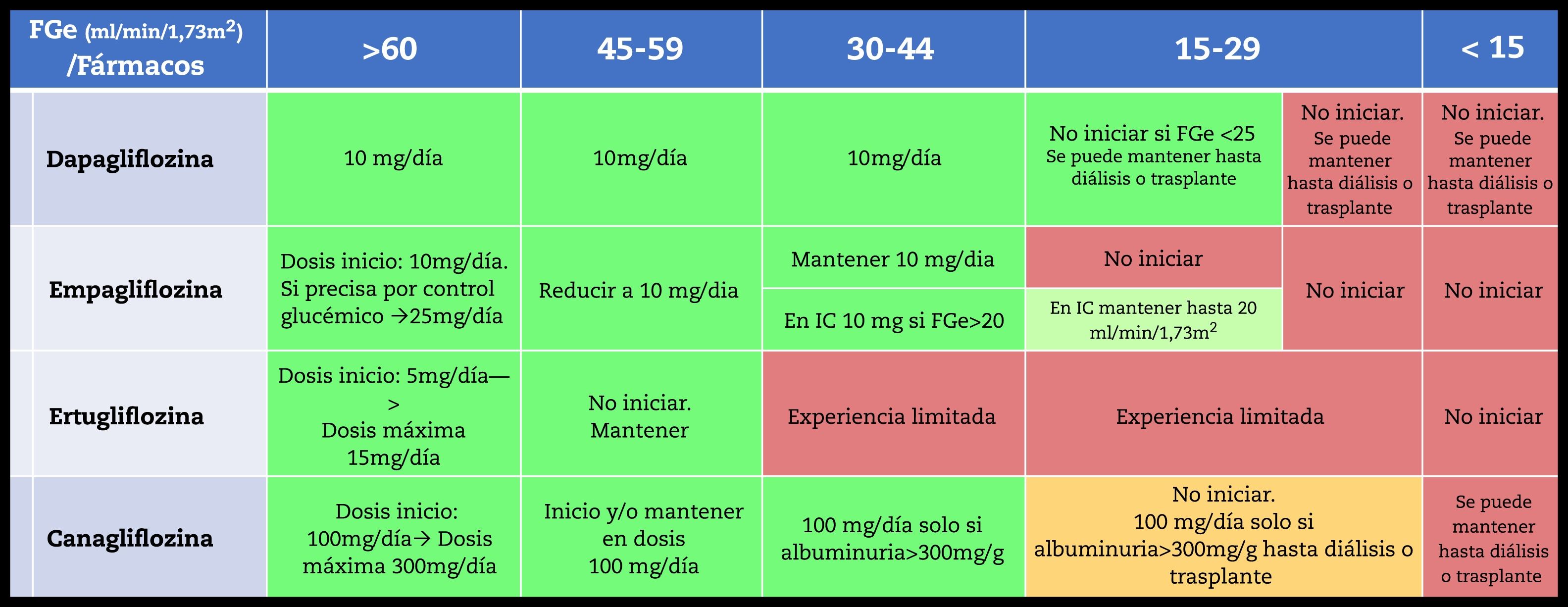
Las fichas técnicas de los iSGLT2 están actualizándose a las evidencias de los estudios que han mostrado beneficio hasta el inicio de diálisis en pacientes con enfermedad renal diabética. Por ello es preciso revisar los muy probables cambios en las fichas técnicas en breve ya sea por inicio y mantenimiento de los iSGLT2 en pacientes con FGe reducidos, como su uso en ERC no diabética o en insuficiencia cardiaca con FGe reducido100. Las actuales recomendaciones de inicio de tratamiento según FGe y mantenimiento de los iSGLT2 se muestran en la tabla 12.
Los iSGLT2 no se han estudiado suficientemente en receptores de trasplante renal, que pueden beneficiarse iSGLT2, pero el estado de inmunosupresión podría favorecer un mayor riesgo de infecciones, especialmente durante el primer año postrasplante. Por lo tanto, la recomendación de usar iSGLT2i no es extensible a receptores de trasplante renal en el momento actual hasta que se disponga de mas experiencia.
Agonistas del receptor del péptido similar al glucagón tipo 1Los AR GLP-1 han demostrado beneficio cardiovascular y reducción en la proteinuria. Se recomienda su utilización en pacientes con DM-2 y ERC que no han alcanzado los objetivos glucémicos individualizados a pesar del uso de metformina e iSGLT2, o en aquellos en los que no se pueden usar esos medicamentos. Se recomiendan aquellos que hayan conseguido beneficio cardiovascular y renal (liraglutida, semaglutida y dulaglutida). Albiglutida no está disponible en España. Estos tres fármacos pueden utilizarse hasta un FG de 15 mL/min/1,73 m2, si bien la experiencia en pacientes con ERC G4 (FG entre 15 y 30 mL/min/1,73 m2) es limitada.
Además de los beneficios cardiovasculares y renales, consiguen importantes reducciones en la HbA1c con bajo riesgo de hipoglucemia y con beneficios adicionales como la reducción de peso y de PA103. El riesgo de hipoglucemia es generalmente bajo con AR GLP-1 cuando se usan solos, pero el riesgo aumenta cuando se usan concomitantemente con otros antidiabéticos, por ello, cuando se administra un AR GLP-1 se debe reducir la dosis de sulfonilureas o de insulina ya que se aumenta el riesgo de hipoglucemia. Para minimizar los efectos secundarios gastrointestinales de estos fármacos, debe comenzarse con una dosis baja de AR GLP-1, y titular lentamente, probablemente de forma mas lenta que la indicada en ficha técnica.
Los AR GLP-1 no deben usarse en combinación con inhibidores de la dipeptidil peptidasa 4 (iDPP-4). En nuestro país, los AR GLP-1 están financiados para el tratamiento de la DM-2 exclusivamente para pacientes con un índice de masa corporal mayor de 30 kg/m2104.
- •
Inhibidores de la dipeptidil peptidasa 4
Son fármacos seguros en términos de escaso riesgo de hipoglucemia y muy bien tolerados. Sin embargo, a diferencia de los AR GLP-1, no han demostrado ofrecer protección cardiovascular ni renal en los estudios realizados. Pueden usarse en monoterapia y en asociación con cualquier otro fármaco, excepto AR GLP-1, ya que habrá que suspender lo iDPP4 cuando se administre un AR GLP-1.
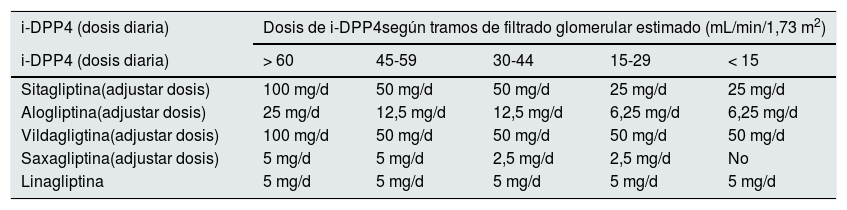
Los ajustes según función renal de los distintos iDPP4 se muestran en la tabla 13.
- •
Secretagogos
Dosificación de los iDPP4 según grado de función renal. Se muestran las dosis diarias
| i-DPP4 (dosis diaria) | Dosis de i-DPP4según tramos de filtrado glomerular estimado (mL/min/1,73 m2) | ||||
|---|---|---|---|---|---|
| i-DPP4 (dosis diaria) | > 60 | 45-59 | 30-44 | 15-29 | < 15 |
| Sitagliptina(adjustar dosis) | 100 mg/d | 50 mg/d | 50 mg/d | 25 mg/d | 25 mg/d |
| Alogliptina(adjustar dosis) | 25 mg/d | 12,5 mg/d | 12,5 mg/d | 6,25 mg/d | 6,25 mg/d |
| Vildagligtina(adjustar dosis) | 100 mg/d | 50 mg/d | 50 mg/d | 50 mg/d | 50 mg/d |
| Saxagliptina(adjustar dosis) | 5 mg/d | 5 mg/d | 2,5 mg/d | 2,5 mg/d | No |
| Linagliptina | 5 mg/d | 5 mg/d | 5 mg/d | 5 mg/d | 5 mg/d |
Las sulfonilureas (SU) no son el fármaco de primera elección en la insuficiencia renal. Glibenclamida y glimepirida son metabolizadas en el hígado a metabolitos más débiles, pero de eliminación urinaria, por lo que su uso incluso en dosis bajas no es ya aconsejable en pacientes con ERC. La glipizida es metabolizada a metabolitos inactivos, en consecuencia, sería la única SU que se puede administrar en la ERC, pero su uso no está permitido con FG más bajos (< 30 mL/min/1,73 m2). La repaglinida tiene un metabolismo hepático con menos de un 10% de eliminación renal. A pesar de ello, cuando se instaure su tratamiento se debe iniciar con una dosis baja 0,5 mg.
- •
Inhibidores de α-glucosidasa
Tanto la acarbosa como el miglitol, como sus metabolitos, se acumulan en la insuficiencia renal, a lo que se añade la escasa experiencia en estudios en pacientes con ERC, su escasa potencia hipoglucemiante y sus efectos secundarios gastrointestinales por lo que su uso no está recomendado105.
- •
Glitazonas
Las glitazonas tienen un metabolismo hepático, excretándose menos del 2% por la orina. En consecuencia, no hay acumulación de metabolitos activos en la insuficiencia renal. Sin embargo, dado que su uso aumenta el riesgo de edema, insuficiencia cardíaca y osteoporosis, su uso está limitado en estos pacientes y contraindicado en aquellos en diálisis.
- •
Insulina
Las necesidades de insulina son muy variables, por lo que la individualización del tratamiento es esencial. Como normas iniciales que deben adaptarse a cada paciente mediante la monitorización de glucosa, podemos señalar:
- ∘
FG > 50 mL/min/1,73 m2: no se precisa ajuste de dosis.
- ∘
FG 50-10 mL/min/1,73 m2: precisará una reducción del 25% de la dosis previa de insulina.
- ∘
FG < 10 mL/min/1,73 m2: precisará una reducción del 50% de la dosis previa de insulina.
El régimen de insulina se adaptará al objetivo de control y puede ser una terapia convencional o un tratamiento intensivo, si bien conviene recordar que la pauta bolo-basal es la que presenta una tasa de hipoglucemias más baja.
Un fenómeno interesante es el llamado «burn-out diabetes» (agotamiento de la diabetes), bien descrita entre algunos pacientes (∼ 15-30%) con ERC avanzada (FG < 20 mL/min/1,73 m2) y DM-2. Estos pacientes habían sido tratados previamente con insulina u otros agentes anti-hiperglucémicos, y a medida que la ERC avanza a ERC terminal necesitan menos o ningún medicamento para el control glucémico106. Se han implicado varios factores, incluyendo: una vida media prolongada de insulina endógena y exógena, disminución de la resistencia a la insulina resultante de la eliminación de toxinas urémicas por diálisis, disminución de la gluconeogénesis y mal estado nutricional107.
Detección y manejo de la dislipemia en la ERCLa dislipemia incrementa el riesgo cardiovascular y es un objetivo a controlar en el paciente con ERC pues es considerado de alto (FG 30-59 mL/min/1,73 m2) o muy alto riesgo cardiovascular (FG < 30 mL/min/1,73 m2). Los objetivos de LDL-c sugeridos son reducción del LDL-c basal ≥ 50% respecto a la cifra basal y 70 mg/dL en ERC G3 y 55 mg/dL en ERC G4 y G5 no en diálisis108.
Existen evidencias de beneficio del tratamiento de la dislipemia en ERC en estadios anteriores a la diálisis (G5D)109, pero los beneficios en los pacientes en diálisis no están tan claros109.
El tratamiento se basará en las medidas dietéticas y la administración de estatinas solas o asociadas a ezetimiba110. La ezetimiba no requiere ajuste de dosis por insuficiencia renal. Las estatinas de elección serían aquellas que presentan eliminación hepática (fluvastatina, atorvastatina y pitavastatina). En el caso de pacientes trasplantados renales debe tenerse en cuenta determinadas interacciones111, particularmente de ciclosporina con atorvastatina, lovastatina y simvastatina, ya que puede aumentar sus niveles y aumentar el riesgo de miopatía. Fluvastatina, pravastatina, pitavastatina, y rosuvastatina tienen menos probabilidad de interaccionar. Aunque tacrolimus se metaboliza también por el CYP3A4 parece que tiene menos riesgo de interaccionar con estatinas. En estos pacientes las estatinas deberán iniciarse a bajas dosis, titularse con cautela y vigilar las interacciones112.
Siendo el control de las cifras de colesterol el objetivo primario, las guías KDIGO113 recomiendan la utilización de fibratos con cifras de triglicéridos > 1.000 mg/dL para evitar pancreatitis. Con cifras > 500 mg/dL se aconseja cambios en el estilo de vida. En caso de asociación con estatinas se prefiere fenofibrato a gemfibrozilo por el menor riesgo de miopatía y rabdomiolisis realizando ajuste a función renal (de 67-100 mg/24 h si el FG entre 30-60 mL/min/1,73 m2). Sin embargo, es esperable una disminución del FG de significado aún incierto, relacionada probablemente con la inhibición de la secreción tubular de la creatinina, incremento en la producción de creatinina por los fibratos o con un incremento en las prostaglandinas vasodilatadoras, dando como consecuencia una falsa disminución del FG, aunque sus consecuencias no están claramente establecidas114.
No hay evidencias en la población general sobre la utilización de ácidos grasos Omega 3 para el tratamiento de la dislipemia115 y tampoco estudios en ERC que apoyen su uso.
Los inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (iPCSK9) pueden ser una alternativa en pacientes con ERC que no hayan respondido a otros tratamientos y hayan presentado acontecimientos cardiovasculares previos. Evolocumab y alirocumab han demostrado su capacidad para reducir las cifras de colesterol LDL, así como la reducción de eventos cardiovasculares mayores en prevención secundaria en pacientes de alto o muy alto riesgo cardiovascular en los estudios FOURIER y ODYSSEY-OUTCOMES116,117. Concretamente, se ha publicado un estudio de eficacia y seguridad en pacientes con ERC incluidos en el estudio FOURIER. Sus resultados muestran que dichos pacientes presentan una reducción de eventos cardiovasculares mayores similar a los que tienen función renal normal, y no muestran una mayor tasa de eventos adversos ni cambios en la función renal, salvo los pacientes que desarrollan rabdomiólisis118. Ninguno de estos estudios se ha diseñado de forma específica para pacientes con ERC. Además, se excluyeron pacientes con FG por debajo de 20 mL/min/1,73 m2 y pacientes trasplantados. No obstante, la Sociedad Española de Aterosclerosis recomienda en los pacientes con ERC grado 3b o superior el tratamiento con iPCSK9 en prevención primaria si no alcanzan un colesterol LDL < 130 mg/dL con estatinas119. La indicación de estos fármacos en nuestro país está sujeta al informe de posicionamiento terapéutico120,121.
Otras estrategias en nefroprotecciónHasta ahora el bloqueo del SRAA había sido la única evidencia en el tratamiento y prevención de la ERC, tanto en diabéticos como en pacientes no diabéticos7,68,89,122,123. En la DM-2 el tratamiento con iSGLT2 tiene hasta el momento las mayores evidencias en nefroprotección36,37,100,101,124 y existen también evidencia de reducción en la albumirnuia con AR GLP-1125–127.
Recientemente finerenona, un antagonista del receptor mineral corticoide mas específico y selectivo sin efectos hormonales y con menos tendencia a la hiperpotasemia que espironolactona y eplerenona, ha demostrado beneficio nefroprotector cuando se comparó con placebo en pacientes DM-2 tratados con iSRAA. Finerenona no está comercializada por el momento128.
Dapagliflozina cuenta con indicación para el manejo de la enfermedad renal crónica no solo en pacientes con DM-2, sino también en pacientes con ERC no diabética (otras etiologías como la nefroangioesclerosis y la nefropatía por IgA entre otras)124,129. En el estudio DAPA-CKD, dapagliflozina ha demostrado enlentecer la progresión de la enfermedad renal, así como mejorar la supervivencia en pacientes con y sin DM2. Su inicio está recomendado hasta un FGe de 25 ml/min/1,73m2, pudiéndose mantener hasta el comienzo de la terapia renal sustitutiva.
De la misma forma, recientemente se ha aprobado el uso de empagliflozina en pacientes con DM-2 hasta un FGe de 30 ml/min/1,73m2. En el caso de insuficiencia cardiaca, con o sin DM2, se puede administrar hasta FGe de 20 ml/min/1,73m2.
En base al estudio CREDENCE100, canagliflozina puede iniciarse en pacientes con DM-2 hasta un FGe de 45 ml/min/1,73m2 o en caso de FGe entre 30-45 ml/min/1,73m2 si la albuminuria es > 300 mg/g. En ambos casos puede mantenerse el tratamiento hasta el inicio de diálisis o trasplante renal (tabla 12). De esta manera se pueden utilizar los iSGLT2 hasta filtrados reducidos, cada uno con sus características específicas de sus fichas técnicas. Probablemente la aparición de nuevos estudios dé lugar a ampliación del espectro de indicaciones de estos fármacos e incluso en mayores rangos de FGe.
Indicaciones de i-SGLT2 aprobadas en diabetes mellitus tipo 2 según FGe (noviembre de 2021)
Considerar un tratamiento adicional para disminuir la glucosa si FGe <45 ml/min/1.73m2.
Fichas técnicas de los productos: último acceso 29 de octubre de 2021.
iSGLT2: inhibidores del co-transportador sodio glucosa tipo 2; FGe: Filtrado glomerular estimado;
La obesidad es un factor de progresión renal y debe considerarse como un objetivo a tratar para reducir el riesgo cardiovascular y el riesgo de progresión renal130. De forma paradójica, se ha comprobado una relación inversa entre obesidad y mortalidad de pacientes en diálisis y parece que un IMC elevado protege a corto plazo, pero este beneficio no se mantiene en el tiempo131.
No hay evidencias sólidas sobre tratamientos para la obesidad en la ERC. En la actualidad se dispone de liraglutide, un AR GLP1 y según ficha técnica está indicado en el tratamiento de la obesidad en combinación con una dieta baja en calorías y un aumento de la actividad física. Su mecanismo de acción incluye el retardo de vaciado gástrico y una acción central de disminución del apetito, aumentando la sensación de saciedad. Los AR GLP-1 comercializados en nuestro país que han demostrado beneficios renales (liraglutida, semaglutida y dulaglutida) se pueden administrar hasta un FG de 15 mL/min/1,73 m2132. Aunque su farmacocinética indica que no incrementa el área bajo la curva, ni siquiera en pacientes en diálisis, no existen estudios para avalar su uso en ERC G5. Se necesitan estudios que puedan demostrar su seguridad y eficacia en ERC G5, ya que la no indicación en ficha técnica está relacionda con falta de estudios.
Detección y manejo de la hiperuricemia en la ERCLa hiperuricemia puede dar lugar a un espectro clínico variable: artritis gotosa aguda debida a la precipitación de cristales de urato monosódico a nivel de las articulaciones, gota tofácea debida a la precipitación de los cristales en piel y tejido celular subcutáneo, la nefrolitiasis úrica, la nefropatía aguda por ácido úrico y la nefropatía crónica por ácido úrico.
En la actualidad no existen suficientes evidencias para el tratamiento de la hiperuricemia asintomática. Las decisiones de iniciar tratamiento se basarán en el riesgo de cada paciente de desarrollar depósitos de cristales, gota o nefropatía úrica, así como en los efectos secundarios relacionados con el tratamiento.
La decisión con respecto a la institución de terapias basadas en el estilo de vida o farmacológicas para la hiperuricemia asintomática deben individualizarse según las estimaciones del riesgo de eventos clínicos relacionados con la hiperuricemia y los posibles beneficios y riesgos de la intervención.
Los fármacos hipouricemiantes incluyen: a) inhibidores de la xantina-oxidasa (XO) que bloquean el metabolismo de las purinas, b) uricosúricos que actúan sobre la principal causa de hiperuricemia, que es la hipoexcreción y 3) tratamiento con uricasa, que oxida el urato a través de una reacción enzimática a alantoína. Se recomienda iniciar el tratamiento con fármacos hipouricemiantes tras el primer ataque de gota en pacientes con ERC ≥ G2. El objetivo es mantener los niveles de ácido úrico por debajo de 6 mg/dL (5 mg/dL en caso de gota tofácea).
En la tabla 14 se enumeran los diferentes fármacos hipouricemiantes comercializados en España, su mecanismo de acción y dosis en los diferentes estadios de ERC.
Fármacos hipouricemiantes comercializados en España. Dosis recomendadas en pacientes con ERC
| Fármacoshipouricemiantes | Clase | Dosis | Recomendaciones en pacientes con ERC (G3-5) | Recomendaciones G5-Diálisis |
|---|---|---|---|---|
| Alopurinol | Inhibidor XO | Inicio 50-100 mg/dMáxima: 800 mg/d | FG ≥ 30 mL/min empezar 50-100 mg/dFG < 30 mL/min/1,73 m2Empezar 50 mg/da | HD: inicio 100 mg posdiálisisDP: inicio 50 mg/d |
| Febuxostatb | Inhibidor XO | Inicio: 40 mg/dMáxima: 120 mg/d | Datos insuficientes en pacientes con FG < 30 mL/minc | Datos insuficientes |
| Benzbromarona | Uricosúrico | Inicio 25-50 mg/dMáxima: 200 mg/d | Contraindicado si FG < 20 mL/min | Contraindicado |
| Lesinurad | Uricosúrico | Inicio 200 mg/d junto iXOMáxima:200 mg/d | Contraindicado si FG < 45 mL/min | Contraindicado |
HD: hemodiálisis, DP: diálisis peritoneal.
Independientemente del fármaco hipouricemiante utilizado, existen unas normas comunes en la utilización de todos ellos: a) iniciar siempre el tratamiento con profilaxis, b) empezar con la dosis más baja, con monitorización de los niveles hasta alcanzar el objetivo, c) el fármaco no debe ser retirado ni modificado en su dosis durante un ataque de gota, y 4) en tratamientos nuevos, el fármaco debe ser introducido tras la resolución del ataque agudo de gota. Las guías recomiendan tratamiento profiláctico cuando se inician hipouricemiantes durante tres meses o seis meses en casos de gota tofácea. La colchicina está contraindicada en pacientes con FG menor de 30 mL/min/1,73 m2 y en pacientes con ERC estadio 3 se deberá dar un comprimido de 0,5 mg al día.
En la tabla 15 se muestran los fármacos que se pueden utilizar durante un ataque agudo de gota y su ajuste en pacientes con ERC133.
Fármacos indicados en el tratamiento del ataque agudo de gota y ajuste de dosis en la ERC
| Función renal normal | ERC (G3-G5) | Diálisis | |
|---|---|---|---|
| Colchicina | 1-2 mg/d. Dosis máxima de 2 mg/d. No superar 6 mg en 4 d. Periodo de lavado de tres días, antes de repetir pauta | Estadio G3 disminuir dosis a la mitad y aumentar intervalosFG < 30 contraindicado | Contraindicado |
| AINEs | Cualquiera a su dosis habitual | En estadio G3 con precaución y disminuyendo dosisEstadio G4 contraindicado | Cualquiera a su dosis habitual |
| Corticoides(en pacientes con contraindicación de colchicina y/o AINEs) | 0,5 mg/kg/d, reduciendo 5 mg cada 2 días | Igual que función renal normal | Igual que función renal normal |
| Análogo de ACTH(tetracosáctida depot) | 25-40 mg i.m. o s.c. en pacientes que no responden a otros ttos. | No requiere ajuste de dosis | No requiere ajuste de dosis |
| Inhibidores de IL-1(gota refractaria) | Anakinra dosis 100 mg s.c./d*Canakinumab 150 mg s.c., monodosis | Estadio G4: Anakinra 100 mg/48 hCanakinumab: no necesita ajuste | Anakinra 100 mg/48 hCanakinumab: no ajuste de dosis |
AINEs: antiinflamatorios no esteroideos; ACTH: corticotropina; IL-1: interleuquina 1; i.m.: intramuscular; s.c.: subcutáneo.
La anemia asociada a la ERC generalmente es normocitica y normocrómica y no suele asociarse a déficit férrico (ferritina > 100 ng/mL e IST > 20%). En caso contrario, es conveniente hacer diagnóstico diferencial con otras causas de anemia. No obstante, la anemia de causa renal es un diagnóstico de exclusión.
Ante la presencia de anemia en un paciente con ERC se deberá realizar estudio para descartar otras causas de anemia, que incluirá: hemograma, porcentaje y recuento de reticulocitos, ISAT, ferritina, B12 y ácido fólico63.
Las indicaciones para la derivación de un paciente con ERC y anemia serán63:
- ∘
Indicación de ferroterapia intravenosa (fallo/intolerancia de la ferroterapia oral).
- ∘
Indicación de tratamiento con AEE-EPO.
- ∘
En el paciente tratado con AEE-EPO y Hb ≥ 13 g/dL o Hb ≤ 9 g/dL confirmados (para ajuste de dosis).
En el documento de consenso para la detección y manejo de la anemia renal de la S.E.N. y las tres sociedades de AP se especifican de manera más detallada estos aspectos63.
Detección y manejo de las alteraciones del metabolismo óseo y mineral en la ERCLas alteraciones en el metabolismo del calcio y fósforo en la ERC se asocian con diversas complicaciones que van más allá de la simple afectación ósea (anteriormente llamada osteodistrofia renal) e implica a otros sistemas, especialmente al cardiovascular (por ejemplo, calcificaciones vasculares y valvulares, rigidez arterial, hipertrofia ventricular izquierda, etc.), asociándose claramente a un aumento de morbimortalidad cardiovascular y global.
La manifestación clínica más conocida es el incremento de la hormona paratiroidea (PTH) [(hiperparatiroidismo secundario (HPS)] producida, entre otros factores, por una tendencia multifactorial a la hipocalcemia, un déficit de vitamina D activa (calcitriol) o la retención de fosfato (con o sin hiperfosfatemia). De hecho, es frecuente el hallazgo de niveles plasmáticos normales de calcio y fósforo a expensas de una elevación significativa de PTH por lo que siempre deberían valorarse en su conjunto134,135. Es poco frecuente la aparición de hipercalcemia y/o hipofosfatemia con PTH elevada debiendo pensar en esos casos en hiperparatiroidismo primario (hiperplasia o adenoma de paratiroides) incluso en pacientes con ERC. El manejo del hiperparatiroidismo secundario a ERC se realiza desde Nefrología.
Los objetivos de la detección y del tratamiento son:
- ∘
Evitar la hiperfosfatemia
- ∘
Evitar el déficit de vitamina D (calcidiol o 25-OH-vitamina D)
- ∘
Evitar el incremento persistente y progresivo del HPS
La hiperfosfatemia se debe tratar inicialmente con una dieta adecuada y equilibrada (con especial precaución a disminuir el aporte de fósforo inorgánico contenido, por ejemplo, en los aditivos de las comidas preparadas) y/o con el uso de captores de fosfato134,135. Se deberá corregir la concentración sérica de vitamina D hasta al menos de 20-30 ng/mL (50-75 nmol/L) mediante suplementos que contribuirán a las acciones hormonales pleiotrópicas de la vitamina D y controlar casos leves de HPS.
Especialmente en los estadios G4 y G5 se aconseja incluso mantener la PTH en valores ligeramente superiores a la normalidad, de modo que los niveles de PTH intacta considerados clásicamente como adecuados en un paciente con ERC G5 se sitúan entre 150-300 pg/mL (dos a cinco veces el límite superior de la normalidad para el ensayo usado). Un pequeño grado de HPS estable no es preocupante y representa un fenómeno adaptativo (i.e. la PTH es una hormona fosfatúrica), pero el HPS progresivo, con valores de PTH dos o tres veces superiores al valor de referencia a pesar de niveles adecuados de calcidiol, podrían requerir una consulta al menos inicial al especialista de Nefrología y/o el inicio de formas activas o análogos de la vitamina D (calcitriol, paricalcitol, alfacalcidol). Niveles persistentemente elevados de fosfato serían igualmente tributarios de consejo dietético y/o consulta nefrológica.
El tratamiento se basa en:
- ∘
Consejos dietéticos para evitar la hiperfosfatemia.
- ∘
Captores o quelantes del fosfato: carbonato cálcico, acetato cálcico o su asociación con magnesio, sevelámer (clorhidrato o carbonato), carbonato de lantano o el oxihidróxido sucroférrico.
- ∘
Vitamina D «nativa» (colecalciferol o calcifediol).
- ∘
En caso de persistencia y especialmente de progresión del HPS (se valoran tendencias), calcitriol o análogos de la vitamina D136. En pacientes en diálisis se pueden utilizar los calcimiméticos.
Recientemente ha adquirido relevancia la osteoporosis como un problema añadido en los pacientes con ERC. Puede ser senil, postmenopáusica o asociada al tratamiento con esteroides, entre otras causas. Además, ahora se sabe que la frecuencia de fracturas y su morbimortalidad es mayor en los pacientes con ERC137 y que la densitometría (DEXA) tiene valor predictivo de fracturas también en estos pacientes. La densitometría estaría indicada si los resultados impactaran en la toma de decisiones terapéuticas. No existen evidencias claras en el tratamiento para la osteoporosis en la ERC y sólo existen experiencias retrospectivas de que estos fármacos son efectivos en pacientes con ERC138,139. Sin embargo, las guías actuales aconsejan adoptar una actitud proactiva al respecto134,140.
Detección y manejo de la hiperpotasemia en la ERCLa hiperpotasemia se define cuando la concentración de potasio sérico se eleva por encima del límite superior de la normalidad (5 mEq/L). Se considera ligera si las concentraciones de potasio son de 5 a 5,5 mEq/L, moderada entre 5,5 y 6 mEq/L y grave si es superior a 6 mEq/L. La hiperpotasemia está generalmente asociada a la disminución del FG (dificultad para excretar potasio), a la utilización de iSRAA y/o ARM o a una alteración en la redistribución del potasio (intra-extracelular). Una excepción importante son los pacientes con hipoaldosteronismo hiporreninémico (acidosis tubular renal tipo IV) en los que puede aparecer hiperpotasemia con grados menores de disminución del FG. Estos se caracterizan por hipoaldosteronismo e hiperpotasemia y aparece en diversas enfermedades renales como la nefropatía diabética, nefropatías intersticiales y la uropatía obstructiva, así como con el uso de AINEs, entre otras causas.
Las resinas de intercambio catiónico eliminan potasio intercambiándolo por otro catión en el tubo digestivo. Su principal inconveniente es su efectividad limitada y el retraso en el inicio de su acción, de varias horas, además de su intolerancia por síntomas gastrointestinales. Recientemente, se han desarrollado dos nuevos quelantes del potasio (el patiromer y el ciclosilicato de zirconio y sodio), que ofrecen una mejor tolerancia y eficacia. El uso de estos nuevos fármacos puede permitir el mantenimiento del beneficio cardio-renal con iSRAA con mucha mejor tolerancia que el polestireno sulfonato cálcico clásico.
Las medidas para el tratamiento de la hiperpotasemia moderada-leve asintomática se muestran en la tabla 16. En la siguiente publicación se pueden conocer más detalles sobre el tratamiento de la hiperpotasemia crónica141.
Tratamiento de la hiperpotasemia crónica leve-moderada
| Tratamiento de la hiperpotasemia crónica leve-moderada | |
|---|---|
| Medidas dietéticas para evitar aumento exógeno de potasio | Evitar alimentos con alto contenido en potasio (> 250 mg por cada 100 g)Dieta baja en potasio (≤ 3 g/d)Evitar sales con potasioEvitar suplementos con potasio |
| Evitar salida intracelular de potasio | Corregir acidosisControlar la glucemiaAjustar betabloqueantesCorregir niveles de digoxina |
| Descartar patología urológica | Obstrucción del tracto urinarioInfección urinaria |
| Valorar ajuste de fármacos que pueden provocar hiperpotasemia | Antagonistas de receptores de mineralocorticoidesAmiloride/triamtereneAntiinflamatorios no esteroideosAnticalcineurínicos: tacrolimus, ciclosporinaInhibidores del SRAACotrimoxazol/pentamidinaHeparina |
| Utilizar fármacos que aumentan la eliminación renal de potasio | Diuréticos de asa: furosemida, torasemida |
| Utilizar fármacos que disminuyen la absorción intestinal de potasio | Resinas de intercambio iónicoPatiromerCiclosilicato de zirconio y sodio |
SRAA: sistema renina-angiotensina-aldosterona.
La acidosis metabólica en la ERC suele ser una acidosis crónica normoclorémica o con hiato aniónico aumentado que frecuentemente aparece con FG < 20 mL/min/1,73 m2 debido a un incremento de la carga de ácidos por la incapacidad renal de eliminarlos. Es importante tratarla para evitar la desmineralización ósea a largo plazo, así como la progresión de la propia ERC, entre otros efectos deletéreos142.
Para su tratamiento, podemos utilizar bicarbonato sódico oral cuando su valor en sangre es inferior a 22 mmol/L7. Además disponemos de otras medidas como son la dietas ricas en proteínas de origen vegetal productoras de bases como frutas y verduras143 y otros fármacos de reciente comercialización como el veverimer, polímero no absorbible que se une selectivamente al ácido clorhídrico, eliminándolo de la luz intestinal a través de las heces144. Obviamente debe evitarse la sobrecarga de sodio inducida por el bicarbonato clásico, así como la sobrecorrección y alcalosis metabólica.
Manejo de la hepatitis por VHC en la ERCLa infección por VHC se asocia con un 23% de mayor riesgo de desarrollo y progresión de ERC, aunque los mecanismos ocultos de esta asociación estén actualmente en investigación145.
Todos los pacientes con ERC con/sin TRS incluso candidatos a trasplante renal, con hepatitis crónica por VHC son candidatos a la terapia antiviral, según las distintas guías y sociedades científicas, incluido el Plan Estratégico de Abordaje de la hepatitis C una excepción los pacientes con contraindicaciones especificas o con esperanza de vida limitada por otras enfermedades intercurrentes. No existen recomendaciones en el manejo de la hepatitis aguda C146,147.
Los tratamientos basados en interferón y ribavirina han sido mal tolerados al eliminarse por el riñón y tener importantes efectos secundarios, con baja tasa de respuesta viral sostenida.
Los antivirales de acción directa, consiguen una respuesta viral sostenida mayor del 90-95%, presentando un excelente perfil de seguridad y tolerancia148–150. Los efectos adversos son muy poco frecuentes, siendo muy habituales las interacciones con fármacos de uso habitual, a tener en cuenta especialmente en el trasplantado renal151.
Entre los regímenes actuales con mayor eficacia y seguridad en ERC avanzada o en diálisis, libres de interferón, se incluyen: elbasvir/grazoprevir (genotipos 1 y 4), ombitsavir/dasabuvir/paritaprevir/ritonavir (genotipo 1), ledipasvir/sofosbuvir (genotipos 1, 4, 5 y 6), glecaprevir/pibrentasvir y sofosbuvir-velpatasvir (todos los genotipos)152–154. En algunos casos se hace necesaria la administración de ribavirina.
Alcanzar la respuesta viral sostenida o el nivel de ARN vírico indetectable después del tratamiento de 12 semanas, supone la curación en el 99% de los pacientes durante su seguimiento a largo plazo. No obstante, se precisa una segunda determinación de ARN vírico durante el primer año tras finalizar la terapia146.
Manejo de los anticoagulantes de acción directa (ACOD) en la ERCLa prevalencia de la fibrilación auricular (FA) está significativamente aumentada en sujetos con ERC y HD, siendo el ictus cardioembólico una de sus complicaciones más frecuentes155. Los pacientes con FA y ERC tienen un riesgo aumentado de complicaciones trombóticas, debido a la frecuente coexistencia de otros factores tales como edad avanzada, DM, comorbilidades vasculares o el propio TSR. Sin embargo, también son muy frecuentes los eventos hemorrágicos, como consecuencia de la alteración en la síntesis, activación y función plaquetaria del paciente renal156.
Existen diferentes ACOD aprobados para la prevención del ictus en pacientes con FA. Actúan a través de la inhibición del factor Xa (rivaroxaban, apixaban, edoxaban), o de la trombina (dabigatran).
Un aspecto importante a considerar es que las recomendaciones de los estudios pivotales con ACOD se han realizado con base en la utilización de la fórmula de C&G y no CKD-EPI. Aunque las sociedades científicas recomienden ésta última ecuación, por el momento la prescripción se debe basar en C&G, ya que es en lo que se basó la dosificación en los estudios pivotales. Las sociedades científicas deberán pronunciarse a este respecto.
En los ensayos clínicos pivotales, los ACOD, cumplen criterios de no inferioridad respecto a warfarina en pacientes con aclaramiento de creatinina (ClCr) calculado mediante la ecuación de C&G de 30-50 mL/min (20-50 mL/min en el caso de apixaban). Sin embargo, no hay evidencia suficiente para recomendar un ACOD sobre los demás, puesto que no se han realizado ensayos en los que se comparen directamente unos fármacos con otros.
Aunque la eficacia (prevención de ictus y embolia sistémica) puede ser simplemente no inferior a warfarina, el perfil de seguridad global de los ACOD es superior a los antagonistas de la vitamina K (AVK). En todos los ensayos pivotales, los ACOD se han asociado con reducciones significativas (en torno a un 50%) del riesgo de hemorragia intracraneal en comparación con warfarina.
Tratamiento anticoagulante en pacientes con ERC según ClCr:
- ∘
ClCr >50 mL/min: La decisión de anticoagular a estos pacientes con FA no valvular se debe basar en los ensayos clínicos, y en estos casos los ACOD son superiores a los AVK (dicumarínicos, en nuestro país).
- ∘
ClCr entre 15-30 mL/min: En estos pacientes se valorará la anticoagulación considerando el riesgo/beneficio del tratamiento.
- ∘
ClCr < 15 mL/min: No existen suficientes evidencias en ensayos clínicos para apoyar la anticoagulación en estos pacientes. Algunos ensayos han mostrado beneficio de ACOD en estos pacientes. Se deberá considerar el tratamiento anticoagulante o no, asi como la dosis y el tipo de tratamiento farmacológico o cierre de la orejuela auricular izquierda mediante procedimiento endovascular, de forma individualizada. En este grupo de pacientes y en aquellos en diálisis se deberá considerar la utilización de ACOD frente a AVK cuando haya calcifilaxis, riesgo de calcificación vascular relevante o antecedentes de nefropatía por warfarina, siempre realizando un ajuste de dosis adecuado156,157. Varios ensayos clínicos están en marcha con ACOD en esta población que nos darán una respuesta a estas necesidades de tratamiento en una población de muy alto riesgo.
En la tabla 17 se muestran las recomendaciones actuales para la administración de ACOD en ERC158.
Funciones del médico de familia en el manejo de la enfermedad renal crónica- ∘
Control de los factores de riesgo cardiovascular y vigilancia de los factores de progresión de la ERC, especialmente PA, peso corporal y glucemia.
- ∘
Vigilancia de la nefrotoxicidad para evitar la iatrogenia en cualquier proceso, prestando especial atención a:
- –
Evitar siempre que sea posible el uso de AINE.
- –
Evitar la hiperpotasemia asociada al uso de fármacos.
- –
Evitar/adecuar el uso de antidiabéticos orales según el FG.
- –
Evitar en lo posible el uso de contrastes yodados, ajustando cualquier fármaco al FG del paciente.
- –
Ante un deterioro en la función renal descartar siempre causas funcionales (exceso de control de la presión arterial, AINEs, depleción) antes de remitir a Nefrología.
- ∘
Participación en el cumplimiento terapéutico y derivación a Nefrología en caso de empeoramiento agudo inexplicado de la función renal o aparición de complicaciones.
- ∘
Seguimiento de los pacientes ancianos, con FG estable, que, por motivos de edad, calidad de vida u otros, no sean tributarios de TSR y no reciban agentes estimulantes de la eritropoyesis (AEE) y/o medicación compleja para el HPS de la ERC.
- ∘
En caso de pacientes en diálisis, conocer las diferentes opciones y su implementación (lugar de realización, periodicidad, necesidades estructurales y posibles complicaciones) sobre todo de las técnicas que el paciente realiza en su domicilio. Mención especial, debida al protagonismo que cobra el médico de familia, en el manejo del paciente en diálisis que por motivos habituales de deterioro clínico y tras una decisión consensuada, se decide la retirada del tratamiento con diálisis para poder prestar esos cuidados de los últimos días en su domicilio.
- ∘
En caso de pacientes trasplantados renales, además de conocer los tipos que existen y sus peculiaridades, cobra especial interés el tratamiento inmunosupresor por las complicaciones, efectos secundarios y evitar las interacciones farmacológicas que se puedan producir.
- ∘
Cuando un paciente opta por el manejo conservador de su ERC, seguiremos tratando activamente las complicaciones que puedan acontecer a lo largo de su evolución (anemia, hiperpotasemia, acidosis metabólica) hasta llegar a la fase de uremia terminal, trabajando de forma coordinada: Nefrología, AP, Atención Domiciliaria y cuidados paliativos si se precisan.
- ∘
Asegurar y participar proactivamente en la vacunación de los pacientes con ERC159:
- –
Recomendación general: tétanos (completar cinco dosis, dosis puesta, dosis que cuenta), triple vírica (pauta con dos dosis, si no vacunado con anterioridad) y virus varicela-zoster si es susceptible (dos dosis intramusculares separadas de dos a seis meses).
- –
Recomendación específica: Gripe anual. Neumococo (pauta secuencial VNP23 + VNC13) si nunca vacunados 1° VNC13 y a los 12 meses VNP23 (pauta acelerada solo esperas dos meses), si vacunados con VNP23 hay que esperar 12 meses para administrar VNC13. Hepatitis B (vacuna de 40 μg de AgHBs, pauta 0, uno, seis meses). Realizar control serológico a las cuatro a ocho semanas para constatar la seroconversión. Dosis de recuerdo si en seguimiento anual los anti-HBs son ˂10 mUI/mL. Obviamente también vacunación frente al SARS-Cov-2 (COVID-19 seria la enfermedad) según las pautas recomendadas por las autoridades y sociedades científicas.
- ∘
Mantener comunicación entre el médico de familia y Nefrología utilizando todos los medios que la tecnología nos brinda, todo ello de manera virtual:
- –
Vía telefónica: con unos horarios prestablecidos y N.° de teléfono directo.
- –
Vía Internet: consultas puntuales tipo «telenefro», intranefro, etc. El médico de familia enviaría dudas, consultas sobre pacientes concretos y el nefrólogo, respondería en menos de 24-48 horas sobre la actitud a adoptar.
- –
Videoconferencias, sobre consultas puntuales o formación on line.
- ∘
Mantener formación médica continuada en colaboración con Nefrología sobre:
- –
Control de los factores de riesgo cardiovascular.
- –
Seguimiento y monitorización de los pacientes con ERC. Valorar la potencial causa, preferentemente el FC y evaluar la presencia de albuminuria en orina (causa y grado), para clasificar el riesgo del paciente.
- –
Conocer los distintos estadios de la pérdida de función renal y conocer los criterios de derivación a Nefrología.
- –
Prevención de nefrotoxicidad y evitar la yatrogenia, sobre todo en los pacientes ancianos polimedicados.
Para evitar demoras en las derivaciones a especialistas adecuados se enumeran ciertas patologías que no deben ser remitidas a Nefrología.
- •
Patología urológica:
- ∘
Cólicos renales/litiasis renal.
- ∘
Quistes renales simples (no derivar), o quistes complejos (Bosniak IIF, III y IV: derivar a Urología).
- ∘
Infecciones urinarias con función renal normal.
- ∘
Tumores/masas renales.
- ∘
- •
Patología no urológica:
- ∘
Anemia no renal.
- ∘
Hiperparatidoidismo primario con función renal normal o secundario a déficit de vitamina D.
- ∘
Existen factores que aceleran el deterioro renal independientemente del ritmo de progresión propio de la ERC. Siendo muchos de estos factores reversibles, es imprescindible reconocerlos y corregirlos.
Medidas generales:
- 1)
Hidratación: no debe recomendarse la ingesta hídrica abundante en todos los pacientes con ERC. Lo realmente importante es limitar la sal en la dieta. Debe asegurarse una adecuada ingesta líquida especialmente en pacientes añosos y en épocas estivales, pero esta recomendación debe aplicarse con cautela e individualizarse. No es aplicable a pacientes con síndrome cardiorrenal, con riesgo de retención hidrosalina e insuficiencia cardiaca congestiva.
- 2)
No se debe generalizar una dieta pobre en potasio y de restricción proteica a todos los pacientes con ERC. Se debe individualizar según resultados de laboratorio, etiología, sintomatología y características individuales de cada paciente. Además no se debe recomendar la toma de sales de régimen (que contienen cloruro potásico) en pacientes con ERC.
- 3)
Derivación a Nefrología: no debe diagnosticarse a un paciente de ERC con una sola medida de creatinina, FG y/o albuminuria.
- 4)
La presencia de marcadores de lesión renal es imprescindible para catalogar un paciente de ERC si su FG es > 60 mL/min/1,73 m2.
Medidas farmacológicas:
No se deben utilizar fármacos sin ajustar la dosis al FG. En líneas generales las recomendaciones más importantes son las siguientes:
- 1)
AINEs: deben evitarse en cualquier estadio de enfermedad renal, aunque en ocasiones determinadas puede ser necesario un uso puntual.
- 2)
iSRAA:
- •
No se recomienda el doble bloqueo del SRAA con IECA asociado a ARA2 o inhibidores directos de la renina en pacientes diabéticos y/o con ERC.
- •
No se deben suspender los iSRAA si aumenta levemente la creatinina y disminuye el FG. Al introducir el fármaco, debe vigilarse la creatinina sérica siete a 10 días después del inicio: elevaciones de hasta un 20-30% si permanecen estables, son tolerables, dados sus beneficios antiproteinúricos / cardio y nefroprotectores.
- •
No suspender estos fármacos si aumenta el potasio sérico de forma leve-moderada. Se debe tratar la hiperpotasemia con medidas dietéticas y farmacológicas, evitando la suspensión del fármaco que ofrece beneficios cardio y nefroprotectores.
- •
Solo suspender el tratamiento con estos fármacos en pacientes con procesos infecciosos o gastrointestinales agudos que supongan deshidratación o hipotensión, intentando reintroducirlos lentamente después tras recuperación.
- •
No administrar iSRAA a pacientes con estenosis de arteria renal bilateral (rara), o con severas lesiones vasculares renales distales difusas, ya que pueden reducir seriamente el FG (> 30%).
- •
- 3)
Diuréticos:
- •
No se recomienda el uso de diuréticos tiazídicos en pacientes con ERC moderada-avanzada (ERC G4-5). Aunque clortalidona ha sido efectiva en el tratamiento de la HTA en ERC 4 160. En estas situaciones deben emplearse preferentemente diuréticos del asa (furosemida, torasemida). Los diuréticos tiazídicos son, en general, inefectivos con FG < 30 mL/min/1,73 m2. Se podrían asociar con diuréticos de asa, en pacientes con síndrome cardiorrenal y episodios de insuficiencia cardíaca, con retención hidrosalina, en quienes se observa una potenciación del efecto diurético. Queda por definir el verdadero papel de la clortalidona en pacientes con ERC G4 tras un primer estudio que ha demostrado su efectividad en el control de la HTA160.
- •
No se recomienda el uso incontrolado de AMR (espironolactona (G4-G5), eplerenona) en pacientes con ERC moderada-avanzada por el riesgo de hiperpotasemia. En casos de indicación por insuficiencia cardiaca con fracción de eyección reducida o en pacientes con hipertensión resistente, con cifras de potasio normal, su uso deberá iniciarse a bajas dosis y con monitorización frecuente del potasio. Se deberá prestar especial atención en períodos de agudización.
- •
- 4)
No debe administrase digoxina sin ajustar dosis según niveles, sobre todo en pacientes con FG menor de 30 mL/min/1,73 m2.
- 5)
No deben administrarse fibratos asociados a estatinas en pacientes con ERC estadio G3b -G5 (FG < 45 mL/min/1,73 m2).
- 6)
No debe administrarse ningún antibiótico sin ajustar la dosis para el estadio de ERC.
- 7)
No administrar antidiabéticos sin tener en cuenta el estadio de ERC y modificar ante variaciones del FG.
- 8)
Contrastes radiológicos: En la medida de lo posible debe evitarse la administración de contrastes yodados en pacientes con ERC G3b -G5 (FG < 45 mL/min/1,73 m2). Siempre se debe valorar riesgo-beneficio. Si es indispensable la administración de contrastes debemos aconsejar una buena hidratación del paciente, suspensión de metformina en diabéticos, evitar diuréticos siempre que sea posible, corregir la acidosis metabólica mediante la administración de bicarbonato sódico y administrar N-acetilcisteína (600 mg el día antes y el día de la prueba radiológica). Evitar resonancias magnéticas con gadolinio en pacientes con ERC con FG < 30 mL/min/1,73 m2 ante el riesgo de desarrollar fibrosis sistémica nefrogénica.
- 9)
No utilizar preparaciones intestinales ricas en fósforo para realizar colonoscopia.
El presente artículo no ha recibido ningún tipo de financiación.
Conflicto de interesesEl Dr. Rafael García Maset declara que ha recibido honorarios por conferencias de Amgen, Boehringer-Ingelheim, Esteve y Fresenius Medical Care, no relacionadas con la realización del trabajo.
El Dr. Jordi Bover Sanjuán declara que ha recibido honorarios por conferencias y consultorías de Abbvie, Amgen, Rubió Astra-Zeneca, Sanofi y Vifor Pharma, no relacionadas con la realización del trabajo.
El Dr. Julián Segura de la Morena declara que ha recibido honorarios por conferencias de AstraZeneca, Esteve y Medtronic, no relacionadas con la realización del trabajo.
La Dra. Marian Goicoechea Diezhandino declara que ha recibido honorarios por conferencias y consultorías de Astellas, AstraZeneca, Boehringer-Ingelheim, Novonordisk, Sanofi y Vifor Pharma, no relacionadas con la realización del trabajo.
El Dr. Javier Escalada San Martin declara que ha recibido honorarios por conferencias de AstraZeneca, Boehringer-Ingelheim, Lilly, Mundipharma y Novonordisk, no relacionadas con la realización del trabajo.
El Dr. Lorenzo Fácila Rubio declara que ha recibido honorarios por conferencias de AstraZeneca, Bayer, Boehringer-Ingelheim, Daiichi-Sankyo y Pfizer, no relacionadas con la realización del trabajo.
El Dr. Lisardo García-Matarín declara que ha recibido honorarios por conferencias y consultorías de AstraZeneca, Bial, Boehringer-Ingelheim, GlaxoSmithKline, Menarini, Novartis, Novonordisk, Pfizer, Sanofi, Teva y Vifor Pharma, no relacionadas con la realización del trabajo.
La Dra. María Isabel Gutiérrez Pérez declara que ha recibido honorarios por conferencias de GlaxoSmithKline, no relacionadas con la realización del trabajo.
La Dra. Pilar Mazón Ramos declara que ha recibido honorarios por conferencias y consultorías de AstraZeneca, Boehringer-Ingelheim, MSD y Novonordisk, no relacionadas con la realización del trabajo.
El Dr. Manuel Muñoz Torres declara que ha recibido honorarios por conferencias de Amgen, Lilly y Novonordisk, no relacionadas con la realización del trabajo.
El Dr. Manuel Pérez-Maraver declara que ha recibido honorarios por conferencias y consultorías de Abbot, AstraZeneca, Lilly, Novonordisk y Sanofi, no relacionadas con la realización del trabajo.
El Dr. José Luis Górriz Teruel declara que ha recibido honorarios por conferencias y consultorías de AstraZeneca, Boehringer-Ingelheim, Lilly, Mundipharma, Novartis, Novonordisk y Vifor Pharma, no relacionadas con la realización del trabajo.
Los Drs. Jesús Cebollada del Hoyo, Javier Gamarra Ortiz, Jose A. García-Donaire, Sílvia Gràcia Garcia, Julio Hernández Moreno, Rosario Montañés Bermudez, Pedro de Pablos-Velasco, Carmen Suárez Fernández y Salvador Tranche Iparraguirre declaran que no tienen conflicto de intereses.
Filiaciones autoresRafael García-Maset1, Servicio de Nefrología. Hospital de Manises. Valencia. Sociedad Española de Nefrología.
Jordi Bover1, Servicio de Nefrología, Hospital Universitario Germans Trias I Pujol, RICORS, Institut d’Investigació en Ciències de la Salut Germans Trias i Pujol (IGTP), Universitat Autònoma de Barcelona, Badalona (Barcelona). Sociedad Española de Nefrología.
Julián Segura2, Servicio de Nefrología. Hospital Universitario 12 de Octubre. Madrid.
Marian Goicoechea1, Servicio de Nefrología, Hospital General Universitario Gregorio Marañón, Madrid. Sociedad Española de Hipertensión-Liga Española para la Lucha contra la Hipertensión Arterial.
Jesús Cebollada del Hoyo3, Servicio de Medicina Interna. Hospital Clínico Universitario Lozano Blesa. Zaragoza. Sociedad Española de Medicina Interna.
Javier Escalada San Martín4, Departamento de Endocrinología y Nutrición. Clínica Universidad de Navarra. Centro de Investigación Biomédica en Red Fisiopatología de la Obesidad y Nutrición (CIBEROBN), ISCIII. Instituto de Investigación Sanitaria de Navarra (IdiSNA). Grupo de Nefrología clínica. Pamplona. Sociedad Española de Endocrinología y Nutrición.
Lorenzo Fácila Rubio5, Servicio de Cardiología Consorcio Hospital General Universitario de Valencia. Universitat de Valencia. Sociedad Española de Cardiología.
Javier Gamarra Ortiz6, (C. S. Medina Rural, Valladolid Este), Grupo de Trabajo Cardiovascular de SEMG.
Jose A. García-Donaire2, Unidad de HTA. Hospital Clínico San Carlos. Madrid. Sociedad Española de HTA (SEH-LELHA)
Lisardo García-Matarín7, Centro de Salud Aguadulce Sur. Distrito Sanitario Poniente de Almería. Roquetas de Mar. Almería
Sociedad Española de Médicos de Atención Primaria (SEMERGEN).
Sílvia Gràcia Garcia8, Servicio de Laboratorio. Fundacio Puigvert. Barcelona
Sociedad Española de Medicina de Laboratorio.
María Isabel Gutiérrez Pérez9, Médico de Familia. Centro de Salud Delicias I, Valladolid Oeste. Coordinadora de GdT nefrourología SocalemFYC y miembro del GdT nefrourología SEMFYC.
Julio Hernández Moreno6, Consultorio local de Argés. EAP de Polán. Toledo. Médico de atención primaria. SEMG.
Pilar Mazón Ramos5, Servicio de Cardiología. Complejo Hospitalario Universitario de Santiago de Compostela. CIBERCV. Sociedad Española de Cardiología
Rosario Montañés Bermudez8, Servicio de Laboratorio. Fundació Puigvert. Barcelona
Sociedad Española de Medicina de Laboratorio.
Manuel Muñoz Torres4, UGC Endocrinología y Nutrición. Hospital Universitario Clínico San Cecilio. CIBERFES. Universidad de Granada. Instituto de Investigación Biosanitaria Ibs. GRANADA.
Pedro de Pablos-Velasco10, Servicio de Endocrinología y Nutrición. H.U.G.C.Dr. Negrín. Instituto de Investigación en Biomedicina y Ciencias de la Salud (IUIBS), Universidad de Las Palmas de Gran Canaria.
Manuel Pérez-Maraver10, Servicio de Endocrinología y Nutrición. Hospital Universitari de Bellvitge, IDIBELL.
Carmen Suárez Fernández3, Servicio de Medicina Interna. Hospital Universitario de La Princesa. IIS La Princesa. UAM. Madrid. Sociedad Española de Medicina Interna
Salvador Tranche Iparraguirre9, Sociedad Española de Medicina Familiar y Comunitaria (SEMFYC). Centro de Salud El Cristo. Servicio de Salud del Principado de Asturias (SESPA). Instituto de Investigación Sanitaria del PPdo de Asturias(ISPA). Oviedo, Asturias. Sociedad Española de Medicina de Familia y Comunitaria.
José Luis Górriz1, Servicio de Nefrología. Hospital Clínico Universitario. INCLIVA. Universidad de Valencia. Valencia. Sociedad Española de Nefrología.
Las filiaciones completas de los autores se detallan al final del artículo.