PROGRESER es un estudio multicéntrico, prospectivo, observacional, con tres años de seguimiento, de una cohorte de pacientes con enfermedad renal crónica (ERC)-3 KDOQI, incluidos en servicios de Nefrología del Sistema Nacional de Salud en 14 comunidades autónomas de España. El objetivo primario fue analizar los factores de riesgo asociados con la progresión de la ERC, para identificar posibles diferencias entre pacientes con y sin diabetes mellitus (DM). El objetivo secundario fue investigar los factores asociados con hospitalizaciones y mortalidad.
Material y métodosSe incluyeron 462 pacientes (342 hombres y 120 mujeres, con una edad media de 66,5±11,5 años), reclutados en 25 centros. Se recogieron datos epidemiológicos, clínicos y analíticos cada seis meses, registrados en cuaderno electrónico. Se recogieron y congelaron muestras biológicas para biobanco basales y a 18 y 36meses.
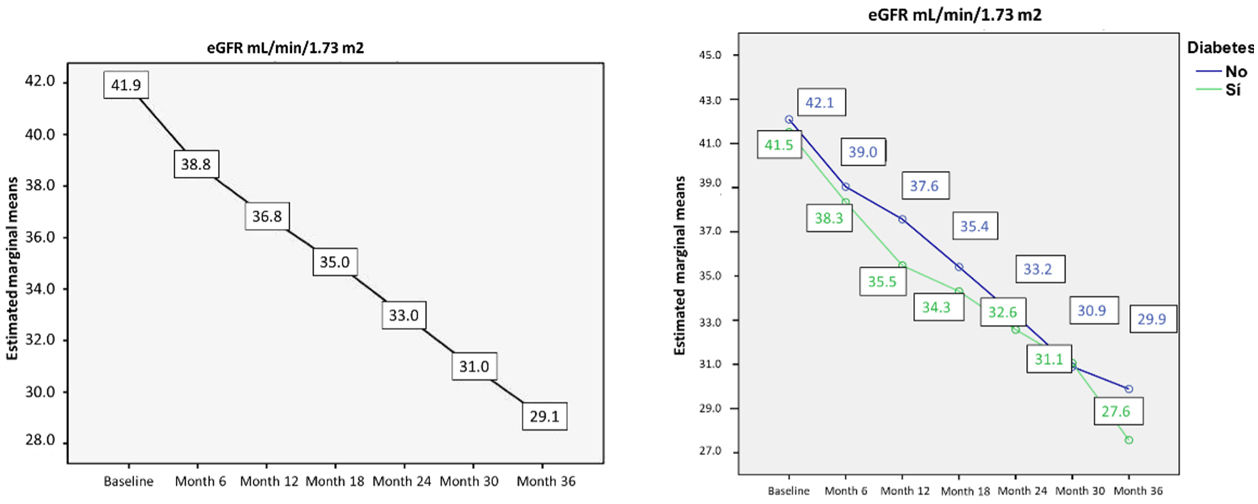
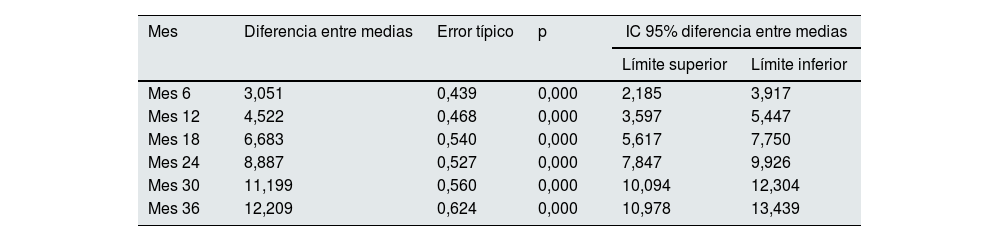
ResultadosEl filtrado glomerular estimado (FGe), calculado inicialmente mediante la ecuación Modification of Diet in Renal Disease (MDRD) y después recalculado mediante CKD-EPI fue de 43,9±7,9mL/min/1,73m2 en el momento basal y de 29,9±6,8mL/min/1,73m2 a los tres años de seguimiento.
Dos tercios de los pacientes (66,2%) presentaron progresión del daño renal según criterio del estudio (descenso mayor del 15% del FGe sobre el valor basal). Un 38,7% presentaron una reducción del FGe≥30%; un 20,3% tuvieron una reducción del FGe ≥40%; un 10,4% tuvieron una reducción ≥50% y un 6,9%, una reducción ≥57%. De los 199 diabéticos, 134 (67,3%) presentaron progresión. De los 263 no diabéticos, 172 (65,3%) presentaron progresión (p=0,456). El 27,3% de pacientes presentaban microalbuminuria y el 22,5%, proteinuria. El estudio mostró que la progresión de un estadio a otros más avanzados no fue superior en los pacientes con DM respecto a los no diabéticos. El análisis multivariante reveló que la presencia de hipertensión arterial (HTA) se aproximó a la significación estadística (p=0,07) asociado a la progresión en los pacientes sin DM, y que en los pacientes con DM unos niveles basales de calcio más bajos y de PTH-i más elevados sobre el valor basal tuvieron significación estadística como factores de progresión de la ERC.
ConclusiónNuestro estudio no ha revelado nuevos factores de progresión de daño renal con relación a los factores clásicos ya conocidos. No hemos encontrado diferencias significativas en cuanto a la progresión en pacientes con y sin DM. La progresión del daño renal en pacientes con ERC-3 KDOQI debe interpretarse en un contexto multifactorial. Se precisa la búsqueda de nuevos biomarcadores, diferentes de los tradicionales, para establecer nuevas estrategias terapéuticas para prevenir la progresión de la ERC.
The PROGRESER study is a multicentre, prospective, observational, 3-year follow-up study of a cohort of patients with stage3 chronic kidney disease (CKD) from different nephrology departments of hospitals in the Spanish healthcare system. The primary study objective was to analyse risk factors for CKD progression, identifying possible differences between patients with and without diabetes mellitus (DM). The secondary objective was to analyse the factors associated with hospitalizations and mortality.
Patients and methodsA total of 462 patients (342 men and 120 women; mean age 66.5±11.5 years) were recruited from 25 participating sites in Spain. Clinical, epidemiological and analytical data were recorder in an electronic register each six months. Biological samples were obtained and frozen for a biobank record at baseline and at 18 and 36 months.
ResultsThe initial mean glomerular filtration rate estimated by MDRD and after that reestimated by CKD-EPI was 43.9±7.9mL/min/1.73m2; and 29±6,8mL/min/1,73m2 at 3years. 27.3% of patients had microalbuminuria and 22.5% had macroalbuminuria. Two-thirds of the patients (66.2%) presented renal damage progression according to the study criteria (decrease of more than 15% in eGFR over the baseline value). 38.7% presented a reduction in eGFR ≥30%; 20.3% had a reduction in eGFR ≥40%; 10.4% had a reduction ≥50% and 6.9% had a reduction ≥57%. Of the 199 diabetics, 134 (67.3%) suffered renal damage progression. Of the 263 non-diabetics, 172 (65.3%) presented progression (P=.456). 27.3% of patients had microalbuminuria and 22.5% proteinuria. The study found that CKD progression to a higher stage was not greater in diabetic compared to non-diabetic patients. Multivariate analysis revealed that the presence of arterial hypertension bordered on significance as a progression factor in non-diabetic patients (P=.07), and that, in diabetic patients, lower calcium levels and elevated intact parathyroid hormone levels at baseline were associated with progression.
ConclusionIn our study we have not found new factors for progression of renal damage, different from the yet well known traditional factors. DM per se was not a differential factor for progression in relation with non DM patients. Progression of renal damage in patients with CKD-3 KDOQI may be interpreted in a multifactorial context. The search for new biomarkers, different from traditional ones, is necessary to establish new therapeutic strategies to prevent the progression of CKD.
Trabajos iniciales mostraron que la enfermedad renal crónica (ERC) presenta una prevalencia aproximada del 9,1%1. En España el estudio EPIRCE (Epidemiología de la ERC en España) encontró una prevalencia de ERC-3 del 9%, que aumentaba al 21,4% en personas de edad superior a 65años2. El estudio EROCAP estimó la incdencia de ERC-3 en centros de atención primaria de España en un 21,3%3. Posteriormente los datos del studio ENRICA (Estudio de nutrición y riesgo cardiovascular en España) reportaron una prevalencia nacional del 15,1%4. Este incremento en la prevalencia de ERC podría explicarse parcialmente por las elevadas tasas de hipertensión arterial (HTA) y de diabetes mellitus (DM)5.
A pesar de la mejoría en nuestra comprensión de los mecanismos fisiopatológicos y de las estrategias terapéuticas en el contexto de la ERC, un elevado porcentaje de pacientes presentarán progresión de la ERC hacia estadios más avanzados que requerirán tratamiento sustitutivo renal (TSR).
Aunque la tasa de progresión está influenciada por factores de riesgo no modificables, tales como la raza y la edad, existen otros factores que podrían ser modificables, como la DM, la obesidad, la HTA, el tabaquismo y la dislipemia, que pueden tener influencia sobre dicha progresión3,6-8. A este respecto, mejorar nuestros conocimientos sobre todos esos factores puede ser de vital importancia desde el punto de vista fisiopatológico y de objetivos terapéuticos.
En los últimos años numerosos estudios han revelado la existencia de nuevos factores que pueden jugar un papel significativo en la progresión de la ERC8-11. Sin embargo, no existen estudios diseñados con criterios específicos para establecer el papel de esos nuevos factores de progresión de una forma integrada que englobe aspectos clínicos, bioquímicos y genéticos.
La ERC no solo va unida al deterioro inexorable de la función renal, sino que además comporta un incremento de riesgo cardiovascular (CV) y de mortalidad en comparación con la población general12. Además, la posibilidad de muerte por factores CV es mayor que la de iniciar TSR7. Aunque son hechos bien conocidos, el incremento de la morbimortalidad asociado a la ERC no ha sido bien elucidado, especialmente en los estadios precoces de ERC2,13-19. En el presente estudio hemos pretendido examinar qué factores pueden asociarse con la progresión del daño renal y CV en pacientes con ERC-3 KDOQI, definida según los criterios de las guías Kidney Disease Outcomes Quality Initiative (KDOQI), analizando posibles diferencias entre pacientes con y sin DM.
Material y métodosDiseño del estudioEl estudio PROGRESER (Factores de PROGRESión en Enfermedad Renal crónica) es un estudio observacional, prospectivo y multicéntrico, en una cohorte de pacientes con ERC estadio3 KDOQI, realizado en servicios de Nefrología de diversos hospitales españoles, y con un seguimiento inicial de tres años. El estudio fue aprobado por la Agencia Española de Medicamentos (AEMPS) el 29 de septiembre de 2010 como estudio observacional postautorización. El protocolo del estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital Universitari de Bellvitge, Hospitalet de Llobregat, Barcelona, así como por los comités éticos de los diversos centros participantes en el mismo (ver Apéndice 1). El objetivo primario del estudio fue valorar los factores de riesgo asociados a la progresión del daño renal en pacientes con ERC-3 KDOQI. Los objetivos secundarios fueron describir los datos de hospitalización y mortalidad y los factores relacionados con ellos.
Criterios de inclusión y exclusiónLos criterios de inclusión fueron: edad igual o superior a 18años, diagnóstico de ERC estadio3 según las guías KDIGO, definida como un filtrado glomerular estimado (FGe) en dos determinaciones sucesivas separadas por al menos 3meses de intervalo, según la ecuación Modification of Diet in Renal Disease (MDRD)-420, entre 60 y 30mL/min/1,73m2 (posteriormente en el análisis global el FGe se reestimó mediante la ecuación Epidemiology of Chronic Kidney Disease (CKD-EPI), pudiendo acompañarse o no de albuminuria (expresada como cociente albúmina/creatinina en orina) igual o superior a 30mg/g en orina de primera muestra matutina; esperanza de vida superior a un año y firma de consentimiento informado.
Los criterios de exclusión fueron: edad inferior a 18años, ERC no en estadio3 KDOQI, enfermedad neoplásica o infección activa; proteinuria superior a 3g/día; enfermedad psiquiátrica o imposibilidad de firmar el consentimiento informado; en el caso de sexo femenino, embarazo o lactancia materna.
Los pacientes fueron incluidos sucesivamente en las consultas externas de los servicios de Nefrología de los centros participantes, entre enero de 2012 y septiembre de 2015. Todos los pacientes firmaron formularios de consentimiento, de conformidad con la Declaración de Helsinki.
Recogida de datosTodos los pacientes recibieron una visita basal donde se realizaron la firma del consentimiento informado, electrocardiograma (ECG), cuestionario sociodemográfico y la toma de muestras (sangre, orina, plasma, suero y restos celulares).
Se realizaron determinaciones hematológicas y bioquímicas cada seis meses y ECG basal y a los 12, 18 y 36meses. Se recogieron los datos relacionados con los tratamientos, así como los eventos con hospitalización que ocurrieron durante el seguimiento del estudio.
Se utilizó un consentimiento específico para el análisis posterior de las muestras de biobanco. Se recogieron muestras de sangre, plasma, orina y restos celulares en los momento basal, 18 y 36meses y se congelaron a −80°C en cada centro hasta su envío al biobanco de la REDinREN, Red de Investigación Renal, en la Universidad de Alcalá de Henares, Madrid. Los resultados de los polimorfismos genéticos serán objeto de un estudio posterior.
El tamaño muestral fue estimado a partir de los datos referentes al FGe obtenidos en el studio MERENA21. La n inicial se estimó en 630 pacientes, considerando un error de tipoI del 5% y un error de tipoII del 5%, para obtener un nivel de significación de p<0,05. Se consideró que existía progresión cuando el FGe descendió igual o más del 15% sobre el valor basal o la transición a un estadio más avanzado de ERC (ERC estadio4, siempre que la progresión fuera mayor al 15%). Posteriormente se estratificó el análisis de resultados considerando si el porcentaje de reducción del FGe era superior al 30%, al 40% o al 50% sobre dicho valor basal.
Todos los datos fueron registrados semestralmente en una web (https://www.e-clinical.org/progreser) desde el momento basal (mes0) hasta la finalización del seguimiento a tres años. Las variables incluidas en el estudio se muestran en la tabla 1 suplementaria. Para valorar la existencia de hipertrofia ventricular izquierda (HVI) se calculó el producto voltaje por duración de Cornell (ver tabla 1 suplementaria). La definición de las variables HTA, DM, obesidad y sobrepeso, insuficiencia cardíaca se muestra en el pie de la tabla 1 suplementaria.
Análisis estadísticoLas variables cuantitativas se describen utilizando medición de tendencia central y dispersión (media y desviación estándar [DE] o media y rango intercuartil [IQR] según la distribución normal o no paramétrica de la variable). El número de pacientes hasta completar la n total incluye a pacientes con datos perdidos. Las variables cualitativas se describen utilizando frecuencias absolutas (n) y relativas (%). Para la comparación de variables cualitativas se ha aplicado el test de chi cuadrado o el test exacto de Fisher, dependiendo del porcentaje de datos obtenidos con una frecuencia esperada o inferior a5. El test de la t de Student o el test de Mann-Whitney U se usaron para comparar dos medias, dependiendo de la normalidad en la distribución de datos. Para la comparación del FGe entre pacientes con y sin DM se ha utilizado el Modelo Lineal General de Medidas Repetidas. La significación estadística se calculó proporcionándose para cada grupo la significación estadística referente a la evolución (Hotteling's trace) y utilizando el test de comparaciones múltiples (método LSD [Least significant difference]) de Fisher.
Para construir la regresión logística binaria se definieron la variable dependiente (progresión/no progresión) y las variables independientes. Para identificar posibles factores que influenciaran la respuesta, primero se realizó un análisis bivariante, y las variables con significación estadística o cercanas a ella (p<0,20) se consideraron como factores posibles para ser incluidos en el modelo. Una vez identificadas las variables, se construyó el modelo de regresión por pasos hacia adelante o por selección automática de variables. Se consideró la significación estadística para valores de p<0,05. Los datos fueron analizados mediante el programa SPSS v.18 o superior. Para las variables predictivas asociadas con el objetivo primario y con los secundarios, cuando fue necesario, se estimó el intervalo de confianza (IC) del 95%.
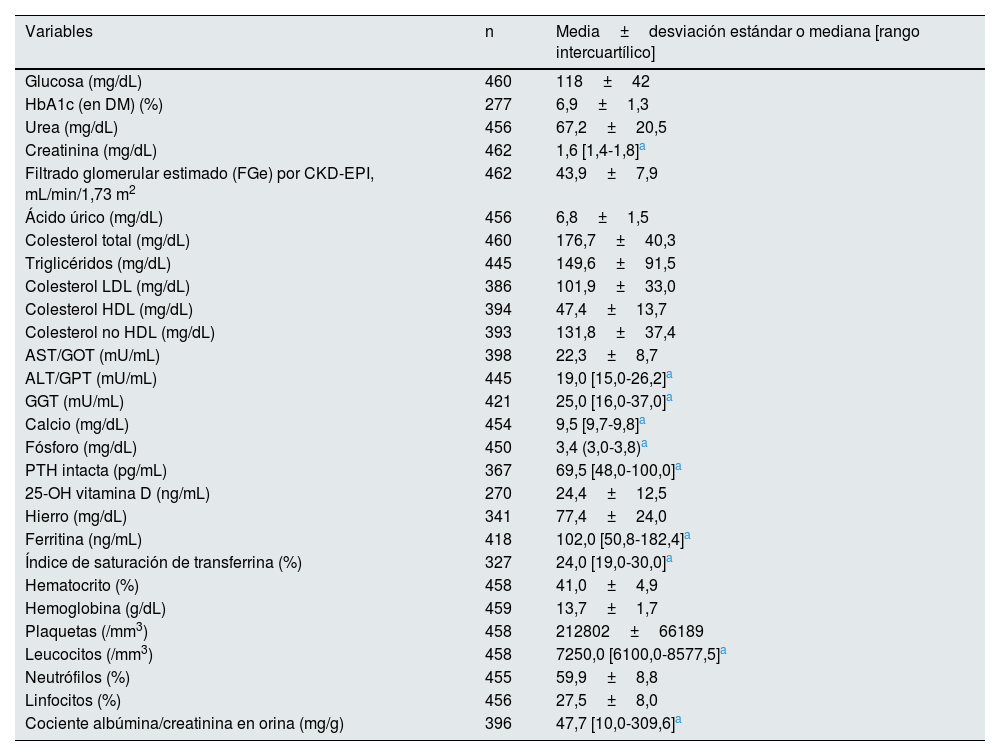
ResultadosCaracterísticas generales de los pacientes (tabla 1)Se incluyeron inicialmente 487 pacientes, reclutados en 25 centros, pero se descartaron 25 de ellos por no cumplir los criterios de inclusión. Así, el número final de pacientes analizados fue de 462 (342 hombres y 120 mujeres, con una edad media de 66,5±11,5 años). Sus características clínicas y antropométricas, así como las causas de la enfermedad renal y los factores de riesgo CV presentes, se muestran en la tabla 1. Los datos de laboratorio basales se reflejan en la tabla 2.
Características generales de los pacientes
| Variables | n | Porcentaje, media±desviación estándar o mediana [rango intercuartílico] |
|---|---|---|
| Edad, años (media | 462 | 65,5±11,5 |
| Sexo | 462 | |
| Varón | 342 (74%) | |
| Mujer | 120 (26%) | |
| Ámbito | 462 | |
| Rural | 106 (11,9%) | |
| Urbano | 353 (76,4%) | |
| Nivel de estudios | 459 | |
| Sin estudios | 68 (14,8%) | |
| Estudios primarios | 337 (73,4%) | |
| Estudios superiores | 54 (11,8%) | |
| Diabetes mellitus | 462 | |
| No DM | 263 (56,9%) | |
| DM1 | 13 (2,8%) | |
| DM2 | 186 (40,3%) | |
| Hipertensión arterial | 462 | 441 (95,5%) |
| Insuficiencia cardiaca con hospitalización | 455 | 49 (10,8%) |
| Cardiopatía isquémica | 456 | 84 (18,4%) |
| Enfermedad cerebrovascular | 457 | 55 (12%) |
| Enfermedad vascular periférica | 456 | 79 (17,3%) |
| Tabaquismo | 462 | |
| Fumador activo | 70 (15,2%) | |
| Exfumador | 226 (49,1%) | |
| Nunca fumador | 164 (35,7%) | |
| Etiología de la enfermedad renal | 461 | |
| Glomerular | 30 (6,5%) | |
| Intersticial | 35 (7,6%) | |
| Vascular/nefroangioesclerosis | 168 (36,4%) | |
| Poliquistosis/ Enf. quística | 31 (6,7%) | |
| Enfermedad renal diabética | 199 (42,6%) | |
| No filiada/otras | 39 (8,5%) | |
| Hipertrofia ventricular izquierda (producto duración voltaje de Cornell > 2440) | 411 | 79 (19,2%) |
| Altura (cm) | 450 | 165,5±10,0 |
| Peso (kg) | 451 | 80,4±14,6 |
| IMC, kg/m2 | 446 | 29,4±4,9 |
| Perímetro de cintura (cm) | 404 | 101,5±13,0 |
| Frecuencia cardiaca, lpm | 455 | 72,9±12,8 |
| Presión arterial sistólica, mmHg | 461 | 138,7±17,5 |
| Presión arterial diastólica, mmHg | 461 | 76,5±10,9 |
| Presión de pulso | 459 | 62,2±16,2 |
Datos de laboratorio al inicio del estudio
| Variables | n | Media±desviación estándar o mediana [rango intercuartílico] |
|---|---|---|
| Glucosa (mg/dL) | 460 | 118±42 |
| HbA1c (en DM) (%) | 277 | 6,9±1,3 |
| Urea (mg/dL) | 456 | 67,2±20,5 |
| Creatinina (mg/dL) | 462 | 1,6 [1,4-1,8]a |
| Filtrado glomerular estimado (FGe) por CKD-EPI, mL/min/1,73 m2 | 462 | 43,9±7,9 |
| Ácido úrico (mg/dL) | 456 | 6,8±1,5 |
| Colesterol total (mg/dL) | 460 | 176,7±40,3 |
| Triglicéridos (mg/dL) | 445 | 149,6±91,5 |
| Colesterol LDL (mg/dL) | 386 | 101,9±33,0 |
| Colesterol HDL (mg/dL) | 394 | 47,4±13,7 |
| Colesterol no HDL (mg/dL) | 393 | 131,8±37,4 |
| AST/GOT (mU/mL) | 398 | 22,3±8,7 |
| ALT/GPT (mU/mL) | 445 | 19,0 [15,0-26,2]a |
| GGT (mU/mL) | 421 | 25,0 [16,0-37,0]a |
| Calcio (mg/dL) | 454 | 9,5 [9,7-9,8]a |
| Fósforo (mg/dL) | 450 | 3,4 (3,0-3,8)a |
| PTH intacta (pg/mL) | 367 | 69,5 [48,0-100,0]a |
| 25-OH vitamina D (ng/mL) | 270 | 24,4±12,5 |
| Hierro (mg/dL) | 341 | 77,4±24,0 |
| Ferritina (ng/mL) | 418 | 102,0 [50,8-182,4]a |
| Índice de saturación de transferrina (%) | 327 | 24,0 [19,0-30,0]a |
| Hematocrito (%) | 458 | 41,0±4,9 |
| Hemoglobina (g/dL) | 459 | 13,7±1,7 |
| Plaquetas (/mm3) | 458 | 212802±66189 |
| Leucocitos (/mm3) | 458 | 7250,0 [6100,0-8577,5]a |
| Neutrófilos (%) | 455 | 59,9±8,8 |
| Linfocitos (%) | 456 | 27,5±8,0 |
| Cociente albúmina/creatinina en orina (mg/g) | 396 | 47,7 [10,0-309,6]a |
En el estudio se incluyeron 199 pacientes cuya causa de ERC se atribuyó a la DM por los investigadores participantes. De los pacientes con DM, el 18,6% recibían tratamiento con insulina, el 13% con metformina, el 10,6% con inhibidores de DPP-4 y el 22,1% con otros agentes hipoglucemiantes, solos o en combinación. Ningún paciente recibía tratamiento con inhibidores del transportador renal sodio-glucosa tipo2 (iSLGT2) y tan solo un paciente recibía tratamiento con agonistas del receptor del péptido similar al glucagón tipo1 (AR GLP-1), fármacos que para el manejo de la DM se introducirían en la clínica habitual años después del inicio de nuestro estudio (tabla 1 suplementaria).
En cuanto a los factores de riesgo CV previos, el 18,4% de los pacientes tenían antecedente de enfermedad arterial coronaria, el 12% de accidente vascular cerebral, el 17,3% de enfermedad vascular periférica y el 10,8% de insuficiencia cardíaca.
Basalmente, el 41,9% de los pacientes presentaban normoalbuminuria, el 31,8% microalbuminuria y el 26,3% proteinuria. En las tablas 1 y 2 se muestran el resto de características clínicas, antropométricas y analíticas.
Progresión del daño renalDos tercios de los pacientes (66,2%) (IC95%: 61,7-70,5) presentaron deterioro de la función renal durante el periodo de seguimiento, definido como descenso mayor del 15% del FGe sobre el valor basal; el 38,7% presentaron una reducción del FGe igual o superior al 30%; el 20,3% tuvieron una reducción del FGe ≥40%; el 10,4%tuvieron una reducción ≥50% y el 6,9% una reducción ≥57%. De los 199 pacientes con DM, 134 (67,3%) presentaron progresión de daño renal. De los 263 no diabéticos, 172 (65,3%) presentaron dicha progresión (p=0,456).
En la tabla 3 se señalan las diferencias en el FGe entre las visitas respecto a la basal, mostrando una progresión de daño renal de 4,5mL/min/1,73m2 el primer año, de 4,3mL/min/1,73m2 el segundo año y de 3,4mL/min/1,73m2 el tercer año.
Diferencias en el filtrado glomerular estimado entre las visitas respecto a la basal
| Mes | Diferencia entre medias | Error típico | p | IC 95% diferencia entre medias | |
|---|---|---|---|---|---|
| Límite superior | Límite inferior | ||||
| Mes 6 | 3,051 | 0,439 | 0,000 | 2,185 | 3,917 |
| Mes 12 | 4,522 | 0,468 | 0,000 | 3,597 | 5,447 |
| Mes 18 | 6,683 | 0,540 | 0,000 | 5,617 | 7,750 |
| Mes 24 | 8,887 | 0,527 | 0,000 | 7,847 | 9,926 |
| Mes 30 | 11,199 | 0,560 | 0,000 | 10,094 | 12,304 |
| Mes 36 | 12,209 | 0,624 | 0,000 | 10,978 | 13,439 |
Valor de la p calculado mediante el test de comparaciones múltiples (método LSD (Least significant difference) de Fisher.
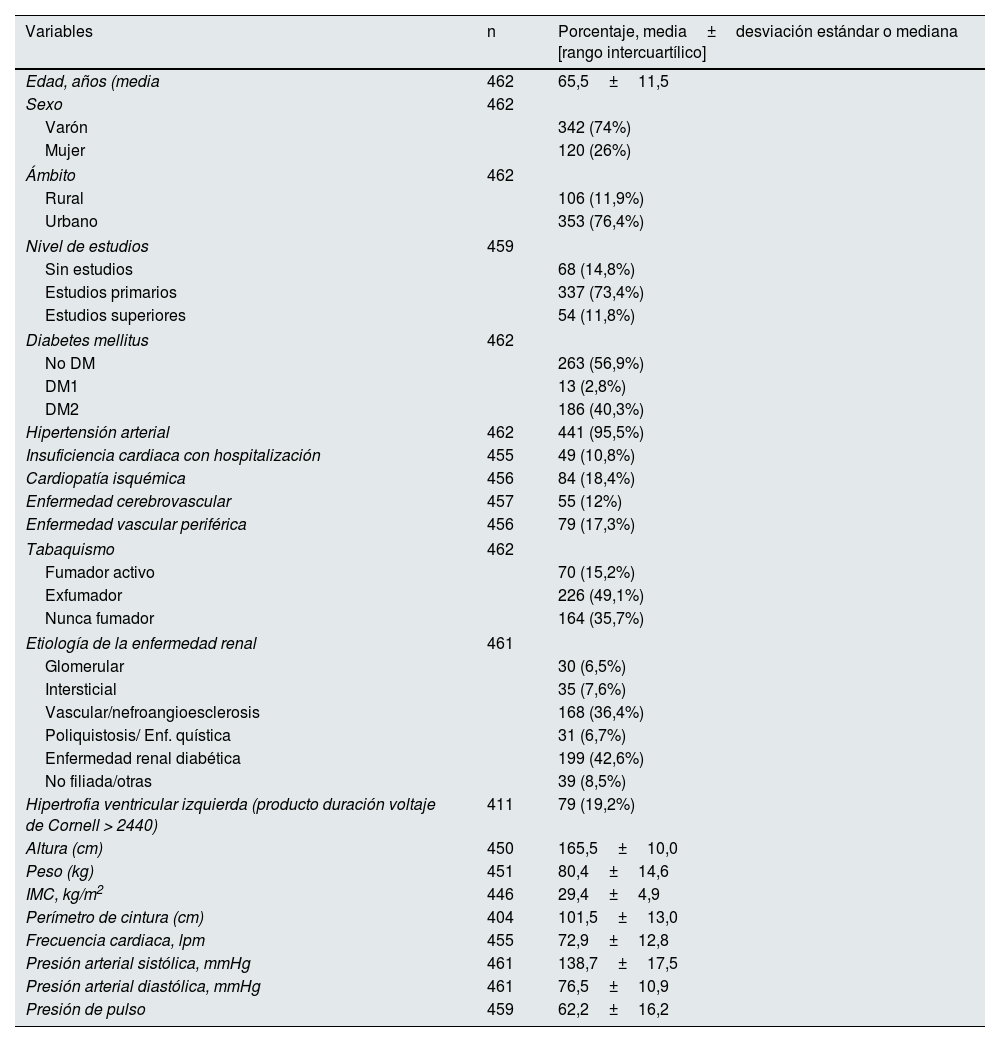
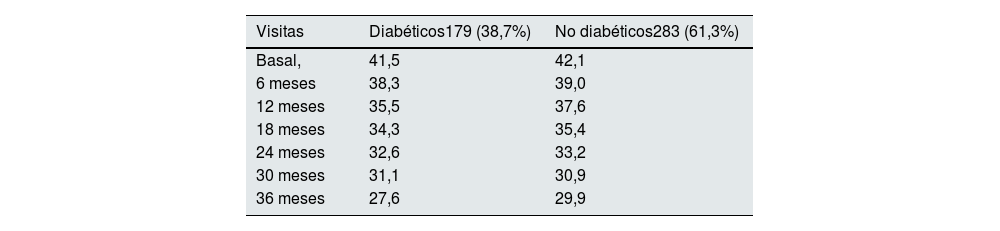
En la tabla 4 se muestran las diferencias en el FGe entre pacientes con y sin DM a lo largo del estudio. No se detectaron diferencias significativas en el FGe cuando se compararon pacientes con y sin DM en todas las visitas del estudio.
Diferencias en la media del filtrado glomerular estimado entre pacientes con y sin diabetes mellitus durante las visitas del estudio
| Visitas | Diabéticos179 (38,7%) | No diabéticos283 (61,3%) |
|---|---|---|
| Basal, | 41,5 | 42,1 |
| 6 meses | 38,3 | 39,0 |
| 12 meses | 35,5 | 37,6 |
| 18 meses | 34,3 | 35,4 |
| 24 meses | 32,6 | 33,2 |
| 30 meses | 31,1 | 30,9 |
| 36 meses | 27,6 | 29,9 |
p=ns en todas las visitas del estudio.
Al finalizar el estudio a los 36 meses, el FGe medio experimentó un descenso del 36%, desde 41,9±7,9mL/min/1,73m2 hasta 29,1±9,6mL/min/1,73m2 (p<0,001) (fig. 1, izquierda). No existió diferencia estadísticamente significativa en el descenso del FGe, estimado mediante CKD-EPI, entre los pacientes con DM y los pacientes sin DM (p=0,325) (fig. 1, derecha).
Evolución del filtrado glomerular estimado durante la evolución del estudio. Izquierda: evolución en el filtrado glomerular estimado en todos los pacientes del estudio. Derecha: evolución en el filtrado glomerualr estimado por grupos (diabéticos y no diabéticos). No se han observado diferencias estadísticamente significativas en la evolución del CKD-EPI entre los grupos de pacientes NO diabéticos y diabéticos (p=0,325, valor de p calculado en la prueba de efectos intersujetos).
En el análisis bivariante, los factores asociados con progresión renal fueron el antecedente de enfermedad cerebrovascular, el nivel de triglicéridos y los niveles de Ca más bajos (p=0,045, p=0,004 y p=0,042, respectivamente). En el análisis multivariante se mantuvo como factor asociado de forma independiente con la progresión de daño renal el nivel más bajo de calcio (OR: 0,548; IC95%: 0,353-852; p=0,007). En los pacientes con DM los factores independientes de peor pronóstico fueron el tabaquismo activo (OR: 6,620; IC95%:1,718-25,513; p=0,006) y niveles más elevados de PTH-i (OR: 1,014; IC95%: 1,004-1,023; p=0,003).
En la tabla tabla 3 suplementaria se muestra el análisis bivariante de los factores de riesgo para la progresión del daño renal (progresión vs no progresión). En relación con las variables continuas se observó que los pacientes que presentaron progresión de daño renal mostraban unos valores de calcio sérico significativamente menor que aquellos en los que no progresó dicho daño (mediana: 9,5; RIQ [9,2-9,8] vs 9,6 [9,3-9,9], p=0,004).
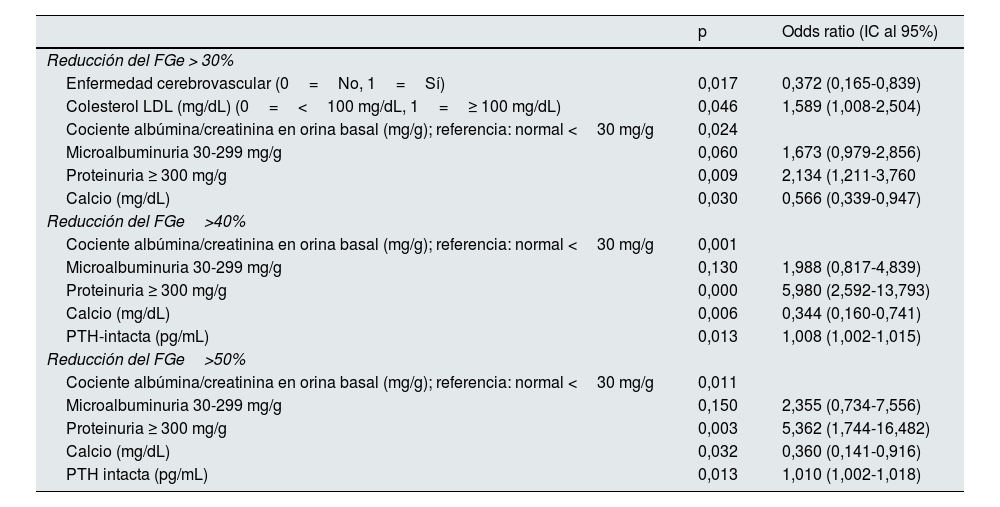
En la tabla 5 se muestran los factores de riesgo asociados a la progresión de daño renal, considerando como progresión no solo el criterio del estudio sino un descenso del FGe del 30%, del 40% o del 50% respecto a FGe basal. En todos los casos (progresión del 30%, del 40% y del 50%). Los factores con peso pronóstico independiente que se asociaron a la presencia de progresión de daño renal en los tres porcentajes de reducción de FGe fueron la presencia de microalbuminuria, proteinuria y los niveles de calcio y PTH-i.
Factores de progresión para la enfermedad renal crónica según porcentaje de reducción del filtrado glomerular estimado (FGe) considerado como variable dependiente (reducción de >30%, >40% o >50%)
| p | Odds ratio (IC al 95%) | |
|---|---|---|
| Reducción del FGe > 30% | ||
| Enfermedad cerebrovascular (0=No, 1=Sí) | 0,017 | 0,372 (0,165-0,839) |
| Colesterol LDL (mg/dL) (0=<100 mg/dL, 1=≥ 100 mg/dL) | 0,046 | 1,589 (1,008-2,504) |
| Cociente albúmina/creatinina en orina basal (mg/g); referencia: normal <30 mg/g | 0,024 | |
| Microalbuminuria 30-299 mg/g | 0,060 | 1,673 (0,979-2,856) |
| Proteinuria ≥ 300 mg/g | 0,009 | 2,134 (1,211-3,760 |
| Calcio (mg/dL) | 0,030 | 0,566 (0,339-0,947) |
| Reducción del FGe>40% | ||
| Cociente albúmina/creatinina en orina basal (mg/g); referencia: normal <30 mg/g | 0,001 | |
| Microalbuminuria 30-299 mg/g | 0,130 | 1,988 (0,817-4,839) |
| Proteinuria ≥ 300 mg/g | 0,000 | 5,980 (2,592-13,793) |
| Calcio (mg/dL) | 0,006 | 0,344 (0,160-0,741) |
| PTH-intacta (pg/mL) | 0,013 | 1,008 (1,002-1,015) |
| Reducción del FGe>50% | ||
| Cociente albúmina/creatinina en orina basal (mg/g); referencia: normal <30 mg/g | 0,011 | |
| Microalbuminuria 30-299 mg/g | 0,150 | 2,355 (0,734-7,556) |
| Proteinuria ≥ 300 mg/g | 0,003 | 5,362 (1,744-16,482) |
| Calcio (mg/dL) | 0,032 | 0,360 (0,141-0,916) |
| PTH intacta (pg/mL) | 0,013 | 1,010 (1,002-1,018) |
FGe: filtrado glomerular estimado por CKD-EPI; IC: intervalo de confianza.
Enfermedad cerebro vascular: incluye accidente isquémico transitorio e ictus.
Los datos son el resultado del análisis del deterioro renal mediante el análisis descriptivo de casos con una reducción mayor o igual al 30%, al 40% o al 50% en el último valor registrado de filtrado glomerular estimado mediante CKD-EPI, respecto al valor basal.
No se detectaron asociaciones significativas entre progresión renal y presencia de diabetes mellitus, IMC, HTA, antecedente de insuficiencia cardiaca, índice de Cornell en el ECG, filtrado glomerular basal, triglicéridos, colesterol HDL, hierro, ferritina, IST y fósforo.
Durante el periodo de seguimiento, el 20,6% de pacientes requirieron hospitalización, sin diferencias en cuanto a la presencia de DM (23,6% de los pacientes con DM y 18,3% de los sujetos sin DM (p=0,172). El 1,7% de los pacientes iniciaron diálisis. La mortalidad global a lo largo del seguimiento fue del 6,1% (43% de causa CV, 21% de causa tumoral, 14% de causa infecciosa y 22% por otras causas) y se asoció significativamente con el antecedente de enfermedad arterial coronaria (p<0,001; IC95%: 2,111-10,386). Se perdió el seguimiento en 1 de cada 10 pacientes (10,4%).
Factores de riesgo asociados con hospitalización y mortalidadEn el análisis de regresión bivariante, las variables predictivas de un mayor riesgo de hospitalización fueron la presencia de DM (OR: 1,370; IC95%: 0,871-2,153), de HTA (OR: 5,418; IC95%: 0,718-40,893), un índice de Cornell mayor de 28mm en hombres y de 20mm en mujeres (OR: 1.547; IC95%: 0,833-2,874), un voltaje de Cornell mayor de 2.440mm×ms (OR: 1,902; IC95%: 1,101-3,283), una concentración de hemoglobina <11g/dL (OR: 2,736; IC95%: 1,085-6,902), un nivel de HbA1c ≥7% (OR: 1,508; IC95%: 0,829-2,742) y una glucemia en ayunas ≥126mg/dL (OR: 1,372; IC95%: 0,849-2,218).
De los parámetros analizados como variables continuas, los niveles más elevados de calcio se asociaron con menor riesgo de hospitalización (OR: 0,988; IC95%: 0,977-1,000), así como el índice de saturación de transferrina (IST) (OR: 0,973; IC95%: 0,946-1,002).
Las variables asociadas con el incremento de mortalidad fueron tabaquismo activo (p<0,2) (OR: 2,698; IC95%: 1,064-6,842), antecedente de insuficiencia cardíaca que requiriera hospitalización (OR: 2,558; IC95%: 0,979-6,684), enfermedad arterial coronaria (OR: 4,682; IC95%: 2,111-10,386), voltaje de Cornell >2.440mm×ms (OR: 2,243; IC95%: 0,967-5,201) y HbA1c >7% (OR: 2,353; IC95%: 0,813-6,808). Niveles bajos de Ca (OR: 2,292; IC95%: 1,006-5,225) y elevados de creatinina (OR: 3,027; IC95%: 0,860-10,66) se asociaron en el análisis bivariante con mayor mortalidad.
En el modelo final de regresión logística para predecir mortalidad, los factores predictores independientes fueron la presencia de enfermedad arterial coronaria (OR: 4,628; IC95%: 2,11-10,28), siendo los niveles más elevados de Ca protectores frente a la hospitalización (OR: 0,460; IC95%: 0,273-0,774).
DiscusiónEl objetivo primario del estudio fue valorar los factores de riesgo asociados a la progresión del daño renal en pacientes con ERC-3 KDOQI, con especial interés en comprobar si existían diferencias entre la población con y sin DM. Los objetivos secundarios fueron describir los datos de hospitalización y de mortalidad y los factores relacionados.
En nuestro estudio los factores de progresión del daño renal han estado en relación con parámetros del metabolismo óseo y mineral en los pacientes con DM (niveles basales más bajos de calcio y más elevados de PTHi), y probablemente con la presencia de HTA en los pacientes sin DM (nivel de p próximo a la significación estadística: p=0,07). Los factores de riesgo tradicionales, tales como diabetes, obesidad, tabaquismo y dislipemia, no resultaron significativamente asociados con la progresión del daño renal en el análisis multivariante. Si bien el tabaquismo —tanto actual como el antecedente del mismo—, el antecedente de enfermedad cerebrovascular previa y la hipertrigliceridemia se asociaban con la progresión del daño renal en la población con DM en el análisis bivariante, perdieron la significación de asociación con la progresión del daño renal como variables independientes en el análisis de regresión múltiple.
Algunos estudios recientes han intentado dilucidar cuáles son los factores que tienen más impacto sobre la evolución y la progresión del daño renal. Así, por ejemplo, en nuestro estudio MERENA22 los datos en 1.156 pacientes con ERC3 y4 mostraron que varios de los factores de riesgo CV (HTA, enfermedad arterial coronaria, enfermedad vascular cerebral, insuficiencia cardíaca o enfermedad vascular periférica) están muy frecuentemente presentes y son más prevalentes en la población con ERC, independientemente de la presencia de DM. Cuando en dicho estudio analizamos la mortalidad tras cinco años de seguimiento, se constató que las hospitalizaciones eran más frecuentes en el grupo de pacientes con DM (44% por causas CV) y que el 44% de los pacientes la ERC había progresado a ERC estadio5, requiriendo TSR (35,9% mediante hemodiálisis y 8,1% mediante diálisis peritoneal), pero la mortalidad no fue significativamente superior en el grupo de pacientes con DM respecto a los pacientes sin DM (17,2% vs 15,4%; p=0,17) (datos presentados en el Congreso de la S.E.N. en Sevilla, 15-18 de octubre de 2011)23. Datos similares se han descrito en el estudio PECERA, que incluyó a 995 pacientes con ERC-KDOQI4, el 35% de ellos con DM, y con un seguimiento de 3años. En dicho estudio la causa principal de hospitalizaciones fue CV, siendo la más importante la insuficiencia cardiaca. De estos pacientes, el 32% requirieron TSR (27% mediante hemodiálisis, 4% mediante diálisis peritoneal y 1% recibió un trasplante renal). A lo largo del seguimiento fallecieron el 15% de ellos (el 46,2% por causa CV)24.
Creemos que es importante señalar que el porcentaje de progresión en estos dos estudios anteriormente referidos22,24 y en el que ahora presentamos, siendo elevado, no lo es en exceso si lo comparamos con datos antiguos de la literatura, lo cual pudiera ser debido en parte a la insistencia de guías y documentos de consenso sobre el mayor control de factores de progresión como la HTA, la dislipemia, la anemia o los parámetros del metabolismo óseo y mineral. En este contexto, es también importante reseñar que los pacientes de nuestro estudio no se beneficiaron de los nuevos fármacos antihiperglucemiantes con potencial efecto nefroprotector y cardioprotector, como los iSGLT2 o los arGLP-1, que aún no estaban introducidos para su uso clínico en los años en que nuestros pacientes fueron incluidos en el estudio.
En el estudio NEFRONA, que incluyó a 4.137 pacientes con ERC estadios3 a5 sin antecedentes CV previos y 843 sujetos controles sin enfermedad renal conocida, los factores asociados con peor pronóstico CV fueron la progresión de la placa de ateroma carotídea, el tabaquismo, la presencia de DM o de HTA sistólica, los niveles bajos de 25-OH vitaminaD, así como la ausencia de tratamiento con captores de fósforo25. Un subanálisis posterior del mismo estudio en una cohorte con 1.152 pacientes mostró que los factores de progresión del daño renal fueron los niveles más elevados de P en ERC-3 a 5, los niveles descendidos de 25-OH vitaminaD y niveles de i-PTH superiores a 110pg/mL en ERC 4 y 526.
En el estudio RIACE (Renal Insufficiency and CV Events), un trabajo multicéntrico y observacional que incluyó a 15.733 pacientes con DM tipo2, los datos más llamativos fueron el elevado número de pacientes sin albuminuria (fenotipo predominante), que además mostraban una elevada prevalencia de factores de riesgo CV, la escasa concordancia entre el estadio de ERC y la presencia de retinopatía diabética, así como la administración de hipoglucemiantes orales no recomendados con FGe <30mL/min/1,72m227.
Un metaanálisis publicado en el año 2016 evaluó doce estudios de progresión de ERC con más de 13.000 pacientes y mostró una progresión de promedio a ERC-5 de 40 eventos/1.000 pacientes/año, la mortalidad de 41 episodios/1.000 pacientes/año, siendo los episodios CV 29/1.000 pacientes/año. Hay que señalar que los autores observaron una gran variabilidad de resultados entre los diferentes países28.
Nos parece interesante resaltar que la estimación del FG mediante ecuaciones que incluyen la creatinina plasmática puede ofrecer variabilidad para clasificar el estadio de función renal en estos pacientes. Cuando iniciamos el presente estudio, la ecuación disponible en los laboratorios de los distintos centros era la MDRD en sus diferentes fórmulas, con las 4, 6 y MDRD-IDMS como las más empleadas, siendo esta última la seleccionada para clasificar a los pacientes incluidos. Posteriormente se han introducido nuevas ecuaciones, siendo la más empleada la CKD-EPI. Por ello recalculamos el FG tanto en el momento basal como a lo largo del estudio y a los tres años de seguimiento.
Como consecuencia de esa reestimación, 19 pacientes fueron reclasificados como ERC-4. No se detectaron otros cambios en reclasificación de estadio. Este dato puede ser importante a la hora de estimar el grado de alteración de la función renal y las posibles consecuencias cuando empleamos medicaciones sujetas a modificación de dosis con arreglo al FG, para evitar posible nefrotoxicidad u otros efectos adversos. No obstante, se realizó el análisis de los pacientes con progresión, así como los factores de riesgo asociados a la misma, en el análisis multivariante, y no se detectaron diferencias cuando se utilizó la fórmula de MDRD y la de CKD-EPI.
Hemos de reconocer diversas limitaciones en nuestro estudio. La primera es que no se alcanzó a incluir el número de pacientes inicialmente propuesto debido a dificultades en el reclutamiento, por lo que el plazo de cierre del mismo hubo de prolongarse de forma significativa. En segundo lugar, el hecho de no alcanzar la n propuesta podría haber influido en no demostrar la significación estadística en el análisis multivariante de algunos de los factores de progresión propuestos en el análisis bivariante. Este mismo hecho podría explicar la falta de significación estadística de la albuminuria y la proteinuria en el análisis multivariante, hecho unido a la pérdida de estos dos datos en algunos pacientes.
Aunque el estudio presente estas limitaciones, especialmente la falta de detección de factores de riesgo en las variables clínicas, este no es un hecho infrecuente, especialmente en pacientes de grandes estudios, ya que suelen presentar adecuados controles de los factores de riesgo (HTA, dislipemia, etc.) y la tasa de eventos suele ser baja. Un reciente ejemplo es el estudio EMPA-KIDNEY29, donde se analizó el efecto de empagliflozina en 6.609 pacientes con ERC y riesgo de progresión de daño renal incluyendo diabéticos y no diabéticos, donde el 65,8% presentaban ERC estadio3 y el 34,2% ERC estadio4. El FGe medio de 37,4±14,4mL/min/1,73m2 (en nuestro estudio el FGe medio era de 43,9±7,9mL/min/1,73m2 y el porcentaje de normo, micro y macroalbuminuria del 52%, del 28% y del 20%, muy similar a los datos de nuestro estudio: 41,9%, 31,8% y 26,3%).
La tasa de eventos relacionados con el end-point primario combinado (reducción del FGe≥40%, alcanzar un FGe de 10mL/min/1,73m2 o inicio de diálisis) fue tan solo del 18% en los pacientes con proteinuria y del 6% y del 7% en los pacientes con normo y microalbuminuria. Este puede ser un aspecto común con nuestro estudio. Es por ello por lo que la búsqueda de nuevos biomarcadores en las muestras guardadas en el biobanco puede cobrar protagonismo en un futuro próximo.
A pesar de estas limitaciones, creemos que las fortalezas de nuestro estudio residen en que ha incluido una amplia representación de pacientes de la geografía española —14 de las 17 comunidades autónomas—, que el período de seguimiento es relativamente largo —tres años— y que la muestra incluye un número significativo de pacientes con DM. Si bien es cierto que los pacientes no recibieron tratamiento con iSLGT2 o con AR GLP-1, este mismo hecho podrá servir para comparar la evolución de nuestros pacientes como grupo control para futuros estudios que evalúen la progresión de daño renal y de daño CV con la de otros pacientes tratados con dichos fármacos, versus los tratados de forma clásica con bloqueadores del sistema renina-angiotensina-aldosterona, además de los tratamientos habituales. Una fortaleza adicional importante es la de poder disponer de muestras biológicas en el biobanco, particularmente de orina y de restos celulares, que nos puede permitir evaluar nuevos biomarcadores que puedan identificar factores de progresión del daño renal con mayor precisión y establecer nuevas dianas terapéuticas.
Un buen ejemplo de ello es un estudio recientemente publicado en Nehrology, Dialysis and Transplantation y en cuyo análisis se incluyeron pacientes de la cohorte PROGRESER junto con pacientes del estudio PRONEDI30. Los autores identificaron la proteína urinaria Dickkopf-3 como un nuevo marcador de progresión y de muerte en pacientes con ERC estadios2 y331. Dicho estudio resalta la importancia de disponer de muestras biológicas en investigación traslacional que valoren no solo aspectos relacionados con la trazabilidad, sino de forma imprescindible con la conexión con características clínicas de los pacientes, aspectos fundamentales para investigaciones futuras32.
Creemos que la progresión del daño renal debe interpretarse en un contexto multifactorial. Se precisa la búsqueda de nuevos biomarcadores, diferentes de los tradicionales, para establecer estrategias terapéuticas para prevenir la progresión de la ERC.
ConclusionesNuestro estudio no ha revelado nuevos factores de progresión de daño renal con relación a los factores ya conocidos. El estudio ha mostrado en el análisis de regresión multivariante que factores como la HTA pueden estar relacionados con la progresión del daño renal en la población con ERC de origen no diabético, y que los bajos niveles de calcio y elevados de PTH intacta se correlacionaron con progresión de daño renal en los pacientes con DM y ERC-3 KDOQI. No hemos encontrado diferencias significativas en cuanto a la progresión de la ERC en pacientes con y sin DM, ni tampoco en los factores relacionados con dicha progresión.
FinanciaciónEl proyecto obtuvo financiación de Laboratorio Esteve, Barcelona, y de la Fundación SENEFRO.
Conflicto de interesesA.M.C. ha sido consultor y ha recibido honorarios por conferencias de AbbVie, Amgen, Boëhringer-Ingelheim, Esteve, Lilly, Merck Sharp Dhôme, Novo-Nordisk, Shire and Vifor-Fresenius Medical Care. J.F.N.G. ha sido consultor y ha recibido honorarios por conferencias de AbbVie, Amgen, AstraZeneca, Bayer, Boehringer Ingelheim, Esteve, Genzyme, Lilly, MSD, Novartis, NovoNordisk, Servier, Shire and Vifor Pharma. J.L.G ha recibido honorarios por conferencias de AstraZeneca, Boehringer Ingelheim, Janssen, Mundipharma, Novartis, Novonordisk, Otsuka and Vifor Pharma. L.D., E.G., G.F-F., E.E., S.C. J.A., NR.R, A.O y el resto de coautores declaran no tener conflicto de intereses para esta publicación.
Nuestro agradecimiento a los miembros del GEENDIAB y a todos los investigadores que han hecho posible la realización del estudio PROGRESER. A Laboratorio ESTEVE que ha financiado toda la realización del estudio. A la CRO DYNASOLUTIONS por su asistemcia técnica. A Antonio Torres Collado, e MSG Consuting por su asistencia editorial. AMC, JLG, AO y JFNG son miembros de la REDinREN del Instituto de Saluds Carlos IIO y de RICORS 2040: RD12/0021/0019, RD16/0009/0022 and RD 21/0005/0013.