La enfermedad renal diabética, frecuente en pacientes con diabetes mellitus tipo 2, se asocia con un marcado incremento de la morbimortalidad, especialmente cardiovascular, y de progresión a enfermedad renal crónica terminal. Hasta la fecha la reducción del riesgo cardiovascular y renal en esta población se ha basado en el control estricto de los factores de riesgo cardiovascular y en el uso de inhibidores del sistema renina-angiotensina. Mas recientemente los inhibidores del cotransportador sodio-glucosa tipo 2 han demostrado ofrecer protección cardiovascular y renal, pero el riesgo residual sigue siendo alto y su eficacia antihiperglucemiante es limitada en ERC moderada-severa.
Por ello se precisan fármacos con un potente efecto antihiperglucemiante, independiente del filtrado glomerular, con bajo riesgo de hipoglicemia, que reduzcan el peso en pacientes con sobrepeso/obesidad y que proporcionen una protección cardiovascular y renal, como los agonistas del receptor de GLP-1. Sin embargo, estos fármacos precisan de su administración subcutánea, lo que puede limitar su uso temprano. La reciente disponibilidad de semaglutida oral puede ayudar a la introducción precoz de esta familia con beneficios cardiovasculares y renales probados y excelente perfil de seguridad. En esta revisión se describe la familia y sus efectos cardiovasculares y renales.
Diabetic kidney disease, a common complication in patients with type 2 diabetes mellitus, is associated with a markedly increased morbidity and mortality, especially of cardiovascular origin, and faster progression to end-stage renal disease. To date, reducing cardiovascular and renal risk in this population was based on strict control of cardiovascular risk factors and the renin–angiotensin system blockade. More recently, sodium-glucose cotransporter type 2 inhibitors have demonstrated to offer cardiovascular and renal protection, but the residual risk remains high and their antihyperglycemic efficacy is limited in moderate-severe CKD.
Therefore, drugs with a potent antihyperglycemic effect, independent of the glomerular filtration rate, with a low risk of hypoglycemia, that reduce weight in overweight/obese patients and that provide cardiovascular and renal protection, such as GLP-1 receptor agonists, are needed. However, these drugs require subcutaneous administration, which may limit their early use. The recent availability of oral semaglutide may facilitate the early introduction of this family with proven cardiovascular and renal benefits and excellent safety profile. In this review the family is analyzed as well as their cardiovascular and renal effects.
La diabetes mellitus tipo 2 (DM2) afecta al 13,8% de la población española1 y su prevalencia se espera que aumente en el futuro2. La presencia de DM2 aumenta significativamente el riesgo de episodios cardiovasculares, enfermedad renal crónica (ERC) y muerte prematura3,4, por lo que su creciente prevalencia previsiblemente aumentará la incidencia de complicaciones micro y macrovasculares5. Hasta la última década el control glucémico, de la presión arterial, o de la dislipidemia y el uso de inhibidores del sistema renina-angiotensina (iSRA) han sido las únicas estrategias para reducir el riesgo cardiovascular y renal en esta población. Aunque el control glucémico estricto tiene efectos beneficiosos sobre las complicaciones microvasculares (retinopatía, nefropatía o neuropatía), no parece reducir el riesgo de enfermedad cardiovascular, y se asocia a un mayor riesgo de hipoglucemia en DM23,6. Los fármacos antihiperglucemiantes disponibles hasta hace poco mejoraban el control glucémico, pero sin beneficios sobre el riesgo cardiovascular y/o renal. Asimismo, algunos se asociaban con potenciales efectos indeseables, como el riesgo de insuficiencia cardiaca o de fracturas (complicaciones especialmente prevalentes per se en pacientes con ERC), como las tiazolidindionas, o el aumento de peso o riesgo de hipoglucemia con sulfonilureas e insulina. Por otro lado, el efecto antihiperglucemiante de los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) disminuye a medida que lo hace el filtrado glomerular (FG), con FGe<45ml/min/1,73m2 especialmente7–9.
La ERC afecta a un 20-40% de la población con diabetes10. En España su prevalencia actual oscila entre el 28-33%11,12, y es un reconocido factor de riesgo cardiovascular y de mortalidad en esta población13–15. Además, en pacientes con DM2 y ERC avanzada existen limitaciones en la prescripción de determinados fármacos antihiperglucemiantes (p. ej. metformina o sulfonilureas) y el riesgo de hipoglucemia con el tratamiento antihiperglucemiante está aumentado16, complicación que se asocia con un mayor riesgo cardiovascular17 y dificulta la consecución de los objetivos de control glucémico.
El tratamiento intensivo y multifactorial de los factores de riesgo reduce el desarrollo/progresión de la enfermedad renal18, por lo que las guías insisten en un manejo integral del paciente con diabetes (control glucémico y de los factores de riesgo cardiovascular, uso de inhibidores del sistema renina-angiotensina, así como cambios en el estilo de vida, incluyendo el cese del tabaquismo o la pérdida de peso en personas con sobrepeso/obesidad, entre otros)19. Sin embargo, el riesgo residual renal sigue siendo muy alto en pacientes óptimamente tratados20. Mas recientemente, los iSGLT2 han demostrado reducir el riesgo de episodios cardiovasculares y renales, pero aun así el riesgo residual de progresión de la enfermedad renal persiste elevado21,22. Por otro lado, aunque las tasas de otras complicaciones relacionadas con la diabetes (como el infarto de miocardio, el ictus, las amputaciones de extremidades inferiores o la mortalidad) han disminuído significativamente en las últimas décadas, no ocurre lo mismo con la ERC que precisa tratamiento sustitutivo renal atribuida a enfermedad renal diabética (ERD)23, por lo que se precisan nuevos tratamientos que mejoren el control glucémico independientemente del FG, con bajo riesgo de hipoglucemia y que reduzcan el riesgo cardiovascular y renal en esta población.
Los agonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1) son una familia de fármacos antihiperglucemiantes que han demostrado una reducción potente de la HbA1c, con bajo riesgo de hipoglucemia, que reducen el peso y con beneficios cardiovasculares y renales demostrados24. En esta revisión se describe la familia, sus beneficios cardiovasculares y renales, así como su potencial clínico en pacientes con ERD, especialmente con la nueva formulación de semaglutida oral, ya disponible en el mercado.
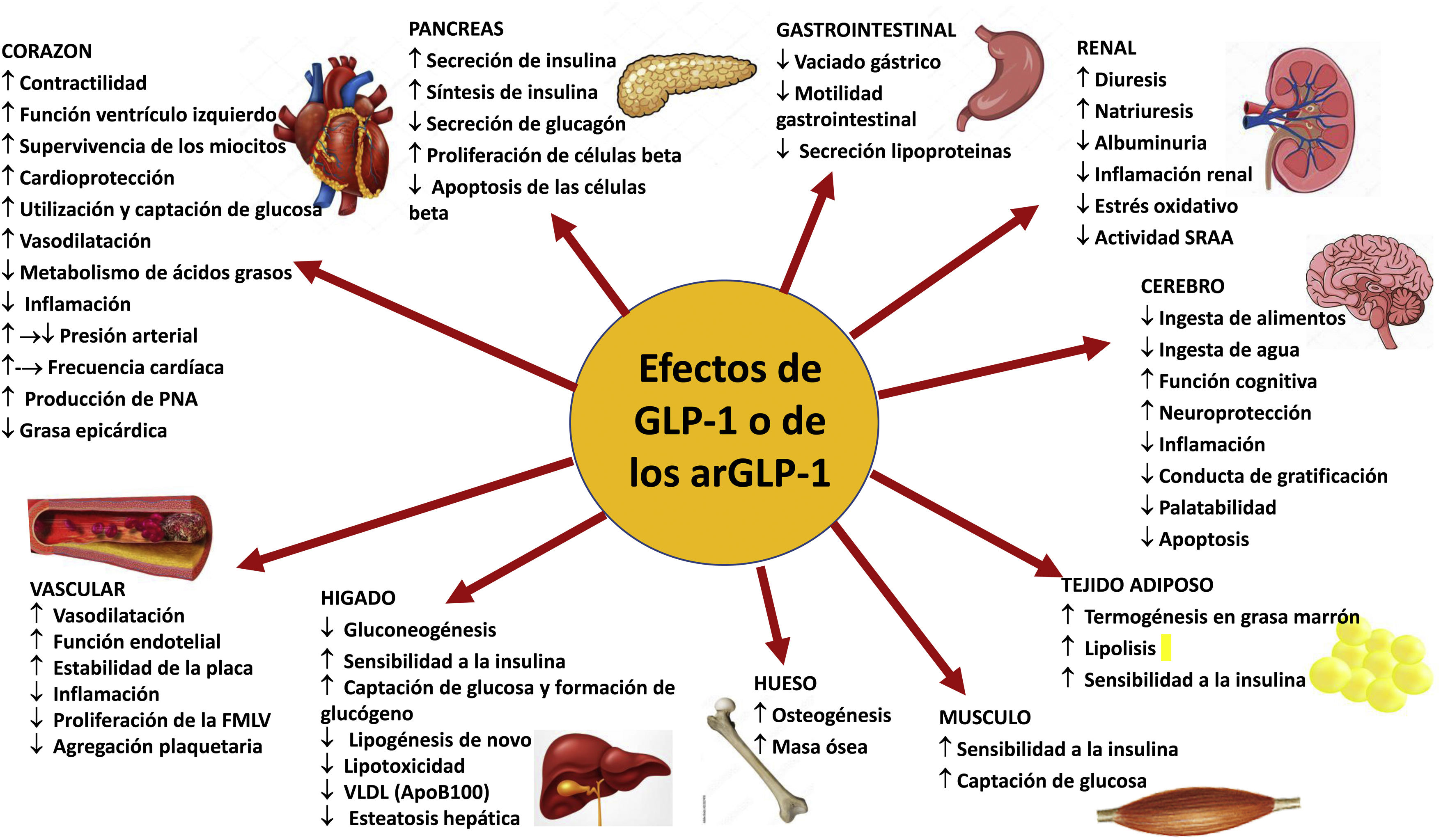
Agonistas del receptor del péptido similar al glucagón tipo 1Efecto incretínico y efectos sistémicos del péptido similar al glucagón tipo 1 y sus agonistasEl efecto incretínico se refiere al fenómeno por el cual la respuesta secretora de insulina a la administración oral de glucosa es 2-3 veces superior respecto a la misma dosis de glucosa administrada por vía intravenosa25. Ello se debe a las hormonas incretínicas, como el GLP-1 o el polipéptido insulinotrópico dependiente de glucosa, que estimulan la secreción de insulina en respuesta a la ingesta de alimentos. El GLP-1 es un péptido secretado por células enteroendocrinas tipo L en el íleon y el colon, en respuesta a diferentes nutrientes, principalmente glucosa y lípidos, mientras que el polipéptido insulinotrópico dependiente de glucosa es producido por las células K presentes en el duodeno y la primera porción del yeyuno. El GLP-1, actuando sobre su receptor, tiene acciones fisiológicas sobre múltiples órganos diana: aumenta la secreción de insulina estimulada por glucosa en las células beta pancreáticas, reduce la secreción de glucagón por las células α, mejora la sensibilidad a la insulina y reduce la ingesta de alimentos26. En modelos celulares y murinos el GLP-1 promueve la neogénesis de células β e inhibe su apoptosis27. La secreción de insulina inducida por el GLP-1 es dependiente de la glucemia, por lo que no induce hipoglucemia (fig. 1). En pacientes con DM2 la respuesta incretínica está disminuida, pero el efecto insulinotrópico de GLP-1 está conservado28. En condiciones normales el GLP-1 tiene una vida media corta (∼2min), pues es rápidamente degradado por la dipeptidilpeptidasa 4, por lo que se han desarrollado análogos del GLP-1 resistentes a esta enzima para el tratamiento de la DM229.
arGLP-1: agonista del receptor del péptido similar al glucagón 1; FMLV: fibra muscular lisa vascular; PNA: péptido natriurético auricular; SRAA: sistema renina-angiotensina-aldosterona. Modificado de Müller et al.29.
El receptor de GLP-1 (rGLP-1) pertenece a la familia B de receptores acoplados a la proteína G y se expresan en el páncreas, el tracto gastrointestinal, el sistema nervioso central (SNC), los riñones, los pulmones o el corazón. También se expresan en otros tejidos, como los vasos sanguíneos o el tejido adiposo29,30, aunque su localización en diferentes tejidos y órganos arroja resultados discrepantes31.
El GLP-1 o sus agonistas enlentecen el vaciado gástrico. También actúan sobre el SNC promoviendo la saciedad, reduciendo la ingesta de alimentos y favoreciendo la pérdida de peso27,29. Los agonistas del rGLP-1(arGLP-1) también han demostrado efectos neuroprotectores, antiapoptóticos, reducen el estres oxidativo y la inflamación y mejoran la función cognitiva y de memoria (fig. 1)29,32.
Con respecto al sistema vascular la activación del rGLP-1 induce descensos modestos de la presión arterial33,34, tiene un efecto vasodilatador, mejora la rigidez arterial y previene la formación de la placa aterosclerótica —y tiene efectos estabilizadores de la misma— a través de sus efectos antiinflamatorios y antiapoptóticos demostrados en modelos animales29,32,35–38. A pesar de las controversias sobre la expresión del rGLP-1 en el músculo liso vascular y las células endoteliales, los estudios han demostrado que los arGLP-1 tienen efectos antiproliferativos sobre estas células39, reducen el estrés oxidativo, mejoran la función endotelial y aumentan la producción de óxido nítrico en modelos experimentales35,40.
En el corazón producen aumentos discretos de la frecuencia cardíaca (2-4ppm), aunque ello no parece asociarse con un incremento de arrítmias o de episodios cardiovasculares. Aumentan la captación y utilización de glucosa y mejoran el metabolismo cardíaco, así como la función del ventrículo izquierdo36,41, aumentan la liberación de péptido natriurético auricular; tienen efectos antiinflamatorios, antiisquémicos y antifibróticos e inhiben la apoptosis de los miocardiocitos29,32,42. Más recientemente se ha descrito que también reducen la grasa epicárdica43. Asimismo, inhiben la agregación plaquetaria y la trombosis44.
En los pulmones la activación del rGLP-1 confería protección frente a la lesión pulmonar aguda inducida por lipopolisacáridos45.
En el tejido adiposo favorecen la diferenciación de los adipocitos, disminuyen el depósito de lípidos en la grasa blanca y facilitan su conversión en grasa marrón, así como la termogénesis y el consumo energético29,32,46–48; en el intestino reducen la lipidemia posprandial y la secreción de quilomicrones48,49. En los músculos mejoran la sensibilidad a la insulina y aumentan la captación de glucosa29.
La expresión renal de los rGLP-1 no se ha caracterizado completamente debido a la insuficiente especificidad y sensibilidad de los anticuerpos utilizados, aunque se han detectado de manera variable en células endoteliales, macrófagos, células yuxtaglomerulares y túbulo proximal en varios modelos animales y tejido humano31. La infusión de GLP-1 aumenta la natriuresis al reducir la reabsorción tubular de sodio y reduce la hiperfiltración en los sujetos obesos50. El tratamiento crónico con arGLP-1 en pacientes con DM2 no ha mostrado efectos sobre el FG medido y el flujo plasmático renal efectivo en ayunas o estado posprandial, pero mantiene su efecto natriurético51. El GLP-1 y sus agonistas inducen natriuresis por inhibición del intercambiador Na+/H+ tipo 3 en el túbulo proximal, aunque no pueden excluirse interacciones con el sistema renina, insulina, o glucagón52–54, pues reducen los niveles circulantes de componentes del SRA51,53–55 (fig. 1).
Efectos metabólicos de los agonistas del receptor del péptido similar al glucagón tipo 1Los arGLP-1 muestran un potente efecto antihiperglucemiante con descensos entre 0,5% y 1,3% de la HbA1c, que es mayor con aquellos de vida media larga56 con bajo riesgo de hipoglucemia, como han demostrado los estudios de seguridad cardiovascular, donde no hubo diferencias en las tasas de hipoglucemia frente a placebo, salvo cuando se asociaban con sulfonilureas o insulina57–64. El bajo riesgo de hipoglucemia se ha observado incluso en pacientes con ERD65–67, más susceptibles de presentar esta complicación16.
Es importante destacar también la pérdida de peso y del perímetro de cintura con los arGLP-1, como consecuencia principalmente de una reducción de la grasa corporal y no de la masa magra, la cual se mantiene durante el seguimiento a largo plazo68. Esta pérdida ponderal se atribuye al enlentecimiento del vaciado gástrico, que incrementa la saciedad, al aumento del gasto energético en reposo y a sus efectos directos sobre los centros de control del apetito y la saciedad en el SNC29.
La obesidad y el sobrepeso, frecuentes en los pacientes con DM2, son un factor de desarrollo/progresión de ERC por efectos tanto directos como indirectos69. Aunque los mecanismos de la asociación entre obesidad y ERC no están claros se ha sugerido la hipertensión, la hiperfiltración glomerular, la hiperglucemia, la lipotoxicidad, la inflamación o el papel del tejido adiposo y sus adipoquinas70. La reducción ponderal mediante cirugía bariátrica, tratamiento farmacológico o dieta se han asociado con un efecto nefroprotector71–73, por lo que la reducción ponderal es un objetivo fundamental en la nefroprotección de los pacientes con ERD.
La esteatosis hepática está estrechamente relacionada con la resistencia a la insulina, la diabetes mellitus o el síndrome metabólico, y se asocia con un aumento del riesgo cardiovascular y renal74. La esteatosis hepática se ha asociado con enfermedad renal prevalente e incidente, y la presencia de un FG disminuido o de albuminuria se han asociado con la presencia de esteatohepatitis no alcohólica o la severidad de la fibrosis, mientras que la mejoría en la histología hepática se asocia con una mejora de la ERC75. Los arGLP1 mejoran los niveles de insulina, regulan la autofagia, inhiben la neoglucogénesis hepática, reducen el contenido de grasa hepática, los niveles de enzimas hepáticas plasmáticas y se han descrito mejoras histológicas hepáticas con liraglutida y semaglutida49,76. Asimismo, la grasa epicárdica y perirrenal se asocian con un incremento del riesgo cardiorrenal77, por lo que la reducción de la grasa ectópica43 que han demostrado los arGLP-1 podría ser beneficiosa en la ERD.
Finalmente, los arGLP-1 han demostrado mejorar el perfil lipídico pre y posprandial, con una reducción de los niveles de ácidos grasos libres, triglicéridos y colesterol LDL, así como de la fracción de LDL pequeñas y densas y una disminución del incremento de triglicéridos y apo-B48 posprandiales78–82. Asimismo, se ha descrito que disminuyen los marcadores de inflamación, del inhibidor del activador plasminógeno tipo 1 y de leptina y aumentan los niveles de adiponectina47,78.
Respecto a los efectos adversos de esta familia los más importantes son de tipo gastrointestinal, especialmente náuseas y vómitos de intensidad leve-moderada, y que disminuyen con el tiempo.
Todo ello se traduce en una mejoría del control glucémico y de la dislipidemia, una reducción de la presión arterial y del peso, de los depósitos ectópicos de grasa visceral, así como de la inflamación y de la coagulación, lo que podría traducirse en una mayor protección cardiovasculorrenal con estos fármacos.
Aspectos diferenciales clave de la familia de los agonistas del receptor del péptido similar al glucagón tipo 1Existen varios arGLP-1 aprobados o en estudio para su uso en DM2: exenatida (exenatida y exenatida LAR o semanal), liraglutida, lixisenatida, dulaglutida, semaglutida, albiglutida (retirada del mercado) y efpeglenatida (en desarrollo clínico). Casi todos se administran por vía subcutánea, aunque actualmente está disponible en España la semaglutida oral (véase más adelante). Estos fármacos se dividen en: incretinmiméticos, derivados de exendina-4 (péptido obtenido de la saliva del monstruo de Gila [Heloderma suspectum]); o análogos del GLP-1 humano, con cambios en la secuencia de aminoácidos que los hacen resistentes a la dipeptidilpeptidasa 4. Estos últimos presentan mayor homología estructural con el GLP-1 humano y tienen menor riesgo de inmunogenicidad que los incretinmiméticos. Los arGLP-1 presentan otras diferencias en sus propiedades biológicas clínicamente relevantes (vida media, intervalo de dosificación y peso molecular).
Los agentes de vida media corta (exenatida 2 veces al día o lixisenatida) inducen picos con aumentos transitorios de los niveles plasmáticos del arGLP-1, produciendo una activación intermitente del receptor y tienen un potente efecto sobre el vaciado gástrico y la glucemia posprandial al reducir la tasa de entrada de glucosa al duodeno.
Los de vida media larga (exenatida semanal, efpeglenatida, liraglutida, semaglutida, albiglutida y dulaglutida) producen una activación sostenida del rGLP1, lo que resulta en una mayor reducción de la HbA1c, de la glucemia basal y del peso y tendrían menores efectos secundarios gastrointestinales; no tienen un efecto importante sobre el vaciado gástrico debido a un fenómeno de taquifilaxis, y presentan un efecto modesto sobre la glucemia posprandial24,78.
Los de peso molecular pequeño (exenatida, lixisenatida, liraglutida y semaglutida) pueden penetrar mejor la barrera hematoencefálica que los de alto peso molecular (dulaglutida, albiglutida y epfeglenatida) y podrían generar efectos diferenciales sobre las vías de señalización del apetito a nivel central y la pérdida de peso24,33,83.
Los análogos de exendina 4 se eliminan por vía renal, por lo que no se aconseja su uso en pacientes con ERC avanzada (FGe<30ml/min/1,73m2), mientras los análogos de GLP-1 tienen otras vías de eliminación y pueden prescribirse hasta ERC estadio 4 (FGe>15ml/min/1,73m2)78.
Todo ello hace que existan diferencias entre ellos en cuanto a su potencia en reducción de HbA1c, glucemia basal o la reducción ponderal, entre otros factores, que deben considerarse al elegir fármacos de esta familia78,83,84.
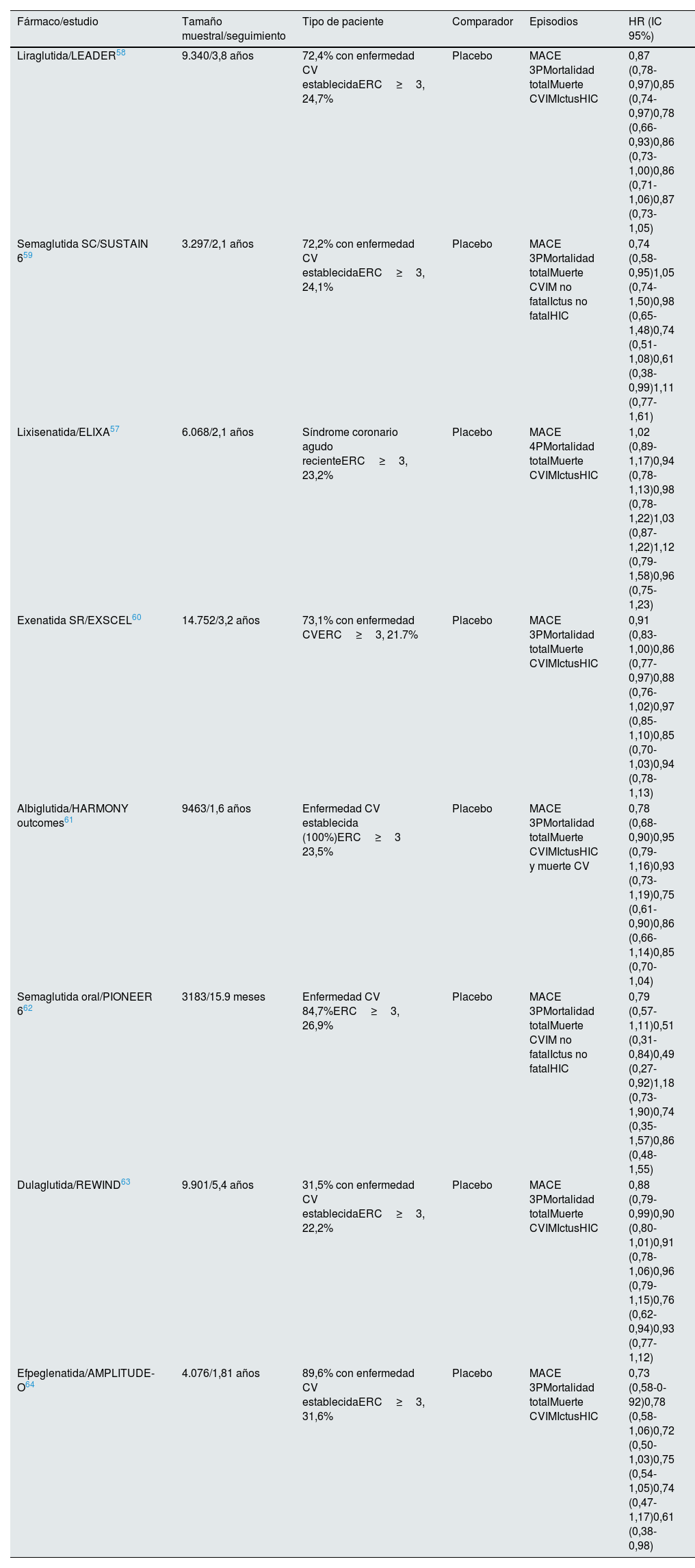
Protección cardiovascular de los agonistas del receptor del péptido similar al glucagón tipo 1Diversos ensayos clínicos aleatorizados han analizado la seguridad cardiovascular (CVOT) de los arGLP1 frente al tratamiento estándar. Todos analizaron el compuesto de 3 episodios adversos cardiovasculares mayores (MACE), que incluía muerte cardiovascular, infarto de miocardio no mortal o ictus no mortal, excepto el estudio con lixisenatida que consideró el MACE de 4 puntos, que incluía además hospitalización por insuficiencia cardíaca (tabla 1)57–64.
Ensayos clínicos de seguridad cardiovascular con arGLP1en pacientes con diabetes mellitus tipo 2
| Fármaco/estudio | Tamaño muestral/seguimiento | Tipo de paciente | Comparador | Episodios | HR (IC 95%) |
|---|---|---|---|---|---|
| Liraglutida/LEADER58 | 9.340/3,8 años | 72,4% con enfermedad CV establecidaERC≥3, 24,7% | Placebo | MACE 3PMortalidad totalMuerte CVIMIctusHIC | 0,87 (0,78-0,97)0,85 (0,74-0,97)0,78 (0,66-0,93)0,86 (0,73-1,00)0,86 (0,71-1,06)0,87 (0,73-1,05) |
| Semaglutida SC/SUSTAIN 659 | 3.297/2,1 años | 72,2% con enfermedad CV establecidaERC≥3, 24,1% | Placebo | MACE 3PMortalidad totalMuerte CVIM no fatalIctus no fatalHIC | 0,74 (0,58-0,95)1,05 (0,74-1,50)0,98 (0,65-1,48)0,74 (0,51-1,08)0,61 (0,38-0,99)1,11 (0,77-1,61) |
| Lixisenatida/ELIXA57 | 6.068/2,1 años | Síndrome coronario agudo recienteERC≥3, 23,2% | Placebo | MACE 4PMortalidad totalMuerte CVIMIctusHIC | 1,02 (0,89-1,17)0,94 (0,78-1,13)0,98 (0,78-1,22)1,03 (0,87-1,22)1,12 (0,79-1,58)0,96 (0,75-1,23) |
| Exenatida SR/EXSCEL60 | 14.752/3,2 años | 73,1% con enfermedad CVERC≥3, 21.7% | Placebo | MACE 3PMortalidad totalMuerte CVIMIctusHIC | 0,91 (0,83-1,00)0,86 (0,77-0,97)0,88 (0,76-1,02)0,97 (0,85-1,10)0,85 (0,70-1,03)0,94 (0,78-1,13) |
| Albiglutida/HARMONY outcomes61 | 9463/1,6 años | Enfermedad CV establecida (100%)ERC≥3 23,5% | Placebo | MACE 3PMortalidad totalMuerte CVIMIctusHIC y muerte CV | 0,78 (0,68-0,90)0,95 (0,79-1,16)0,93 (0,73-1,19)0,75 (0,61-0,90)0,86 (0,66-1,14)0,85 (0,70-1,04) |
| Semaglutida oral/PIONEER 662 | 3183/15.9 meses | Enfermedad CV 84,7%ERC≥3, 26,9% | Placebo | MACE 3PMortalidad totalMuerte CVIM no fatalIctus no fatalHIC | 0,79 (0,57-1,11)0,51 (0,31-0,84)0,49 (0,27-0,92)1,18 (0,73-1,90)0,74 (0,35-1,57)0,86 (0,48-1,55) |
| Dulaglutida/REWIND63 | 9.901/5,4 años | 31,5% con enfermedad CV establecidaERC≥3, 22,2% | Placebo | MACE 3PMortalidad totalMuerte CVIMIctusHIC | 0,88 (0,79-0,99)0,90 (0,80-1,01)0,91 (0,78-1,06)0,96 (0,79-1,15)0,76 (0,62-0,94)0,93 (0,77-1,12) |
| Efpeglenatida/AMPLITUDE-O64 | 4.076/1,81 años | 89,6% con enfermedad CV establecidaERC≥3, 31,6% | Placebo | MACE 3PMortalidad totalMuerte CVIMIctusHIC | 0,73 (0,58-0-92)0,78 (0,58-1,06)0,72 (0,50-1,03)0,75 (0,54-1,05)0,74 (0,47-1,17)0,61 (0,38-0,98) |
CV: cardiovascular; ERC: enfermedad renal crónica estadio≥3 (FGe<60ml/min/1,73m2); HIC: hospitalización por insuficiencia CARDIACA; IM: infarto de miocardio; MACE 3P: episodio compuesto cardiovascular de 3 puntos; MACE 4P: episodio compuesto cardiovascular de 4 puntos, incluyendo además hospitalización por angina inestable.
Aunque todos los estudios con arGLP-1 han demostrado su seguridad cardiovascular (no inferioridad vs. placebo), la mayoría de ellos (liraglituda, semaglutida SC, dulaglutida, albiglutida y efpeglenatida) han demostrado además una reducción de los MACE respecto a placebo, mientras exenatida semanal o semaglutida oral mostraron una tendencia a reducir los MACE. En el estudio LEADER con liraglutida, en pacientes con ERC estadio≥3, este beneficio cardiovascular resultó ser mayor58. Aunque los estudios de seguridad cardiovascular no tenían poder para detectar diferencias en los componentes individuales del MACE, se vieron algunas diferencias entre los estudios en estos componentes individuales; así liraglutida y semaglutida oral redujeron significativamente la muerte cardiovascular, semaglutida subcutánea y dulaglutida redujeron significativamente el ictus no mortal, albiglutida redujo el riesgo de infarto de miocardio no mortal y epfeglenatida redujo la incidencia de insuficiencia cardíaca, mientras exenatida semanal o lixisenatida no mostraron beneficio significativo sobre ningún componente del MACE.
Sin embargo, es difícil discernir si estas diferencias entre estudios obedecen a diferencias reales entre las moléculas en cuanto a sus efectos cardiovasculares. Las potenciales explicaciones incluyen diferencias en el tipo de pacientes incluidos, la adherencia al tratamiento del estudio, el tamaño muestral, la duración de la exposición al fármaco y la activación del receptor GLP1 con una mayor reducción de HbA1c con análogos basados en GLP1 humano de acción más prolongada que con algunos análogos de exendina 4 de acción corta. Los recientes resultados del ensayo AMPLITUDE-O con efpeglenatida64 sugieren que los beneficios cardiovasculares de esta familia no son exclusivos de los análogos de GLP-1 humano. Asimismo, el beneficio cardiovascular de efpeglenatida fue independiente del FG o del uso concomitante de iSGLT-2, lo que sugiere su efecto aditivo e independiente con estos últimos85, como se ha visto también en el estudio EXSCEL86.
Un reciente metaanálisis de los 8 ensayos clínicos de seguridad cardiovascular publicados, y que incluyó un total de 60.080 pacientes, concluyó que, en general, los arGLP-1 reducen los MACE en un 14% (HR 0,86; IC 95%: 0,80-0,93, p<0,0001), sin diferencias significativas respecto a la homología estructural con el GLP-1 humano, riesgo de episodios cardiovasculares (basado en el riesgo de MACE en el grupo placebo como bajo, medio o alto), presencia o no de enfermedad cardiovascular, HbA1c basal, índice de masa corporal, duración del seguimiento, intervalo de administración (diario o semanal) o función renal. Analizando los componentes individuales del MACE, el uso de arGLP-1 redujo el riesgo de muerte cardiovascular (HR 0,87, IC 95%: 0,80-0,94; p=0,0010), infarto de miocardio mortal y no mortal (HR 0,90, IC 95%: 0,83-0,98; p=0,020) e ictus mortal o no mortal (HR 0,83, IC 95%: 0,76-0,92; p=0,0002). Los arGLP-1 también redujeron la mortalidad total (HR 0,88; IC 95%: 0,82-0,94; p=0,0001) y el ingreso hospitalario por insuficiencia cardíaca (HR 0,89; IC 95%: 0,82-0,98, p=0,013), todo ello sin aumentar el riesgo de hipoglucemia grave, de problemas pancreáticos o de retinopatía87. Un reciente análisis post hoc de los CVOT con semaglutida ha objetivado una ganancia de tiempo libre de enfermedad cardiovascular de 1,7 años en aquellos pacientes con ERC vs. 0,2 años en pacientes diabéticos con factores de riesgo cardiovascular únicamente, sugiriendo un beneficio adicional de semaglutida en esta población de alto riesgo cardiovascular88.
Los mecanismos implicados en los beneficios cardiovasculares de esta familia son varios. Un estudio de metarregresión sugirió una relación lineal entre la reducción de la HbA1c y el riesgo de MACE con los arGLP-189. Los análisis de mediación publicados también indican que el beneficio cardiovascular podría estar mediado en parte por los efectos sobre la HbA1c, presión arterial o reducción del cociente albúmina-creatinina90,91 (véase más adelante), así como por su efecto sobre el perfil lipídico81. Sin embargo, en los análisis de subgrupos de los estudios de seguridad cardiovascular la HbA1c basal, el peso, la enfermedad cardiovascular previa o la función renal no predecían los efectos beneficiosos sobre los MACE de estos fármacos87, por lo que se ha sugerido que otros mecanismos, como los efectos antiinflamatorios, antifibróticos, antiaterogénicos, vasodilatadores o de mejora de la función endotelial, previamente mencionados, influyan en el beneficio cardiovascular de estos fármacos29,78 (fig. 1).
Protección renal con los agonistas del receptor del péptido similar al glucagón tipo 1En los CVOT de los arGLP1 los resultados renales se preespecificaron como resultados secundarios clave en 4 estudios con liraglutida, semaglutida subcutánea, dulaglutida y efpeglenatida58,59,63,64, o se recogieron como parámetros de seguridad en otros estudios60. En general, la prevalencia de ERC estadio≥3 en estos estudios fue baja (20-30%) (tabla 1).
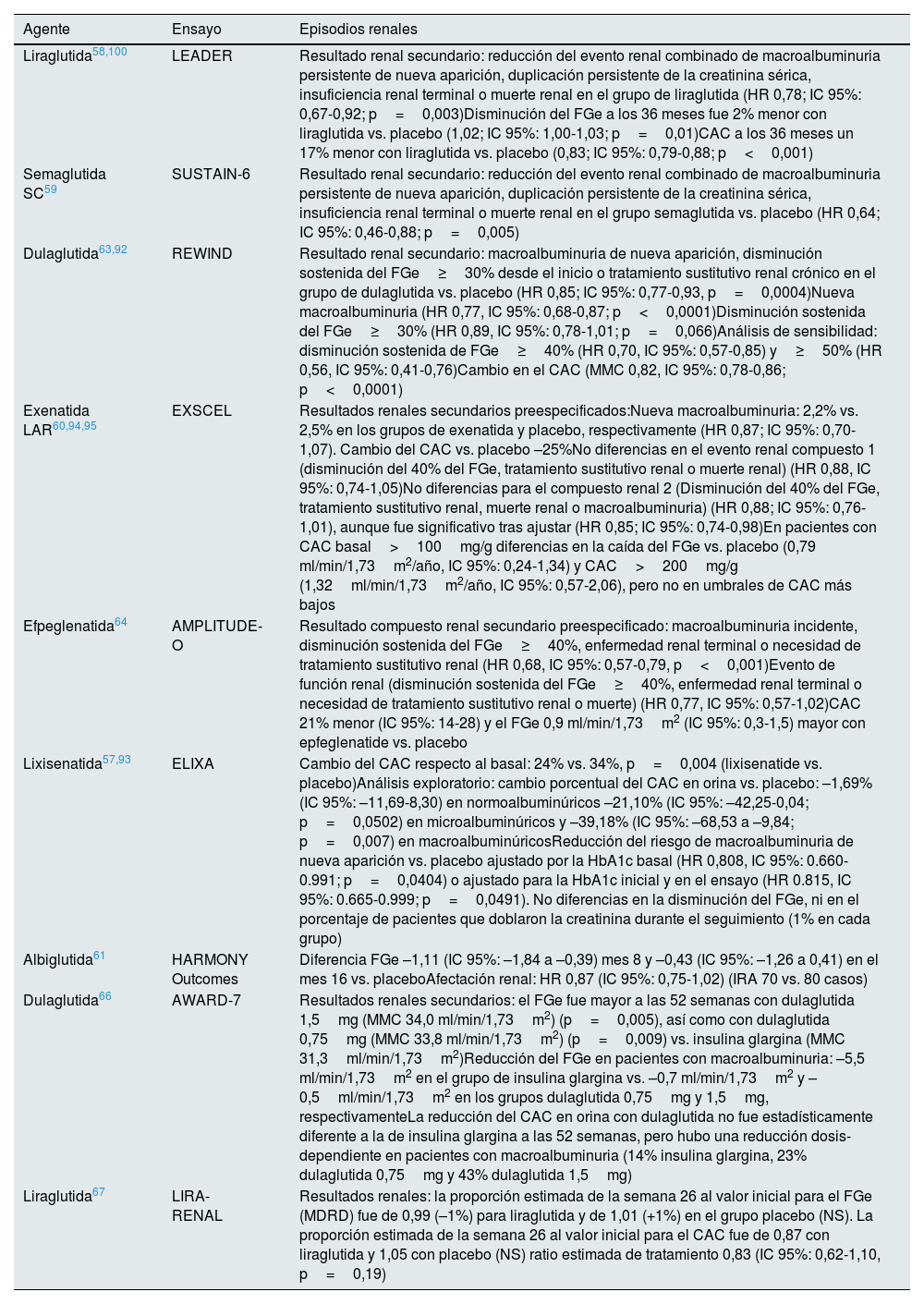
En aquellos que evaluaron prospectivamente los objetivos renales como criterios de valoración secundarios clave, se analizó un episodio compuesto renal que incluyó desarrollo de macroalbuminuria, ERC terminal o necesidad de tratamiento sustitutivo renal o reducción significativa de la función renal respecto a la basal, que incluía un FGe<45ml/min/1,73m2 y una duplicación de la creatinina sérica58,59 o una disminución del FGe≥30%63 o≥40%64. El objetivo renal combinado se redujo aproximadamente entre un 15% y un 35% con liraglutida, semaglutida SC, dulaglutida o efpeglenatida comparado con placebo, básicamente a expensas de la reducción del riesgo de desarrollar macroalbuminuria, sin alcanzar significación estadística para los demás componentes (tabla 2). Sin embargo, en un análisis de sensibilidad del estudio REWIND con dulaglutida, la reducción del riesgo relativo para una disminución del FGe del 40% o 50% fue del 30% y 44%, ambos significativos, en el grupo de dulaglutida comparado con placebo, respectivamente92. Este menor riesgo de desarrollar macroalbuminuria se confirmó también en un análisis exploratorio del estudio ELIXA lixisenatida93. En el estudio EXSCEL (exenatida LAR) se analizaron los episodios renales como episodios microvasculares adicionales, y no se observaron diferencias en el riesgo de episodios relacionados con disminución del FGe, pero sí en el episodio compuesto, que incluía disminución del FG y macroalbuminuria, aunque solo tras ajustar94 (tabla 2).
Resultados renales con arGLP1 en los ensayos clínicos
| Agente | Ensayo | Episodios renales |
|---|---|---|
| Liraglutida58,100 | LEADER | Resultado renal secundario: reducción del evento renal combinado de macroalbuminuria persistente de nueva aparición, duplicación persistente de la creatinina sérica, insuficiencia renal terminal o muerte renal en el grupo de liraglutida (HR 0,78; IC 95%: 0,67-0,92; p=0,003)Disminución del FGe a los 36 meses fue 2% menor con liraglutida vs. placebo (1,02; IC 95%: 1,00-1,03; p=0,01)CAC a los 36 meses un 17% menor con liraglutida vs. placebo (0,83; IC 95%: 0,79-0,88; p<0,001) |
| Semaglutida SC59 | SUSTAIN-6 | Resultado renal secundario: reducción del evento renal combinado de macroalbuminuria persistente de nueva aparición, duplicación persistente de la creatinina sérica, insuficiencia renal terminal o muerte renal en el grupo semaglutida vs. placebo (HR 0,64; IC 95%: 0,46-0,88; p=0,005) |
| Dulaglutida63,92 | REWIND | Resultado renal secundario: macroalbuminuria de nueva aparición, disminución sostenida del FGe≥30% desde el inicio o tratamiento sustitutivo renal crónico en el grupo de dulaglutida vs. placebo (HR 0,85; IC 95%: 0,77-0,93, p=0,0004)Nueva macroalbuminuria (HR 0,77, IC 95%: 0,68-0,87; p<0,0001)Disminución sostenida del FGe≥30% (HR 0,89, IC 95%: 0,78-1,01; p=0,066)Análisis de sensibilidad: disminución sostenida de FGe≥40% (HR 0,70, IC 95%: 0,57-0,85) y≥50% (HR 0,56, IC 95%: 0,41-0,76)Cambio en el CAC (MMC 0,82, IC 95%: 0,78-0,86; p<0,0001) |
| Exenatida LAR60,94,95 | EXSCEL | Resultados renales secundarios preespecificados:Nueva macroalbuminuria: 2,2% vs. 2,5% en los grupos de exenatida y placebo, respectivamente (HR 0,87; IC 95%: 0,70-1,07). Cambio del CAC vs. placebo –25%No diferencias en el evento renal compuesto 1 (disminución del 40% del FGe, tratamiento sustitutivo renal o muerte renal) (HR 0,88, IC 95%: 0,74-1,05)No diferencias para el compuesto renal 2 (Disminución del 40% del FGe, tratamiento sustitutivo renal, muerte renal o macroalbuminuria) (HR 0,88; IC 95%: 0,76-1,01), aunque fue significativo tras ajustar (HR 0,85; IC 95%: 0,74-0,98)En pacientes con CAC basal>100mg/g diferencias en la caída del FGe vs. placebo (0,79 ml/min/1,73m2/año, IC 95%: 0,24-1,34) y CAC>200mg/g (1,32ml/min/1,73m2/año, IC 95%: 0,57-2,06), pero no en umbrales de CAC más bajos |
| Efpeglenatida64 | AMPLITUDE-O | Resultado compuesto renal secundario preespecificado: macroalbuminuria incidente, disminución sostenida del FGe≥40%, enfermedad renal terminal o necesidad de tratamiento sustitutivo renal (HR 0,68, IC 95%: 0,57-0,79, p<0,001)Evento de función renal (disminución sostenida del FGe≥40%, enfermedad renal terminal o necesidad de tratamiento sustitutivo renal o muerte) (HR 0,77, IC 95%: 0,57-1,02)CAC 21% menor (IC 95%: 14-28) y el FGe 0,9 ml/min/1,73m2 (IC 95%: 0,3-1,5) mayor con epfeglenatide vs. placebo |
| Lixisenatida57,93 | ELIXA | Cambio del CAC respecto al basal: 24% vs. 34%, p=0,004 (lixisenatide vs. placebo)Análisis exploratorio: cambio porcentual del CAC en orina vs. placebo: –1,69% (IC 95%: –11,69-8,30) en normoalbuminúricos –21,10% (IC 95%: –42,25-0,04; p=0,0502) en microalbuminúricos y –39,18% (IC 95%: –68,53 a –9,84; p=0,007) en macroalbuminúricosReducción del riesgo de macroalbuminuria de nueva aparición vs. placebo ajustado por la HbA1c basal (HR 0,808, IC 95%: 0.660-0.991; p=0,0404) o ajustado para la HbA1c inicial y en el ensayo (HR 0.815, IC 95%: 0.665-0.999; p=0,0491). No diferencias en la disminución del FGe, ni en el porcentaje de pacientes que doblaron la creatinina durante el seguimiento (1% en cada grupo) |
| Albiglutida61 | HARMONY Outcomes | Diferencia FGe –1,11 (IC 95%: –1,84 a –0,39) mes 8 y –0,43 (IC 95%: –1,26 a 0,41) en el mes 16 vs. placeboAfectación renal: HR 0,87 (IC 95%: 0,75-1,02) (IRA 70 vs. 80 casos) |
| Dulaglutida66 | AWARD-7 | Resultados renales secundarios: el FGe fue mayor a las 52 semanas con dulaglutida 1,5mg (MMC 34,0 ml/min/1,73m2) (p=0,005), así como con dulaglutida 0,75mg (MMC 33,8 ml/min/1,73m2) (p=0,009) vs. insulina glargina (MMC 31,3ml/min/1,73m2)Reducción del FGe en pacientes con macroalbuminuria: –5,5 ml/min/1,73m2 en el grupo de insulina glargina vs. –0,7 ml/min/1,73m2 y –0,5ml/min/1,73m2 en los grupos dulaglutida 0,75mg y 1,5mg, respectivamenteLa reducción del CAC en orina con dulaglutida no fue estadísticamente diferente a la de insulina glargina a las 52 semanas, pero hubo una reducción dosis-dependiente en pacientes con macroalbuminuria (14% insulina glargina, 23% dulaglutida 0,75mg y 43% dulaglutida 1,5mg) |
| Liraglutida67 | LIRA-RENAL | Resultados renales: la proporción estimada de la semana 26 al valor inicial para el FGe (MDRD) fue de 0,99 (–1%) para liraglutida y de 1,01 (+1%) en el grupo placebo (NS). La proporción estimada de la semana 26 al valor inicial para el CAC fue de 0,87 con liraglutida y 1,05 con placebo (NS) ratio estimada de tratamiento 0,83 (IC 95%: 0,62-1,10, p=0,19) |
CAC: cociente albúmina creatinina; FGe: filtrado glomerular estimado, IRA: insuficiencia renal aguda; MMC: media de mínimos cuadrados.
Los efectos sobre la evolución del FGe durante el seguimiento son variables entre los diferentes ensayos, con mínimas diferencias entre el grupo activo y placebo57,63,64, aunque un análisis exploratorio del estudio EXSCEL demostró una menor caída del FGe en pacientes con albuminurias superiores a 100mg/g y 200mg/g de creatinina95. Asimismo, en un análisis post-hoc de los estudios LEADER y SUSTAIN se observó, en aquellos con FGe<60ml/min/1,73m2, una menor caída del FGe96. La reducción de la albuminuria (o menor incremento) es el hallazgo más constante en estos estudios58,59,64,93, así como en un análisis post hoc de los ensayos SUSTAIN 1-7 con semaglutida SC97 y de aquellos con dulaglutida98.
En el metaanálisis de Sattar antes mencionado el objetivo renal compuesto de deterioro de la función renal, necesidad de tratamiento sustitutivo renal, muerte renal y desarrollo de macroalbuminuria se redujo en un 21% (HR 0,79, IC 95%: 0,73-0,87; p<0,0001), pero no fue significativo para los episodios de deterioro de la función renal (HR 0,86, IC 95%: 0,72-1,02, p=0,089), aunque también se redujeron significativamente tras excluir el estudio ELIXA87.
Los efectos renales de los arGLP1 en pacientes con ERC se han evaluado en otros estudios. El estudio «Liraglutida versus placebo como complemento de la terapia para reducir la glucosa en pacientes con diabetes tipo 2 e insuficiencia renal moderada» (LIRA-RENAL) no demostró un beneficio de liraglutida en la disminución del FGe, aunque la duración del estudio (26 semanas) podría haber sido insuficiente para mostrar un efecto. En este también se observó una reducción no significativa del 17% de la albuminuria67. El estudio AWARD-7 analizó la eficacia de dulaglutida en pacientes con DM2 y ERC moderada-severa (FGe medio 38ml/min/1,73m2). La disminución del FGe medio a las 52 semanas fue menor en los grupos de tratamiento con dosis altas (1,5mg) y bajas de dulaglutida (0,75mg) (ambos –0,7ml/min/1,73m2) vs. el grupo de insulina glargina (–3,3ml/min/1,73m2). Este beneficio fue mayor en los pacientes con macroalbuminuria66 (tabla 2).
Así pues, los arGLP-1 reducen la albuminuria en pacientes con ERD, pero sus efectos sobre la progresión de la enfermedad renal no son tan concluyentes. Sin embargo, la albuminuria es un potente predictor de la caída del FGe, por lo que estos fármacos podrían retrasar su progresión en la ERD al reducirla99. En un análisis de subgrupos del ensayo LEADER el efecto de liraglutida vs. placebo sobre la caída del FGe fue mejor entre los pacientes con macroalbuminuria o en aquellos con FGe entre 30-60ml/min/1,73m2100, y en el ensayo AWARD-7 el efecto de dulaglutida sobre los resultados clínicos renales y la disminución del FGe fue más pronunciado en los participantes con macroalbuminuria al inicio del estudio66. Asimismo, en un análisis post hoc del estudio LEADER aquellos que experimentaron una reducción del 30% de la albuminuria durante el seguimiento tuvieron menos episodios cardiovasculares y renales101, confirmando que la reducción de la albuminuria se asocia con una reducción de eventos cardiovasculares y renales99,102.
Finalmente, los beneficios renales de los arGLP-1 parecen aditivos a los de los iSGLT2, lo que es especialmente interesante en pacientes con ERD85,86,103.
Los beneficios cardiovasculares y renales de estos fármacos también se están demostrando en estudios de vida real104,105.
Las causas de esta nefroprotección con algunos arGLP-1 no están claras. El ajuste post hoc para HbA1C y otros factores de riesgo renal tradicionales no tuvo una influencia importante en el beneficio renal con liraglutida, semaglutida o dulaglutida en los CVOT, ni hubo diferencias en el control glucémico en el estudio AWARD-766. De hecho, los análisis de mediación realizados sugirieron que solo aproximadamente el 25% del beneficio sobre los resultados renales puede estar mediado por un mejor control glucémico y un 9-22% por los cambios sobre la presión arterial92,106, lo que sugiere el papel de mecanismos directos: reducción de la hiperfiltración, del estrés oxidativo y de la inflamación, efectos antifibróticos, mejora de la disfunción endotelial y/o posible reducción de niveles de angiotensina ii52,54,107–109. En estudios experimentales de ERD el tratamiento con arGLP-1 se ha asociado con mejoras histológicas (reducción de la hipertrofia glomerular, de la expansión mesangial, del engrosamiento de la membrana basal glomerular y del daño tubulointersticial)110,111.
De hecho, las guías KDIGO para el manejo de pacientes con diabetes y ERC posicionan a los arGLP-1 como segunda línea de tratamiento y los indican para pacientes con DM2 y ERC que no han alcanzado los objetivos glucémicos individualizados a pesar del uso de metformina e iSGLT2, o en los que no pueden utilizar estos medicamentos porque liraglutida, semaglutida y dulaglutida (no se habían publicado los resultados con epfeglenatida) han demostrado beneficios cardiovasculares, especialmente entre pacientes con enfermedad cardiovascular establecida, asociado a beneficios renales favorables con una reducción sustancial de la albuminuria y probable preservación del FGe112, así como otras guias en pacientes con DM2 y riesgo cardiovascular alto/muy alto, como son los pacientes con ERD19,113. Además, los arGLP-1 son agentes antihiperglucemiantes más potentes comparados con los iSGLT2s en la población con ERD, y algunos también confieren un mayor potencial de pérdida de peso, como semaglutida. Finalmente, algunos estudios de casos clínicos y series cortas sugieren sus beneficios también en pacientes con ERC estadio 5D, aunque debe recordarse que esta indicación no está incluida en la ficha técnica de los arGLP-1114,115.
Actualmente está en marcha el estudio Effect of semaglutide versus placebo on the progression of renal impairment in subjects with type 2 diabetes and chronic kidney disease (FLOW), un ensayo clínico de fase 3 que incluye más de 3.000 pacientes con DM tipo 2 y ERC moderada-severa (FGe 25-75ml/min/1.73m2 y CAC 300-5.000mg/g) (NCT03819153). El objetivo principal es un episodio compuesto renal definido por una disminución del FGe≥50%, insuficiencia renal terminal y muerte de causa renal o muerte de causa cardiovascular, y cuya finalización se prevé en 2024. Este ensayo, el primero en incluir resultados de enfermedad renal como objetivo primario con esta familia, definirá la eficacia clínica y la seguridad renal de un arGLP-1 y, por lo tanto, informará de las futuras recomendaciones de tratamiento basadas en evidencia para la ERD.
Semaglutida oralLa semaglutida oral es el primer arGLP-1 oral. Semaglutida oral está coformulada con sodio N-(8-[2 hidroxibenzoil]amino) caprilato (salcaprozato sódico o SNAC, por sus siglas en inglés) que permite la absorción de semaglutida a través de la mucosa gástrica. Semaglutida oral ha sido aprobada y recientemente comercializada en España tras las evidencias aportadas por el programa de ensayos clínicos de fase 3 Peptide InnOvatioN for Early diabEtes tReatment (PIONEER). Este programa evaluó la eficacia y seguridad de semaglutida oral en pacientes con DM2 desde la monoterapia hasta la adición de insulina, incluyendo resultados de reducción de la HbA1c y del peso corporal, además de otros criterios de valoración relevantes de eficacia y seguridad, comparado tanto con placebo como con otros fármacos antihiperglucemiantes comunes. A dosis de 7 y 14mg/día semaglutida oral redujo la HbA1c y el peso corporal en todo el espectro de la DM2, así como otros criterios de valoración, como la glucemia en ayunas. La semaglutida oral fue superior a placebo y otros fármacos antihiperglucemiantes, como los iDPP4 (sitagliptina), los iSGLT2 (empagliflozina) u otros arGLP-1 (liraglutida) para reducir la HbA1c o el peso116. Semaglutida oral fue bien tolerada, con un perfil de seguridad similar al de otros arGLP-1. Los efectos secundarios reportados con mayor frecuencia fueron los gastrointestinales de intensidad leve-moderada y transitorios en el tiempo. Su seguridad cardiovascular en pacientes con enfermedad cardiovascular o alto riesgo cardiovascular quedó demostrada en el estudio PIONEER-6 antes mencionado62. En el estudio PIONEER 5, en pacientes con ERC estadio 3, se evaluó la eficacia y seguridad de la dosis de 14mg, resultando superior a placebo en cuanto a reducción de la HbA1c (–0,8% vs. placebo) y del peso corporal (–2.5kg vs. placebo), con mayor porcentaje de pacientes que consiguen niveles de HbA1c<7,0% (57,8% vs. 22,6% en placebo) y pérdidas de peso≥5% (35,7% vs. 9,7% en placebo). Los efectos adversos más frecuentes consistieron en náuseas leves-moderadas que disminuyeron con el tiempo (19% vs. 8% en el placebo) y con bajo riesgo de hipoglucemia sintomática o confirmada (5,5% vs. 1,9% con placebo). No hubo diferencias en el FGe entre ambos grupos, pero hubo una reducción de la albuminuria con semaglutida oral vs. un aumento en el grupo placebo117.
Los resultados del programa PIONEER demuestran que la semaglutida oral es eficaz, segura y bien tolerada para el control glucémico de pacientes con DM2, incluso en aquellos con ERD, con los beneficios propios de la familia. La disponibilidad de semaglutida oral puede ayudar a ampliar las opciones de tratamiento y facilitar la adopción de un tratamiento más precoz con arGLP-1 en el manejo de la DM2. Actualmente está en marcha el estudio A heart disease study of semaglutide in patients with type 2 diabetes (SOUL, NCT03914326) que evalua el beneficio cardiovascular de la semaglutida oral.
Conclusiones- -
La prevalencia de la ERC es elevada en la DM2 y la ERD y se asocia con un mayor riesgo cardiovascular, de mortalidad y de progresión a ERC terminal, lo que requiere un tratamiento precoz e intensivo para minimizar estas complicaciones.
- -
Los arGLP-1 han demostrado un beneficio CV en pacientes con DM2 que parece extenderse a pacientes con función renal reducida.
- -
Algunos arGLP-1 reducen la progresión a albuminuria abierta, disminuyen la albuminuria durante el seguimiento y podrían retrasar la progresión de la disfunción renal en ERD, especialmente en el subgrupo con ERC establecida.
- -
La semaglutida oral es eficaz, segura y bien tolerada en pacientes con DM2, incluso en aquellos con ERD, con los beneficios propios de esta familia de fármacos, lo que puede facilitar la introducción más precoz de un arGLP-1 en el manejo de la DM2.
Aleix Cases declara haber recibido una beca, honorarios por consultoría y ponencias de Vifor Pharma, honorarios por charlas y consultoría de Astellas, Astra Zeneca, Bayer y Novo Nordisk; honorarios por consultoría de Boehringer Ingelheim, GSK y Otsuka y honorarios por charlas de Amgen y Sanofi (México), pero no ha percibido financiación en relación con la redacción de este artículo.