A pesar de los tratamientos actuales, que incluyen los inhibidores del sistema renina angiotensina y los inhibidores SGLT2, el riesgo de progresión de la enfermedad renal en los sujetos con diabetes y enfermedad renal crónica (ERC) continúa inaceptablemente alto. La patogenia de la ERC en el paciente con diabetes es compleja e incluiría factores hemodinámicos, metabólicos y de inflamación y fibrosis. La finerenona es un antagonista no esteroideo altamente selectivo del receptor mineralocorticoide que, a diferencia de los tratamientos actuales, podría disminuir directamente la inflamación y la fibrosis, aportando un valor añadido al abordaje de estos pacientes. De hecho, la finerenona disminuye la albuminuria y enlentece la progresión de la ERC en personas con diabetes. La presente revisión aborda el mecanismo de acción de la finerenona, los resultados de ensayos clínicos recientes y la integración en práctica clínica de la nefroprotección y cardioprotección de la finerenona en el abordaje terapéutico integral del paciente diabético con ERC.
Despite current treatments, that include renin angiotensin system blockers and SGLT2 inhibitors, the risk of renal disease progression among patients with diabetes and chronic kidney disease (CKD) remains unacceptably high. The pathogenesis of CKD in patients with diabetes is complex and includes hemodynamic and metabolic factors, as well as inflammation and fibrosis. Finerenone is a nonsteroidal highly selective mineralocorticoid antagonist that, in contrast to current therapies, may directly reduce inflammation and fibrosis, supporting an added value in the management of these patients. In fact, finerenone decreased albuminuria and slowed CKD progression in persons with diabetes. We now review the mechanisms of action of finerenone, the results of recent clinical trials and a practical approach to integrate the kidney and cardiovascular protection afforded by finerenone in the routine care of patients with diabetes and CKD.
Se calcula que, en el año 2021, 537 millones de sujetos entre 20 y 79 años tenían diabetes mellitus en todo el mundo (uno de cada 10, aproximadamente). Además, la diabetes fue responsable de 6,7 millones de muertes y se asoció con unos gastos sanitarios muy elevados, principalmente relacionados con las complicaciones asociadas a la enfermedad. Sin embargo, tanto por el envejecimiento de la población, como por los hábitos de vida (sedentarismo y sobrepeso/obesidad), se estima que estas cifras aumentarán hasta los 783 millones de personas en 2045.1 Por otra parte, 850 millones de personas tienen enfermedad renal crónica (ERC), en España uno de cada 6 adultos, y se estima que antes de fin de siglo uno de cada 4 españoles tendrá ERC y se convertirá en la segunda causa de muerte tras el Alzhemier2,3. Aproximadamente 2 de cada 5 pacientes con diabetes tienen ERC, y cerca del 40% de los casos de ERC terminal son atribuibles a la diabetes4.
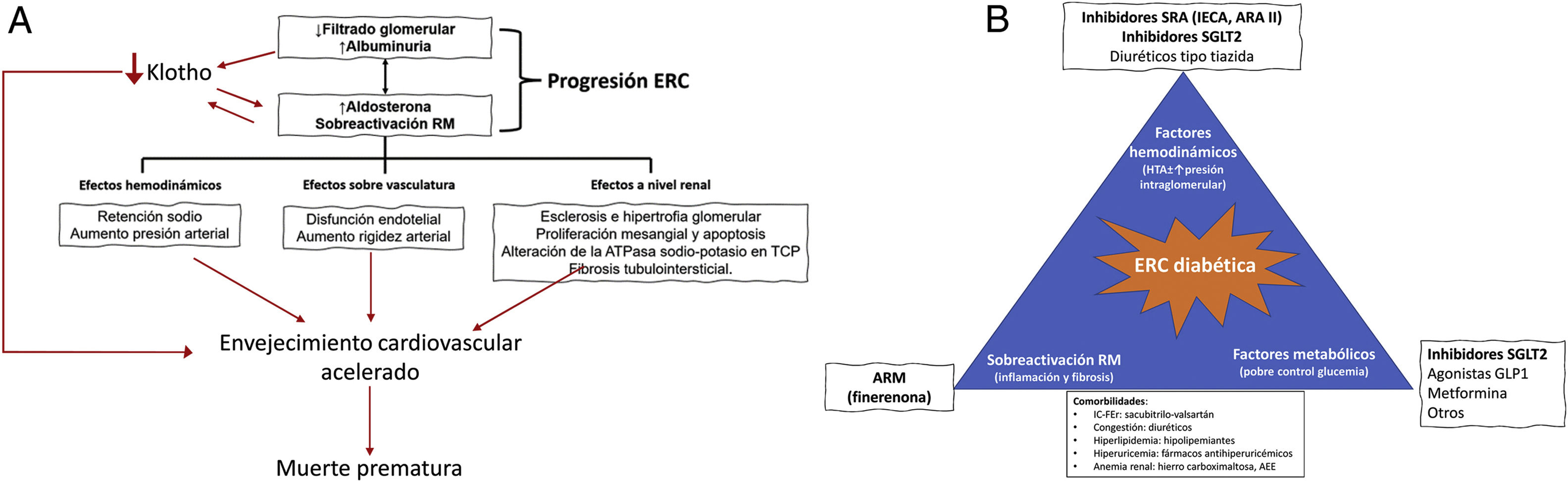
Aunque tanto la diabetes como la ERC disminuyen por sí solas la expectativa de vida, cuando ambas condiciones concurren esta reducción es mucho mayor. Así, en pacientes con diabetes y ERC temprana la expectativa de vida disminuiría en 16 años5. La albuminuria persistente aislada basta para diagnosticar ERC, ya que aumenta el riesgo de presentar complicaciones renales, cardiovasculares y muerte6. De hecho, la albuminuria hace perder una función clave de los riñones, la producción de la proteína antienvejecimiento Klotho, mucho antes de que disminuya el filtrado glomerular. La pérdida de Klotho causa hiperaldosteronismo y envejecimiento acelerado caracterizado por hipertrofia, fibrosis cardiaca y calcificación vascular7,8.
Varios factores, incluyendo la hiperglucemia, la hipertensión arterial, las alteraciones del metabolismo lipídico, la activación del sistema renina angiotensina (SRA) y la inflamación se han relacionado con el desarrollo de las complicaciones microvasculares de los pacientes con diabetes3. Asimismo, tanto la aldosterona como la sobreactivación del receptor mineralocorticoide (RM) participan en el desarrollo y la progresión de la ERC. La finerenona, un nuevo antagonista no esteroideo del RM, no solo disminuye la proteinuria en personas con diabetes tipo 2 (DM2) y ERC, sino también parece que enlentecería la progresión de la ERC9,10.
En la presente revisión se analizan los efectos de la finerenona en el abordaje del paciente con DM2 y ERC, así como aspectos prácticos para el manejo de este fármaco y de estos pacientes. Para ello se ha realizado una revisión narrativa mediante una búsqueda en PubMed (MEDLINE) hasta abril de 2022, empleando los términos MeSH [diabetes]+ [chronic kidney disease]+[Mineralocorticoid Receptor Antagonists]+[finerenone]+[albuminuria] sin restricciones de idioma.
Riesgo residual en el paciente con enfermedad renal diabética a pesar de los tratamientos tradicionalesDesde hace décadas, para enlentecer la progresión de la ERC en los sujetos con diabetes se han empleado los inhibidores de la enzima convertidora de angiotensina (IECA) o los antagonistas de los receptores de angiotensina ii (ARA II)4,11–13. Sin embargo, a pesar del beneficio mostrado en los sujetos con nefropatía diabética en cuanto a la progresión de la enfermedad renal, tanto en el estudio RENAAL (losartán), como en el IDNT (irbesartán), el 43,5% y el 32,6% de los pacientes tratados con ARA II, respectivamente, desarrollaron el desenlace primario del estudio (doblar la concentración basal de creatinina, enfermedad renal terminal o muerte)12,13.
Los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) también reducen el riesgo de desarrollar ERC y enlentecen su progresión. No obstante, tanto en el estudio CREDENCE (canagliflozina) como en el DAPA-CKD (dapagliflozina), aproximadamente el 10% de los pacientes con ERC tratados con los iSGLT2 y bloqueo del SRA presentaron progresión de la ERC14,15. En consecuencia, aunque es evidente el beneficio de estos tratamientos en el paciente diabético con ERC, todavía existe un riesgo residual sustancial de progresión de la enfermedad renal16.
En los sujetos tratados con IECA o ARA II existe un escape de la aldosterona, que se asocia con una mayor proteinuria y con un empeoramiento de la función renal17. Aunque los antialdosterónicos clásicos (espironolactona y eplerenona), añadidos a los IECA o ARA II, reducen la proteinuria, no se ha demostrado un beneficio sobre la progresión de la ERC4,18. En cambio, la finerenona no solo reduce significativamente la proteinuria en sujetos con DM2 y ERC, sino que también enlentece la progresión de la ERC9,10. La finerenona está indicada para el tratamiento de la ERC (estadios 3 y 4 con albuminuria) asociada a DM219. En la actualidad solo los inhibidores del SRA (IECA y ARA II), los iSGLT2 (canagliflozina y dapagliflozina) y la finerenona están aprobados para la protección renal en sujetos con ERC y diabetes4.
De hecho, las evidencias provenientes de los diferentes ensayos clínicos han hecho que las guías KDIGO sobre el tratamiento de la ERC en la diabetes se hayan actualizado en un breve periodo de tiempo. En 2020 se actualizaron para incluir los iSGLT2 y en 2022 se volverán a actualizar, incluyendo las novedades con los iSGLT2, pero también por la aparición de las evidencias de los ensayos con finerenona20–22. Además, en la última actualización de las guías de la Asociación Americana de Diabetes (ADA) de 2022, se recomienda el empleo de la finerenona para enlentecer la progresión de la ERC y reducir los eventos CV en los pacientes diabéticos con ERC con un riesgo aumentado de eventos CV o de progresión de la ERC o que no puedan usar iSGLT2, con el máximo nivel de evidencia (clase A)23.
El receptor mineralocorticoide en la etiopatogenia de la enfermedad renal crónicaLa comprensión del papel del SRA en la etiopatogenia de la ERC ha cambiado a lo largo del tiempo. Así, de acuerdo con el viejo paradigma, ante la caída de presión arterial o de volumen el SRA se activaba, aumentando la liberación de renina por el riñón, lo que incrementaba los niveles de angiotensina ii, que tiene un papel directo sobre los vasos sanguíneos, estimulando la vasoconstricción, y también sobre la liberación de aldosterona en la corteza suprarrenal. La aldosterona actúa en el riñón, promoviendo la retención de sodio y del volumen sanguíneo y, concomitantemente, la excreción de potasio en el túbulo contorneado distal. De esta forma, la aldosterona desempeñaba un papel central en mantener tanto la homeostasis del volumen extracelular como para el control de la presión arterial. La hiperactivación del SRAA se asociaba a mayor riesgo de hipertensión arterial y de ERC, entre otros18,24–30.
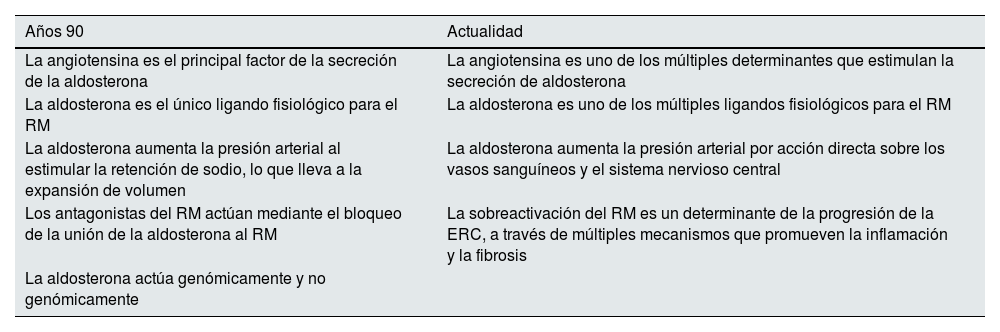
Sin embargo, ahora se reconoce la mayor complejidad del SRAA. Así, la sobreactivación del RM desempeña un papel crucial en la génesis de la ERC (tabla 1). Antes se pensaba que la angiotensina ii era el principal impulsor de la secreción de aldosterona, y que la aldosterona era el único ligando fisiológico para el RM. Sin embargo, el RM también se activa por la unión de otros ligandos (aldosterona, cortisol y progesterona), por la pérdida de la homeostasis (glucemia elevada o exceso de sodio proveniente de la dieta) o por proteínas específicas18,24,25.
Cambio de paradigma del papel de la aldosterona y del receptor mineralocorticoide en la etiopatogenia de la enfermedad renal crónica
| Años 90 | Actualidad |
|---|---|
| La angiotensina es el principal factor de la secreción de la aldosterona | La angiotensina es uno de los múltiples determinantes que estimulan la secreción de aldosterona |
| La aldosterona es el único ligando fisiológico para el RM | La aldosterona es uno de los múltiples ligandos fisiológicos para el RM |
| La aldosterona aumenta la presión arterial al estimular la retención de sodio, lo que lleva a la expansión de volumen | La aldosterona aumenta la presión arterial por acción directa sobre los vasos sanguíneos y el sistema nervioso central |
| Los antagonistas del RM actúan mediante el bloqueo de la unión de la aldosterona al RM | La sobreactivación del RM es un determinante de la progresión de la ERC, a través de múltiples mecanismos que promueven la inflamación y la fibrosis |
| La aldosterona actúa genómicamente y no genómicamente |
Por otra parte, clásicamente se ha pensado que el mecanismo a través del cual la aldosterona aumentaba la presión arterial era por estimular la retención de sodio, lo que llevaba a la expansión de volumen. Sin embargo, este no es el único mecanismo, ya que también actúa directamente sobre los vasos y el sistema nervioso central. Asimismo, la sobreactivación del RM disminuye la producción tubular de la proteína antienvejecimiento Klotho y aumenta la inflamación y la fibrosis, promoviendo el daño renal y cardiovascular8. De esta forma, la sobreactivación del RM favorece la glomeruloesclerosis e hipertrofia glomerular, pérdida de podocitos e infiltración por macrófagos4,18. En el túbulo contorneado proximal aumenta la expresión de la ATPasa sodio-potasio, el principal consumidor de energía en estas células4,18. Además, la inflamación y el estrés oxidativo promueven la fibrosis tubulointersticial. La lesión podocitaria promueve la albuminuria y la proteinuria, lo que agrava la lesión tubular proximal y la pérdida de Klotho, generando un circuito que tiende a autoperpetuarse, favoreciendo la progresión de la ERC, incluso después de desaparecer el factor desencadenante (en el caso de la diabetes, la hiperglucemia)31. La pérdida de podocitos y la consiguiente glomeruloesclerosis hace disminuir el número de glomérulos, reclutando factores hemodinámicos, como el aumento de la presión intraglomerular, que conducen a la hiperfiltración de los glomérulos restantes, arrastrando más podocitos, aumentando así la albuminuria y sobrecargando más los túbulos renales y agravando la inflamación y fibrosis. De esta forma se entiende el papel central que ejerce la sobreactivación de los RM sobre la génesis y desarrollo de la ERC, y que es mucho más complejo de lo que se pensaba en un principio (fig. 1A)16,18.
Aldosterona y receptor mineralocorticoide en la etiopatogenia de la enfermedad renal crónica (A) y protección integral del paciente con nefropatía diabética (B).
AEE: agentes estimulantes de la eritropoyesis; ARA II: antagonistas de los receptores de angiotensina ii; ARM: antagonista receptor mineralocorticoide; ERC: enfermedad renal crónica; GLP1R: receptor del péptido similar al glucagón tipo 1; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IECA: inhibidores de la enzima convertidora de angiotensina; RM: receptor mineralocorticoide; SGLT2: cotransportador sodio-glucosa tipo 2; SRA: sistema renina angiotensina; TCP: túbulo contorneado proximal.
Fuente: Fernández-Fernández et al.7, Barrera-Chimal et al.16, Erráez et al.18, Epstein24, Epstein25, Alicic et al.26, Buonafine et al.27, Bauersachs et al.28, DuPont et al.29, Alicic et al.30, Ruiz Ortega et al.31, Brown et al.32 y Mima33.
En definitiva, la patogenia de la ERC en el paciente con DM2 implica múltiples mecanismos convergentes, que incluyen el mal control metabólico como desencadenante y potencial acelerador del proceso, pero también la inflamación y la fibrosis mediada por el RM y la hemodinámica anormal que, una vez establecidos, se autoperpetúan, incluso tras la corrección del factor desencadenante (fig. 1B)16,18,24–33.
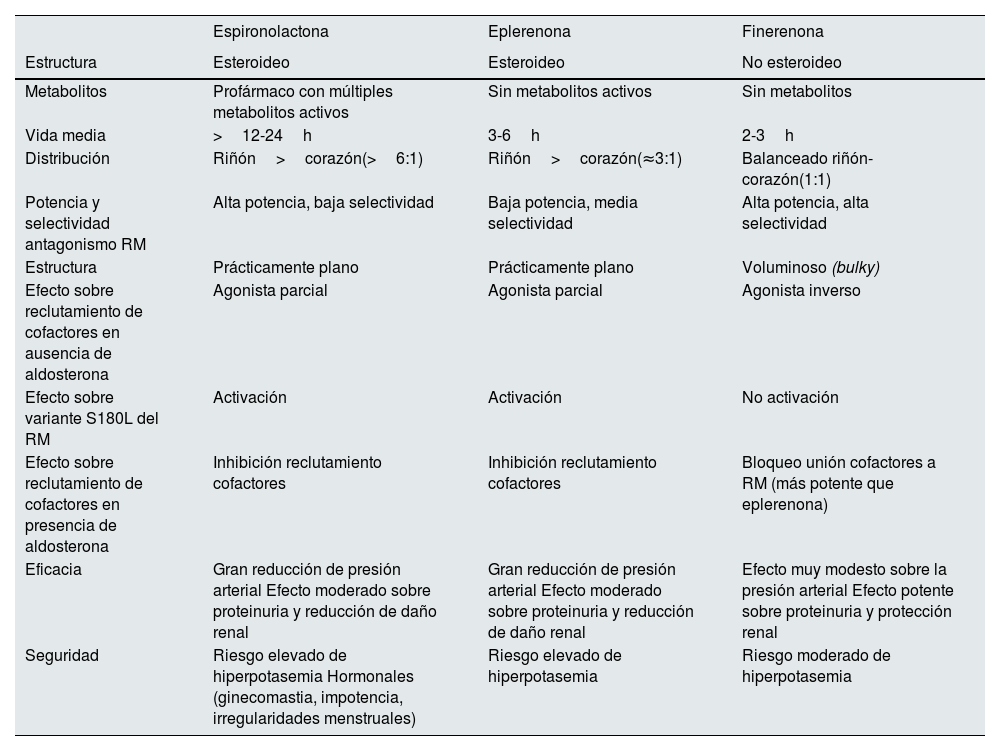
Diferencias entre los distintos antagonistas del receptor mineralocorticoideLa espironolactona, la eplerenona y la finerenona son antagonistas del RM. Sin embargo, existen diferencias relevantes entre la finerenona y los otros 2, que tienen un impacto fundamental en la eficacia y seguridad de los mismos (tabla 2).
Características de los antagonistas del receptor mineralocorticoide
| Espironolactona | Eplerenona | Finerenona | |
|---|---|---|---|
| Estructura | Esteroideo | Esteroideo | No esteroideo |
| Metabolitos | Profármaco con múltiples metabolitos activos | Sin metabolitos activos | Sin metabolitos |
| Vida media | >12-24h | 3-6h | 2-3h |
| Distribución | Riñón>corazón(>6:1) | Riñón>corazón(≈3:1) | Balanceado riñón-corazón(1:1) |
| Potencia y selectividad antagonismo RM | Alta potencia, baja selectividad | Baja potencia, media selectividad | Alta potencia, alta selectividad |
| Estructura | Prácticamente plano | Prácticamente plano | Voluminoso (bulky) |
| Efecto sobre reclutamiento de cofactores en ausencia de aldosterona | Agonista parcial | Agonista parcial | Agonista inverso |
| Efecto sobre variante S180L del RM | Activación | Activación | No activación |
| Efecto sobre reclutamiento de cofactores en presencia de aldosterona | Inhibición reclutamiento cofactores | Inhibición reclutamiento cofactores | Bloqueo unión cofactores a RM (más potente que eplerenona) |
| Eficacia | Gran reducción de presión arterial Efecto moderado sobre proteinuria y reducción de daño renal | Gran reducción de presión arterial Efecto moderado sobre proteinuria y reducción de daño renal | Efecto muy modesto sobre la presión arterial Efecto potente sobre proteinuria y protección renal |
| Seguridad | Riesgo elevado de hiperpotasemia Hormonales (ginecomastia, impotencia, irregularidades menstruales) | Riesgo elevado de hiperpotasemia | Riesgo moderado de hiperpotasemia |
La finerenona es un antagonista no esteroideo altamente selectivo del RM. Su unión al RM da lugar a un complejo receptor-ligando específico que bloquea el reclutamiento de coactivadores transcripcionales implicados en la expresión de mediadores proinflamatorios y profibróticos4,19,24. Esto se debe a que la finerenona tiene una naturaleza voluminosa (bulky) que le permite unirse al RM de una manera que ocupa todo el receptor impidiendo cualquier tipo de activación y evita que el RM se convierta o adopte una conformación agonista. En cambio, la espironolactona es un antagonista esteroideo, de estructura prácticamente plana, a modo de tarjeta de crédito, con alta potencia y baja selectividad por el RM, mientras que la eplerenona es un antagonista esteroideo con baja potencia y selectividad media por el RM. Además, en ausencia de aldosterona tanto la espironolactona como la eplerenona actúan como agonistas parciales sobre el reclutamiento de cofactores que pueden favorecer la transcripción de genes proinflamatorios y la expresión de genes profibróticos. De hecho, ambas activan la variante S810L del RM, causante de HTA grave temprana. Sin embargo, la finerenona es un agonista inverso (inhibe la unión del cofactor en ausencia de aldosterona) que por su conformación voluminosa inhibe o disminuye el reclutamiento de cofactores, por lo que es esperable una reducción de la inflamación y la fibrosis debido al antagonismo del RM. Los ARM también difieren en su distribución, como se ha mostrado en modelos animales: para la espironolactona y la eplerenona predomina la distribución en el riñón sobre el corazón, lo que podría aumentar el riesgo de hiperpotasemia, mientras que la distribución de la finerenona se encuentra balanceada (tabla 2)4,19,24,25,34–39.
Estas diferencias tienen traducción sobre la eficacia y seguridad de estos fármacos. Así, la espironolactona y la eplerenona reducen bastante la presión arterial y tienen un impacto moderado sobre la inflamación, la fibrosis y la proteinuria, lo que limita el efecto beneficioso sobre el daño renal4,19,34–37. La finerenona, sin embargo, tiene un efecto muy modesto sobre la presión arterial. Como se ha demostrado en modelos animales, la finerenona proporciona protección renal a través de múltiples mecanismos al actuar sobre el RM, al bloquear la transcripción de genes profibróticos y proinflamatorios en varios tipos de células a nivel renal, como los podocitos, las células mesangiales, los macrófagos y los fibroblastos, así como las células tubulares, lo que se va a traducir en un menor grado de lesiones, inflamación y fibrosis, y en último término, en la menor albuminuria y más lenta progresión de la ERC observadas en los ensayos clínicos40.
Además, el riesgo de hiperpotasemia es claramente superior con la espironolactona y la eplerenona que con la finerenona (tabla 2)4,19,34–37.
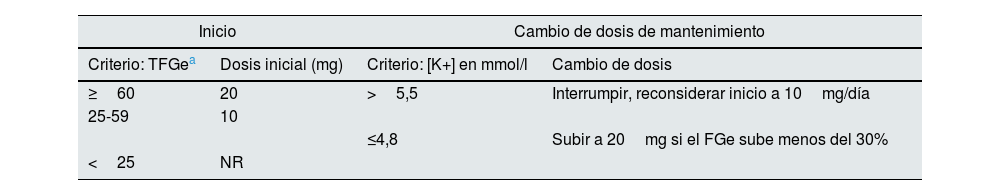
Finerenona en el tratamiento de la enfermedad renal diabéticaLa finerenona es el único ARM aprobado para tratar la enfermedad renal diabética. En concreto, está indicado para tratar adultos con ERC categoría G3 o G4 (filtrado glomerular 15-60ml/min/1,73m2) con albuminuria A2 o A3 (cociente albúmina: creatinina en orina>30mg/g) asociada a DM222. Aunque la finerenona, una vez iniciada, se puede mantener hasta que el filtrado glomerular cae por debajo de 15ml/min/1,73m2, no se recomienda iniciarla si el filtrado glomerular es<25ml/min/1,73m2 por falta de datos clínicos. El efecto de la finerenona es dosis dependiente, se absorbe (tiempo hasta la concentración máxima de 0,5-1,0h) y elimina (vida media terminal ≈2-3h) rápidamente. La dosis objetivo recomendada de finerenona es de 20mg una vez al día, que es la dosis máxima recomendada. En la tabla 3 se indica la dosis de inicio y cómo ajustar la dosis durante el seguimiento. El potasio sérico y el filtrado glomerular se deben medir basalmente y a las 4 semanas tras el inicio, reinicio o aumento de dosis de finerenona. No es necesario ajustar la dosis en función de la edad, el peso corporal, o la presencia de insuficiencia hepática leve o moderada; además, otra ventaja de la finerenona es que requiere una sola toma al día. En cambio, no se recomienda su uso en casos de insuficiencia hepática grave, por falta de datos clínicos. La finerenona se metaboliza vía CYP3A4. No se debe emplear de manera concomitante con inductores o inhibidores potentes del CYP3A4. Por el contrario, sí se puede tomar con inhibidores moderados o débiles del CYP3A4 y con suplementos de potasio, aunque se debe monitorizar más estrictamente la función renal y el potasio en estos pacientes19,37.
Finerenona. Dosis de inicio y ajuste de dosis durante el seguimiento
| Inicio | Cambio de dosis de mantenimiento | ||
|---|---|---|---|
| Criterio: TFGea | Dosis inicial (mg) | Criterio: [K+] en mmol/l | Cambio de dosis |
| ≥60 | 20 | >5,5 | Interrumpir, reconsiderar inicio a 10mg/día |
| 25-59 | 10 | ||
| ≤4,8 | Subir a 20mg si el FGe sube menos del 30% | ||
| <25 | NR | ||
TFGe: tasa de filtrado glomerular estimada; NR: no recomendado; K+: potasio.
Varios estudios han demostrado que la finerenona reduce eficazmente la albuminuria en pacientes con ERC. Así, en el ensayo clínico de fase 2 Mineralocorticoid Receptor Antagonist Tolerability Study (ARTS)41, la finerenona en dosis de 2,5 a 10mg/día redujo la albuminuria en pacientes con ERC, con una menor incidencia de hiperpotasemia que la espironolactona en pacientes con insuficiencia cardiaca con fracción de eyección reducida y ERC leve a moderada. En el estudio ARTS-Diabetic Nephropathy (ARTS-DN),42 cuyo objetivo primario fue evaluar la seguridad y eficacia de 7,5, 10, 15 y 20mg orales al día de finerenona, durante 90 días, en pacientes con DM2 y albuminuria>30mg/g en tratamiento con IECA o ARA II, la finerenona redujo significativamente la albuminuria en comparación con el placebo. Pero sin duda, los ensayos clínicos Finerenone in Reducing Kidney Failure and Disease Progression in Diabetic Kidney Disease (FIDELIO-DKD)9 y Finerenone in Reducing Cardiovascular Mortality and Morbidity in Diabetic Kidney Disease (FIGARO-DKD)10 han sido los estudios pivotales que más evidencias han aportado acerca de los beneficios de la finerenona sobre la protección renal.
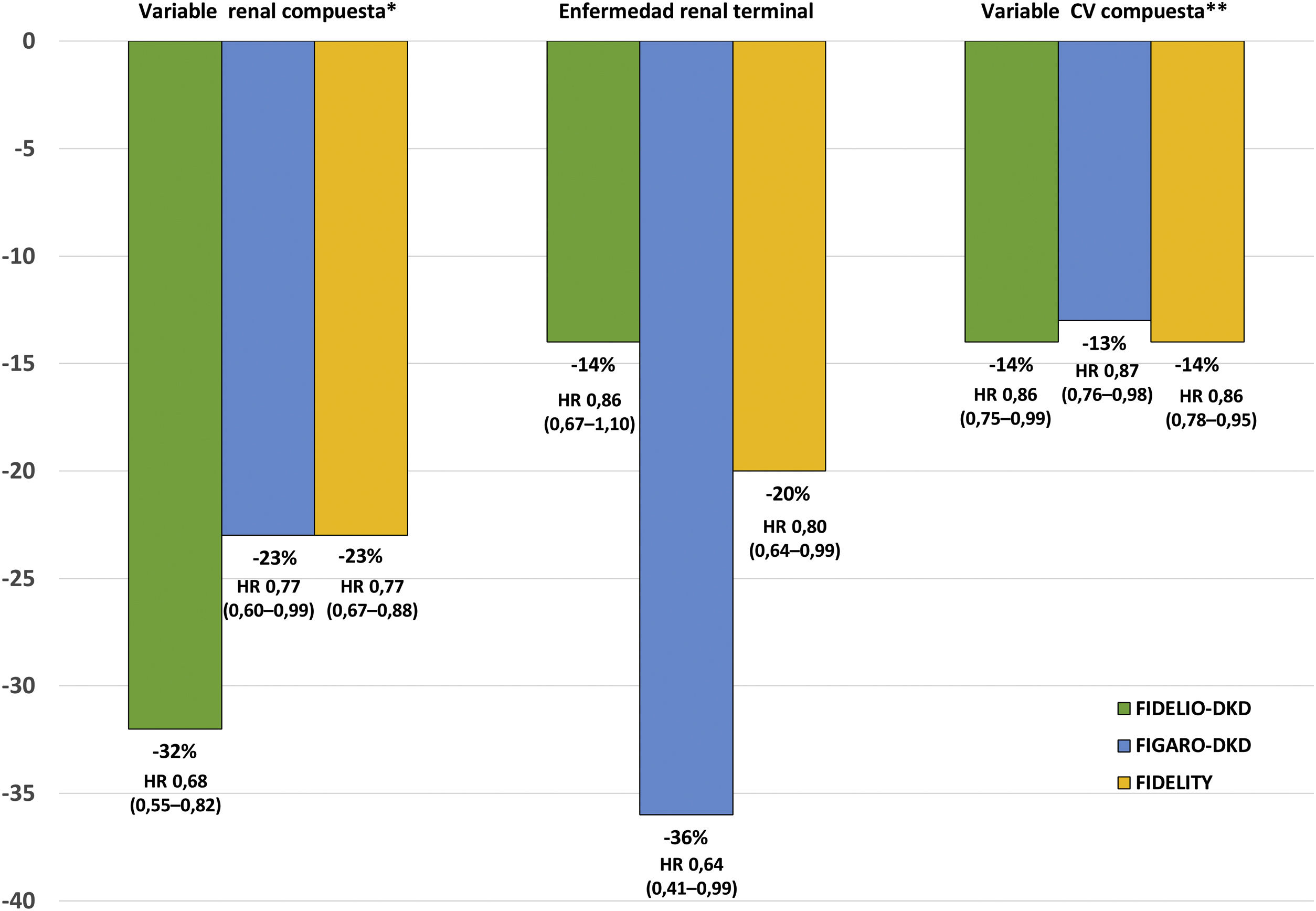
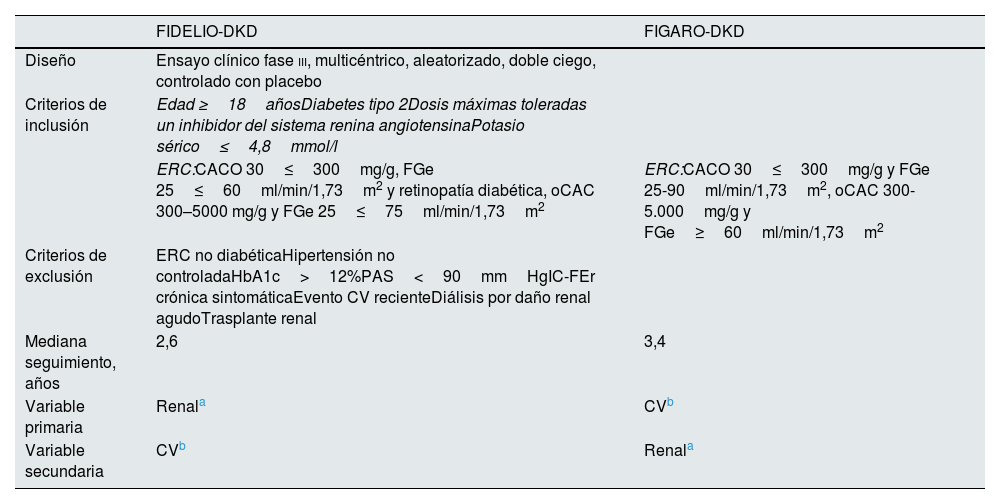
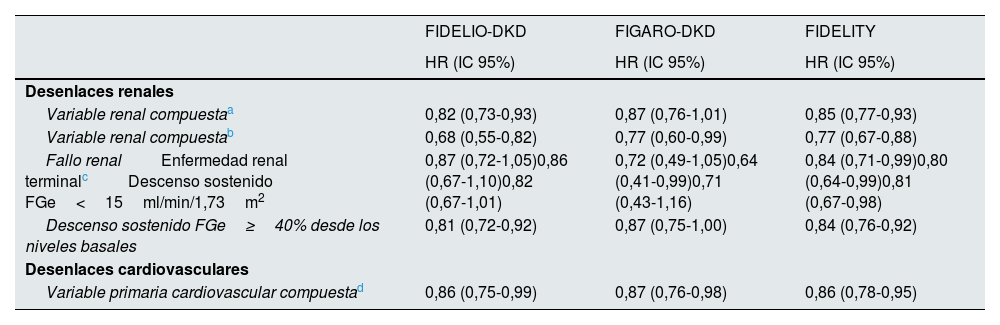
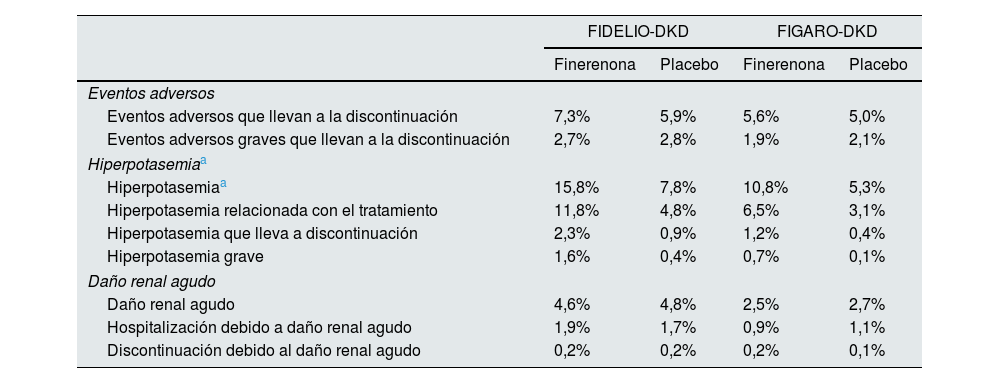
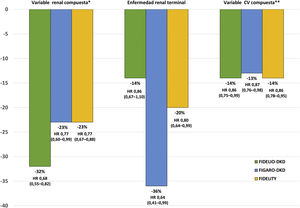
El estudio FIDELIO-DKD9 aleatorizó a finerenona o placebo a unos 5.700 pacientes con DM2 y ERC, definida como un cociente albúmina creatinina 30≤300mg/g, filtrado glomerular estimado 25≤60ml/min/1,73m2 y retinopatía diabética, o como cociente albúmina creatinina 300-5.000mg/g y filtrado glomerular estimado 25≤75ml/min/1,73m2, en tratamiento con dosis máximas toleradas un IECA o ARA ii y un potasio sérico≤4,8mmol/l (tabla 4). Tras un seguimiento medio de 2,6 años, en comparación con placebo, el tratamiento con finerenona se asoció con una reducción significativa del 18% del desenlace primario compuesto renal y del 19% en el descenso sostenido del filtrado glomerular≥40% desde los niveles basales (tabla 5 y fig. 2). Además, la finerenona redujo un 31% la albuminuria a los 4 meses, en comparación con placebo, que se mantuvo a lo largo del seguimiento. Es decir, la finerenona enlenteció la progresión de la ERC en los pacientes con DM2 y ERC. El riesgo de efectos adversos graves que llevaron a la discontinuación, así como el daño renal agudo, fueron similares en ambos grupos. En cambio, la incidencia de hiperpotasemia grave fue mayor en el grupo de finerenona (1,6% vs. 0,4%), pero hubo pocos casos de hiperpotasemia que llevaron a la discontinuación (2,3% vs. 0,9%) y no hubo casos de muerte por hiperpotasemia (tabla 6). Los efectos de la finerenona sobre la presión arterial sistólica fueron muy modestos (–2,1mmHg al año de tratamiento, frente a –0,9mmHg en el grupo placebo).
Características generales de los estudios FIDELIO-DKD y FIGARO-DKD
| FIDELIO-DKD | FIGARO-DKD | |
|---|---|---|
| Diseño | Ensayo clínico fase iii, multicéntrico, aleatorizado, doble ciego, controlado con placebo | |
| Criterios de inclusión | Edad ≥18añosDiabetes tipo 2Dosis máximas toleradas un inhibidor del sistema renina angiotensinaPotasio sérico≤4,8mmol/l | |
| ERC:CACO 30≤300mg/g, FGe 25≤60ml/min/1,73m2 y retinopatía diabética, oCAC 300–5000 mg/g y FGe 25≤75ml/min/1,73m2 | ERC:CACO 30≤300mg/g y FGe 25-90ml/min/1,73m2, oCAC 300-5.000mg/g y FGe≥60ml/min/1,73m2 | |
| Criterios de exclusión | ERC no diabéticaHipertensión no controladaHbA1c>12%PAS<90mmHgIC-FEr crónica sintomáticaEvento CV recienteDiálisis por daño renal agudoTrasplante renal | |
| Mediana seguimiento, años | 2,6 | 3,4 |
| Variable primaria | Renala | CVb |
| Variable secundaria | CVb | Renala |
| Características clínicas y tratamientos basales | ||
|---|---|---|
| Edad, años | 65,6±9,1 | 64,1±9,8 |
| Sexo masculino (%) | 70,2 | 69,4 |
| HbA1c, % | 7,7±1,3 | 7,7±1,4 |
| FGe, ml/min/1,73m2 | 44,3±12.6 | 67,8±21,7 |
| Cociente albúmina creatinina, mg/g | 852 (446-1.634) | 308 (108-740) |
| ≥300mg/g (%) | 87,5 | 50,7 |
| IECA/ARA II | 100 | 100 |
| Agonista receptor GLP-1 | 394 (6,9) | 550 (7,5) |
| Inhibidor SGLT2 | 259 (4,6) | 618 (8,4) |
ARA II: antagonistas de los receptores de angiotensina ii; CAC: cociente albúmina creatinina en orina; CV: cardiovascular; ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado; GLP1: péptido similar al glucagón tipo 1; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IECA: inhibidores de la enzima convertidora de angiotensina; IM: infarto de miocardio; PAS: presión arterial sistólica; SGLT2: cotransportador sodio-glucosa tipo 2.
Resultados principales de los estudios FIDELIO-DKD y FIGARO-DKD
| FIDELIO-DKD | FIGARO-DKD | FIDELITY | |
|---|---|---|---|
| HR (IC 95%) | HR (IC 95%) | HR (IC 95%) | |
| Desenlaces renales | |||
| Variable renal compuestaa | 0,82 (0,73-0,93) | 0,87 (0,76-1,01) | 0,85 (0,77-0,93) |
| Variable renal compuestab | 0,68 (0,55-0,82) | 0,77 (0,60-0,99) | 0,77 (0,67-0,88) |
| Fallo renalEnfermedad renal terminalcDescenso sostenido FGe<15ml/min/1,73m2 | 0,87 (0,72-1,05)0,86 (0,67-1,10)0,82 (0,67-1,01) | 0,72 (0,49-1,05)0,64 (0,41-0,99)0,71 (0,43-1,16) | 0,84 (0,71-0,99)0,80 (0,64-0,99)0,81 (0,67-0,98) |
| Descenso sostenido FGe≥40% desde los niveles basales | 0,81 (0,72-0,92) | 0,87 (0,75-1,00) | 0,84 (0,76-0,92) |
| Desenlaces cardiovasculares | |||
| Variable primaria cardiovascular compuestad | 0,86 (0,75-0,99) | 0,87 (0,76-0,98) | 0,86 (0,78-0,95) |
FGe: filtrado glomerular estimado; HR: hazard ratio; IC: intervalo de confianza.
Fallo renal, descenso sostenido FGe≥40% desde los niveles basales o muerte de causa renal (variable renal secundaria en estudio FIDELITY; objetivo renal primario en estudios FIDELIO-DKD y FIGARO-DKD).
Resultados principales de los estudios FIDELIO-DKD, FIGARO-DKD y FIDELITY (finerenona vs. placebo).
*Variable renal compuesta: fallo renal, descenso sostenido FGe≥57% desde los niveles basales o muerte de causa renal (variable renal primaria en estudio FIDELITY; objetivo renal secundario en estudios FIDELIO-DKD y FIGARO-DKD).
**Variable CV compuesta: tiempo hasta la primera muerte CV, IM no mortal, ictus no mortal u hospitalización IC.
CV: cardiovascular; FGe: filtrado glomerular estimado; HR: hazard ratio; IC: intervalo de confianza.
Efectos adversos en los estudios FIDELIO-DKD y FIGARO-DKD
| FIDELIO-DKD | FIGARO-DKD | |||
|---|---|---|---|---|
| Finerenona | Placebo | Finerenona | Placebo | |
| Eventos adversos | ||||
| Eventos adversos que llevan a la discontinuación | 7,3% | 5,9% | 5,6% | 5,0% |
| Eventos adversos graves que llevan a la discontinuación | 2,7% | 2,8% | 1,9% | 2,1% |
| Hiperpotasemiaa | ||||
| Hiperpotasemiaa | 15,8% | 7,8% | 10,8% | 5,3% |
| Hiperpotasemia relacionada con el tratamiento | 11,8% | 4,8% | 6,5% | 3,1% |
| Hiperpotasemia que lleva a discontinuación | 2,3% | 0,9% | 1,2% | 0,4% |
| Hiperpotasemia grave | 1,6% | 0,4% | 0,7% | 0,1% |
| Daño renal agudo | ||||
| Daño renal agudo | 4,6% | 4,8% | 2,5% | 2,7% |
| Hospitalización debido a daño renal agudo | 1,9% | 1,7% | 0,9% | 1,1% |
| Discontinuación debido al daño renal agudo | 0,2% | 0,2% | 0,2% | 0,1% |
En el estudio FIGARO-DKD10 se incluyeron a más de 7.000 pacientes con DM2 y ERC, definida como un cociente albúmina creatinina 30≤300mg/g y filtrado glomerular 25-90ml/min/1,73m2, o un cociente albúmina creatinina 300-5.000mg/g y filtrado glomerular ≥60ml/min/1,73m2, en tratamiento con dosis máximas toleradas un IECA o ARA II y un potasio sérico≤4,8mmol/l (tabla 4). Tras 3,4 años de seguimiento, en comparación con placebo, el tratamiento con finerenona se asoció con una reducción significativa en el objetivo primario cardiovascular (CV) del 13% (HR: 0,87; IC 95%: 0,76-0,98; p=0,03). Además, se asoció con una reducción no significativa del 13% del desenlace compuesto renal y significativa del 36% en el riesgo de enfermedad renal terminal (tabla 5 y fig. 2). Además, la finerenona redujo un 32% la excreción urinaria de albúmina a los 4 meses de tratamiento en comparación con placebo. El riesgo de efectos adversos graves que llevaban a la discontinuación, así como el daño renal agudo fueron similares en ambos grupos. Sin embargo, la incidencia de hiperpotasemia grave fue mayor en el grupo de finerenona (0,7% vs. 0,1%), pero hubo pocos casos de hiperpotasemia que llevaron a la discontinuación (1,2% vs. 0,4%), y no hubo casos de muerte por hiperpotasemia (tabla 6). Los efectos de finerenona sobre la presión arterial sistólica fueron modestos (la diferencia entre ambos grupos de tratamiento fue de 2,6mmHg a los 24meses).
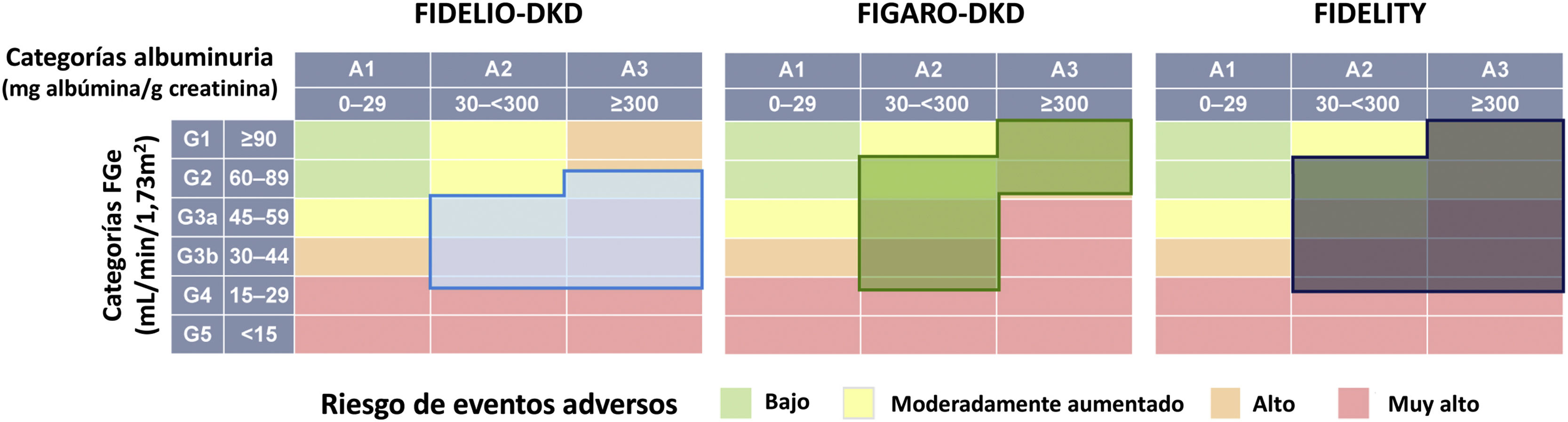
En FInerenone in chronic kiDney diseasE and type 2 diabetes: Combined FIDELIO-DKD and FIGARO-DKD Trial programme analYsis (FIDELITY)43 se realizó un análisis combinado de los estudios FIDELIO-DKD y FIGARO-DKD para, de esta forma, lograr una estimación más robusta de los resultados de ambos estudios. Globalmente, de acuerdo con las categorías de riesgo KDIGO que combinan filtrado glomerular estimado y albuminuria basales, el 48% de los participantes era de muy alto riesgo, el 41% de alto riesgo, el 10% de moderado riesgo y el 0,5% de bajo riesgo (fig. 3). Tras una mediana de seguimiento de 3 años, en comparación con el placebo, el tratamiento con finerenona redujo en un 23% la variable compuesta de fallo renal, descenso sostenido ≥57% del filtrado glomerular desde los niveles basales, o muerte renal (HR 0,77; IC 95%: 0,67-0,88), y en un 15% la variable renal compuesta de fallo renal, descenso sostenido del filtrado glomerular ≥40% desde los niveles basales o muerte de causa renal (HR 0,85; IC 95%: 0,77-0,93). Asimismo, el tratamiento con finerenona también se asoció con reducciones significativas en el riesgo de progresión de enfermedad renal. Además, se observó una reducción significativa del 14% en el riesgo de desarrollar la variable combinada muerte CV, infarto de miocardio no mortal e ictus no mortal (tabla 5 y fig. 2). En consecuencia, la finerenona enlenteció la progresión de la ERC y disminuyó el riesgo de eventos CV. Si bien el riesgo de efectos adversos fue similar entre la finerenona y el placebo, la hiperpotasemia que conduce a la discontinuación fue más frecuente con finerenona, aunque fue igualmente baja (1,7% vs. 0,6%).
En una revisión sistemática de 4 ensayos clínicos (n=7.048), que incluyó a FIDELIO-DKD, en comparación con placebo, la finerenona redujo significativamente el cociente albúmina creatinina en pacientes con ERC, sin aumentar el riesgo de efectos adversos, salvo por un mayor riesgo de hiperpotasemia frente al placebo44. En otro metaanálisis de 13.945 pacientes con DM2 y ERC, que incluyó a FIDELIO-DKD y FIGARO-DKD, entre otros estudios, se confirmó la misma reducción del cociente albúmina creatinina. Además, hubo menos pacientes con una pérdida de filtrado glomerular ≥40% desde los niveles basales en comparación con el placebo (RR 0,85; IC 95%: 0,78-0,93), sin aumentar el riesgo de efectos adversos, salvo por un mayor riesgo de hiperpotasemia45.
En definitiva, los ensayos clínicos con finerenona han demostrado este fármacoreduce la albuminuria y retrasa la progresión de la ERC en pacientes con DM2, contribuyendo a reducir el riesgo residual.
La finerenona en el abordaje global del paciente con enfermedad renal diabéticaEn estos momentos los únicos fármacos específicamente aprobados para enlentecer la progresión de la ERC en la diabetes mellitus son los IECA, los ARA II, la finerenona, la canagliflozina y la dapagliflozina22. La patogenia de la ERC es múltiple, y solo desde un abordaje integral, que implica el tratamiento con fármacos con mecanismos de acción complementarios, es posible una protección completa (fig. 1B)16,18,24–33.
En los estudios FIDELIO-DKD9 y FIGARO-DKD10 todos los pacientes estaban siendo tratados con IECA o ARA II. En consecuencia, estos estudios muestran que la finerenona añadida a los IECA y ARA II, en los pacientes con DM2 y ERC, aporta beneficios adicionales sobre la progresión de la ERC. Ahora bien ¿podría la terapia combinada con finerenona e inhibidores SGLT2 producir un beneficio cardiorrenal adicional? Desafortunadamente solo un pequeño porcentaje de pacientes en estos estudios estaba siendo tratado con inhibidores SGLT2. Así, en el análisis FIDELITY43 aproximadamente el 7% de los pacientes tomaba inhibidores SGLT2. Los beneficios de la finerenona fueron independientes del tratamiento con inhibidores SGLT2, tanto para el descenso de la albuminuria, como sobre la progresión de la ERC y eventos cardiovasculares43,46. De hecho, los mejores desenlaces se observaron en los pacientes que combinaban inhibidores de SGLT2 y finerenona. En este sentido, en el estudio ROTATE-3, realizado en pacientes con albuminuria≥100mg/24h y filtrado glomerular estimado 30-90ml/min/1,73m2, en tratamiento con dosis máximas toleradas de IECA o ARA II, la combinación de dapagliflozina con eplerenona resultó en un efecto aditivo robusto sobre la reducción de la albuminuria47. Además, en el estudio DAPA-CKD, como en los ensayos clínicos de insuficiencia cardiaca realizados con iSGLT2, el beneficio sobre la reducción de eventos fue independiente del empleo de antagonistas de la aldosterona15,48–51. Apoyando los resultados de los ensayos clínicos, en un modelo animal de daño orgánico asociado a la hipertensión, la combinación de finerenona y empagliflozina se asoció con reducciones en la proteinuria, la presión arterial, así como lesiones histológicas renales y cardiacas, sugiriendo un beneficio adicional con la combinación de ambos fármacos52. Existe una plausibilidad biológica para estas observaciones, ya que probablemente la finerenona y los inhibidores SGLT2 tienen mecanismos de acción complementarios, que disminuyen el riesgo de progresión de la ERC. Así, la finerenona tiene propiedades antiinflamatorias y antifibróticas según modelos preclínicos, y los inhibidores SLGT2 reducen la hiperfiltración glomerular y tienen efectos directos sobre la función metabólica y celular.
Además, el riesgo de hiperpotasemia de la finerenona puede disminuir con la adición de los inhibidores SGLT2. Por ejemplo, en el estudio CREDENCE, la canagliflozina redujo el riesgo de hiperpotasemia en pacientes con DM2 y ERC tratados con un inhibidor del SRA49. Además, en FIDELIO ningún paciente tratado con finerenona y un inhibidor SGLT2 de manera concomitante presentó un potasio sérico>6,0mmol/l, lo que indica que el tratamiento combinado facilitaría el mayor uso de los antagonistas del RM, al presentar un menor riesgo de hiperpotasemia15,46,49. En consecuencia, todos estos datos indican que ambos fármacos son complementarios y podrían aportar beneficios adicionales cuando se emplean de manera concomitante.
En la actualidad hay ensayos clínicos en marcha que están analizando específicamente el impacto de la asociación de finerenona e inhibidores de SGLT2 sobre la seguridad y eficacia (CONFIDENCE trial, NCT05254002).
Si bien algunos agonistas del receptor del péptido similar al glucagón tipo 1 (GLP1) han mostrado un efecto nefroprotector, fundamentalmente antiproteinúrico, se necesitan estudios específicamente diseñados, para valorar los efectos del tratamiento combinado con finerenona53–55. En el estudio FIDELIO-DKD el 6,9% de los pacientes estaba tomando agonistas del receptor de GLP1 y los efectos de finerenona sobre la albuminuria y los eventos renales fueron independientes del tratamiento con agonistas del receptor de GLP1 o del uso de insulina56.
Desde un punto de vista de coste-efectividad, si bien la finerenona a priori es más cara que la espironolactona y la eplerenona, solo la finerenona ha demostrado enlentecer la progresión de la ERC, lo que se asocia con una reducción de costes importantes, en particular las hospitalizaciones, enfermedad renal terminal y diálisis, que son los mayores determinantes del coste sanitario asociado en el abordaje del paciente con ERC, por lo que es esperable que un mayor uso de finerenona en la práctica clínica se traduzca en una reducción de los costes sanitarios asociados a la ERC57,58.
En consecuencia, la triple terapia de inhibidores del SRA, inhibidores SGLT2 y finerenona supone un cambio en la historia natural del paciente con ERC y DM2. Ahora bien ¿cómo se puede garantizar el acceso a las terapias cardiorrenales comprobadas para quienes más las necesitan? Es necesario vencer las barreras que impiden su implementación. En este sentido, todo paciente con DM2 debería conocer su albuminuria por lo menos una vez al año, independientemente del tratamiento, tal y como recomiendan las últimas guías de la ADA de 202223. Una mejor coordinación entre los niveles asistenciales (atención primaria y nefrología) podría ayudar a la implementación de un abordaje óptimo a los pacientes con diabetes mellitus y ERC, que pasa por una detección temprana de la ERC en la DM2. Tanto el inicio como la titulación de la finerenona son sencillos, y siguiendo unas pautas simples no debería ofrecer grandes complicaciones en su empleo en el día a día. Su escaso efecto sobre la presión arterial, el bajo riesgo de hiperpotasemia en comparación con la espironolactona y la eplerenona, así como los beneficios demostrados en los ensayos clínicos sobre la progresión de la enfermedad renal, deberían facilitar su implementación en la práctica clínica, independientemente del nivel asistencial donde fuese atendido el paciente59–61.
Sin embargo, todavía existen dudas que hay que resolver: ¿qué posición ocupará la finerenona en las guías de práctica clínica en el abordaje del paciente con DM2 y ERC?, ¿qué efectos tendrá la finerenona en los pacientes con nefropatía no diabética?, ¿se puede iniciar finerenona en pacientes con un filtrado glomerular<25ml/min/1,73m2 o presenta beneficios en pacientes en diálisis, trasplante renal o sin albuminuria? Finalmente, cabe recordar que existe también la esaxerenona, otro antagonista no esteroideo del RM, que si bien ha demostrado aumentar la probabilidad de normalizar la albuminuria y disminuir la progresión a mayores niveles de albuminuria en pacientes con DM2 y microalbuminuria tratados con inhibidores del SRA, todavía no existen evidencias sobre su capacidad para reducir la progresión de la ERC en esta población62.
ConclusionesLa finerenona es un antagonista no esteroideo potente y selectivo del RM, que en pacientes con DM2 y ERC reduce la albuminuria, enlentece la progresión de la ERC y ofrece protección cardiovascular. Este beneficio parece independiente de otros tratamientos nefroprotectores, como los inhibidores del SRA y los inhibidores SGLT2, con un buen perfil de seguridad y un bajo riesgo de hiperpotasemia. El mayor beneficio en el abordaje terapéutico de estos pacientes se conseguirá mediante un tratamiento integral, que actúe sobre la etiopatogenia multifactorial de la ERC asociada a la diabetes. Una vez que el tratamiento con IECA o ARA II y los inhibidores SGLT2 se han consolidado en las guías de práctica clínica en el abordaje del paciente con diabetes y ERC, la finerenona supone una gran innovación en el armamentario terapéutico, constituyendo también uno de los pilares en el tratamiento de esta población. Por su mecanismo de acción, el beneficio ofrecido por la finerenona podría extenderse más allá de la enfermedad renal diabética, por lo que en el futuro se podría extender a otras formas de ERC e incluso a otras indicaciones terapéuticas.
- •
A pesar de los tratamientos actuales los pacientes con diabetes siguen teniendo un elevado riesgo de progresión de ERC.
- •
La patogenia de la ERC en el paciente con diabetes es compleja, e intervienen factores hemodinámicos, metabólicos y de inflamación y fibrosis.
- •
El RM desempeña un papel clave en la génesis y desarrollo de la ERC.
- •
La espironolactona y la eplerenona, a pesar de disminuir la proteinuria, no han demostrado reducir la progresión de la ERC.
- •
La finerenona es un antagonista no esteroideo altamente selectivo del RM caracterizado por una estructura voluminosa.
- •
La unión de la finerenona al RM da lugar a un complejo receptor-ligando específico que bloquea el reclutamiento de coactivadores transcripcionales implicados en la expresión de mediadores proinflamatorios y profibróticos.
- •
La finerenona ha demostrado reducir de forma importante la albuminuria en pacientes con DM2 y ERC ya desde el 4.° mes de tratamiento.
- •
En pacientes con ERC y DM2 la finerenona reduce tanto la progresión de la ERC como el riesgo de eventos CV.
- •
El riesgo de hiperpotasemia es menor con finerenona que con espironolactona y eplerenona, lo que facilita su uso en la práctica clínica.
- •
El abordaje de los pacientes con diabetes y ERC debe ser multifactorial e incluiría los IECA o ARA II, los inhibidores SGLT2 y la finerenona.
Los autores no han recibido ningún tipo de honorarios y/o compensación económica por su participación en este artículo. Los autores agradecen a Content Ed Net por la colaboración en la redacción del artículo y la asistencia editorial. Estas tareas fueron financiadas por Bayer Hispania.
Conflicto de interesesJLG declara honorarios personales de NovoNordisk (honorarios, advisory), Boehringer (honorarios, asesoramiento y consultoría), Eli Lilly (honorarios), AstraZeneca (honorarios, asesoramiento y subvenciones), Esteve (honorarios), Bayer (honorarios, asesoramiento y consultoría) y Vifor (honorarios y asesoramiento).
JRGJ reporta honorarios por conferencias y por participar en consejo asesor de Bayer.
LF ha recibido honorarios de Novonordisk, Boehringer, AstraZeneca, Bayer, Esteve y Eli Lilly.
AO ha recibido subvenciones de Sanofi y honorarios por consultoría o conferencias o apoyo para viajes de Advicciene, Astellas, Astrazeneca, Amicus, Amgen, Fresenius Medical Care, GSK, Bayer, Sanofi-Genzyme, Menarini, Mundipharma, Kyowa Kirin, Alexion, Freeline, Idorsia, Chiesi, Otsuka, Novo-Nordisk, Sysmex y Vifor Fresenius Medical Care Renal Pharma y es Director de la Cátedra Mundipharma-UAM de enfermedad renal diabética y de la Cátedra Astrazeneca-UAM de enfermedad renal crónica y electrolitos.
MJS ha recibido honorarios personales de NovoNordisk (honorarios, asesoramiento), Janssen (honorarios), Boehringer (honorarios, asesoramiento, subvenciones y consultoría), Eli Lilly (honorarios), AstraZeneca (honorarios y asesoramiento), Esteve (honorarios), Fresenius Medical Care (honorarios), Mundipharma (honorarios y asesoramiento), NovoNordisk (honorarios, asesoramiento y consultoría), Bayer (honorarios, asesoramiento y consultoría), Travere Therapeutics (honorarios y asesoramiento), GE Healthcare (asesoramiento) y Vifor (honorarios y asesoramiento). MJS también es el editor en jefe de Clinical Kidney Journal.
AV ha recibido honorarios por ponencias de Bayer, Boehringer-Ingelheim, Daiichi Sankyo y Pfizer-BMS.
La investigación de AO está apoyada por el Instituto de Salud Carlos III (ISCIII) RICORS program to RICORS2040 (RD21/0005/0001) y SPACKDc PMP21/00109, fondos FEDER. La investigación de MJS está apoyada por el Instituto de Salud Carlos III (ISCIII) RICORS program to RICORS2040 (RD21/0005/0016) y Marató TV3 2020 421/C/2020, Marató TV3 2021 215/C/2021, (PI21/01292) fondos FEDER, y EIN2020-1123381.