La biopsia renal preimplante puede aportar información útil evolutiva postrasplante.
ObjetivoAnalizar el valor pronóstico de la biopsia renal de donantes de edad avanzada respecto al filtrado glomerular estimado MDRD-4 (FGe) al año del trasplante.
MétodosEstudiamos a 124 receptores de trasplante renal de donantes fallecidos de ≥60 años, con biopsia renal preimplante. Los trasplantes fueron realizados en nuestro centro, entre marzo del 2008 y mayo del 2012. Las biopsias se valoraron según el baremo propuesto por O’Valle et al. y se categorizaron en 3 grupos: 0-3, 4-5, 6-8 puntos. Se descartaron los riñones con una puntuación >8. El 77% de los donantes tenía ≥70 años.
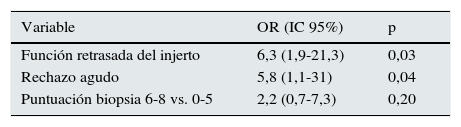
ResultadosEl FGe medio (DE) del grupo 6-8 al año del trasplante: 38,5 (14,1) mL/min/1,73m2 fue menor que el del grupo 4-5: 46,3 (15,7) (p=0,03) y del grupo 0-3: 49,6 (12,5) (p=0,04). Se registraron 7 (19%) pacientes con FGe<30mL/min/1,73m2 en el grupo 6-8 vs. 8 (14%) en el grupo 4-5 y ninguno en el grupo 0-3 (p=0,17). En el análisis de regresión logística, OR (IC 95%), que valoró los pacientes con FGe<30mL/min/1,73m2 al año del trasplante, la función retrasada del injerto (6,3 [1,9-21,3]) y el rechazo agudo (5,8 [1,1-31]) fueron significativos. La puntuación del daño histológico de las biopsias, grupo 6-8 vs. 0-5, presentó un OR ajustado no significativo de 2,2 (0,7-7,3).
ConclusionesLos riñones con mayor afectación histológica presentaron un menor FGe al año del trasplante. La función renal retrasada del injerto y el rechazo fueron factores de riesgo significativos de un bajo FGe al año del trasplante.
Preimplantation renal biopsy provides potentially valuable information about post-transplant renal function.
ObjectiveTo assess the prognostic value of preimplantation kidney biopsy from older donors in determining 1-year post-transplant estimated glomerular filtration rate MDRD-4 (eGFR).
MethodsWe evaluated a cohort of 124 renal transplant recipients from deceased donors ≥60 years old, performed at our center between March 2008 and May 2012. Biopsies were assessed by applying the score proposed by O’Valle et al. The overall score was stratified into 3 levels: 0-3, 4-5 and 6-8 points. Kidneys scoring > 8 points were discarded. A total of 77% of the donors were ≥70 years.
ResultsOne year post-transplant, mean eGFR (SD) was lower in transplant recipients with 6-8 points (38.5 [14.1] mL/min/1.73m2) than in the group scoring 4-5 points (46.3 [15.7] [p=0.03]) and the group scoring 0-3 (49.6 [12.5] [P=.04]). Seven patients (19%) had eGFR <30mL/min/1.73m2 1 year post-transplant in group 6-8 vs. 8 (14%) in group 4-5 and none in group 0-3. In the logistic regression, OR (95% IC), to determine patients with 1-year post-transplant eGFR (<30mL/min/1.73m2), delayed graft function (6.3 [1.9-21.3]) and acute rejection (5.8 [1.1-31]), were significant. The adjusted OR of biopsy score group 6-8 vs. 0-5, was 2.2 (0.7-7.3).
ConclusionsAllografts with higher pathologic score in preimplantation renal biopsy were associated with a worse 1-year post-transplant eGFR. Delayed graft function and acute rejection were significant risk factors for 1-year post-transplant low eGFR.
El trasplante renal constituye la mejor opción de tratamiento renal sustitutivo para las personas que desarrollan una enfermedad renal crónica avanzada. Sin embargo, la oferta de donantes jóvenes, teóricamente ideales, es limitada y no permite cubrir la demanda de pacientes en lista de espera de trasplante renal. Este desequilibrio ha determinado la utilización creciente de donantes de mayor edad, con frecuencia con morbilidad asociada, como la hipertensión arterial o la diabetes, con los que se obtienen buenos resultados clínicos, siempre que la aceptación y la asignación de dichos injertos sean adecuadas1–4.
Se han desarrollado varias escalas con la finalidad de valorar la calidad de los riñones de los donantes y establecer su viabilidad y funcionalidad postrasplante. La Organ Procurement and Transplantation Network/United Network for Organ Sharing (OPT/UNOS) definió el concepto de donante con criterio expandido, pero su utilidad pronóstica es limitada, ya que engloba perfiles clínicos heterogéneos con resultados clínicos diferentes5,6. Otros índices estratifican de forma más precisa la supervivencia del injerto, pero con un moderado valor discriminatorio7–11. La biopsia renal del donante aporta información que puede mejorar la estimación de su pronóstico funcional. Sin embargo, los resultados publicados son controvertidos y su empleo no se ha generalizado12,13.
En el Hospital Universitario Cruces se protocolizó en el año 2008 la biopsia renal de los donantes fallecidos de edad avanzada con la finalidad de garantizar la calidad de los injertos renales utilizados. En este estudio se analizan los resultados clínicos obtenidos y se valora de forma específica la relación entre las lesiones histológicas y el filtrado glomerular al año del trasplante.
Pacientes y métodosDiseño del estudioEstudio retrospectivo de una cohorte de 124 receptores de trasplante renal. Los trasplantes fueron realizados en nuestro centro entre marzo del 2008 y mayo del 2012, con injertos procedentes de donantes de ≥60 años fallecidos por muerte encefálica, con biopsia preimplante. La recogida de los datos evolutivos se realizó hasta mayo del 2013 o hasta la fecha previa de fallecimiento o pérdida del injerto.
Biopsia renal del donanteSe realizó biopsia en todos los donantes de ≥70 años y en los de 60-69 años que presentaron antecedentes de HTA o diabetes. En todos los casos se exigió un estado macroscópico adecuado de los riñones y un filtrado glomerular estimado (FGe) MDRD-4 >60mL/min/1,73m2. Las muestras de las biopsias se obtuvieron mediante una cuña renal y se incluyeron de forma manual en parafina. La fijación en formol se aceleró, cuando fue necesario, en estufa a 60–70°C. Se realizaron cortes de 3-4 μ que fueron teñidos con hematoxilina-eosina y ácido periódico de Schiff. Las lesiones histológicas fueron valoradas por uno de los patólogos de un equipo de 5 de nuestro centro, aplicando el baremo propuesto por O’Valle et al.14,15 (tabla 1). Se desecharon los riñones con una puntuación acumulada >8 y aquellos con una valoración parcial de 3 en las lesiones de glomeruloesclerosis, arteriolopatía hialina o elastosis miointimal. Los riñones con una puntuación >5 se asignaron a receptores de >60 años, el resto se consideraron aptos para cualquier receptor adulto. En el periodo del estudio, un total de 39 injertos fueron descartados por no adaptarse a los criterios histológicos señalados.
Puntuación de las lesiones histológicas renales preimplante
| Glomeruloesclerosis |
| 0. Ausencia |
| 1. 0-10% |
| 2. 11-20% |
| 3. >20% |
| Fibrosis capsular glomerular |
| 0. Ausencia |
| 1. 0-15% |
| 2. 16-40% |
| 3. >40% |
| Glomérulos quistificados |
| 0. Ausencia |
| 1. 0-15% |
| 2. 16-40% |
| 3. >40% |
| Arteriolopatía hialina |
| 0. Ausencia |
| 1. No oclusiva en < 50% de las arterias |
| 2. No oclusiva en > 50% de las arterias |
| 3. Oclusiva en > 50% de las arterias |
| Elastosis miointimal |
| 0. Ausencia |
| 1. Engrosamiento de la íntima que reduce la luz 0-20% |
| 2. Engrosamiento de la íntima que reduce la luz 21-50% |
| 3. Engrosamiento de la íntima que reduce la luz > 50% |
| Atrofia tubular |
| 0. Ausencia |
| 1. Atrofia < 4/20 campos (x40) |
| 2. Atrofia 4-10/20 campos (x40) |
| 3. Atrofia > 10/20 campos (x40) |
| Fibrosis intersticial |
| 0. Ausencia |
| 1. Fibrosis < 3/20 campos (x40) |
| 2. Fibrosis 3-8/20 campos (x40) |
| 3. Fibrosis > 8/20 campos (x40) |
Se prescribió terapia inicial cuádruple con corticoides, ácido micofenólico, tacrolimus e inducción con 2 dosis I.V. de basiliximab de 20mg los días +0 y +4 del trasplante. Se administraron 125mg de 6-metil-prednisolona I.V. en la intervención quirúrgica, 60mg/día I.V. los 3 primeros días y a continuación 30mg/día de prednisona oral con posterior descenso progresivo hasta 5mg/día en los 3 primeros meses. La dosis inicial de tacrolimus fue de 0,1mg/kg/día oral, con ajustes posteriores intentando mantener niveles de 6–8ng/mL. También recibieron 1.500mg/día de micofenolato mofetilo o 1.080mg/día de micofenolato sódico oral en 3 dosis. Los episodios de rechazo agudo fueron tratados con bolos de 250mg I.V. de 6-metil-prednisolona, 3 días consecutivos.
Definición de variablesEn el estudio se incluyeron variables del donante: edad, género, peso, talla, creatinina al ingreso y previa a la extracción, HTA, diabetes, causa de muerte, puntuación de cada componente individual histológico y puntuación acumulada de las lesiones histológicas. Variables del receptor: edad, género, causa de la enfermedad renal, modalidad de tratamiento sustitutivo previo al trasplante, trasplantes previos, tasa histórica y actual de anticuerpos reactivos contra el panel (PRA). Variables basales y evolutivas del trasplante: incompatibilidades HLA A, B, DR, isquemia fría, función retrasada del injerto, rechazo agudo, fallecimiento, reinicio de diálisis, niveles de tacrolimus y creatinina (primer mes, 3 meses, año, 2 años y 3 años) y el cociente proteinuria/creatinina al año del trasplante.
Se definió como función retrasada del injerto la necesidad de diálisis en la primera semana del trasplante. La fecha de la última sesión de diálisis se aceptó como el inicio de la recuperación funcional. Se registraron como rechazos agudos los episodios clínicos tratados con bolos I.V. de 6-metil-prednisolona. La puntuación acumulada de las lesiones histológicas se categorizó de forma arbitraria, pero con la intención de optimizar su análisis estadístico, en 3 grupos: 0–3, 4–5 y 6–8 puntos.
La variable final del estudio fue el filtrado glomerular al año del trasplante, estimado mediante la ecuación MDRD-4. Se analizó su valor medio, su distribución categórica: <30, 30-59, ≥60mL/min/1,73m2 y la incidencia de pacientes con FGe < 30mL/min/1,73m2.
Análisis estadísticoLas variables cuantitativas se describen mediante la media y la desviación estándar (DE) o la mediana y los cuartiles (Q1-Q3) en caso de distribución no normal. Las variables categóricas se expresan en frecuencias absolutas y porcentajes. La asociación de variables categóricas se analizó mediante el test chi-cuadrado o el test exacto de Fisher, según los valores esperados. Se estimó la supervivencia de los injertos mediante la metodología de Kaplan-Meier. Las medias del FGe al año del trasplante de los grupos histológicos: 0–3, 4–5, 6–8 puntos, se compararon mediante el test de ANOVA, con contrastes post hoc, si en el test global la p < 0,05. La relación entre la puntuación histológica y la incidencia de pacientes con FGe < 30mL/min/1,73m2 al año del trasplante se evaluó mediante análisis de regresión logística. En el análisis univariante se evaluaron la puntuación histológica y las variables clínicas potencialmente influyentes en dicho resultado. En el modelo multivariante se incluyeron la puntuación histológica, que se mantuvo fija, y las variables que en el análisis univariante presentaron una p < 0,20. Se retiraron progresivamente del modelo las variables de mayor valor de p hasta obtener un modelo en el que todas las variables predictoras mostraban una p < 0,05. Los análisis estadísticos se realizaron con el programa IBM-SPSS 20.0.
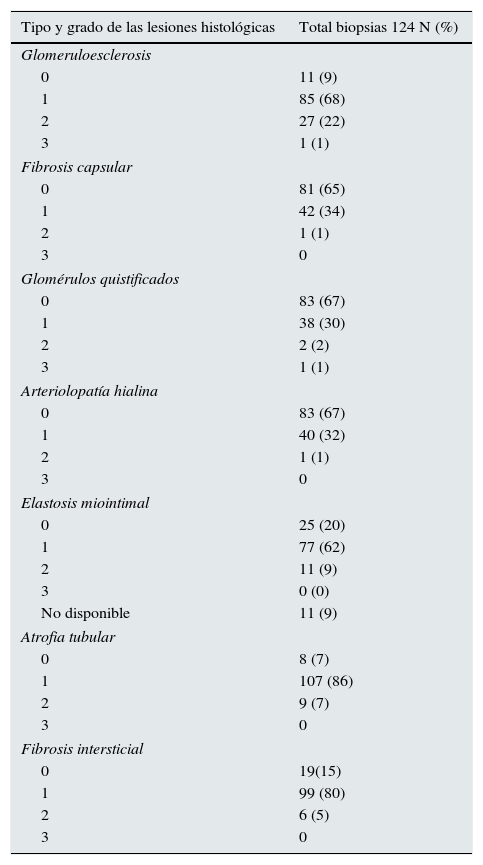
ResultadosLa tabla 2 muestra las características clínicas y demográficas de los pacientes del estudio. El 77% de los donantes tenía ≥70 años, el 45% presentaron HTA y el 14% diabetes. El 89% de los receptores tenía ≥60 años. El FGe de todos los donantes fue >60mL/min/1,73m2. En la tabla 3 se indica la distribución de las lesiones histológicas de las biopsias renales preimplante. Estas mostraron una mediana (Q1-Q3) de 48 glomérulos (32-71) y 2 arterias (1-3). En 11 biopsias (9%) no se visualizaron arterias. Un total de 19 biopsias (15%) obtuvieron una puntuación de 0-3, 63 (51%) 4-5 y 42 (34%) una valoración de 6-8 puntos.
Características basales, clínicas y demográficas de los donantes y pacientes trasplantados
| Variable | Total trasplantes N=124 |
|---|---|
| Edad del donante, años | |
| Media (DE) | 72,5 (4,9) |
| 60-69 | 29 (23) |
| 70-80 | 95 (77) |
| Donantes varones, N (%) | 53 (43) |
| Causa de muerte del donante, N (%) | |
| Hemorragia cerebral | 107 (86) |
| Traumatismo craneoencefálico | 10 (8) |
| Otras | 7 (6) |
| Donantes con antecedentes de HTA, N (%) | 56 (45) |
| Donantes con antecedentes de diabetes, N (%) | 17 (14) |
| Creatinina del donante, mg/dl, media (DE) | 0,67 (0,17) |
| Filtrado glomerular MDRD-4 del donante, ml/min/173m2, media (DE) | 107 (28) |
| Edad del receptor, años | |
| Media (DE) | 66,8 (6,3) |
| <60 | 14 (11) |
| 60-69 | 68 (55) |
| 70-79 | 42 (34) |
| Receptores varones, N (%) | 84 (68) |
| Causa de enfermedad renal, N (%) | |
| No filiada | 29 (23) |
| Glomerular | 21 (17) |
| Vascular | 22 (18) |
| Poliquistosis | 23 (19) |
| Diabetes | 10 (8) |
| Otras | 19 (15) |
| Modalidad de diálisis, N (%)a | |
| Hemodiálisis | 82 (71) |
| Diálisis peritoneal | 36 (29) |
| Tiempo en diálisis pretrasplante, meses mediana (Q1-Q3) | 26 (17-41) |
| PRA actual del receptor, N (%) | |
| Negativo | 104 (84) |
| 1-50 | 17 (14) |
| 51-100 | 3 (2) |
| Pacientes con trasplante renal previo, N (%) | 12 (10) |
| Incompatibilidades HLA A-B-DR, N (%) | |
| 0-2 | 23 (19) |
| 3-4 | 92 (74) |
| 5-6 | 9 (7) |
| Isquemia fría, horas, media (DE) | 18,4 (3,3) |
| Puntuación de la biopsia, N (%) | |
| 0-3 | 19 (15) |
| 4-5 | 63 (51) |
| 6-8 | 42 (34) |
Distribución de las lesiones histológicas de las biopsias renales preimplante
| Tipo y grado de las lesiones histológicas | Total biopsias 124 N (%) |
|---|---|
| Glomeruloesclerosis | |
| 0 | 11 (9) |
| 1 | 85 (68) |
| 2 | 27 (22) |
| 3 | 1 (1) |
| Fibrosis capsular | |
| 0 | 81 (65) |
| 1 | 42 (34) |
| 2 | 1 (1) |
| 3 | 0 |
| Glomérulos quistificados | |
| 0 | 83 (67) |
| 1 | 38 (30) |
| 2 | 2 (2) |
| 3 | 1 (1) |
| Arteriolopatía hialina | |
| 0 | 83 (67) |
| 1 | 40 (32) |
| 2 | 1 (1) |
| 3 | 0 |
| Elastosis miointimal | |
| 0 | 25 (20) |
| 1 | 77 (62) |
| 2 | 11 (9) |
| 3 | 0 (0) |
| No disponible | 11 (9) |
| Atrofia tubular | |
| 0 | 8 (7) |
| 1 | 107 (86) |
| 2 | 9 (7) |
| 3 | 0 |
| Fibrosis intersticial | |
| 0 | 19(15) |
| 1 | 99 (80) |
| 2 | 6 (5) |
| 3 | 0 |
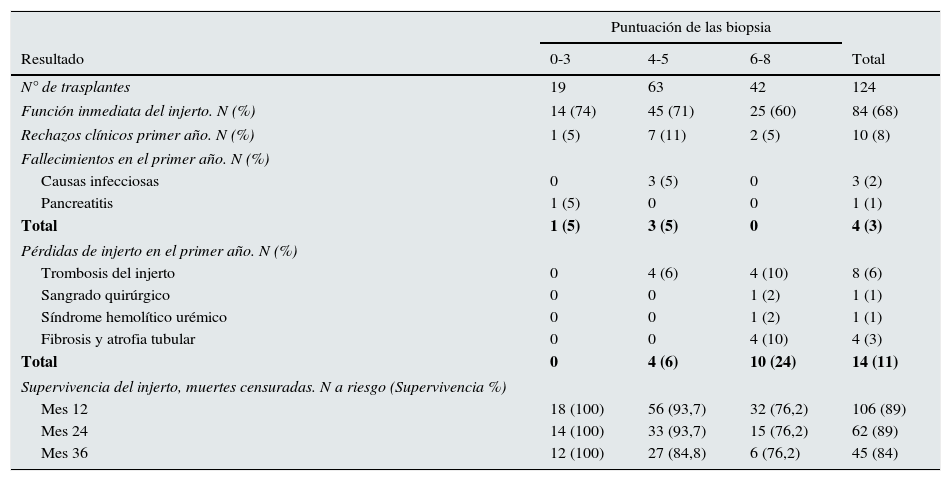
En la tabla 4 se presentan los resultados obtenidos, tanto globales como en cada una de las categorías histológicas. El 68% de los injertos funcionaron de forma inmediata tras el trasplante, el 8% nunca funcionaron y el resto lo hicieron al cabo de una media de 10 días. El 8% de los pacientes recibieron bolos de corticoides por sospecha de rechazo agudo. Cuatro pacientes (3%) fallecieron en el primer año del trasplante. Un total de 14 pacientes (11%) perdieron el injerto en ese periodo de tiempo, en 8 casos por trombosis arterial o venosa del injerto, 4 del grupo histológico 6-8 y otros 4 del grupo 4-5. Cuatro pacientes del grupo 6-8 perdieron el injerto con lesiones de fibrosis, atrofia tubular y lesiones vasculares crónicas inespecíficas. La supervivencia global de los injertos, censurando los fallecimientos, fue de un 89% al primer y segundo año y del 84% al tercer año.
Resultados clínicos postrasplante, globales y agrupados, según la puntuación histológica de las biopsias
| Puntuación de las biopsia | ||||
|---|---|---|---|---|
| Resultado | 0-3 | 4-5 | 6-8 | Total |
| N° de trasplantes | 19 | 63 | 42 | 124 |
| Función inmediata del injerto. N (%) | 14 (74) | 45 (71) | 25 (60) | 84 (68) |
| Rechazos clínicos primer año. N (%) | 1 (5) | 7 (11) | 2 (5) | 10 (8) |
| Fallecimientos en el primer año. N (%) | ||||
| Causas infecciosas | 0 | 3 (5) | 0 | 3 (2) |
| Pancreatitis | 1 (5) | 0 | 0 | 1 (1) |
| Total | 1 (5) | 3 (5) | 0 | 4 (3) |
| Pérdidas de injerto en el primer año. N (%) | ||||
| Trombosis del injerto | 0 | 4 (6) | 4 (10) | 8 (6) |
| Sangrado quirúrgico | 0 | 0 | 1 (2) | 1 (1) |
| Síndrome hemolítico urémico | 0 | 0 | 1 (2) | 1 (1) |
| Fibrosis y atrofia tubular | 0 | 0 | 4 (10) | 4 (3) |
| Total | 0 | 4 (6) | 10 (24) | 14 (11) |
| Supervivencia del injerto, muertes censuradas. N a riesgo (Supervivencia %) | ||||
| Mes 12 | 18 (100) | 56 (93,7) | 32 (76,2) | 106 (89) |
| Mes 24 | 14 (100) | 33 (93,7) | 15 (76,2) | 62 (89) |
| Mes 36 | 12 (100) | 27 (84,8) | 6 (76,2) | 45 (84) |
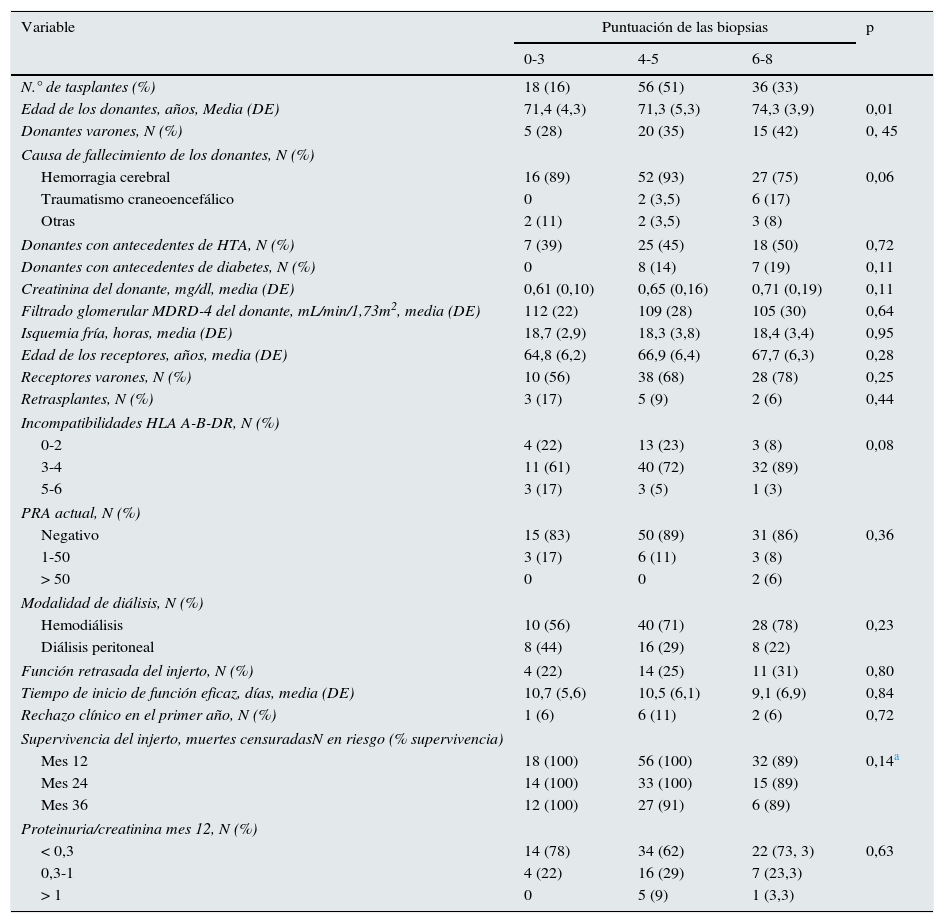
En 110 pacientes se analizó la relación de la puntuación obtenida en la biopsia renal preimplante y el FGe al año del trasplante. Se descartaron del análisis 14 pacientes: 4 por fallecimiento en el primer año postrasplante, 8 por trombosis del injerto, un paciente con síndrome hemolítico urémico y una pérdida de injerto asociada a sangrado postoperatorio. Sí se incluyó a los 4 pacientes del grupo 6-8 que perdieron el injerto con lesiones ya referidas de fibrosis y atrofia tubular; a estos pacientes se les asignó al año del trasplante un filtrado de 10ml/min/1,73m2. Dieciocho pacientes (16%) obtuvieron una puntuación acumulada de 0-3, 56 (51%) valores de 4-5 y 36 (33%) una valoración de 6-8 puntos. Las biopsias mostraron una mediana (Q1-Q3) de 48 glomérulos (33-73) y 2,3 arterias (1-3). En 9 biopsias (8%) no se visualizaron arterias. La edad de los donantes con puntuación de 6-8 fue mayor que la del resto de los grupos, sin que registraran diferencias relevantes en el resto de las características basales clínicas ni demográficas analizadas. En cuanto a resultados clínicos, la incidencia de pacientes con función retrasada del injerto fue de 4 (22%) en el grupo 0-3, 14 (25%) en el grupo 4-5 y 11 (31%) en la categoría 6-8 (p=0,80). El tiempo de inicio de función de dichos injertos fue similar en los 3 grupos. Nueve pacientes presentaron rechazo agudo: uno (6%), 6 (11%) y 2 (6%), respectivamente en los grupos: 0-3, 4-5, 6-8 (p=0,72). La supervivencia de los injertos a los 3 años del trasplante, censurando los fallecimientos, fue del 100% en el grupo 0-3, 91% en el 4-5 y 89% en el 6-8 (tabla 5).
Características clínicas de los 110 trasplantes incluidos en el análisis de la función renal postrasplante
| Variable | Puntuación de las biopsias | p | ||
|---|---|---|---|---|
| 0-3 | 4-5 | 6-8 | ||
| N.° de tasplantes (%) | 18 (16) | 56 (51) | 36 (33) | |
| Edad de los donantes, años, Media (DE) | 71,4 (4,3) | 71,3 (5,3) | 74,3 (3,9) | 0,01 |
| Donantes varones, N (%) | 5 (28) | 20 (35) | 15 (42) | 0, 45 |
| Causa de fallecimiento de los donantes, N (%) | ||||
| Hemorragia cerebral | 16 (89) | 52 (93) | 27 (75) | 0,06 |
| Traumatismo craneoencefálico | 0 | 2 (3,5) | 6 (17) | |
| Otras | 2 (11) | 2 (3,5) | 3 (8) | |
| Donantes con antecedentes de HTA, N (%) | 7 (39) | 25 (45) | 18 (50) | 0,72 |
| Donantes con antecedentes de diabetes, N (%) | 0 | 8 (14) | 7 (19) | 0,11 |
| Creatinina del donante, mg/dl, media (DE) | 0,61 (0,10) | 0,65 (0,16) | 0,71 (0,19) | 0,11 |
| Filtrado glomerular MDRD-4 del donante, mL/min/1,73m2, media (DE) | 112 (22) | 109 (28) | 105 (30) | 0,64 |
| Isquemia fría, horas, media (DE) | 18,7 (2,9) | 18,3 (3,8) | 18,4 (3,4) | 0,95 |
| Edad de los receptores, años, media (DE) | 64,8 (6,2) | 66,9 (6,4) | 67,7 (6,3) | 0,28 |
| Receptores varones, N (%) | 10 (56) | 38 (68) | 28 (78) | 0,25 |
| Retrasplantes, N (%) | 3 (17) | 5 (9) | 2 (6) | 0,44 |
| Incompatibilidades HLA A-B-DR, N (%) | ||||
| 0-2 | 4 (22) | 13 (23) | 3 (8) | 0,08 |
| 3-4 | 11 (61) | 40 (72) | 32 (89) | |
| 5-6 | 3 (17) | 3 (5) | 1 (3) | |
| PRA actual, N (%) | ||||
| Negativo | 15 (83) | 50 (89) | 31 (86) | 0,36 |
| 1-50 | 3 (17) | 6 (11) | 3 (8) | |
| > 50 | 0 | 0 | 2 (6) | |
| Modalidad de diálisis, N (%) | ||||
| Hemodiálisis | 10 (56) | 40 (71) | 28 (78) | 0,23 |
| Diálisis peritoneal | 8 (44) | 16 (29) | 8 (22) | |
| Función retrasada del injerto, N (%) | 4 (22) | 14 (25) | 11 (31) | 0,80 |
| Tiempo de inicio de función eficaz, días, media (DE) | 10,7 (5,6) | 10,5 (6,1) | 9,1 (6,9) | 0,84 |
| Rechazo clínico en el primer año, N (%) | 1 (6) | 6 (11) | 2 (6) | 0,72 |
| Supervivencia del injerto, muertes censuradasN en riesgo (% supervivencia) | ||||
| Mes 12 | 18 (100) | 56 (100) | 32 (89) | 0,14a |
| Mes 24 | 14 (100) | 33 (100) | 15 (89) | |
| Mes 36 | 12 (100) | 27 (91) | 6 (89) | |
| Proteinuria/creatinina mes 12, N (%) | ||||
| < 0,3 | 14 (78) | 34 (62) | 22 (73, 3) | 0,63 |
| 0,3-1 | 4 (22) | 16 (29) | 7 (23,3) | |
| > 1 | 0 | 5 (9) | 1 (3,3) | |
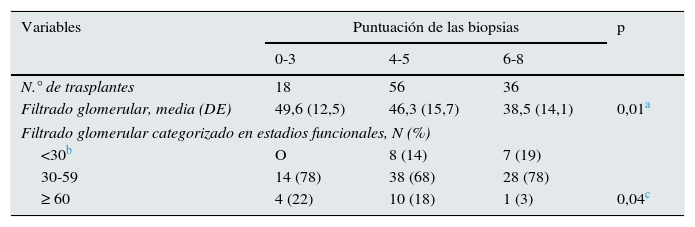
Con relación al FGe, resultado principal del estudio, se detectaron diferencias estadísticas. El FGe medio (DE) del grupo 6-8: 38,5 (14,1) mL/min/1,73m2 fue menor que el alcanzado en el grupo con puntuación 4-5: 46,3 (15,7) mL/min/1,73m2 (p=0,03) y el conseguido en el grupo 0-3: 49,6 (12,5) mL/min/1,73m2 (p=0,04). Así mismo, se detectó una asociación significativa (p=0,04) entre la puntuación de las biopsias y la distribución categórica del FGe al año del trasplante. Los pacientes con mayor puntuación presentaron una distribución más desfavorable (tabla 6).
Asociación entre la puntuación de las lesiones de las biopsias preimplante y el filtrado glomerular estimado MDRD-4(mL/min/1,73m2) al año del trasplante
La incidencia de pacientes con baja función renal al año del trasplante, FGe < 30mL/min/1,73m2, fue de 7 (19%) en el grupo 6-8, 8 (14%) en el 4-5 y nula en los pacientes con puntuación 0-3. Estas diferencias no fueron estadísticamente significativas (p=0,17). En el análisis de regresión logística univariante, que analizó dicha incidencia de pacientes con FGe < 30mL/min/1,73m2 al año del trasplante, las variables que mostraron una asociación con un valor de p < 0,20 fueron la modalidad de diálisis (hemodiálisis vs. diálisis peritoneal), la función retrasada del injerto, el rechazo agudo, la HTA del donante, la diabetes mellitus del donante y la puntuación histológica final de la biopsia. La atrofia tubular, la fibrosis intersticial, la arteriolopatía hialina y la elastosis miointimal valoradas individualmente también presentaron una p < 0,20. La función retrasada del injerto fue la única variable que presentó una asociación estadísticamente significativa (p < 0,05). En el modelo multivariante final (tabla 7) las variables que mostraron asociación significativa fueron la función retrasada del injerto y el rechazo agudo. La puntuación del daño histológico de las biopsias, grupo 6-8 vs. 0-5, presentó una OR ajustada no significativa de 2,2 (IC 95%, 0,7-7,3). En estos análisis de regresión, la puntuación de las biopsias se categorizó en 2 grupos: 0-5 y 6-8, debido a que en los pacientes del grupo 0-3 no hubo pacientes con FGe < 30mL/min/1,73m2.
DiscusiónPresentamos los resultados de un estudio de seguimiento de 124 receptores de trasplante renal procedente de donantes de edad avanzada en los que se realizó biopsia renal preimplante. Los resultados globales conseguidos en cuanto a mortalidad, supervivencia del injerto, trombosis del injerto, funcionamiento inicial del injerto, rechazo agudo y filtrado glomerular concuerdan con los referidos en la literatura en trasplantes realizados con un perfil clínico similar3,16.
El objetivo principal de nuestro estudio fue valorar la relación entre el grado de severidad de las lesiones histológicas de las biopsias renales realizadas y el FGe al año del trasplante. Los estudios que han abordado el valor pronóstico de la biopsia renal preimplante son heterogéneos, tanto en su metodología como en los resultados obtenidos. La glomeruloesclerosis del donante fue la lesión inicial más estudiada, una afectación ≥ 20% se asoció con una peor evolución del injerto17,18. Según los datos de la OPTN/UNOS, con 2.096 riñones biopsiados, solamente los riñones con glomeruloesclerosis < 6% presentaron una ligera mejor supervivencia del injerto a los 5 años que el resto de los grupos19. Las lesiones vasculares y túbulo-intersticiales también se han asociado con peores resultados evolutivos20–22. Con la finalidad de mejorar su utilidad pronóstica se han propuesto varias escalas para puntuar de forma global las lesiones renales anteriores. Las más difundidas son la de Pirani-Remuzzi23 y el Maryland Aggregate Pathology Index (MAPI)24. También se han utilizado escalas basadas en los criterios de Banff, pero por el momento no existe una propuesta específica de dicho grupo25–30. Todas ellas muestran, con sus limitaciones y sus diferencias metodológicas, una asociación entre la severidad de las lesiones histológicas y la evolución funcional de los injertos, tanto en términos de filtrado glomerular como en la supervivencia del injerto. Sin embargo, el análisis de las curvas ROC de los estudios realizados muestra que su capacidad discriminatoria, referida a la supervivencia de los injertos, es moderada, con valores de área bajo la curva de 0,7-0,812,13,31–33. La escala de O’Valle et al.14-15 utilizada en este estudio fue una propuesta empírica desarrollada por patólogos de nuestro país, diseñada específicamente para valorar el daño histológico crónico de las biopsias renales de los donantes. Las biopsias fueron procesadas en parafina, procedimiento que consume más tiempo y recursos que la congelación, pero permite una mejor valoración de los distintos compartimentos renales34.
El FGe medio y la incidencia de pacientes con FGe < 30mL/min/1,73m2 al año del trasplante fueron los resultados principales de nuestro estudio. Estas variables ya han sido utilizadas anteriormente en otras publicaciones, por ser factores pronósticos de gran impacto en la supervivencia de los injertos renales a medio-largo plazo29–33,35–38. En nuestros resultados, los injertos con una puntuación de 6-8 alcanzaron al año del trasplante un filtrado glomerular medio inferior al conseguido en los otros 2 grupos. También fue el grupo que registró una mayor incidencia de injertos con bajo FGe < 30mL/min/1,73m2 al año del trasplante, aunque esta diferencia no fue estadísticamente significativa. La asociación entre la severidad de la afectación histológica de la biopsia preimplante y el FGe evolutivo del injerto ya ha sido referida en otras pubblicaciones29-33. En nuestro análisis, la función retrasada del injerto y el rechazo agudo se asociaron de forma significativa con la presentación de una baja función renal al año del trasplante, FGe < 30mL/min/1,73m2. Los pacientes del grupo 6-8 tuvieron una ligera mayor incidencia de función retrasada del injerto, que ha podido influir en la peor función renal de dicho grupo. Hay estudios que muestran una asociación entre las lesiones renales preimplante del donante, la incidencia de función retrasada y la evolución del filtrado glomerular del injerto21,22,27. La incidencia de rechazos agudos fue baja, muy similar, en los 3 grupos analizados.
En la interpretación de los resultados obtenidos debemos reseñar algunas consideraciones y limitaciones: 1. Los criterios histológicos utilizados en la aceptación de los injertos descartaron el empleo de riñones con afectación histológica más severa; esto impide la valoración de su influencia en los resultados. 2. En el análisis del filtrado glomerular al año del trasplante se excluyó a los pacientes que fallecieron o perdieron el injerto en el primer año del trasplante, salvo 4 pérdidas del injerto que se consideraron relacionadas con la calidad de los riñones implantados, con lesiones inespecíficas de fibrosis y atrofia tubular en la biopsia postrasplante. A estos pacientes se les asignó un FGe de 10mL/min/1,73m2. Las trombosis de injerto se consideraron complicaciones técnicas, no relacionadas directamente con las lesiones parenquimatosas preimplante. 3. No se controló la variabilidad entre los patólogos que analizaron las biopsias. 4. En 9 biopsias no se observaron arterias, por lo que no se les puntuó la elastosis miointimal. Esto supone un posible error de clasificación que ha podido incluir a algunos de estos trasplantes en un grupo histológico inferior al que les hubiera correspondido. Este hecho ha podido reducir las diferencias clínicas encontradas entre los grupos de mayor y menor severidad histológica. 5. El número de pacientes analizados limitó la potencia de los análisis estadísticos realizados.
En este estudio podemos concluir que nuestros resultados globales del trasplante renal con donantes de edad avanzada, con los criterios de aceptación y asignación utilizados, han sido adecuados. Los riñones con mayor daño estructural en la biopsia preimplante, una puntuación histológica de 6-8, han evolucionado con peor función renal al año del trasplante, que puede condicionar, como ya ha sido referido en estudios previos, una peor supervivencia de dichos injertos a medio-largo plazo30-33. La función retrasada del injerto ha sido una variable determinante en la incidencia de injertos con baja función renal al año del trasplante, un aspecto en el que debemos intervenir para mejor los resultados obtenidos. El rechazo agudo también ha incidido en la función evolutiva de los injertos, pero su incidencia en nuestra serie ha sido muy baja.
En nuestra opinión, la utilización de riñones con daño estructural crónico supone una penalización en los resultados del trasplante, pero asumible en muchos casos, especialmente en receptores de edad avanzada. Es difícil establecer el límite de daño histológico que excluya el trasplante. En nuestro estudio hemos establecido un límite cautelar, similar al utilizado en otras escalas histopatológicas23,28,29. Admitir riñones con más afectación histológica aumentaría el número de injertos disponibles, pero con unos resultados globales presumiblemente peores. La biopsia preimplante tiene sus limitaciones, requiere una disponibilidad localizada de patólogos entrenados, su valor pronóstico funcional individual es moderado y puede descartar riñones viables. Sin embargo, a pesar de estas debilidades, la biopsia renal preimplante permite establecer la severidad de las lesiones renales del donante. Una información que consideramos útil, especialmentel en donantes de edad avanzada o con mobilidad vascular asociada, que complementa la valoración clínica–analítica habitual del donante y macroscópica del injerto, y ayuda a decidir con más criterio la aceptación y asignación de los riñones a a trasplantar. Futuras iniciativas deberían validar de forma rigurosa alguna de las escalas existentes o modificaciones de las mismas y consensuar su uso como garante de calidad de nuestra actividad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a los coordinadores de trasplante del Hospital Universitario Cruces por su colaboración en la obtención de los datos del donante.