En los pacientes receptores de trasplante renal (TR), la diabetes mellitus (DM) se relaciona con una mayor mortalidad y menor supervivencia del injerto. Los agonistas del receptor del péptido 1 similar al glucagón (ar-GLP1) han demostrado beneficios cardiovasculares y renales en la población general. Sin embargo, su evidencia en pacientes TR es limitada.
ObjetivoAnalizar la eficacia y seguridad de los ar-GLP1 en una cohorte de pacientes TR.
MétodosEstudio de cohortes retrospectivo multicéntrico de los pacientes TR con DM que iniciaron ar-GLP1 de administración subcutánea en tres hospitales de la provincia de Cádiz entre febrero de 2016 y julio de 2022. Se recogió filtrado glomerular estimado (FGe), proteinuria y peso al inicio del tratamiento y tras 6 y 12 meses. Analizamos control glucémico, tensión arterial, perfil lipídico y niveles valle y dosis de tacrolimus. Documentamos episodios de rechazo agudo (RA), anticuerpos donantes específicos de novo (DSAn) y efectos adversos.
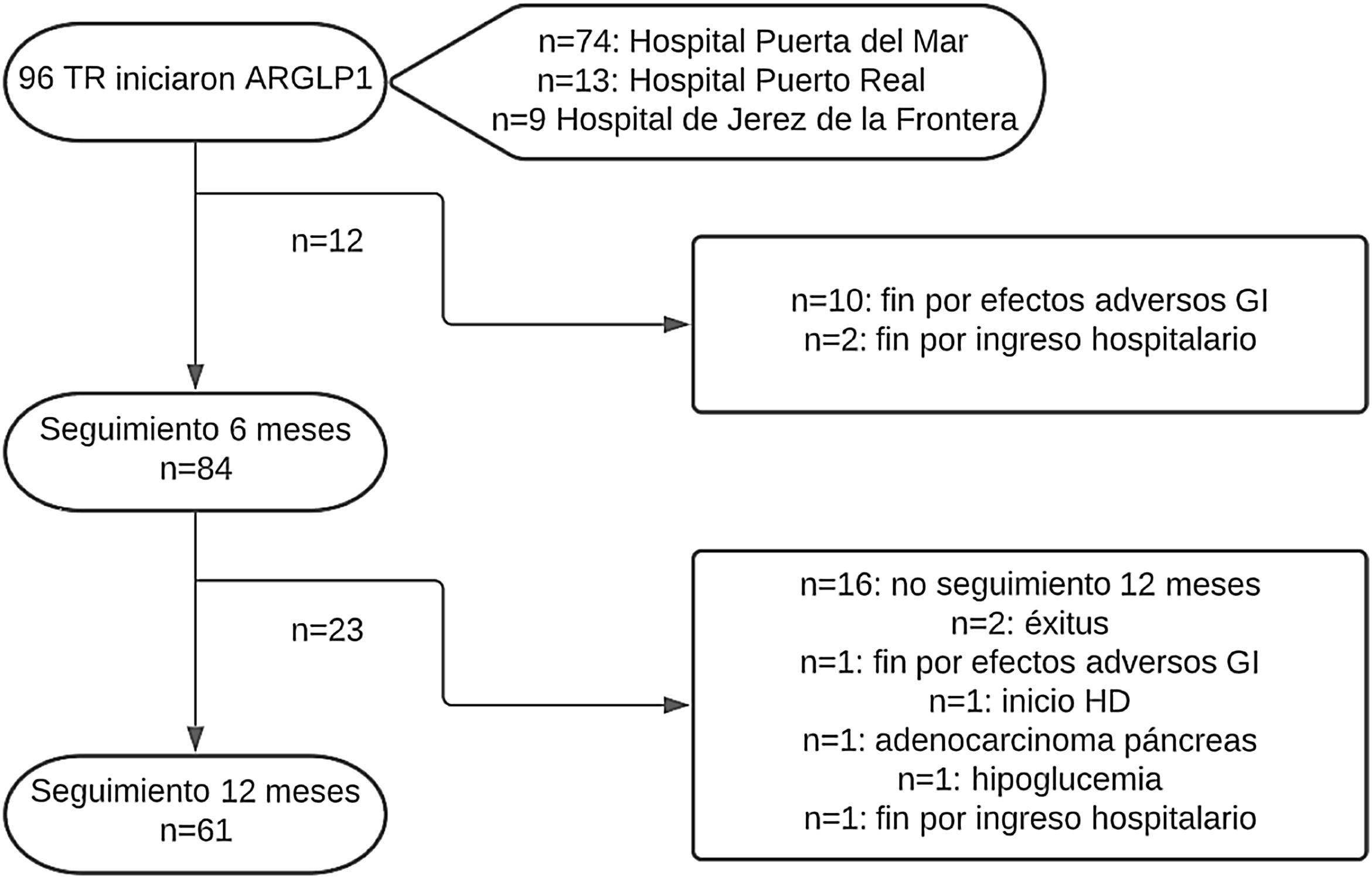
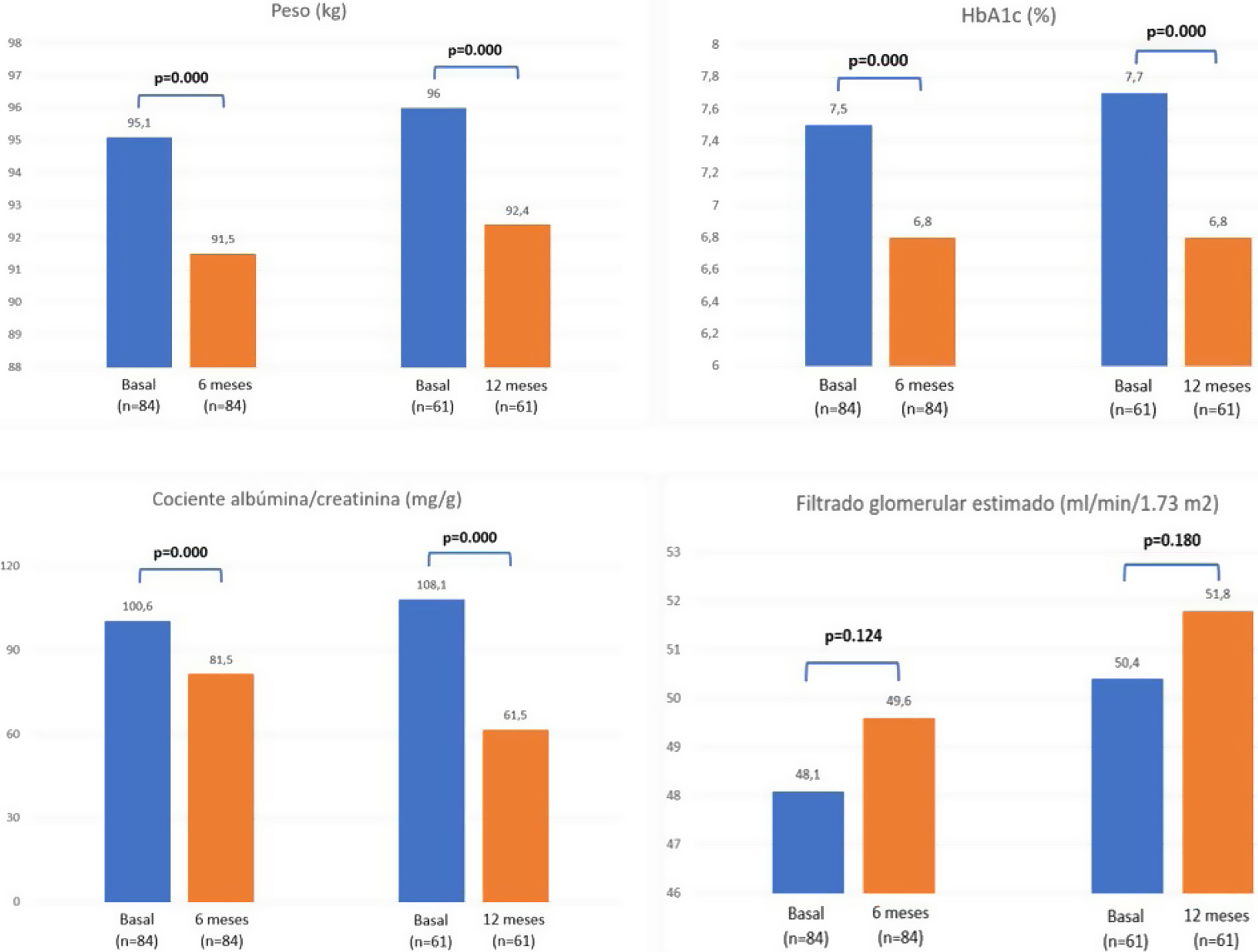
ResultadosEn este periodo, 96 TR con DM iniciaron tratamiento con ar-GLP1, de los cuales 84 cumplieron el seguimiento mínimo de 6 meses y 61 pacientes de 1 año. Se observó una reducción significativa de la proteinuria (−19,1 mg/g, p = 0,000; −46,6 mg/g, p = 0,000), peso (−3,6 kg, p = 0,000; −3,6 kg, p = 0,000), hemoglobina glicosilada (−0,7%, p = 0,000; −0,9%, p = 0,000), tensión arterial sistólica (−7,5 mmHg, p = 0,013; −7,3 mmHg, p = 0,004), colesterol total (−11,5 mg/dL, p = 0,001; −15,6 mg/dL, p = 0,002) y LDL colesterol (−9,2 mg/dL, p = 0,002; −16,8 mg/dL, p = 0,000) a los 6 meses y al año de seguimiento. El FGe se mantuvo estable y no se modificó ni la dosis ni los niveles valle de tacrolimus. No se objetivaron episodios de RA ni desarrollo de DSAn durante el seguimiento.
ConclusionesLos ar-GLP1 en pacientes TR demuestran que puede ser una opción segura y eficaz para el manejo de la DM en TR.
In kidney transplant (KT) recipients, diabetes mellitus (DM) are associated with an increased mortality and a poorer graft survival. Glucagon-like peptide 1 receptor agonists (GLP1-RA) have demonstrated cardiovascular and renal benefits in the general population. However, there is lacking evidence in KT recipients.
ObjectiveTo analyze the efficacy and safety of glucagon-like peptide 1 receptor GLP1-RA in a cohort of KT recipients.
MethodsMulticenter retrospective cohort study of KT patients with DM who started subcutaneous GLP1-RA in three hospitals in the province of Cádiz between February 2016 and July 2022. Estimated glomerular filtration rate (eGFR), proteinuria, and weight at baseline and after 6 and 12 months were collected. We analyzed glycemic control, blood pressure, lipid profile, and doses and trough levels of tacrolimus. We document episodes of acute rejection (AR), de novo donor-specific antibodies (dnDSA), and adverse effects.
ResultsDuring this period, 96 KT with DM started treatment with GLP1-RA, of which 84 had a minimum follow-up of 6 months and 61 were followed for 12 months. A significant reduction was observed in proteinuria (−19.1 mg/g, P = .000; −46.6 mg/g, P = .000), weight (−3.6 kg, P = .000; −3.6 kg, P = .000), glycosylated hemoglobin (−0.7%, P = .000; −0.9%, P = .000), systolic blood pressure (−7.5 mmHg, P = .013; −7.3 mmHg, P = .004), total cholesterol (−11.5 mg/dl, P = .001; −15.6 mg/dl, P = .002) and LDL cholesterol (−9.2 mg/dl, P = .002; −16.8 mg/dl, P = .000) at 6 months and 1 year of follow-up. The eGFR remained stable and the dose and trough levels of tacrolimus did not change. No episodes of AR or development of dnDSA were observed during follow-up.
ConclusionsGLP1-RA in KT patients can be a safe and effective option for the management of DM in KT.
La diabetes mellitus (DM) es una complicación tras el trasplante renal (TR), con una prevalencia de aproximadamente 40%. Además, 10-20% de los TR no diabéticos desarrollan DM post-TR. Tanto la DM preexistente como la DM post-TR se relacionan con mayor mortalidad del receptor y afectan negativamente a la supervivencia del injerto renal1–3, por lo que es necesario modificar los factores de riesgo en esta población.
Los agonistas del receptor del péptido 1 similar al glucagón (ar-GLP1) son una clase de antidiabéticos que han demostrado beneficios cardiovasculares y renales, reduciendo la proteinuria y enlenteciendo la caída del filtrado glomerular (FGe)4,5. Por otra parte, favorecen la pérdida de peso, ya que retrasan el vaciamiento gástrico y promueven la saciedad. Asimismo, conllevan menor riesgo de hipoglucemia porque inducen la secreción de insulina de manera dependiente de la glucosa4,5. Su metabolismo no implica interacciones fármaco-fármaco mediadas por citocromos o transportadores. No obstante, se sugiere que su papel en el vaciamiento gástrico podría afectar a la absorción de determinados fármacos4,5.
Sin embargo, la experiencia con los ar-GLP1 en TR es limitada6–11. Previamente, comunicamos resultados de nuestra experiencia en un grupo reducido de TR12. El objetivo del estudio actual es analizar los resultados del tratamiento con ar-GLP1 en una cohorte más extensa y con mayor seguimiento para evaluar la eficacia y seguridad de estos fármacos en pacientes diabéticos portadores de trasplante renal.
Material y métodosEstudio de cohortes retrospectivo multicéntrico de pacientes TR con DM tipo II preexistente o DM post-TR que iniciaron tratamiento con ar-GLP1 de administración subcutánea entre febrero de 2016 y julio de 2022. Los criterios de prescripción se basaron en las recomendaciones de la American Diabetes Association13. Se prefirió el uso de ar-GLP1 sobre los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) en los pacientes con obesidad (índice de masa corporal [IMC] > 30 kg/m2). Participaron los tres hospitales que realizan seguimiento de pacientes TR en la provincia de Cádiz (Hospitales Puerta del Mar, Jerez de la Frontera y Puerto Real). En todos los pacientes en los que se prescribió un ar-GLP1 se realizaron revisiones mensuales hasta alcanzar la dosis máxima tolerada del fármaco con el objetivo de monitorizar niveles de inmunosupresores e identificar efectos adversos. Posteriormente se espaciaron las revisiones según necesidades de cada paciente y tiempo post-TR. Todos los pacientes incluidos tuvieron un seguimiento mínimo de seis meses tras el inicio del fármaco. Dada la eficacia de estos fármacos mostrada por otros grupos no planteamos un grupo control e iniciamos tratamiento en aquellos pacientes en los que se consideraba que los ar-GLP1 podían aportarles especiales beneficios como los pacientes diabéticos obesos.
Se recogieron datos clínicos y analíticos basales y a los 6 y 12 meses tras el inicio del tratamiento. El FGe fue medido mediante la ecuación Modification of Diet in Renal Disease (MDRD)14. La proteinuria se cuantificó mediante el cociente albúmina/creatinina (CAC) en una muestra de primera orina de la mañana. La presión arterial (PA) fue medida por una enfermera usando un dispositivo oscilométrico (Welch Allyn Spot Vital Signs LXi, Soma Technology Inc., EE. UU.) con el paciente sentado, antes de entrar a la consulta médica y al menos cinco minutos después de su llegada. La PA se calculó como un promedio de tres tomas separadas por cinco minutos. Documentamos episodios de rechazo agudo (RA), desarrollo de anticuerpos donante específicos de novo (DSAn) y aparición de efectos adversos. Los DSAn eran solicitados de forma prospectiva anualmente en todos los pacientes o ante cualquier episodio de deterioro de la función renal. Recogimos tipo y dosis de ar-GLP1 y resto de fármacos antidiabéticos, hipolipemiantes, antihipertensivos e inmunosupresores; así como niveles valle, dosis y C/D ratio de tacrolimus (niveles de tacrolimus en sangre predosis [ng/mL]/dosis diaria de tacrolimus [mg]) en cada periodo analizado.
Análisis estadísticoLas variables continuas se presentan como media y desviación estándar (DE) o mediana y rango intercuartílico (RIQ), según corresponda, y las categóricas como valor absoluto y porcentaje. Las variables continuas fueron comparadas utilizando pruebas paramétricas (t de Student para datos apareados) y pruebas no paramétricas (Wilcoxon para datos apareados y la prueba de Kruskal-Wallis para tres o más grupos independientes). La normalidad de las muestras se analizó mediante el test de Kolmogorov-Smirnov. Para las variables categóricas, las diferencias significativas se evaluaron mediante la prueba de McNemar para comparaciones entre visitas. Se excluyeron del análisis aquellos pacientes que no cumplieron el seguimiento mínimo de seis meses tras el inicio del fármaco. Una vez superado este periodo, se incluyeron todos los pacientes, aunque posteriormente se suspendiera el fármaco por algún motivo. La significancia se fijó en p < 0,05. Se utilizó el paquete estadístico SPSS versión 26.0 para analizar las variables estudiadas (IBM Corp., Armonk, NY, EE. UU.).
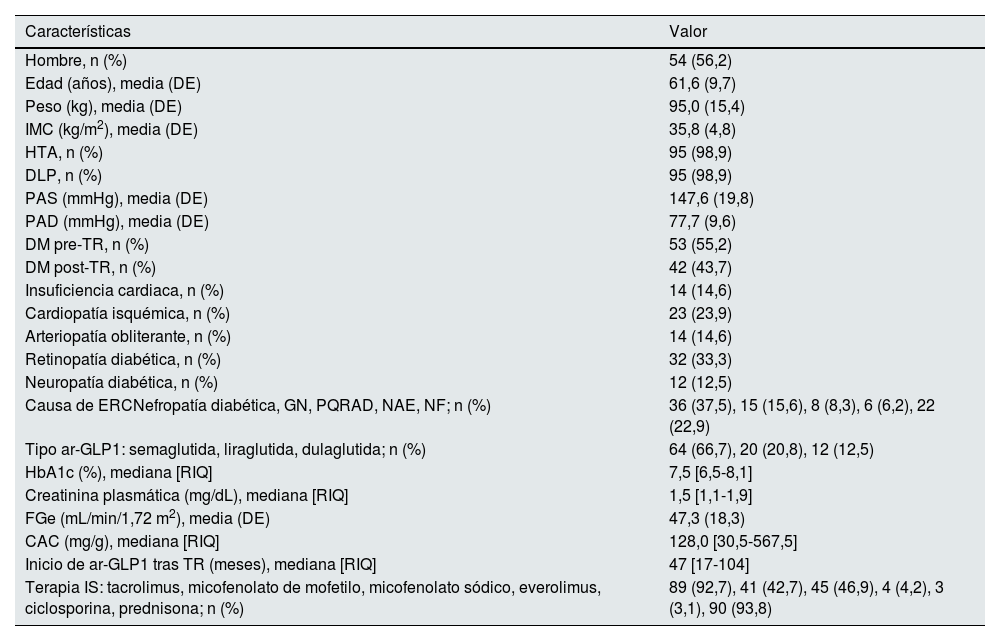
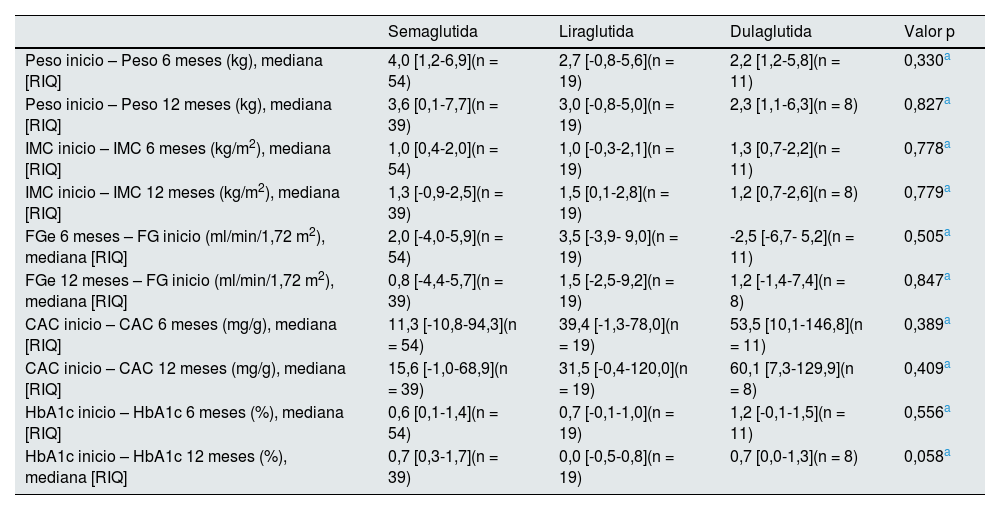
ResultadosDurante el periodo de estudio 96 pacientes iniciaron tratamiento con ar-GLP1. Las características basales se recogen en la tabla 1. La mayoría eran hombres (56,2%) con una edad media de 61,6 ± 9,7 años. Cincuenta y tres pacientes (55,2%) presentaban DM antes del TR y el resto desarrollaron DM post-TR. Semaglutida fue el ar-GLP1 más prescrito (66,7%), seguido de liraglutida (20,8%) y dulaglutida (12,5%). Cincuenta y dos pacientes (54,2%) alcanzaron la dosis máxima recomendada del fármaco. Finalmente, 84 TR alcanzaron un seguimiento mínimo de 6 meses tras el inicio del tratamiento y, de ellos, 61 TR cumplieron 12 meses de seguimiento (fig. 1). Las variables de estudio comparadas a los 6 y 12 meses se muestran en la tabla 2 y figura 2. El análisis de las principales variables se realizó también comparando entre los tres tipos de ar-GLP1 (semaglutida, liraglutida y dulaglutida) que recibían nuestros pacientes, sin observar diferencias significativas entre ellos en ninguna de las variables analizadas (tabla 3).
Características clínicas y demográficas de los pacientes trasplantados renales (TR) incluidos al iniciar tratamiento con ARGLP1
| Características | Valor |
|---|---|
| Hombre, n (%) | 54 (56,2) |
| Edad (años), media (DE) | 61,6 (9,7) |
| Peso (kg), media (DE) | 95,0 (15,4) |
| IMC (kg/m2), media (DE) | 35,8 (4,8) |
| HTA, n (%) | 95 (98,9) |
| DLP, n (%) | 95 (98,9) |
| PAS (mmHg), media (DE) | 147,6 (19,8) |
| PAD (mmHg), media (DE) | 77,7 (9,6) |
| DM pre-TR, n (%) | 53 (55,2) |
| DM post-TR, n (%) | 42 (43,7) |
| Insuficiencia cardiaca, n (%) | 14 (14,6) |
| Cardiopatía isquémica, n (%) | 23 (23,9) |
| Arteriopatía obliterante, n (%) | 14 (14,6) |
| Retinopatía diabética, n (%) | 32 (33,3) |
| Neuropatía diabética, n (%) | 12 (12,5) |
| Causa de ERCNefropatía diabética, GN, PQRAD, NAE, NF; n (%) | 36 (37,5), 15 (15,6), 8 (8,3), 6 (6,2), 22 (22,9) |
| Tipo ar-GLP1: semaglutida, liraglutida, dulaglutida; n (%) | 64 (66,7), 20 (20,8), 12 (12,5) |
| HbA1c (%), mediana [RIQ] | 7,5 [6,5-8,1] |
| Creatinina plasmática (mg/dL), mediana [RIQ] | 1,5 [1,1-1,9] |
| FGe (mL/min/1,72 m2), media (DE) | 47,3 (18,3) |
| CAC (mg/g), mediana [RIQ] | 128,0 [30,5-567,5] |
| Inicio de ar-GLP1 tras TR (meses), mediana [RIQ] | 47 [17-104] |
| Terapia IS: tacrolimus, micofenolato de mofetilo, micofenolato sódico, everolimus, ciclosporina, prednisona; n (%) | 89 (92,7), 41 (42,7), 45 (46,9), 4 (4,2), 3 (3,1), 90 (93,8) |
IMC: índice de masa corporal; HTA: hipertensión arterial; DLP: dislipemia; PAS: presión arterial sistólica; PAD: presión arterial diastólica; DM: diabetes mellitus; TR: trasplante renal; ERC: enfermedad renal crónica; GN: glomerulonefritis; PQRAD: poliquistosis renal autosómica dominante; NAE: nefroangioesclerosis; NF: no filiada; FGe: filtrado glomerular estimado; CAC: cociente albúmina/creatinina en orina aislada; IS: inmunosupresora; DE: desviación estándar; RIQ: rango intercuartílico.
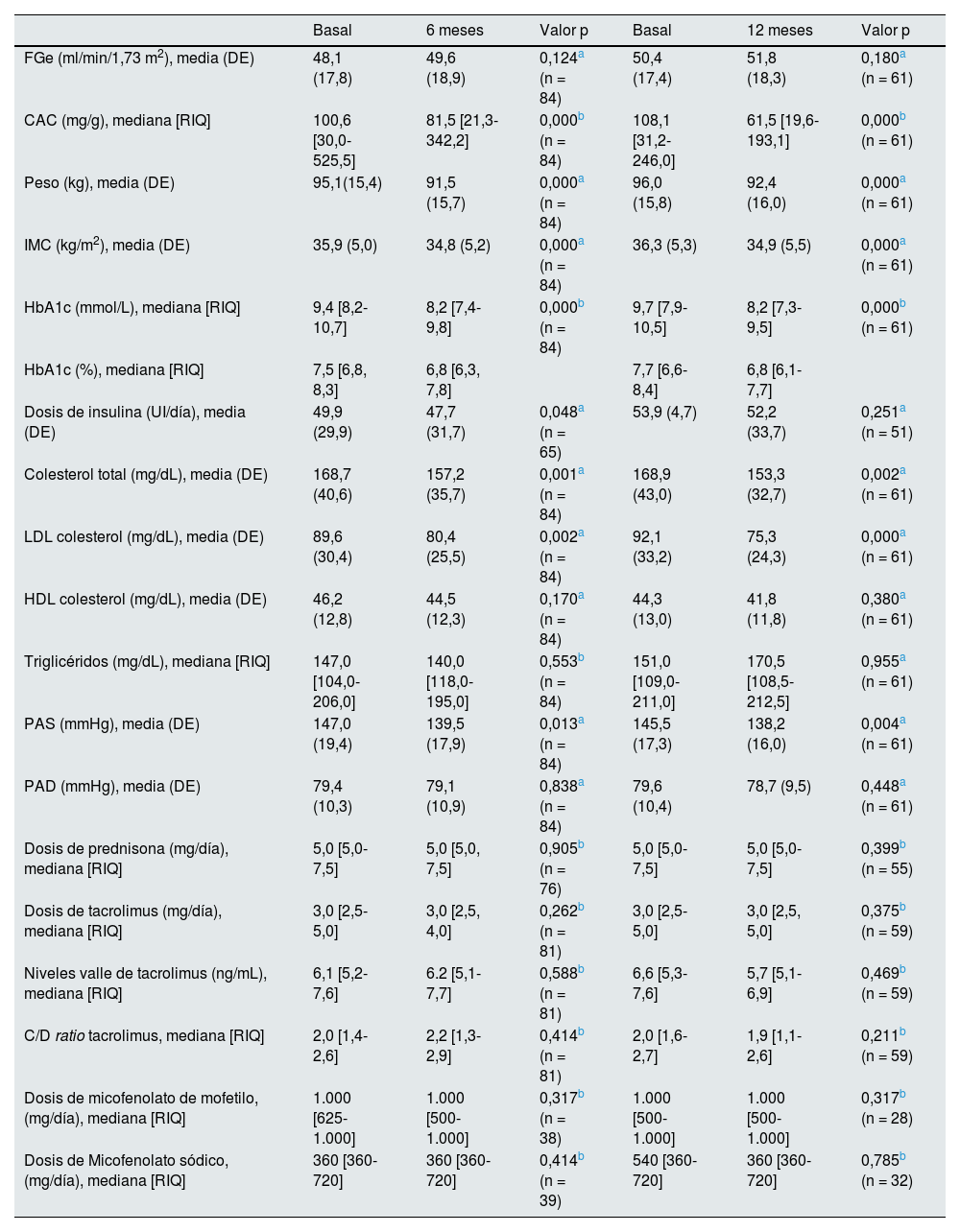
Valores basales, a los seis meses ya los 12 meses de las variables clínicas y analíticas comparadas durante el seguimiento
| Basal | 6 meses | Valor p | Basal | 12 meses | Valor p | |
|---|---|---|---|---|---|---|
| FGe (ml/min/1,73 m2), media (DE) | 48,1 (17,8) | 49,6 (18,9) | 0,124a (n = 84) | 50,4 (17,4) | 51,8 (18,3) | 0,180a (n = 61) |
| CAC (mg/g), mediana [RIQ] | 100,6 [30,0-525,5] | 81,5 [21,3-342,2] | 0,000b (n = 84) | 108,1 [31,2-246,0] | 61,5 [19,6-193,1] | 0,000b (n = 61) |
| Peso (kg), media (DE) | 95,1(15,4) | 91,5 (15,7) | 0,000a (n = 84) | 96,0 (15,8) | 92,4 (16,0) | 0,000a (n = 61) |
| IMC (kg/m2), media (DE) | 35,9 (5,0) | 34,8 (5,2) | 0,000a (n = 84) | 36,3 (5,3) | 34,9 (5,5) | 0,000a (n = 61) |
| HbA1c (mmol/L), mediana [RIQ] | 9,4 [8,2-10,7] | 8,2 [7,4-9,8] | 0,000b (n = 84) | 9,7 [7,9-10,5] | 8,2 [7,3-9,5] | 0,000b (n = 61) |
| HbA1c (%), mediana [RIQ] | 7,5 [6,8, 8,3] | 6,8 [6,3, 7,8] | 7,7 [6,6-8,4] | 6,8 [6,1-7,7] | ||
| Dosis de insulina (UI/día), media (DE) | 49,9 (29,9) | 47,7 (31,7) | 0,048a (n = 65) | 53,9 (4,7) | 52,2 (33,7) | 0,251a (n = 51) |
| Colesterol total (mg/dL), media (DE) | 168,7 (40,6) | 157,2 (35,7) | 0,001a (n = 84) | 168,9 (43,0) | 153,3 (32,7) | 0,002a (n = 61) |
| LDL colesterol (mg/dL), media (DE) | 89,6 (30,4) | 80,4 (25,5) | 0,002a (n = 84) | 92,1 (33,2) | 75,3 (24,3) | 0,000a (n = 61) |
| HDL colesterol (mg/dL), media (DE) | 46,2 (12,8) | 44,5 (12,3) | 0,170a (n = 84) | 44,3 (13,0) | 41,8 (11,8) | 0,380a (n = 61) |
| Triglicéridos (mg/dL), mediana [RIQ] | 147,0 [104,0-206,0] | 140,0 [118,0-195,0] | 0,553b (n = 84) | 151,0 [109,0-211,0] | 170,5 [108,5-212,5] | 0,955a (n = 61) |
| PAS (mmHg), media (DE) | 147,0 (19,4) | 139,5 (17,9) | 0,013a (n = 84) | 145,5 (17,3) | 138,2 (16,0) | 0,004a (n = 61) |
| PAD (mmHg), media (DE) | 79,4 (10,3) | 79,1 (10,9) | 0,838a (n = 84) | 79,6 (10,4) | 78,7 (9,5) | 0,448a (n = 61) |
| Dosis de prednisona (mg/día), mediana [RIQ] | 5,0 [5,0-7,5] | 5,0 [5,0, 7,5] | 0,905b (n = 76) | 5,0 [5,0-7,5] | 5,0 [5,0-7,5] | 0,399b (n = 55) |
| Dosis de tacrolimus (mg/día), mediana [RIQ] | 3,0 [2,5-5,0] | 3,0 [2,5, 4,0] | 0,262b (n = 81) | 3,0 [2,5-5,0] | 3,0 [2,5, 5,0] | 0,375b (n = 59) |
| Niveles valle de tacrolimus (ng/mL), mediana [RIQ] | 6,1 [5,2-7,6] | 6.2 [5,1-7,7] | 0,588b (n = 81) | 6,6 [5,3-7,6] | 5,7 [5,1-6,9] | 0,469b (n = 59) |
| C/D ratio tacrolimus, mediana [RIQ] | 2,0 [1,4-2,6] | 2,2 [1,3-2,9] | 0,414b (n = 81) | 2,0 [1,6-2,7] | 1,9 [1,1-2,6] | 0,211b (n = 59) |
| Dosis de micofenolato de mofetilo, (mg/día), mediana [RIQ] | 1.000 [625-1.000] | 1.000 [500-1.000] | 0,317b (n = 38) | 1.000 [500-1.000] | 1.000 [500-1.000] | 0,317b (n = 28) |
| Dosis de Micofenolato sódico, (mg/día), mediana [RIQ] | 360 [360-720] | 360 [360-720] | 0,414b (n = 39) | 540 [360-720] | 360 [360-720] | 0,785b (n = 32) |
FGe: filtrado glomerular estimado; DE: desviación estándar; RIQ: rango intercuartílico, CAC: cociente albúmina-creatinina en orina aislada; IMC: índice de masa corporal, PAS: presión arterial sistólica; PAD: presión arterial diastólica; HbA1c: hemoglobina glicosilada.
Diferencias entre los valores basales, a los seis y a los 12 meses de las principales variables analizadas entre los diferentes tipos de ar-GLP1
| Semaglutida | Liraglutida | Dulaglutida | Valor p | |
|---|---|---|---|---|
| Peso inicio – Peso 6 meses (kg), mediana [RIQ] | 4,0 [1,2-6,9](n = 54) | 2,7 [-0,8-5,6](n = 19) | 2,2 [1,2-5,8](n = 11) | 0,330a |
| Peso inicio – Peso 12 meses (kg), mediana [RIQ] | 3,6 [0,1-7,7](n = 39) | 3,0 [-0,8-5,0](n = 19) | 2,3 [1,1-6,3](n = 8) | 0,827a |
| IMC inicio – IMC 6 meses (kg/m2), mediana [RIQ] | 1,0 [0,4-2,0](n = 54) | 1,0 [-0,3-2,1](n = 19) | 1,3 [0,7-2,2](n = 11) | 0,778a |
| IMC inicio – IMC 12 meses (kg/m2), mediana [RIQ] | 1,3 [-0,9-2,5](n = 39) | 1,5 [0,1-2,8](n = 19) | 1,2 [0,7-2,6](n = 8) | 0,779a |
| FGe 6 meses – FG inicio (ml/min/1,72 m2), mediana [RIQ] | 2,0 [-4,0-5,9](n = 54) | 3,5 [-3,9- 9,0](n = 19) | -2,5 [-6,7- 5,2](n = 11) | 0,505a |
| FGe 12 meses – FG inicio (ml/min/1,72 m2), mediana [RIQ] | 0,8 [-4,4-5,7](n = 39) | 1,5 [-2,5-9,2](n = 19) | 1,2 [-1,4-7,4](n = 8) | 0,847a |
| CAC inicio – CAC 6 meses (mg/g), mediana [RIQ] | 11,3 [-10,8-94,3](n = 54) | 39,4 [-1,3-78,0](n = 19) | 53,5 [10,1-146,8](n = 11) | 0,389a |
| CAC inicio – CAC 12 meses (mg/g), mediana [RIQ] | 15,6 [-1,0-68,9](n = 39) | 31,5 [-0,4-120,0](n = 19) | 60,1 [7,3-129,9](n = 8) | 0,409a |
| HbA1c inicio – HbA1c 6 meses (%), mediana [RIQ] | 0,6 [0,1-1,4](n = 54) | 0,7 [-0,1-1,0](n = 19) | 1,2 [-0,1-1,5](n = 11) | 0,556a |
| HbA1c inicio – HbA1c 12 meses (%), mediana [RIQ] | 0,7 [0,3-1,7](n = 39) | 0,0 [-0,5-0,8](n = 19) | 0,7 [0,0-1,3](n = 8) | 0,058a |
Se observó una estabilidad en el FGe a los 6 meses (p = 0,124) y al año (p = 0,180). Identificamos también una reducción significativa de la proteinuria en el CAC a los 6 meses (−19,1 mg/g, p = 0,000) y al año (−46,6 mg/g, p = 0,000).
Parámetros antropométricosTras 6 meses de tratamiento con ar-GLP1 encontramos una reducción significativa del peso (−3,6 kg, p = 0,000), manteniéndose al año (−3,6 kg, p = 0,000). El IMC también se redujo a los 6 meses (−1,1 kg/m2, p = 0,000) y al año (−1,4 kg/m2, p = 0,000).
Presión arterial, control glucémico y lipídico.Se objetivó un descenso significativo de la presión arterial sistólica durante todo el seguimiento (−7,5 mmHg a los 6 meses, p = 0,013; −7,3 mmHg a los 12 meses, p = 0,004). No encontramos diferencias significativas en las cifras de presión arterial diastólica.
En cuanto al control glucémico, los valores de hemoglobina glucosilada (HbA1c) también se redujeron (−0,7% a los 6 meses, p = 0,000; −0,9% a los 12 meses, p = 0,000). No hubo diferencias significativas en la dosis de esteroides o de tacrolimus que pudiera influir en estos cambios.
Además, observamos una reducción del colesterol total (−11,5 mg/dL a los 6 meses, p = 0,001; −15,6 mg/dL a los 12 meses, p = 0,002) y de LDLc (−9,2 mg/dL a los 6 meses, p = 0,002; −16,8 mg/dL a los 12 meses, p = 0,000). No observamos diferencias en los niveles de triglicéridos ni de HDL-c.
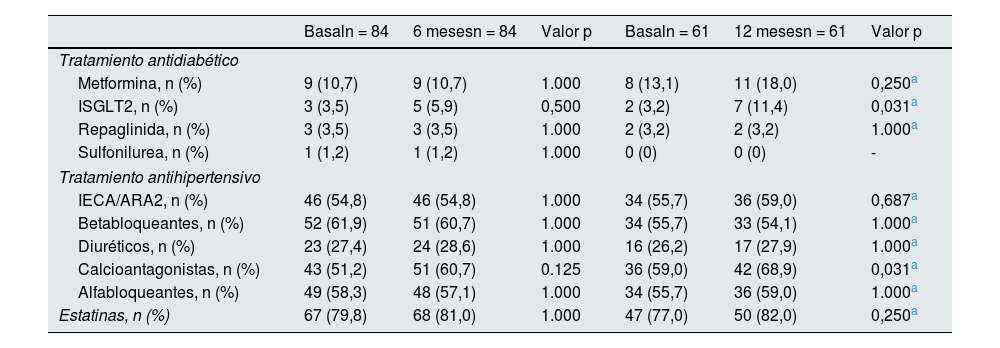
Fármacos antihipertensivos, antidiabéticos y estatinasLos cambios en relación con estos fármacos aparecen recogidos en la tabla 4. La dosis de insulina se redujo tras el inicio del ar-GLP1 (-2,2 UI/día a los 6 meses, p = 0,048). No encontramos diferencias en el número de pacientes tratados con fármacos antidiabéticos orales durante el seguimiento, salvo un aumento en el número de pacientes recibiendo iSGLT2 al año (p = 0,031).
Proporción de pacientes con los diferentes tratamientos antidiabéticos, antihipertensivos y estatinas en los diferentes periodos
| Basaln = 84 | 6 mesesn = 84 | Valor p | Basaln = 61 | 12 mesesn = 61 | Valor p | |
|---|---|---|---|---|---|---|
| Tratamiento antidiabético | ||||||
| Metformina, n (%) | 9 (10,7) | 9 (10,7) | 1.000 | 8 (13,1) | 11 (18,0) | 0,250a |
| ISGLT2, n (%) | 3 (3,5) | 5 (5,9) | 0,500 | 2 (3,2) | 7 (11,4) | 0,031a |
| Repaglinida, n (%) | 3 (3,5) | 3 (3,5) | 1.000 | 2 (3,2) | 2 (3,2) | 1.000a |
| Sulfonilurea, n (%) | 1 (1,2) | 1 (1,2) | 1.000 | 0 (0) | 0 (0) | - |
| Tratamiento antihipertensivo | ||||||
| IECA/ARA2, n (%) | 46 (54,8) | 46 (54,8) | 1.000 | 34 (55,7) | 36 (59,0) | 0,687a |
| Betabloqueantes, n (%) | 52 (61,9) | 51 (60,7) | 1.000 | 34 (55,7) | 33 (54,1) | 1.000a |
| Diuréticos, n (%) | 23 (27,4) | 24 (28,6) | 1.000 | 16 (26,2) | 17 (27,9) | 1.000a |
| Calcioantagonistas, n (%) | 43 (51,2) | 51 (60,7) | 0.125 | 36 (59,0) | 42 (68,9) | 0,031a |
| Alfabloqueantes, n (%) | 49 (58,3) | 48 (57,1) | 1.000 | 34 (55,7) | 36 (59,0) | 1.000a |
| Estatinas, n (%) | 67 (79,8) | 68 (81,0) | 1.000 | 47 (77,0) | 50 (82,0) | 0,250a |
El porcentaje de pacientes tratados con diferentes antihipertensivos no cambió para la mayoría de los fármacos. Únicamente observamos un mayor número de pacientes tratados con antagonistas del calcio al año (p = 0,031).
No encontramos diferencias significativas en el porcentaje de pacientes tomando estatinas ni en la dosis de las mismas. Solo tres pacientes aumentaron la dosis de estatinas durante el seguimiento y tres iniciaron estatinas ya estando en tratamiento con ar-GLP1.
Efectos adversos y seguridadDieciséis pacientes sufrieron efectos adversos gastrointestinales (náuseas, vómitos o diarrea). En cinco, los síntomas mejoraron al reducir la dosis de ar-GLP1 y los once restantes suspendieron el tratamiento. No hubo cambios en la formulación de micofenolato por efectos adversos gastrointestinales ni en las dosis. Un paciente suspendió dulaglutida tras ocho meses de tratamiento al diagnosticarse un adenocarcinoma de páncreas. Tres pacientes abandonaron el fármaco tras ingresos hospitalarios prolongados y un paciente por el desarrollo de hipoglucemia. Se registraron dos éxitus durante el seguimiento. Uno debido a insuficiencia respiratoria secundario a neumonía bilateral COVID-19 y el segundo paciente falleció tras el desarrollo de un adenocarcinoma pulmonar metastásico.
Las dosis, los niveles valle y el C/D ratio de tacrolimus no se modificaron de forma significativa (tabla 2). No se notificaron episodios de rechazo agudo ni se detectaron DSAn. Dos pacientes se sometieron a biopsia renal en el periodo de estudio por deterioro progresivo de la función renal, con datos de fibrosis intersticial y atrofia tubular moderadas. Únicamente un paciente precisó reiniciar terapia sustitutiva con hemodiálisis durante el seguimiento, sin que esto se considerara relacionado con el fármaco.
DiscusiónPresentamos la serie más extensa comunicada hasta ahora de pacientes TR con DM tipo 2 preexistente o DM post-TR que han recibido tratamiento con ar-GLP1. Además, mostramos datos sobre niveles y dosis de tacrolimus, incidencia de rechazo agudo y potencial desarrollo de DSAn durante el seguimiento. Estos fármacos han sido bien tolerados por nuestros pacientes, sin alteraciones en el tratamiento inmunosupresor y con mejoría del control metabólico y de los parámetros antropométricos. Adicionalmente, hemos observado efectos beneficiosos sobre el control de la tensión arterial y en parámetros relacionados con la función renal que pueden aportar ventajas relevantes a los receptores TR diabéticos.
De modo similar a la eficacia constatada en la población general diabética, en nuestros pacientes hemos observado una mejora significativa en el control glucémico, con descenso en los niveles de HbA1c4,5. Cabe destacar que se redujo la dosis de insulina y que no se modificó la mayor parte de fármacos antidiabéticos.
Los ar-GLP1 pueden provocar efectos adversos gastrointestinales que podrían alterar la absorción de la medicación inmunosupresora y favorecer la disfunción del injerto renal. Sin embargo, diversos estudios sugieren el potencial papel nefroprotector de este grupo farmacológico en otras poblaciones, influenciado por diferentes factores: mitigación de la hiperglucemia, el sobrepeso y la resistencia a la insulina, la hipertensión sistémica y glomerular, la dislipidemia, la retención de sodio, la inflamación y la hipoxia renal15,16. En nuestra serie la función renal se mantuvo estable, coincidiendo con lo comunicado en otras series de pacientes TR8–10. Por tanto, nuestros datos, apoyan que, con el seguimiento adecuado, los ar-GLP1 son fármacos seguros en relación con la función del injerto.
Adicionalmente observamos una reducción del peso corporal y del IMC de forma similar a lo descrito en población general5,15. Este efecto ha sido explicado por el retraso en el vaciamiento gástrico y la saciedad que provocan este grupo de antidiabéticos4,5. La prevalencia de la obesidad en la población TR es elevada. Se relaciona con el desarrollo de DM post-TR, hipertensión arterial y dislipemia, incrementando el riesgo de muerte y de fracaso del injerto17. Por otro lado, en nuestra serie observamos también un descenso significativo de la albuminuria, similar a la población no TR, no descrito previamente en otras experiencias en pacientes TR. La albuminuria es también predictora de mortalidad y desarrollo de ERC en el TR18. Se ha sugerido que el peso corporal influye en el desarrollo de albuminuria en los TR, de forma similar a lo reportado en el paciente no TR18. Nuestros resultados muestran una disminución significativa del peso, lo que podría explicar este descenso del CAC observado en nuestros pacientes. El número de pacientes tratados con iSGLT2 al año fue mayor, lo que puede haber influido también en estos hallazgos. No obstante, no podemos descartar efectos beneficiosos directos de los ar-GLP1 sobre la albuminuria, que deberían ser objeto de futuros estudios.
Varios ensayos clínicos han reportado mejoría en la presión arterial sistólica con ar-GLP1 en población no TR19,20. Esto puede deberse a la pérdida de peso y a los efectos natriuréticos y vasodilatadores de este grupo farmacológico21,22. Pero estos hallazgos no han sido analizados ni descritos en la población TR. En nuestra serie observamos mejoría en la presión arterial sistólica. Sin embargo, el incremento en el número de pacientes tratados con antagonistas del calcio al año de seguimiento pudo contribuir a esta mejora en el control tensional.
Por otra parte, la dislipemia es una complicación frecuente tras el TR y es un factor de riesgo para el desarrollo de enfermedad cardiovascular y pérdida del injerto23. Además, la mayoría de los fármacos inmunosupresores utilizados en trasplante tienen un efecto perjudicial sobre el perfil lipídico24. Dichas alteraciones no han sido analizadas adecuadamente en las series de pacientes TR tratados con ar-GLP1 publicadas previamente6–11. En nuestra experiencia observamos una reducción significativa del colesterol total y LDLc, siendo de interés destacar que no existieron diferencias en el número de pacientes que recibieron estatinas y en la dosis de estos fármacos. Todo ello sugiere que los beneficios derivados del tratamiento con ar-GLP1 pueden ayudar a mejorar el perfil lipídico de los pacientes TR y, en consecuencia, el control cardiovascular.
Los ar-GLP1 se eliminan por degradación proteolítica y su metabolismo no involucra enzimas del citocromo P450 ni interacciones farmacológicas mediadas por transportadores4. Por tanto, las probabilidades de interacción con los medicamentos inmunosupresores son bajas. Sin embargo, existe cierta preocupación de que los ar-GLP1 puedan afectar la absorción de los fármacos inmunosupresores debido a su papel en el enlentecimiento del vaciamiento gástrico4,5. Hasta la fecha se han publicado datos sobre las dosis y niveles de tacrolimus en un número reducido de pacientes TR tratados con ar-GLP16,8–11. En nuestra experiencia, con un número relevante de pacientes, analizando niveles valle, dosis y C/D ratio de tacrolimus, estos no se modificaron de forma significativa durante el seguimiento lo que permite generar confianza en cuanto a la seguridad respecto al tratamiento inmunosupresor. Además, no hemos observado episodios de RA, desarrollo de DSAn ni incremento en el número de biopsias realizadas, lo que aporta también datos de seguridad en relación con este grupo de antidiabéticos.
Los efectos secundarios de los ar-GLP1 son principalmente gastrointestinales. Ocurren en los ensayos clínicos en población no TR entre 10-50%21,25 En nuestra serie estos efectos adversos no se observaron en mayor medida que en la población general y se asemejan a lo reportado en otros trabajos en población TR6–11. En uno de nuestros pacientes se suspendió el ar-GLP1 a los ocho meses de tratamiento tras el diagnóstico de adenocarcinoma de páncreas. En los primeros años de uso de los ar-GLP1 se sugirió un mayor riesgo de pancreatitis y tumores pancreáticos relacionado con el empleo de estos antidiabéticos26. Sin embargo, grandes ensayos clínicos y otros estudios posteriores no lo confirmaron, por lo que la Administración de Drogas y Alimentos de Estados Unidos (FDA) y la Agencia Europea de Medicamentos (EMA) concluyeron que no podía establecerse una relación causal entre estos fármacos y el desarrollo de pancreatitis o cáncer de páncreas27–31.
Nuestro trabajo presenta varias limitaciones. Se trata de un estudio observacional y retrospectivo en vida real, sin grupo control, con las limitaciones inherentes a este diseño. Hubiera sido de interés disponer de un brazo de comparación, pero estos fármacos se indicaron en diabéticos con obesidad no siendo posible disponer de un grupo control de similares características, por lo que los resultados deben tomarse con precaución. Aunque más extensa que otras series, el número de pacientes sigue siendo reducido. No disponemos de datos sobre la adherencia del paciente al tratamiento con ar-GLP1, pero todas las suspensiones del fármaco reportadas por los pacientes fueron recogidas. Por otro lado, no podemos extraer conclusiones sobre la influencia de estos fármacos en la dosis y niveles de everolimus o ciclosporina debido a la escasez de pacientes en nuestra serie tomando estos inmunosupresores.
Como conclusión, los ar-GLP1 parecen ser una opción para el manejo de la DM en TR. Nuestros resultados sugieren que son seguros y no parecen alterar los niveles valle de tacrolimus ni inducir episodios de RA o desarrollo de DSAn, manteniéndose estable la función renal. La mejora del control metabólico, del peso y la tensión arterial son de gran relevancia en esta población. Por todo ello se necesitan estudios prospectivos, controlados y randomizados que nos permitan avanzar en el conocimiento de los efectos de estos agentes en los pacientes TR.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.