Introducción: Estudios recientes sugieren que los niveles del receptor soluble de la uroquinasa (suPAR) podrían ser útiles para diferenciar la glomeruloesclerosis focal y segmentaria (GFS) idiopática de otras glomerulopatías causantes de síndrome nefrótico, pero estos datos no han sido confirmados en estudios independientes. El objetivo de nuestro estudio es analizar si los niveles circulantes de suPAR son útiles para identificar la enfermedad renal primaria en enfermos afectos de síndrome nefrótico secundario a GFS, enfermedad por cambios mínimos o nefropatía membranosa (NM) idiopática. Métodos: Se realizaron mediciones de niveles de suPAR circulante en el momento del diagnóstico en 60 pacientes con síndrome nefrótico secundario a GFS, enfermedad por cambios mínimos (ECM) y NM. Se analizaron las correlaciones entre niveles de suPAR y variables demográficas, clínicas y bioquímicas. La sensibilidad y la especificidad de suPAR para diferenciar a los enfermos con GFS se analizaron mediante curvas ROC. Resultados: Tras ajustar por edad y función renal, los niveles de suPAR fueron significativamente más elevados en enfermos con GFS que en ECM (p < 0,001), pero no hubo diferencias entre GFS y NM (p = 0,12). Un valor de suPAR ≥ 3452 pg/ml tuvo una sensibilidad del 73,7 % y una especificidad del 72,5 %, con un área bajo la curva (ABC) de 0,782 ± 0,124, p = 0,001, para identificar a los enfermos con GFS. Tras excluir a los enfermos con NM, un valor ≥ 3531 pg/ml tuvo una especificidad del 99,93 % para diferenciar entre ECM y GFS. Conclusiones: Los valores de suPAR por sí solos no diferencian entre los tres tipos de glomerulopatía. Sin embargo, tras excluir el diagnóstico de NM, un nivel de suPAR > 3531 pg/ml podría tener una elevada especificidad (pero baja sensibilidad) para el diagnóstico de GFS.
Introduction: Recent studies suggest that soluble urokinase-type plasminogen activator receptor (suPAR) levels could be useful for distinguishing idiopathic focal segmental glomerulosclerosis (FSGS) from other glomerulopathies that cause nephrotic syndrome, but these data have not been confirmed in independent studies. The objective of our study is to analyse whether circulating levels of suPAR are useful for identifying primary kidney disease in patients with nephrotic syndrome secondary to FSGS, minimal change disease or idiopathic membranous nephropathy (MN). Methods: We measured circulating suPAR at diagnosis in 60 patients with nephrotic syndrome secondary to FSGS, minimal change disease (MCD) and membranous nephropathy (MN). The correlations between suPAR levels and demographic, clinical and biochemical variables were analysed. The sensitivity and specificity of suPAR in distinguishing FSGS patients were analysed by ROC curves. Results: After adjusting for age and renal function, suPAR levels were significantly higher in patients with FSGS than in those with MCD (p<.001), but there were no differences between FSGS and MN (P=.12). A suPAR value ≥3452pg/ml had a sensitivity of 73.7% and a specificity of 72.5%, with an area under the curve (AUC) of 0.782±0.124, p=.001, for identifying patients with FSGS. After excluding patients with MN, a value ≥3531pg/ml had a specificity of 99.93% for distinguishing between MCD and FSGS. Conclusions: suPAR values alone do not distinguish between the three types of glomerulopathy. Nevertheless, after excluding the diagnosis of MN, a suPAR level >3531pg/ml could have a high specificity (but a low sensitivity) in the diagnosis of FSGS.
INTRODUCCIÓN
La enfermedad por cambios mínimos (ECM), la glomeruloesclerosis focal y segmentaria (GFS) y la nefropatía membranosa (NM) son las tres glomerulopatías primarias responsables de la mayor parte de los síndromes nefróticos puros en el adulto1-3. Las tres entidades tienen una forma de presentación similar, por lo que habitualmente no es posible diferenciarlas en función de criterios clínicos o bioquímicos y, para llegar a un diagnóstico de certeza, es necesario realizar una biopsia renal. Actualmente se considera la presencia de un factor de permeabilidad glomerular soluble como principal factor etiológico de la GFS primaria4-10. En un estudio reciente, Wei et al.11 han identificado el receptor soluble de la uroquinasa (suPAR) como uno de los potenciales factores responsables de la lesión podocitaria en la GFS y han propuesto que un nivel sérico superior a 3000 pg/ml podría ser un biomarcador sensible y específico para diferenciar la GFS idiopática de otras formas de síndrome nefrótico. Sin embargo, aunque el número de enfermos con NM incluido en dicho estudio fue escaso, algunos enfermos con NM presentaban valores de suPAR superiores al punto de corte seleccionado, lo que no sugiere que suPAR permita diferenciar adecuadamente entre ambas entidades. Los datos de Wei et al., por otra parte, no han sido reproducidos en un estudio independiente realizado con un escaso número de enfermos en el que no se apreciaron diferencias en los niveles de suPAR entre enfermos con formas primarias y secundarias de GFS ni entre ambas y enfermos con nefropatía por cambios mínimos12,13.
En un estudio posterior, Wei et al.14 midieron los niveles de suPAR en enfermos jóvenes con GFS corticorresistente y en enfermos de edad inferior a 18 años reclutados en el consorcio europeo PodoNet para el estudio del síndrome nefrótico corticorresistente y confirmaron que, en ambos grupos de enfermos con GFS, los valores de suPAR fueron significativamente superiores a los de los controles sanos, pero con una distribución muy heterogénea y una considerable superposición de valores entre enfermos y controles sanos. En la cohorte americana de dicho estudio, los niveles basales de suPAR tuvieron una asociación independiente con el filtrado glomerular, similar a la descrita por Maas et al.12 y con la raza negra, lo que sugiere que el valor de suPAR puede ser distinto en función del nivel de función renal o del grupo étnico estudiado.
En un estudio muy recientemente realizado en China15, en el que se incluyeron tanto niños como adultos con GFS idiopática, NM, ECM y GFS secundaria, se hallaron niveles de suPAR más elevados en los enfermos con GFS idiopática con relación a los demás grupos, pero los niveles de suPAR no diferenciaron la GFS idiopática de otras glomerulopatías debido a la considerable superposición de valores entre grupos. Por otra parte, los niveles medios de suPAR de los enfermos con GFS idiopática descritos en dicho estudio fueron claramente inferiores a los observados en estudios previos11,12, lo que, junto a las evidencias de la influencia racial descritas en la cohorte norteamericana12, sugiere que podría haber diferencias étnicas en la distribución de los niveles de suPAR o en la relación patogénica entre suPAR y GFS. Estos hallazgos sugieren una utilidad clínica de los niveles séricos de suPAR respecto a la GFS cuestionable en la práctica clínica16. Sin embargo, al margen de las posibles diferencias que pueda haber entre estudios en cuanto a variables étnico/geográficas, tamaño de la muestra o criterios de clasificación de formas de GFS idiopáticas, los estudios realizados hasta la fecha coinciden en identificar un grupo de enfermos afectos de GFS que presentan niveles séricos de suPAR elevados, pero los datos aportados no permiten conocer si dicho aumento se asocia o no a unas determinadas características clínicas de la enfermedad.
En el presente estudio, se determinaron los niveles de suPAR circulante en el momento del diagnóstico en una cohorte de enfermos afectos de síndrome nefrótico idiopático causado por ECM, GFS o NM con los objetivos de: 1) Analizar las variables clínicas, bioquímicas e histopatológicas asociadas a los niveles de suPAR circulante. 2) Analizar si el nivel sérico de suPAR es útil para diferenciar a los enfermos con GFS de los enfermos con NCM y NM. 3) Analizar si, en los enfermos con GFS idiopática, hay diferencias en las características clínicas o bioquímicas basales de la enfermedad en función del nivel de suPAR circulante.
PACIENTES Y MÉTODOS
Se incluyeron 60 pacientes con edad > 18 años con síndrome nefrótico puro, definido por la presencia de proteinuria > 3,5 g/día, albumina sérica < 3,5 g/dl, hiperlipidemia y edemas, en ausencia de hematuria o hipertensión arterial, secundario a GFS idiopática, ECM o NM, diagnosticados por biopsia renal. El diagnóstico de GFS primaria se realizó ante la evidencia de lesiones típicas en la microscopía óptica (todas las biopsias fueron analizadas por los mismos patólogos), borramiento difuso de podocitos en ME y tras la exclusión de etiologías secundarias incluyendo: reducción de masa renal, obesidad mórbida, nefropatía asociada a virus de la inmunodeficiencia humana, consumo de heroína o cocaína, infección por parvovirus B19, consumo de analgésicos, bifosfonatos o interferón, reflujo vésico-ureteral o apnea obstructiva del sueño. En 4 enfermos con edad inferior a 30 años, se realizó estudio genético que descartó la presencia de mutaciones en nefrina o podocina. Todos los pacientes con GFS presentaban la variante clásica (NOS). En el estudio de inmunofluorescencia, en 12 pacientes se detectaron depósitos de IgM; en 3, depósitos de C3; en 2, depósitos de IgM y C3, y en 3, ningún depósito. El diagnóstico de ECM idiopática se realizó en ausencia de lesiones evidentes en microscopía óptica y en presencia de fusión podocitaria difusa en la microscopía electrónica, tras descartar antecedentes de consumo de fármacos o procesos linfoproliferativos asociados. El diagnóstico de NM se realizó ante la evidencia de datos característicos en la microscopía óptica y evidencia de depósitos subepiteliales de IgG y C3 en el estudio de inmunofluorescencia. En todos los enfermos con nefropatía membranosa incluidos en el estudio se confirmó la positividad de anticuerpos contra el receptor de la fosfolipasa A2 (anti-PLA2R) y se descartaron posibles causas secundarias, de forma protocolizada. En el momento de obtener las muestras de sangre, ningún paciente recibía tratamiento con corticoesteroides, inmunosupresores, bloqueantes de angiotensina II, antagonistas de receptores de aldosterona o estatinas.
Métodos
La creatinina sérica se midió mediante un método compensado IDMS trazable (Hitachi Modular P-800 Roche Diagnostics, Germany). El filtrado glomerular estimado (eGFR) se calculó mediante la fórmula CKD-EPI17. Las determinaciones de los niveles de suPAR se realizaron en muestras de suero utilizando un ELISA comercial (Human uPAR Quantikine® ELISA kit; R&D Systems, Minneapolis, MN, USA; variabilidad intraensayo: 4,1 %-7,5 %; variabilidad interensayo: 5,1-5,9 %)11. Para analizar la reproductibilidad de las medidas, en 11 enfermos se realizaron tres o más determinaciones de suPAR durante la fase nefrótica previa al inicio del tratamiento apreciándose coeficientes de variación inferiores al 10 %. Las determinaciones de anticuerpos anti-PLA2R, se realizaron mediante un ensayo comercial de inmunofluorescencia (Anti-Phospholipase A2 receptor IIFT; Euroimmun AG, Lübeck, Alemania)18,19.
Análisis anatomopatológico de las biopsias renales
Las biopsias fueron teñidas con hematoxilina-eosina, PAS (ácido peryódico de Schiff)-metenamina y tricrómico de Masson para análisis morfológico y se realizaron estudios de inmunofluorescencia con anticuerpos frente a IgA, IgG, IgM, C3, fibrinógeno y cadenas ligeras y procesadas para estudio con microscopia electrónica. En las biopsias con patrón de NM se realizó tinción inmunohistoquímica con anticuerpos anti-PLA2R (HPA012657, Sigma-Aldrich Co.LLC. St Louis, EE. UU.).
El presente trabajo siguió los parámetros de la Declaración de Helsinki. Todos los pacientes otorgaron consentimiento informado por escrito y el comité de bioética del centro correspondiente aprobó el estudio.
Análisis estadístico
Las variables cuantitativas se expresan como la media ± 1 desviación estándar y las cualitativas como proporción. Las comparaciones de medias entre grupos para datos independientes se realizaron mediante la prueba t de Student en el caso de dos medias o el análisis de la varianza, con la corrección de Bonferroni para la comparación de grupos, en el caso de más de dos medias. La comparación entre variables categóricas se realizó mediante la prueba de χ2. En cada enfermedad renal por separado, se analizó la relación entre niveles de suPAR y variables demográficas y bioquímicas, considerando las concentraciones de suPAR tanto de en forma de variable continua como en terciles. Con objeto de identificar las variables independientemente asociadas con el nivel circulante de suPAR, se realizó análisis de la varianza ordenando las variables estudiadas en tertiles. Tras analizar las diferencias entre grupos, se analizó la sensibilidad y la especificidad de los niveles de suPAR para identificar a los pacientes con GFS, mediante curvas ROC. Se consideró significativo todo valor de p < 0,05. Los cálculos estadísticos se realizaron utilizando el programa SPSS versión 20.0.
RESULTADOS
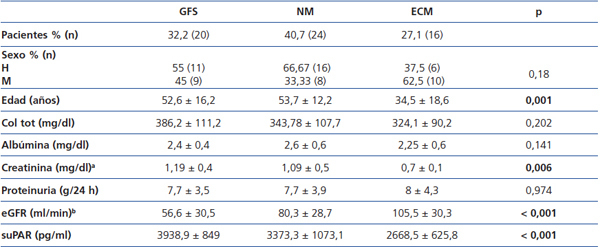
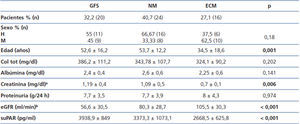
En la tabla 1 se resumen las características clínicas y demográficas de los pacientes incluidos en el estudio. No se observaron diferencias significativas en cuanto a la distribución por sexos entre los grupos de estudio. Los pacientes con ECM presentaron menor edad y menores niveles de albúmina sérica que los pacientes con GFS y NM.
Los pacientes con GFS presentaron valores de eGFR significativamente inferiores respecto a los otros dos grupos y los pacientes con ECM presentaron los valores de eGFR más altos (GFS vs. NM, p = 0,040; GFS vs. ECM, p < 0,001; NM vs ECM, p = 0,045).
No se observaron diferencias significativas entre los valores de suPAR entre sexos en ninguno de los tres grupos de enfermedad glomerular.
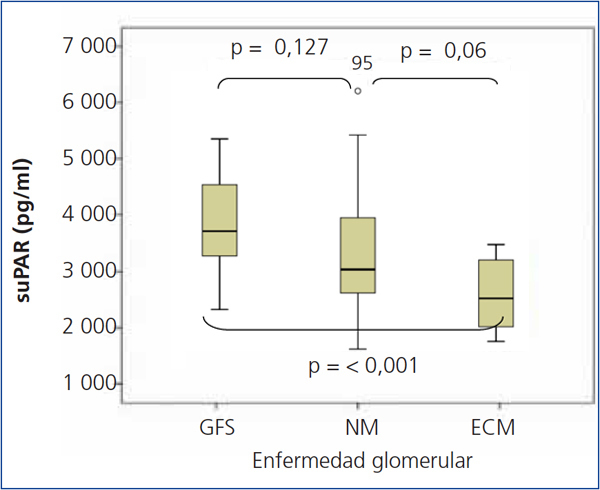
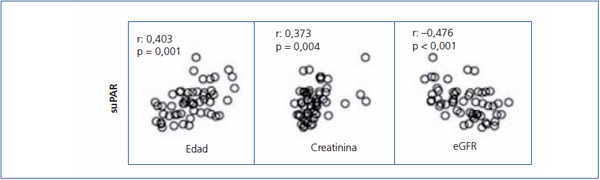
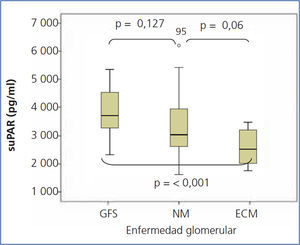
Los niveles de suPAR de los enfermos con ECM fueron significativamente inferiores a los de los enfermos con GFS (2668,5 ± 625,8 vs. 3938,9 ± 849 pg/ml, p < 0,001), pero no se apreciaron diferencias significativas entre enfermos con NM y GFS (3373,3 ± 1073,1 vs. 3938,9 ± 849 pg/ml, p = 0,127) ni entre ECM y NM (2668 ± 625,8 vs. 3373,3 ± 1073,1 p = 0,055) (figura 1). En el conjunto de la muestra de enfermos, los valores de suPAR se correlacionaron positivamente con la edad y creatinina sérica, y negativamente con el eGFR (figura 2). No se observaron correlaciones estadísticamente significativas entre niveles de suPAR y proteinuria.
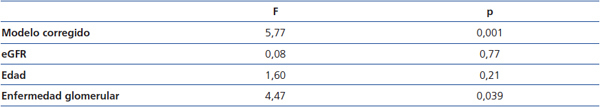
En el análisis de la varianza, se apreció que, tras ajustar por edad y filtrado glomerular, la única variable significativamente asociada con el nivel de suPAR fue el tipo de enfermedad glomerular y esta asociación se debió a que los enfermos con ECM presentaron niveles de suPAR significativamente inferiores que los enfermos con GFS y NM. En conjunto, el modelo explicó un 26,9 % de la variabilidad observada en los niveles de suPAR (F: 4,47, p = 0,039) (tabla 2) y no se explicaban por las diferencias de edad y filtrado glomerular entre los grupos.
Tras agrupar a los pacientes de cada grupo de enfermedad glomerular en función de los respectivos terciles de suPAR, no se apreciaron diferencias significativas en ninguna de las características clínicas o bioquímicas de la enfermedad en el momento del diagnóstico entre grupos (datos no mostrados).
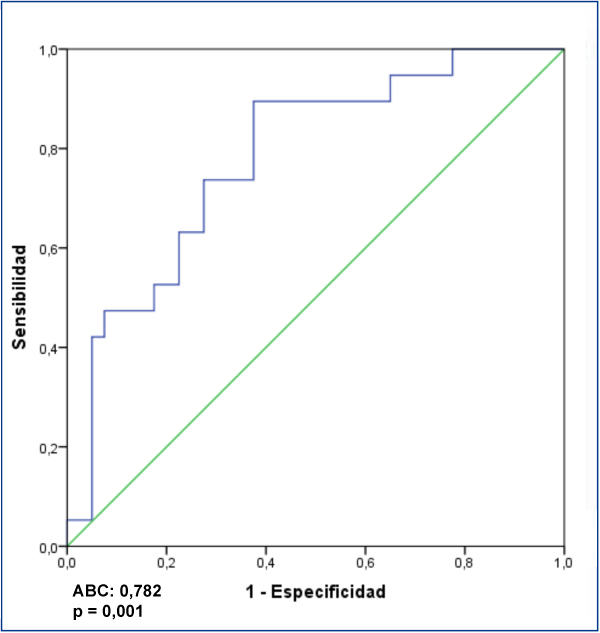
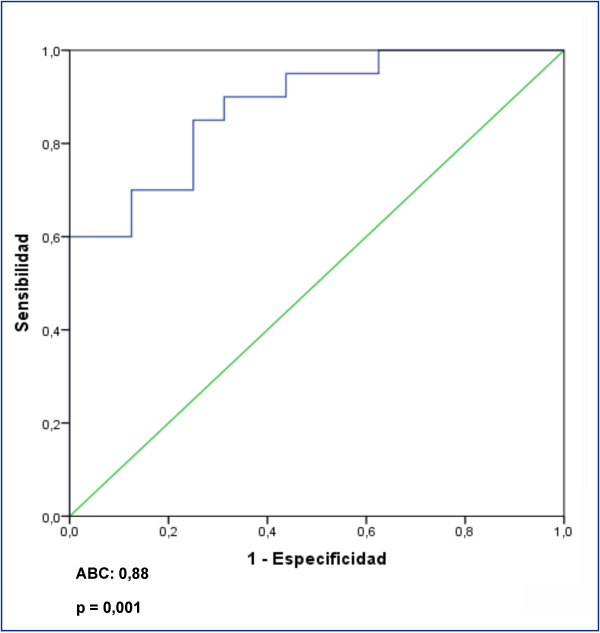
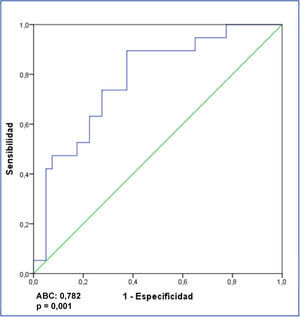
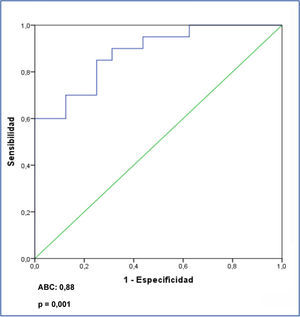
Al analizar el posible valor diagnóstico del nivel sérico de suPAR para la identificación de los enfermos con GFS en el conjunto de los enfermos, se apreció que un valor de 3452 pg/ml tuvo una sensibilidad del 73,7 % y una especificidad del 72,5 %, con un área bajo la curva (ABC) de 0,782 ± 0,124, p = 0,001 (figura 3). Al analizar la capacidad de suPAR para discriminar entre enfermos con GFS y ECM, tras excluir del análisis a los enfermos con NM, se apreció que un valor ≥ 3442,4 pg/ml tuvo una sensibilidad de 70 % y una especificidad de 87,5 %, con un ABC de 0,881 ± intervalo de confianza (IC) al 95 % 0,107, p < 0,001. Valores ≥ 3530,9 pg/ml tuvieron una especificidad del 99,93 % para diferenciar entre ambas entidades (figura 4) a expensas de la sensibilidad.
DISCUSIÓN
Los resultados de nuestro estudio indican que los niveles circulantes de suPAR están relacionados con el tipo de enfermedad renal causante del síndrome nefrótico, pero también con la edad y con la función renal. La relación observada entre niveles de suPAR, edad y filtrado glomerular coincide con la descrita en los estudios previos realizados11-14. En el análisis multivariado, se apreció que, tras realizar los correspondientes ajustes, la única variable con asociación significativa fue el tipo de enfermedad glomerular y la asociación se debió a que los enfermos con ECM presentaron niveles de suPAR significativamente inferiores a los de los enfermos con GFS y NM, sin apreciarse diferencias significativas entre estos dos últimos grupos. Las diferencias halladas entre GFS y ECM coinciden con las descritas en dos estudios previos11,14. Tanto los niveles medios como la distribución de los valores de suPAR observados en nuestro grupo de enfermos con GFS son similares a los descritos por Wei et al.11, pero, a diferencia de ellos, nuestros datos coinciden con los descritos por Huang15 en que niveles de suPAR superiores a 3000 ng/ml no permiten diferenciar adecuadamente a los enfermos con GFS de las otras dos enfermedades glomerulares causantes de síndrome nefrótico. Los enfermos con ECM presentaron una distribución más homogénea y menor variabilidad en los niveles de suPAR que los enfermos con GFS y NM. Dada la amplia dispersión de valores de suPAR observada en el grupo de enfermos con GFS, consideramos que tenía interés analizar si existían diferencias en el perfil clínico de la enfermedad en función del nivel de suPAR, pero no hallamos asociación entre estos últimos y ninguna de las características clínicas o bioquímicas estudiadas.
Mediante análisis de curvas ROC, se apreció que los niveles de suPAR tuvieron escasa sensibilidad y especificidad para identificar de forma adecuada a los enfermos con GFS debido fundamentalmente a la gran superposición de valores entre enfermos con GFS y NM por una parte y entre enfermos con NM y ECM por la otra.
Por otro lado, teniendo en cuanta las claras diferencias que hay entre GFS y ECM en cuanto al pronóstico y/o respuesta al tratamiento y las diferencias observadas entre ambas en los niveles de suPAR, consideramos de especial interés analizar la utilidad de suPAR para diferenciar entre ambas enfermedades glomerulares. Nuestros datos indican que la sensibilidad de suPAR para diferenciar entre ellas fue baja, debido al considerable número de enfermos con GFS y niveles de suPAR bajos. Sin embargo, fue posible identificar un nivel de suPAR con elevada especificidad (99 %) para descartar el diagnóstico de ECM, debido a la baja probabilidad de hallar una concentración de suPAR igual o superior a 3531 ng/ml en la ECM. Este dato, si se confirma en estudios independientes, podría tener implicaciones prácticas en casos en los que la biopsia renal no sea concluyente o en casos clasificados como ECM que no responden al tratamiento de la forma esperada.
El presente estudio tiene como limitación principal el tamaño de la muestra estudiada. Analizando las distribuciones en los niveles de suPAR de cada grupo y las diferencias entre grupos, es posible considerar que la inclusión de un mayor número de enfermos, al reducir la amplitud de los IC, podría resultar en una mayor sensibilidad para diferenciar entre GFS y ECM. Sin embargo, dada la gran dispersión de los niveles de suPAR que se observa tanto en GFS como en NM, aunque el aumento del tamaño de la muestra permitiera detectar diferencias significativas entre ambas, parece incuestionable que un valor bajo de suPAR no permitiría excluir el diagnóstico de GFS, ni un nivel elevado de suPAR, el diagnóstico de NM. Otra limitación a tener en cuenta, que es común a todos los estudios en los que se incluyen enfermos con ambas entidades, es el posible error de clasificación entre ECM y GFS. Los criterios de diagnósticos utilizados en el presente estudio excluyen la posibilidad de que enfermos con ECM hayan sido clasificados como GFS. Sin embargo, debido al carácter focal de las lesiones, no es posible descartar que algún enfermo con GFS haya sido clasificado como ECM al no objetivarse lesiones de esclerosis segmentaria ni en la microscopía óptica ni en la electrónica en la muestra de tejido renal disponible para análisis. Aunque somos conscientes de esta limitación, consideramos que es poco probable que este hecho conlleve un error sistemático que tenga una influencia relevante en los resultados.
En resumen, nuestros datos indican que en enfermos con síndrome nefrótico causado por ECM, GFS o NM, tras ajustar por edad y función renal como principales variables de confusión, los enfermos con ECM presentan niveles séricos de suPAR significativamente inferiores a los de los enfermos con GFS o NM. A pesar de estas diferencias, la gran superposición de valores entre grupos motiva que los valores de suPAR por sí solos no proporcionen información útil en la práctica clínica para diferenciar entre los tres tipos de glomerulopatía. Sin embargo, una vez descartada con certeza la NM como causa del síndrome nefrótico, en los enfermos con dudas diagnósticas entre ECM y GFS, por presencia de patrones de lesión no concluyentes y no siendo posible practicar otra biopsia, un nivel de suPAR superior a 3531 pg/ml podría ser útil como indicador de alto grado de sospecha de GFS.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 2. Variables asociadas a niveles circulantes de receptor soluble de la uroquinasa. ANOVA
Figura 1. Niveles de receptor soluble de la uroquinasa en función del tipo de enfermedad glomerular
Figura 2. Correlaciones entre niveles séricos de receptor soluble de la uroquinasa, variables clínicas y bioquímicas en la muestra
Figura 3. Valores de receptor soluble de la uroquinasa para identificar a los enfermos con glomeruloesclerosis focal y segmentaria idiopática
Tabla 1. Variables clínico-demográficas en la muestra de enfermos estudiada
Figura 4. Curva ROC de valores de receptor soluble de la uroquinasa para discriminar entre glomeruloesclerosis focal y segmentaria y enfermedad por cambios mínimos