La enfermedad renal crónica (ERC) y la diabetes mellitus tipo 2 (DM2) son afecciones crónicas de elevada prevalencia que representan un importante problema de salud pública y requieren un abordaje interdisciplinario. La DM2 es la principal causa de ERC en nuestro medio y también constituye una importante comorbilidad de la nefropatía no diabética. Los pacientes con diabetes e insuficiencia renal son un grupo de especial riesgo, pues presentan una mayor morbimortalidad y un superior riesgo de hipoglucemias que los sujetos diabéticos con función renal normal. El tratamiento de la DM2 en los pacientes con ERC resulta controvertido dada la escasez de evidencias disponibles. El presente documento de consenso pretende facilitar la adecuada elección y dosificación de los fármacos antidiabéticos y el establecimiento de unos objetivos seguros de control glucémico en los pacientes con ERC.
Chronic kidney disease (CKD) and type 2 diabetes mellitus (T2DM) are highly prevalent chronic diseases that represent a significant public health problem and require multidisciplinary management. T2DM is the main cause of CKD in our setting and it is also a major comorbidity of non-diabetic nephropathy. Patients with diabetes and renal failure represent a special risk group as they have higher morbidity and mortality and are at a higher risk of hypoglycaemia than diabetic individuals with normal renal function. Treatment of T2DM in patients with CKD is controversial because of the scarcity of evidence available. This consensus document aims to facilitate the appropriate selection and dosage of anti-diabetic drugs as well as establishing glycaemic control safety targets in patients with CKD.
INTRODUCCIÓN
Epidemiología
La enfermedad renal crónica (ERC) y la diabetes mellitus tipo 2 (DM2) son enfermedades crónicas muy prevalentes que representan un importante problema de salud pública, generan un gran consumo de recursos y requieren para su abordaje una adecuada coordinación de los diversos profesionales implicados en su atención1,2.
La DM2 ha adquirido un carácter pandémico1,3. La prevalencia de diabetes en España se ha estimado cercana al 14 % de la población adulta4. Asimismo, la ERC es un problema emergente en todo el mundo. En España, el estudio Epidemiología de la Insuficiencia Renal Crónica en España –EPIRCE– estimó que aproximadamente el 10 % de la población adulta sufriría de algún grado de ERC5.
La diabetes es un importante factor de riesgo modificable para el desarrollo de ERC. La DM2 representa la principal causa de ERC y es una morbilidad frecuente en la nefropatía no diabética. Se ha estimado que el 27,9 % de los pacientes con DM2 en España presentan ERC6 y que más del 35 % tienen microalbuminuria, proteinuria o ERC7. Según estos datos, en España existirían cerca de 2 millones de personas con diabetes y diversos grados de afectación renal. Estudios realizados en diferentes países han encontrado que, en población con DM2, la prevalencia de microalbuminuria (la manifestación más precoz de nefropatía diabética) y de proteinuria es del 27-43 % y del 7-10 %, respectivamente8-10. La prevalencia de proteinuria se incrementa de forma significativa a partir de los 15 años del diagnóstico de la diabetes11. La presencia de albuminuria en pacientes con DM2 es un factor predictivo de insuficiencia renal crónica, siendo la duración media desde el inicio de la proteinuria hasta la insuficiencia renal terminal de 7 años12. El riesgo de aparición de insuficiencia renal se multiplica por 25 en el diabético con respecto a la población no diabética7. En España, un 22 % de los pacientes con DM2 presentan una disminución del filtrado glomerular (FG) por debajo de 60 ml/min/1,73 m213. Según datos de la Sociedad Española de Nefrología (S.E.N.) correspondientes al año 2010, la diabetes representa la principal causa de ERC avanzada en España y es responsable del 24,7 % de los casos de tratamiento sustitutivo renal, aunque en algunas regiones, como las Islas Canarias, esta tasa alcanza el 45 %14. En nuestro país, los pacientes con diabetes y ERC tienen más edad y presentan una mayor morbilidad cardiovascular (dislipidemia, cardiopatía isquémica, insuficiencia cardíaca o enfermedad vascular periférica) que la población no diabética con ERC15, así como una mayor mortalidad, que en el 49 % de los casos es de causa cardiovascular (datos no publicados correspondientes al estudio MERENA de la S.E.N.).
Estimación de la función renal y clasificación de la enfermedad renal crónica
Dado que la DM2 es un factor de riesgo para el desarrollo de ERC y que la prevalencia de ERC oculta o no diagnosticada es muy elevada, se recomienda realizar al menos anualmente un cribado de la función renal, mediante la determinación del FG y de la albuminuria, en todos los pacientes con DM216,17. Para evaluar la función renal, la estimación del FG es más fiable que la medida de la creatinina plasmática, especialmente en el paciente con diabetes. La guía Kidney Disease Global Outcomes (KDIGO) 201218 recomienda la utilización de la fórmula de Chronic Kidney Disease Epidemiology –CKD-EPI– 19.
Las guías K-DOQI20 definen la ERC como la presencia durante al menos 3 meses de un FG inferior a 60 ml/min/1,73 m2 o de lesiones renales estructurales (alteraciones histológicas en la biopsia renal) o funcionales (albuminuria, alteraciones en el sedimento urinario o en las pruebas de imagen) que puedan provocar potencialmente un descenso del FG.
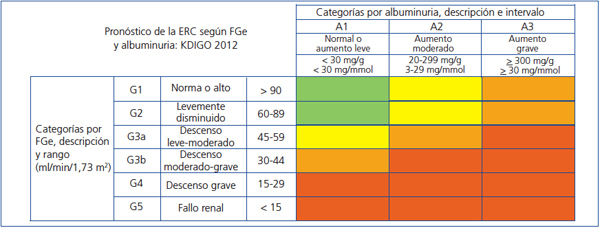
La nueva clasificación pronóstica de la ERC propuesta por la KDIGO18 se basa en estadios de FG y albuminuria (figura 1).
El documento de consenso sobre ERC suscrito por la S.E.N. y la Sociedad Española de Medicina de Familia y Comunitaria en 2008 ya estableció que el diagnóstico precoz de la ERC oculta es importante, muy especialmente en el paciente con diabetes, para disminuir la morbilidad, la progresión de la ERC y la mortalidad de dichos pacientes16.
TRATAMIENTO DE LOS FACTORES DE RIESGO VASCULAR EN EL PACIENTE CON DIABETES Y ENFERMEDAD RENAL CRÓNICA
Importancia pronóstica de la enfermedad renal crónica en el paciente con diabetes
La nefropatía diabética es un importante marcador de morbimortalidad en el paciente con diabetes. La microalbuminuria y la disminución del FG por debajo de 60 ml/min/1,73 m2 son considerados un factor principal de riesgo cardiovascular en el informe del Joint National Committee21 y de lesión subclínica de órganos diana en las Guías Europeas de las sociedades europeas de Hipertensión y Cardiología22, respectivamente.
En el estudio Action in Diabetes and Vascular disease: preterAx and diamicroN-MR Controlled Evaluation (ADVANCE) se observe que, a medida que aumentaba la albuminuria y disminuía el FG estimado, el paciente con DM2 presentaba más acontecimientos cardiovasculares, de manera que para un cociente albúmina/creatinina > 300 mg/g y un FG estimado de 60 ml/min/1,73 m2, el riesgo de sufrir un acontecimiento cardiovascular o renal fue 3,2 y 22 veces mayor, respectivamente, que en los pacientes con ambos valores normales23.
La presencia de proteinuria en el paciente con diabetes, incluso con cifras normales de FG, es un potente indicador de progresión de enfermedad renal y de mortalidad24,25. La macroalbuminuria es mejor predictor de la tasa de deterioro renal que el nivel del FG basal26. La tasa de deterioro renal es también mayor en ancianos diabéticos27.
La ERC se asocia a un marcado incremento de episodios cardiovasculares (infarto de miocardio, insuficiencia cardíaca crónica, accidente cerebrovascular, arteriopatía periférica) genéricamente encuadrados en el llamado síndrome cardiorrenal tipo IV28. Recientemente, las Guías Europeas han considerado la ERC (definida como un FG inferior a 60
ml/min/1,73 m2) como un equivalente coronario29.
Objetivos de control de presión arterial en el paciente con diabetes y enfermedad renal crónica
La hipertensión es un factor implicado en la progresión de la ERC conjuntamente con la proteinuria y el mal control del metabolismo hidrocarbonado. En pacientes con ERC, el objetivo del tratamiento antihipertensivo es triple: reducir la presión arterial, reducir el riesgo de complicaciones cardiovasculares y retardar la progresión de la ERC. Alguna revisión sistemática estima que el buen control tensional en el diabético hipertenso es de tan solo el 12 %30, aunque datos recientes señalan una tendencia favorable en el control de la hipertensión arterial. En España, el estudio PRESCAP 201031, realizado en Atención Primaria en una población de casi 13 000 pacientes hipertensos que incluía un 31 % de sujetos con diabetes, casi el 50 % de los pacientes tenían un adecuado control tensional. Por otro lado, los pacientes con diabetes presentan con frecuencia hipertensión nocturna no diagnosticada, lo que podría explicar en parte el exceso de riesgo cardiovascular de algunos pacientes. Además, en el normotenso diabético de años de evolución hay que descartar una posible hipertensión enmascarada, que puede estar presente hasta en un 29 % de las ocasiones32. En el caso de los hipertensos con diabetes, un 4,9 % de los que tienen buen control de la presión arterial en la consulta presentan un mal control en la monitorización ambulatoria de la presión arterial (MAPA)33. Por todo ello, debe considerarse un uso rutinario y protocolizado de la MAPA en el paciente con diabetes, especialmente si presenta ERC.
En general, se recomiendan cifras de presión arterial clínica < 140/90 mmHg en el paciente con ERC26,34. Sin embargo, la presencia de diabetes puede hacer aconsejable un objetivo tensional algo inferior. La reciente Guía Europea sobre Hipertensión Arterial35 cifra un objetivo general de presión arterial sistólica < 140 mmHg para todos los pacientes, incluso para sujetos de alto riesgo, incluyendo aquellos con diabetes y con ERC. En ancianos, se propone un objetivo más flexible de 140-150 mmHg. La American Diabetes Association recomienda en pacientes con diabetes unos objetivos generales de control de presión arterial de < 140/80 mmHg36.
Objetivos de control lipídico en el paciente con diabetes y enfermedad renal crónica
Uno de los factores que aceleran el deterioro funcional renal es la dislipidemia, independientemente de su efecto promotor de la arterioesclerosis.
De acuerdo con las últimas Guías Europeas29, los sujetos con ERC deben considerarse de alto o muy alto riesgo cardiovascular, sin requerir aplicar escalas de riesgo. Así, la presencia de ERC con FG < 60 ml/min/1,73 m2 clasifica al sujeto como equivalente coronario y establece un objetivo de c-LDL < 70 mg/dl o una reducción del 50 % si el objetivo previo no es alcanzable.
Datos obtenidos de análisis post-hoc apoyan la capacidad de las estatinas de reducir las complicaciones cardiovasculares en pacientes con estadios de ERC 2 y 337,38. Los resultados en ERC estadios 4 y 5, o en hemodiálisis no son tan claros39,40. Sin embargo, en el estudio SHARP, que incluyó un importante número de pacientes con diabetes, se observó una reducción del 17 % en los episodios cardiovasculares en los sujetos con ERC, estadios 3, 4 y 5, tratados con simvastatina-ezetimiba frente a placebo. Esta reducción no se observó en aquellos pacientes con diálisis41.
El fármaco de elección es la estatina, sola o asociada a ezetimiba. Las estatinas con escasa eliminación renal, como atorvastatina y fluvastatina, no requieren ajuste de dosis en pacientes con ERC. La dosis de simvastatina y pravastatina debe reducirse en pacientes con FG < 30 ml/min. Según su ficha técnica, rosuvastatina no requiere ajuste de dosis con FG > 60 ml/min, debe usarse a dosis medias si el FG es < 60 ml/min, y está contraindicada en pacientes con ERC avanzada. Pitavastatina debe usarse con precaución en pacientes con insuficiencia renal moderada o grave, evitando dosis máximas en estos casos. Ezetimiba no requiere ajuste de dosis.
Para el tratamiento de la hipertrigliceridemia grave se utilizan fibratos y ácidos grasos omega-3. La mayor parte de las guías recomiendan como fibrato de elección el gemfibrozilo, aunque se desaconseja su uso si el FG es < 15 ml/min.
Hay que tener en cuenta que el riesgo de rabdomiolisis por estatinas se incrementa en pacientes con ERC. El riesgo se incrementa en más de 5 veces con el tratamiento combinado de estatinas y fibratos (en esta situación se debe usar fenofibrato en vez de gemfibrozilo), por lo que este doble tratamiento debe usarse con cautela y siguiendo una estrecha monitorización.
Antiagregación en el paciente con diabetes y enfermedad renal crónica
Las guías KDIGO18 aconsejan el uso de antiagregantes en pacientes con ERC con riesgo de complicaciones ateroscleróticas siempre y cuando su riesgo de sangrado no supere el beneficio esperado. Esta recomendación, que se ha generalizado al paciente con diabetes, es de difícil aplicación clínica cuando el sujeto presenta un FG < 60 ml/min, dado que en estos casos se cumplen ambas condiciones (aterosclerosis más frecuente y riesgo de sangrado por la insuficiencia renal), por lo que es particularmente importante la individualización de tal indicación y que la presión arterial esté bien controlada (< 140/90 mmHg). En caso de utilizarse, no deberá superarse la dosis de 100 mg/día de ácido acetilsalicílico.
TRATAMIENTO DE LA HIPERGLUCEMIA EN EL PACIENTE CON ENFERMEDAD RENAL CRÓNICA
Valoración del control glucémico en pacientes con enfermedad renal crónica
La hemoglobina glucosilada (HbA1c) es el parámetro de referencia para valorar el control metabólico en el paciente con ERC, aunque en esta existen unas circunstancias que limitan su precisión. Por un lado, la uremia favorece la formación de carbamilato de hemoglobina, que interfiere en la determinación de la HbA1c cuando se determina mediante cromatografía líquida de alta presión, dando lugar a niveles falsamente elevados. Por el contrario, hay otros factores que pueden producir un falso descenso en los niveles de HbA1c, como la menor vida media de los eritrocitos, las transfusiones y el aumento de la eritropoyesis tras el tratamiento con eritropoyetina42-47.
Este falso descenso de los valores de HbA1c y la falta de correlación con los niveles de glucemia se observan sobre todo en los pacientes en hemodiálisis que están recibiendo estimulantes de la eritropoyesis48. Aunque algunos autores aconsejan utilizar la determinación de albúmina glucosilada como método de evaluación del control glucémico49,50, esta posición no es la mayoritariamente aceptada. La alternativa en estos casos sería realizar controles frecuentes de la glucemia capilar.
Hipoglucemia y enfermedad renal crónica
La ERC es un factor de riesgo para el desarrollo de hipoglucemia. Los pacientes con diabetes y ERC, en comparación con los que no presentan ERC, tienen un riesgo doble de sufrir una hipoglucemia grave51.
En la ERC concurren diversas circunstancias predisponentes a la hipoglucemia. La mayoría de los fármacos antidiabéticos presentan excreción renal, por lo que su semivida se incrementa en pacientes con ERC. Por otro lado, la insulina tiene un aclaramiento renal, por lo que las necesidades de esta suelen reducirse en presencia de insuficiencia renal (FG < 60 ml/min/1,73 m2)52; además, la degradación de la insulina en los tejidos periféricos disminuye en pacientes con ERC53. Por último, los pacientes con uremia frecuentemente presentan hiporexia, desnutrición y reducción de los depósitos de glucógeno hepático54, y la gluconeogénesis renal disminuye a medida que se reduce la masa renal53,55. El riesgo de hipoglucemia grave puede ser particularmente alto en pacientes en diálisis y en aquellos que sufren neuropatía autonómica, en los que los síntomas de alarma adrenérgicos suelen estar ausentes.
Por otro lado, el tratamiento intensivo de la DM2 se asocia a un incremento del riesgo de hipoglucemia grave56. Además, los estudios The Action to Control Cardiovascular Risk in Diabetes (ACCORD)57, ADVANCE58 y Veterans Affairs Diabetes Trials –VADT– 59 han demostrado que la hipoglucemia grave es un marcador de mortalidad cardiovascular y total en los pacientes con DM2.
En consecuencia, a la hora de planificar el tratamiento antidiabético en pacientes con ERC es muy importante minimizar el riesgo de episodios de hipoglucemia mediante el establecimiento de unos objetivos seguros de control glucémico y una adecuada elección y dosificación de los fármacos antidiabéticos.
Objetivos de control glucémico en el paciente con enfermedad renal crónica
Una de las principales decisiones en el abordaje de la DM2 es establecer los objetivos de control glucémico. Cada vez se enfatiza más la necesidad de individualizar los objetivos de HbA1c, pero no se han establecido métodos para aplicar unos criterios de individualización específicos para pacientes con ERC.
El United Kingdom Prospective Diabetes Study (UKPDS)60 demostró que el tratamiento intensivo de la glucemia (HbA1c 7,9 frente a 7 %) reducía un 25 % las complicaciones microvasculares en general, un 33 % la aparición de microalbuminuria, y un 39 % la progresión a proteinuria. A partir de este estudio, se estableció como objetivo general alcanzar una HbA1c inferior al 7 %. Sin embargo, el estudio UKPDS se llevó a cabo en pacientes con DM2 de inicio, en su mayoría sin enfermedad cardiovascular ni renal, por lo que sus conclusiones no pueden aplicarse a sujetos con ERC.
El estudio ADVANCE58, realizado en pacientes con DM2 y al menos un factor de riesgo vascular, encontró que el control intensivo de la glucemia (HbA1c 6,5 frente a 7,3 % en el grupo control) produjo a los 5 años de seguimiento una reducción del 10 % del resultado combinado de complicaciones macrovasculares y microvasculares mayores, principalmente como consecuencia de una reducción del 21 % de la nefropatía. También hubo una disminución significativa del 9 % en la aparición de microalbuminuria61.
El estudio ACCORD57, realizado en población con DM2 evolucionada (media de 10 años) y antecedentes de enfermedad cardiovascular clínica o subclínica y/o múltiples factores de riesgo, encontró un exceso de mortalidad global (22 %) en el grupo de control intensivo respecto al grupo de control glucémico convencional (HbA1c 6,4 frente a 7,5 %).
En base a estos resultados, actualmente se recomienda la individualización de los objetivos de control glucémico en función de las características clínicas y psicosociales del paciente62. Sin embargo, la mayoría de los estudios que han valorado el objetivo de control glucémico mediante HbA1c no tenían estratificados a los pacientes en función del FG o el aclaramiento de creatinina; a lo sumo, el estado de la función renal fue valorado mediante los niveles de creatinina plasmática, por lo que las evidencias existentes en este sentido son limitadas.
En pacientes con DM2 de corta evolución, sin comorbilidad importante, con un bajo riesgo de episodios de hipoglucemia y con buena expectativa de vida, es recomendable realizar un control glucémico intensivo y alcanzar una HbA1c de
6,5-7 %29. Esta recomendación podría ser aplicable a pacientes con DM2 y ERC leve (FG > 60 ml/min/1,73 m2), especialmente si presentan microalbuminuria, ya que el control estricto de la glucemia en estos casos puede retrasar la progresión de la lesión renal61.
Por el contrario, en pacientes con DM2 de larga duración, con comorbilidad importante, marcado riesgo de episodios de hipoglucemia, alto riesgo vascular o corta expectativa de vida, se recomienda un control glucémico menos intensivo (HbA1c 7,5-8 %)62. Estos objetivos podrían asumirse para pacientes con ERC moderada-avanzada (FG < 60 ml/min/1,73 m2), dado su carácter de equivalente coronario29, su elevado riesgo de episodios de hipoglucemia y la ausencia de evidencias sobre la prevención de la progresión de la ERC en estos casos. En ancianos frágiles puede ser preferible, incluso, un objetivo de control glucémico más laxo (HbA1c < 8,5 %)63. No obstante, un control glucémico más estricto (HbA1c < 7 %) puede estar justificado en estos pacientes siempre que pueda obtenerse de forma segura, con fármacos que no condicionen riesgo de hipoglucemias y que sean bien tolerados.
Las guías K/DOQI 200549 no tienen establecido un nivel óptimo de HbA1c para los pacientes en diálisis. Algunos estudios con un tamaño muestral pequeño han mostrado algún beneficio microvascular optimizando el control50,64-66, aunque no se ha evidenciado una mejora de la supervivencia67.
FÁRMACOS HIPOGLUCEMIANTES EN EL PACIENTE CON INSUFICIENCIA RENAL CRÓNICA
Metformina
La metformina es el fármaco de elección en el tratamiento de la DM2 dada su eficacia hipoglucemiante, su seguridad y bajo riesgo de episodios de hipoglucemia, y sus beneficios demostrados a largo plazo62,68.
La metformina se elimina principalmente sin ser metabolizada, por vía renal mediante filtración glomerular y secreción tubular. Por tanto, los pacientes con insuficiencia renal son más susceptibles a su acumulación y al desarrollo de acidosis láctica, complicación que puede resultar mortal. Por este motivo, según la ficha técnica, no debe utilizarse en pacientes que presenten un FG inferior a 60 ml/min/1,73 m2 y se aconseja monitorizar anualmente la función renal. Sin embargo, la relación entre acidosis láctica y acumulación de metformina no está bien documentada69. Debe destacarse que el riesgo de acidosis láctica es muy bajo (5/100.000 pacientes/año) y se asocia habitualmente a situaciones de hipoxia70. Además, en los últimos años ha aumentado de forma considerable la experiencia en la utilización de la metformina, de tal forma que (basándose en estudios observacionales) su empleo se considera razonablemente seguro en pacientes con FG de entre 45 y 60 ml/min/1,73 m2, monitorizando la función renal cada 3-6 meses; si el FG es de entre 30 y 45 ml/min/1,73 m2 se recomienda reducir al 50 % la dosis de metformina, monitorizar la función renal cada 3 meses y no iniciar nuevos tratamientos; cuando el FG es inferior a 30 ml/min/1,73 m2 el uso de metformina debe evitarse70.
La función renal debe determinarse siempre antes de comenzar el tratamiento con metformina, y después periódicamente, prestando una atención especial a aquellos pacientes que se encuentran en situaciones en las que se puede alterar la función renal, como pueden ser el tratamiento con diuréticos o con antiinflamatorios no esteroideos, o el riesgo de deshidratación (por ejemplo, en pacientes con demencia). La metformina debe suspenderse temporalmente cuando existan vómitos, diarreas u otras causas potenciales de deshidratación. Cuando se administren contrastes yodados, o frente a una intervención quirúrgica mayor, se recomienda su suspensión 24 h antes o, si no ha sido posible, retirarla el día de la prueba o intervención, y esperar 48 h para su reintroducción hasta comprobar la función renal del paciente71.
En conclusión, se recomienda:
1. Monitorizar la función renal antes de iniciar el tratamiento con metformina y periódicamente tras su instauración, especialmente en pacientes con factores de riesgo de deterioro de la función renal (diuréticos, antiinflamatorios no esteroideos, contrastes yodados, deshidratación).
2. Reducir la dosis de metformina cuando el FG esté entre 30 y 45 ml/min/1,73 m2 y no utilizarla cuando sea inferior a 30 ml/min/1,73 m2.
3. Suspender temporalmente la metformina ante circunstancias que pongan en riesgo la función renal (vómitos, diarrea, radiocontrastes, cirugía mayor).
Sulfonilureas
Dado que el riesgo de hipoglucemia se incrementa marcadamente en la ERC, las sulfonilureas no se consideran fármacos de elección en pacientes con insuficiencia renal. En caso de utilizarlas deberá considerarse cuidadosamente su metabolismo y el grado de función renal53,72. Las fichas técnicas de las diferentes sulfonilureas existentes en el mercado son poco precisas cuando se refieren a su empleo en pacientes con insuficiencia renal, por lo que el documento de consenso ha optado por realizar las recomendaciones de uso de las sulfonilureas en base a su diferente farmacocinética.
La glibenclamida y la glimepirida son metabolizadas en el hígado a metabolitos activos que conservan acción hipoglucemiante y se eliminan por la orina, por lo que se acumulan en caso de ERC y pueden producir hipoglucemias graves de duración prolongada. En particular, el empleo de glibenclamida debe evitarse en pacientes con ERC de cualquier grado, tal como recoge su ficha técnica, puesto que es la sulfonilurea con mayor riesgo de hipoglucemia73,74. La ficha técnica de la glimepirida señala que su uso está contraindicado en pacientes con alteraciones graves de la función renal. La recomendación de este consenso es limitar el uso de glimepirida, ajustando la dosis, a pacientes con FG > 60 ml/min/1,73 m275.
La gliclazida y la glipizida, tras su metabolización hepática, generan metabolitos inactivos que son eliminados en su mayor parte por la orina, por lo que tienen un menor riesgo de producir hipoglucemias graves. Las fichas técnicas de ambos fármacos indican que pueden utilizarse en pacientes con insuficiencia renal leve o moderada, ajustando la dosis y monitorizando cuidadosamente la función renal.
La gliquidona se metaboliza en el hígado y sus metabolitos inactivos se excretan por la bilis, por lo que no requiere ajuste de dosis ni está contraindicada en pacientes con ERC76.
Sin embargo, existen pocas evidencias que avalen el empleo de sulfonilureas en pacientes con ERC grave77,78, por lo que la recomendación de este consenso es limitar su uso a pacientes con un FG > 45 ml/min/1,73 m2.
Las sulfonilureas se ligan a proteínas plasmáticas, especialmente a la albúmina, por lo que, en caso necesario, no se pueden eliminar mediante diálisis. Algunos fármacos (betabloqueantes, warfarina, salicilatos, gemfibrozilo, sulfamidas, tiazidas) pueden desplazarlas de su unión con la albúmina aumentando los niveles del fármaco libre, con el consiguiente riesgo de hipoglucemia.
En conclusión:
1. El riesgo de hipoglucemia por sulfonilureas se incrementa en pacientes con ERC, por lo que, en general, su uso no es recomendable.
2. Su empleo debería limitarse a pacientes con FG > 45 ml/min/1,73 m2.
3. En caso de utilizarlas, se recomienda el uso (ajustando dosis) de gliclazida, glipizida o (sin necesidad de ajuste de dosis) gliquidona.
Glinidas
Las glinidas son fármacos secretagogos, por lo que su uso puede provocar hipoglucemias79. Al contrario que las sulfonilureas, las glinidas tienen un metabolismo hepático, con menos de un 10 % de eliminación renal, y su semivida es más corta. Aunque algunos estudios no han encontrado diferencias en la tasa de episodios de hipoglucemia entre las glinidas y otros secretagogos73, en general se acepta que el riesgo de hipoglucemia asociado al uso de glinidas es menor que con las sulfonilureas80.
La repaglinida puede utilizarse con cualquier grado de insuficiencia renal, incluso en pacientes en diálisis. A pesar de ello, es recomendable iniciar el tratamiento con una dosis baja (0,5 mg).
La nateglinida, pese a tener metabolismo hepático, se degrada a metabolitos activos que se excretan a nivel renal, por lo que no está recomendada en la ERC. Además, su potencia hipoglucemiante es muy limitada.
En conclusión, la repaglinida es el secretagogo más recomendable en los pacientes con ERC.
Glitazonas
Las glitazonas tienen un metabolismo hepático, y su excreción por la orina es inferior al 2 %; en consecuencia, no hay acumulación de metabolitos activos en la ERC. La farmacocinética de la pioglitazona, la única comercializada en Europa en la actualidad, no se ve afectada por la función renal, por lo que no requiere ajuste de dosis, ni siquiera en pacientes en diálisis, si bien la experiencia clínica en estos pacientes es muy limitada.
La pioglitazona no induce episodios de hipoglucemia, mejora el perfil lipídico y ha demostrado cierto beneficio cardiovascular y un efecto nefroprotector en pacientes con ERC81. Su uso se asocia a retención hidrosalina, edemas e incremento del riesgo de insuficiencia cardiaca82, lo que limita su empleo en pacientes con ERC; la retención hidrosalina es máxima cuando se usa en combinación con insulina. Además, aumenta el riesgo de osteoporosis y fracturas, especialmente en mujeres posmenopáusicas83, y su empleo prolongado se ha asociado a un posible incremento del riesgo de cáncer de vejiga84.
En conclusión, aunque la pioglitazona puede utilizarse en cualquier grado de ERC, sus efectos adversos (edemas, insuficiencia cardíaca, fracturas, riesgo de carcinoma de vejiga) limitan su indicación en pacientes con dicha enfermedad. La recomendación del consenso es emplearla con precaución en pacientes con FG < 60 ml/min/1,73 m2 y evitar su indicación cuando el FG sea < 30 ml/min/1,73 m2.
Inhibidores de alfaglucosidasa
Tanto la acarbosa como el miglitol y sus metabolitos se acumulan en la ERC, por lo que, aunque no se ha documentado que aumenten el riesgo de hipoglucemia, su uso no está recomendado53, dada su potencial toxicidad, especialmente a nivel hepático85, y sus efectos adversos gastrointestinales.
Inhibidores de la dipeptidil peptidasa-4
En la actualidad son 4 los inhibidores de la dipeptidil peptidasa-4 (DPP4) comercializados en España: sitagliptina, vildagliptina, saxagliptina y linagliptina. Las gliptinas, al estimular la secreción de insulina de forma dependiente de la glucosa, tienen un muy bajo riesgo de hipoglucemias77, por lo que su empleo es especialmente atractivo en pacientes de ERC86.
Aunque comparten el mismo mecanismo de acción, las gliptinas presentan importantes diferencias farmacocinéticas que condicionan su forma de utilización en presencia de ERC.
Sitagliptina, vildagliptina y saxagliptina se eliminan en su mayor parte mediante excreción renal, bien sin metabolizar (sitagliptina), bien como metabolitos activos (vildagliptina y saxagliptina). En consecuencia, estos 3 fármacos requerirán ajuste de la dosis cuando el FG sea < 50 ml/min/1,73 m2. La sitagliptina se debe usar a dosis de 50 y 25 mg cuando el FG sea de 50-30 ml/min/1,73 m2 y < 30 ml/min/1,73 m2 (incluyendo diálisis), respectivamente87. La vildagliptina se debe usar a dosis de 50 mg si el FG es < 50 ml/min/1,73 m2, incluida la ERC en estadio 588. La saxagliptina se debe usar a dosis de 2,5 mg en los pacientes con FG < 50 ml/min/1,73 m2; aunque saxagliptina no tiene indicación de uso en pacientes con ERC terminal o diálisis, un estudio reciente ha mostrado su seguridad en estos casos89.
La linagliptina tiene una eliminación hepatobiliar, por lo que su semivida apenas se prolonga en la ERC90 y por ello no precisa ajuste de dosis, ni siquiera en pacientes con ERC avanzada91, pudiendo emplearse también en pacientes diabéticos en diálisis.
En conclusión:
1. Las gliptinas son fármacos que han demostrado ser eficaces y seguros en pacientes con ERC.
2. Requieren ajuste de dosis, a excepción de linagliptina.
3. Aunque pueden emplearse en casos de ERC avanzada o terminal, la experiencia de uso en estos casos es aún limitada.
Agonistas del receptor del péptido-1 similar al glucagón
Los glucagon-like peptide-1 receptor agonists (GLP1-RA, «agonistas del receptor del GLP-1») actualmente comercializados en España son exenatida, exenatida LAR, lixisenatida y liraglutida. Los 3 primeros derivan de una proteína de origen animal, la exendina, mientras que liraglutida es un análogo del GLP-1 humano. Por su duración, pueden clasificarse en GLP1-RA de acción corta y de acción larga. Entre los primeros se incluyen exenatida, que se administra 2 veces al día, y lixisenatida, que se administra en dosis única diaria; entre los de acción larga se encuentran liraglutida, que se administra una vez al día, y exenatida LAR, de administración semanal.
Los GLP1-RA, al tratarse de péptidos, se eliminan por filtración glomerular, seguido de reabsorción tubular y posterior degradación proteolítica, que da como resultado péptidos de menor tamaño y aminoácidos, los cuales se reincorporan al metabolismo de las proteínas. Aunque teóricamente, al no sufrir un metabolismo específico hepático ni renal, ni eliminarse por las heces o la orina, podrían ser fármacos seguros y sin necesidad de ajuste de dosis en pacientes con ERC, su uso está limitado por los potenciales efectos adversos y la falta de experiencia clínica en estos casos.
Según sus respectivas fichas técnicas, exenatida, exenatida LAR y lixisenatida pueden usarse sin ajuste de dosis en pacientes con FG > 50 ml/min/1,73 m2. Liraglutida tampoco requiere ajuste de dosis con FG > 60 ml/min/1,73 m2. Exenatida puede emplearse en pacientes con FG entre 30 y 50
ml/min/1,73 m2, procediendo a una cuidadosa escalada de dosis, siendo la dosis máxima de 5 mg/12 h. Lixisenatida, según su ficha técnica, también puede emplearse con precaución en estos casos92. Aunque se ha comunicado la eficacia y seguridad de la liraglutida en pacientes con ERC moderada93, la escasa experiencia clínica justifica que, en la ficha técnica, no se recomiende su empleo cuando el FG sea < 60 ml/min/1,73 m2. En pacientes con FG < 30 ml/min/1,73 m2, los GLP1-RA no deben utilizarse dada la falta de experiencia clínica.
Los GLP1-RA son los únicos fármacos antidiabéticos que inducen una pérdida significativa de peso, por lo que pueden estar especialmente indicados en pacientes con DM2 y obesidad. Además, no inducen episodios de hipoglucemia, lo que supone una ventaja en pacientes con alto riesgo de padecerlos, como ocurre en la ERC. Sin embargo, el tratamiento con GLP1-RA se asocia con frecuencia a efectos adversos gastrointestinales (náuseas, vómitos, diarrea), los cuales pueden ser más frecuentes en pacientes con ERC93. Por ello, cuando usemos GLP1-RA en pacientes con ERC es importante vigilar la tolerancia del paciente, y monitorizar la función renal en caso de vómitos o diarrea. La presencia de neuropatía del sistema autónomo y gastroparesia, frecuente en pacientes con diabetes y ERC, podría facilitar la aparición de vómitos. Los GLP1-RA también inducen natriuresis. Las pérdidas digestivas y renales (especialmente en pacientes tratados con diuréticos o inhibidores del sistema renina-angiotensina-aldosterona) pueden condicionar una contracción del volumen extracelular que conlleve un deterioro de la función renal en pacientes con disfunción renal previa. En pacientes tratados con exenatida se han descrito casos de insuficiencia renal aguda, tanto de origen prerrenal94 como por nefritis intersticial aguda95.
En conclusión:
1. Existe poca experiencia de uso de los GLP1-RA en pacientes con ERC.
2. Los efectos adversos gastrointestinales inducidos por los GLP1-RA pueden ser más frecuentes en los pacientes con ERC.
3. Actualmente su uso está limitado a pacientes con ERC leve-moderada.
Inhibidores del cotransportador sodio-glucosa tipo 2
Los inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT2-inh), como la dapagliflozina, la canagliflozina y la empagliflozina, actúan inhibiendo la reabsorción de glucosa en el túbulo proximal.
La eficacia de los SGLT2-inh depende de la función renal, por lo que se reduce en pacientes con ERC moderada y es prácticamente nula en la ERC avanzada93.
Dapagliflozina, el primer fármaco de esta familia autorizado en España, puede usarse sin ajuste de dosis en pacientes con insuficiencia renal leve, y no está indicado en aquellos con FG < 60 ml/min/1,73 m2. Se recomienda la monitorización de la función renal antes de iniciar dapagliflozina y al menos anualmente (entre 2-4 veces al año en pacientes con función renal alterada, y antes de iniciar el tratamiento concomitante con medicamentos que puedan reducir la función renal). Si la función renal cae por debajo de un FG < 60 ml/min/1,73 m2, debe interrumpirse el tratamiento con dapagliflozina94.
Son fármacos de administración oral que no provocan hipoglucemia, inducen pérdida de peso y ligeros descensos de la presión arterial. Su uso se asocia a un incremento de infecciones urinarias y de micosis genital. Puesto que provocan diuresis osmótica, sobre todo en casos de hiperglucemia importante, pueden causar deshidratación, hipotensión y deterioro de la función renal, especialmente en ancianos o en pacientes tratados con fármacos antihipertensivos. No se recomienda su uso concomitante con diuréticos, en situaciones de depleción de volumen (por ejemplo, gastroenteritis aguda) ni en personas mayores de 75 años.
Insulina
La ERC se asocia a resistencia a la insulina. Sin embargo, la ERC avanzada produce una disminución del catabolismo renal de la insulina, por lo que suele ser necesaria una reducción de la dosis de esta, siendo posible incluso la interrupción del tratamiento insulínico en algunos pacientes con DM2 y ERC avanzada (burnt-outdiabetes)95.
El tratamiento con insulina en pacientes con ERC requiere una monitorización estrecha para ajustar dicho tratamiento, siendo muy importante asegurar una adecuada educación terapéutica en diabetes. El régimen de insulinoterapia se adaptará a los objetivos de control, pudiendo contemplarse tanto un tratamiento insulínico convencional como una terapia intensiva.
Como norma general, que deberá adaptarse a cada paciente en base a la monitorización de la glucemia, se puede decir que no se precisa ajuste de la dosis de insulina mientras el FG no descienda a menos de 60 ml/min/1,73 m2; por debajo de este FG la dosis debe reducirse en aproximadamente un 25 %, y si baja de 20 ml/min/1,73 m2 se reducirá un 50 %96.
La diálisis revierte parcialmente la resistencia a la insulina y el menor catabolismo de esta asociados a la ERC. Como resultado de todo ello, las necesidades de insulina en un paciente determinado en programa de diálisis dependerán del balance entre la mejora de la sensibilidad de la insulina y la normalización del metabolismo de la insulina, por lo que la individualización del tratamiento resulta esencial.
Es muy recomendable vigilar la glucemia en el paciente en hemodiálisis y recordar que después de la sesión este es más susceptible de desarrollar hipoglucemia –el líquido de diálisis contiene habitualmente una concentración de glucosa de 100 mg/dl, por lo que puede ser aconsejable disminuir la dosis de insulina prediálisis y, en cualquier caso, estar prevenidos ante posibles episodios de hipoglucemia posdiálisis97. Se recomienda el uso de insulina de acción larga (glargina, detemir o NPH) para los requerimientos basales, con la adición de insulina de acción rápida antes de las comidas si es necesaria. Los análogos basales (glargina, detemir) y rápidos (aspart, lispro, glulisina) inducen menos hipoglucemias que las insulinas humanas (NPH o regular), con el inconveniente de tener un coste más elevado. En algunos pacientes, con horarios de comidas muy regulares, pueden utilizarse las insulinas premezcladas. Para pacientes con DM2 y ERC estadio 5 la dosis inicial total diaria de insulina suele ser 0,25 UI/kg, con ajustes posteriores individualizados, en función del autocontrol glucémico98. Las particularidades del tratamiento insulínico en pacientes con diálisis se escapan de los objetivos del consenso. Hay que enfatizar que no existen pautas fijas de insulinoterapia y que todas las guías de práctica clínica recomiendan la individualización y contar con el apoyo de un experto para los casos de diabetes de difícil control.
En pacientes con diálisis peritoneal, la administración de insulina intraperitoneal puede ser preferible a su administración subcutánea, pues consigue un mejor control glucémico, aunque empeora el perfil lipídico (descenso del colesterol de lipoproteínas de alta densidad, incremento de triglicéridos)99. Por otra parte, hay que tener en cuenta que el líquido de diálisis peritoneal tiene un contenido muy elevado de glucosa, si bien las soluciones de infusión intraperitoneal más recientes llevan una menor cantidad o han sustituido la glucosa por icodextrina. Tampoco en estos casos existen pautas fijas y, una vez más, es aconsejable la individualización100.
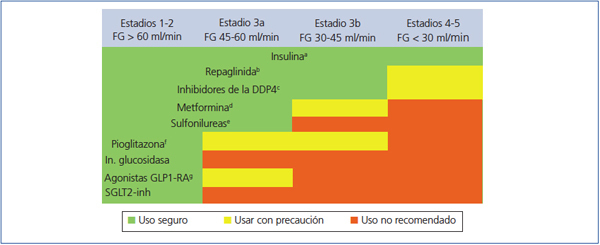
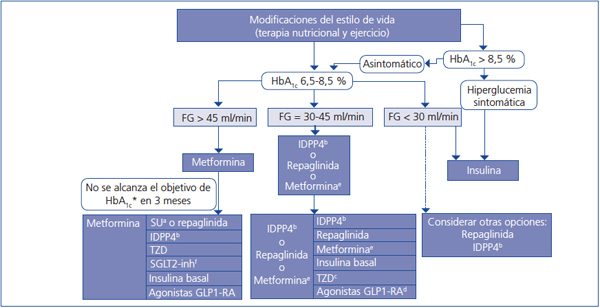
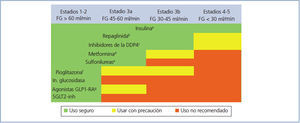
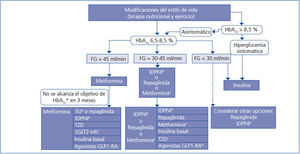
Elección del tratamiento hipoglucemiante en el paciente con enfermedad renal crónica (figura 2 y figura 3)
La metformina sigue siendo el fármaco de primera línea en el tratamiento de la DM2 en todos los pacientes con un FG estimado superior a 45 ml/min/1,73 m2.
Cuando el FG está entre 30 y 45 ml/min/1,73 m2, el empleo de metformina debe ser prudente, dado el riesgo de acidosis láctica, y es recomendable reducir la dosis y monitorizar estrechamente la función renal. Tanto la repaglinida como los inhibidores de la DPP4 han demostrado su utilidad y seguridad en pacientes con este rango de valores de FG, si bien es necesaria una reducción de la dosis habitual de estos fármacos, con excepción de la linagliptina, que no requiere ajuste de dosis.
En pacientes con FG < 30 ml/min/1,73 m2 o en diálisis, la experiencia con los fármacos antidiabéticos no insulínicos es muy limitada hasta ahora, por lo que el tratamiento de elección debe ser la insulina. No obstante, en los pacientes con hiperglucemia no muy marcada, tanto la repaglinida como los inhibidores de DPP4 son alternativas a valorar.
En pacientes con FG > 45 ml/min/1,73 m2 en los que no se consigue el objetivo de control glucémico con metformina, se puede asociar, bien un inhibidor de DPP4, bien repaglinida, asociaciones de efectividad contrastada. Si aun así el control no es el adecuado, se debería añadir insulina basal. Existe poca experiencia con la triple terapia oral en esta población.
Si el FG es < 45 ml/min/1,73 m2, el segundo escalón sería la combinación de un inhibidor de DPP4 y repaglinida, pasando a la insulinización con una insulina basal si no se alcanzase el objetivo de control. La combinación de insulina con fármacos secretagogos incrementa el riesgo de episodios de hipoglucemia, por lo que, en general, no es recomendable en estos pacientes.
En conclusión, la diabetes mellitus es una enfermedad de alta prevalencia en los pacientes con ERC. Actualmente disponemos de múltiples opciones de tratamiento de la hiperglucemia, que seguirán incrementándose en el futuro próximo. El adecuado uso de estos fármacos requiere un amplio conocimiento de su farmacocinética y de su perfil de seguridad por parte de todos los profesionales implicados en el tratamiento del paciente con diabetes y ERC.
Conflictos de interesés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Estadificación de la enfermedad renal crónica según la guía Kidney Disease Global Outcomes 2012
Figura 2. Indicación de fármacos antidiabéticos según el grado de insuficiencia renal
Figura 3. Algoritmo terapéutico en pacientes con diabetes mellitus tipo 2 y enfermedad renal crónica