El tacrolimus (Tac) es un inmunosupresor ampliamente usado para prevenir el rechazo en el trasplante renal. Los pacientes reciben una dosis inicial estándar y se miden los niveles sanguíneos, con ajuste de la dosis hasta alcanzar una concentración dentro del rango aceptado. Existe una gran variabilidad interindividual en las dosis necesarias para alcanzar ese nivel diana en sangre, y muchos pacientes requieren varias modificaciones de la dosis hasta alcanzarlo. Uno de los principales determinantes de estas diferencias es un polimorfismo del gen CYP3A5 que determina que alrededor del 80 % de los caucásicos sean metabolizadores lentos y requieran dosis menores que los metabolizadores rápidos. Se ha propuesto que los pacientes trasplantados reciban dosis iniciales de Tac con base en el genotipo CYP3A5. Para que este procedimiento fuese aceptado por los clínicos, deberían demostrarse sus ventajas frente al procedimiento actual, más allá de un menor tiempo para alcanzar la dosis óptima. Por ejemplo, menor tasa de nefrotoxicidad y rechazo o menor coste por necesitar, entre otros, menos modificaciones de la dosis de Tac y menos terapia de inducción con anticuerpos.
Tacrolimus (FK-506) is an immunosuppressant widely used to prevent kidney transplant rejection. Patients receive an initial standard dose and tacrolimus levels are measured in blood. If necessary, the dose is adjusted to reach a blood concentration within the accepted range. There is great interindividual variability in the dose required to achieve the target blood level, and many patients require multiple modifications of the dose to reach the range. One of the main determinants of these differences is a CYP3A5 gene polymorphism that determines that about 80% of Caucasians are poor metabolisers and require lower doses compared to the extensive metabolisers. It has been proposed that transplanted patients could receive an initial Tacrolimus dose based on the CYP3A5 genotype. This could reduce the time to achieve the optimal blood level, reducing the number of dose modifications. However, to be accepted by clinicians and translated to the clinical practice this adapted dose procedure should give additional advantages such as a significant reduction of the rates of nephrotoxicity and rejection, or a lower cost due to less dose modifications of Tacrolimus and less antibody induction therapy.
INTRODUCCIÓN
El objetivo del tratamiento inmunosupresor es prevenir el rechazo del injerto. Para ello se administran fármacos que actúan sobre distintas vías de la respuesta aloinmune, tratando de obtener el mayor grado de inmunosupresión, pero minimizando la toxicidad y otros efectos adversos, especialmente el desarrollo de tumores y de infecciones1. El tratamiento inmunosupresor recomendado consiste en una terapia inicial de «inducción» con anticuerpos (monoclonales o policlonales) dirigida a evitar el rechazo temprano y a reducir las dosis de otros inmunosupresores, especialmente anticalcineurínicos; y una inmunosupresión de mantenimiento con tres fármacos: un inhibidor de la calcineurina, como el tacrolimus o la ciclosporina A, un inhibidor de la síntesis de purinas (micofenolato mofetilo [MMF]) y esteroides2. Otros inmunosupresores, como los inhibidores del receptor de la rapamicina en mamíferos (sirolimus y everolimus), aunque no se suelen utilizar desde el principio, permiten realizar distintas combinaciones inmunosupresoras a lo largo del tiempo.
Para la mayoría de los fármacos cada paciente recibe una dosis inicial en función de variables como el peso y la edad. En el caso de que los niveles del fármaco se puedan medir en la sangre, la dosis puede ser ajustada hasta un valor sanguíneo dentro de un rango aceptable. En el caso de los inmunosupresores, una dosis demasiado baja podría resultar en rechazo del órgano, y una demasiado alta en toxicidad. La variación en los genes (mutaciones y polimorfismos) que codifican proteínas implicadas en la metabolización de los fármacos puede condicionar la concentración sanguínea del principio farmacológicamente activo. Las proteínas codificadas por estos genes con relevancia farmacogenética pueden actuar a nivel de la absorción intestinal (condicionando así la cantidad del fármaco que pasa al torrente sanguíneo) o en el hígado, generando moléculas terapéuticamente inactivas o activas. Por último, pueden modificar al fármaco o sus metabolitos para facilitar su eliminación. Para la mayoría de los genes que participan en esos procesos hay polimorfismos que determinan formas más o menos activas de las proteínas, por lo que a partir de los genotipos correspondientes podríamos incluir a cada paciente dentro de grupos de mejor/peor respuesta terapéutica. En esta revisión analizamos la farmacogenética del tacrolimus, discutiendo los pros y los contras de decidir la dosis con base en el genotipo del paciente.
TACROLIMUS: MECANISMO DE ACCIÓN, FARMACOCINÉTICA Y FARMACODINÁMICA
El tacrolimus (FK-506) es un inhibidor de la calcineurina, una fosfoproteína que promueve la transcripción de genes implicados en el crecimiento y diferenciación de los linfocitos T-CD4. Cuando el tacrolimus se une a su diana intracelular, se produce una inhibición de la transcripción de genes como la interleucina-23. Este inmunosupresor se caracteriza por su variabilidad farmacocinética (interindividual) y tener un margen terapéutico estrecho4. Debido a ello, se requiere la monitorización de las dosis de forma continuada durante las primeras semanas posteriores al trasplante con el objetivo de alcanzar un nivel sanguíneo adecuado para evitar el rechazo (niveles demasiado bajos) o la nefrotoxicidad (demasiado altos)5,6. Aunque se absorbe de forma rápida (a nivel intestinal), su biodisponibilidad oral es muy baja: de la dosis total que recibe el paciente solo el 25 % pasaría a la sangre. La concentración sanguínea máxima se alcanza entre una y tres horas después de la toma. La administración, bien en dos tomas (Prograf®, Astellas®) o en una sola toma diaria en el caso de la forma de liberación prolongada (Advagraf®), debería iniciarse dentro de las 24 horas posteriores al trasplante; aunque atendiendo a las características del donante puede haber diferencias entre los centros, tanto en las pautas de administración y las dosis como en las combinaciones con otros inmunosupresores. En el caso del trasplante renal el estudio Symphony recomienda una dosis oral inicial de tacrolimus en el rango 0,10-0,30 mg/kg/día, en función de las características de donante y receptor y de la medicación inmunosupresora asociada7.
A nivel intestinal el tacrolimus es sustrato de la glicoproteína-P (PgP) o MDR-1 (multidrug resistance-1), codificada por el gen ABCB18-10. Esta proteína se encuentra en la membrana de los enterocitos y regula el paso de sustancias desde el interior de la célula hacia el espacio extracelular a través de un mecanismo dependiente de adenosín trifosfato (ATP). Una vez en la sangre, el tacrolimus llegará al hígado, donde es metabolizado por citocromo-P450 reductasas de la familia CYP3A, fundamentalmente CYP3A5 y CYP3A411. Finalmente, los metabolitos son excretados por la orina y la bilis. El estrecho margen terapéutico y la gran variabilidad farmacocinética y farmacodinámica entre individuos hacen necesario medir los niveles sanguíneos del tacrolimus y sus metabolitos para ajustar la dosis hasta alcanzar una concentración circulante adecuada12. Existen varios métodos de medición basados en el empleo de anticuerpos (ELISA) o en la espectrometría de masas. La monitorización de los niveles «valle» de tacrolimus (C0) es fundamental durante los primeros días posteriores al trasplante y se realiza inmediatamente antes de cada toma. En el caso del trasplante renal, el estudio Symphony recomienda que los valores C0 en sangre total se hallen entre 5 y 20 ng/ml durante las primeras semanas posteriores al trasplante, y entre 3 y 12 ng/ml cuando el paciente pase a la terapia de mantenimiento7. La monitorización y ajuste de la dosis debe realizarse cuando se introduzcan cambios en el régimen inmunosupresor, en su forma farmacéutica, o después de la administración de otros fármacos que pudieran interferir con su absorción y/o metabolismo (como el clopidogrel y la simvastatina). Estas modificaciones de la dosis serían también necesarias cuando haya sospechas de nefrotoxicidad13,14.
FARMACOGENÉTICA DEL TACROLIMUS
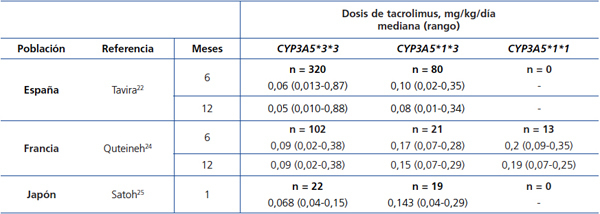
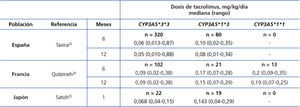
El principal determinante de variabilidad interindividual en las dosis de tacrolimus es la actividad del citocromo P450-3A5, codificado por el gen CYP3A5. De todos los polimorfismos de este gen, un cambio de un solo nucleótido (SNP), conocido como CYP3A5*3 (SNP rs776746), es el principal regulador de la dosis óptima15-19. Esta variante se halla en el intrón 3 del gen CYP3A5 y afecta al procesamiento del pre-ARNm, de forma que no tiene lugar una unión perfecta entre los exones 3 y 4. El ARNm resultante tendrá una secuencia anómala, por lo que es inestable y será eliminado por la célula, de forma que no se llega a sintetizar proteína20,21. Así, los portadores de dos copias (homocigotos) del alelo CYP3A5*3 carecen de la proteína (no expresores) frente a los portadores de al menos una copia del alelo normal (designado como CYP3A5*1)22-26. En resumen, CYP3A5*3 permitiría clasificar a cada paciente en un fenotipo «metabolizador lento» (homocigotos CYP3A5*3*3), «metabolizador intermedio» o «metabolizador rápido» (heterocigotos CYP3A5*1*3 y homocigotos CYP3A5*1*1, respectivamente). Estos últimos necesitarían las dosis más altas para alcanzar los niveles diana de tacrolimus (tabla 1)24-26. Otras variantes génicas podrían estar implicadas en la metabolización del tacrolimus, aunque los resultados obtenidos hasta la fecha no son tan concluyentes como los del CYP3A5*327-30. Las diferencias en las frecuencias de los alelos del gen CYP3A5 entre grupos étnicos podrían explicar el mayor requerimiento de dosis en los afroamericanos: mientras que alrededor del 80 % de los caucásicos son metabolizadores lentos (homocigotos para el alelo CYP3A5*3), la mayoría de los sujetos de raza negra son homocigotos CYP3A5*1*1 (metabolizadores rápidos)31,32. Estas diferencias genéticas podrían también explicar el mayor riesgo de rechazo y nefrotoxicidad entre los afroamericanos33.
Alrededor del 40 % del tacrolimus que recibe un paciente sería metabolizado por el P450-3A4. En el gen CYP3A4 se han hallado variantes que podrían afectar a la actividad de este citocromo y, por tanto, a los niveles/dosis de sus fármacos sustrato. En el caso del tacrolimus el polimorfismo CYP3A4*1B (SNP rs2740574) en la región promotora del gen (-392 A>G) ha sido relacionado con las dosis, precisando los portadores del alelo CYP3A4*1B dosis mayores del fármaco22,34,35. El efecto podría deberse a que este alelo se traduciría en mayores niveles de la proteína. Por otro lado, se han descrito recientemente algunas variantes que podrían afectar al metabolismo del tacrolimus, como el polimorfismo CYP3A4*2236,37. Sin embargo, otros estudios no apoyan un efecto significativo de esta variante del CYP3A4 sobre los requerimientos de dosis38,39. A la hora de valorar estas discrepancias debemos tener en cuenta que la mayoría de los portadores del alelo CYP3A4*22 son a su vez homocigotos para el alelo CYP3A5*3, por lo que resulta difícil cuantificar su efecto en los pacientes metabolizadores rápidos para CYP3A539.
El gen ABCB1 codifica la PgP, una proteína que se expresa en muchos tipos celulares y tejidos y regularía la absorción intestinal de muchos fármacos. Se ha descrito una relación entre el polimorfismo C3435T (SNP rs1045642) en el exón 26 del gen y la expresión intestinal de esta glicoproteína, por lo que este (y otros polimorfismos) podría condicionar los requerimientos de dosis de varios fármacos40,41. En el caso del tacrolimus varios estudios hallaron una relación significativa entre la dosis y el genotipo del polimorfismo C3435T17,28,42. Sin embargo, este efecto no ha sido confirmado por otros y tampoco afectaría a la dosis en nuestros pacientes17,22,28,42-44. La expresión de la PgP en las células renales podría condicionar la cantidad de tacrolimus que accede a su interior y, por tanto, el nivel de toxicidad. En este sentido, ha sido descrita una relación entre el genotipo C3435T del donante y el riesgo de nefrotoxicidad45. Aunque este estudio abriría una nueva vía farmacogenética en el trasplante renal, está basado en un número reducido de pacientes, por lo que debería confirmarse en otras poblaciones.
APLICACIÓN CLÍNICA DE LA FARMACOGENÉTICA DEL TACROLIMUS
La dosis inicial de tacrolimus se determina en función de variables como la edad, el peso o la raza del paciente7,46,47. Algunos autores han propuesto algoritmos para calcular la dosis inicial que incluyen como variable el genotipo CYP3A5, que debería ser determinado antes del trasplante. En teoría, la inclusión del genotipo podría reducir el número de ajustes de la dosis y el tiempo necesario para alcanzar la concentración sanguínea deseada. Para varios fármacos, la elección de una dosis con base en el genotipo ya figura como recomendación de la Food and Drug Administration y otras agencias. En el caso del tacrolimus, para que la comunidad médica aceptase la farmacogenética como criterio de prescripción, el genotipo del paciente debería otorgar alguna ventaja significativa sobre el procedimiento actual: por ejemplo, la reducción del porcentaje de rechazo u otros eventos adversos; menos modificaciones de las dosis postrasplante; ahorro gracias a la reducción del gasto farmacéutico o de la estancia hospitalaria, etc. Sin embargo, hasta ahora no hay estudios que hayan demostrado claramente las ventajas de dar una dosis inicial variable según el genotipo frente al procedimiento actual de una dosis prefijada.
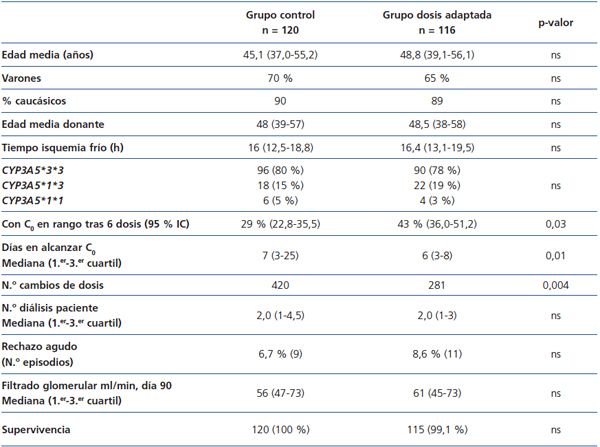
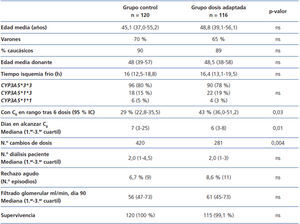
Para demostrar esas ventajas, habría que tratar a un grupo de pacientes con una dosis inicial basada en el genotipo y comparar los resultados con los de otro grupo de similares características (edad, sexo, régimen inmunosupresor) que reciben tacrolimus según las pautas tradicionales. El estudio que más se aproximaría es uno realizado sobre 236 trasplantados renales divididos en dos grupos: 120 pacientes (grupo control) recibieron 0,2 mg/kg/día y 116 pacientes (grupo dosis adaptada) una dosis según el genotipo CYP3A5: 0,15 mg/kg/día los metabolizadores lentos (homocigotos CYP3A5*3*3, n = 90) y 0,30 mg/kg/día los rápidos (portadores CYP3A5*1, n = 26)48. Ahora bien, los pacientes empezaron a recibir tacrolimus a partir del séptimo día posterior al trasplante (y no desde el primer día), manteniéndose bajo terapia de inducción con basiliximab (Simulect®; Novartis, Basel, Switzerland) o con globulina antitimocítica (Thymoglobulin®; Genzyme, Cambridge, MA) durante esa semana. Los dos grupos fueron comparados para el porcentaje de casos con valor C0 en el rango 10-15 ng/l tras seis dosis orales de tacrolimus, tiempo necesario para alcanzar ese rango, número de modificaciones de la dosis hasta alcanzar el rango, número de sesiones de diálisis hasta funcionamiento del órgano, incidencia de rechazo agudo (demostrado por biopsia), pérdida del órgano y fallecimiento48. El estudio concluyó que tras tres días de tratamiento con tacrolimus había un mayor porcentaje de pacientes que alcanzaban el valor diana C0 (43,2 % frente a 29,1 %; p = 0,03) en el grupo de dosis adaptada, y estos pacientes necesitaron también menos modificaciones de la dosis. Sin embargo, la incidencia de rechazo agudo o los valores de la función renal eran similares entre los dos grupos (tabla 2). El tamaño de la muestra sería suficiente para alcanzar una potencia estadística del 80 %.
Puesto que midiendo los niveles y ajustando la dosis diariamente la mayoría de los pacientes alcanzarían el nivel diana en sangre dentro de las dos primeras semanas posteriores al trasplante, el nefrólogo podría ver poca utilidad en dosificar según el genotipo en ausencia de otras ventajas. Dado que el estudio de Thervet et al. incluyó pacientes tratados con terapia de inducción y una dosis elevada de MMF, no resulta extraño que no hubiese diferencias en el porcentaje de rechazo agudo y otras variables clínicas. Por tanto, habría que evaluar el papel de dosificar según el genotipo en pacientes sin terapia de inducción y prescribiendo la dosis de tacrolimus inmediatamente después del trasplante, en lugar de esperar una semana49.
CONCLUSIONES
Aunque el papel del genotipo del CYP3A5 como determinante de las dosis de tacrolimus es incuestionable, la utilidad de dar una dosis inicial con base en el genotipo podría depender de ventajas más allá de la reducción del número de modificaciones de la dosis. Se necesitan ensayos que demuestren que dar una dosis adaptada reduciría las tasas de nefrotoxicidad y rechazo, o ahorro económico por un menor requerimiento de terapias de inducción o menos tiempo de hospitalización.
CONCEPTOS CLAVE
AGRADECIMIENTOS
Estudio financiado por la Red de Investigación Renal del Instituto de Salud Carlos III (RD12/0021/0012; RD12/0021/0018).
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Dosis diaria de tacrolimus (mediana y rango) según el genotipo CYP3A5 en tres series de trasplantados renales
Tabla 2. Resumen del estudio de Thervet et al.48