Objetivo: Evaluar valores de corte (VC) para el diagnóstico del síndrome coronario agudo (SCA) en pacientes con insuficiencia renal crónica (IRC) para los biomarcadores cardíacos troponina I cardíaca (TnIc) y creatina cinasa MB (CK-MB) diferentes a los recomendados por los fabricantes de los reactivos y utilizados habitualmente en los laboratorios. Métodos: Realizamos un estudio prospectivo de pruebas diagnósticas en pacientes con IRC con una tasa de filtración glomerular estimada con la ecuación MDRD4 < 60 ml/min ingresados por sospecha de SCA según la historia clínica, la exploración física y el electrocardiograma. Se evaluó la concentración de TnIc y CK-MB al ingreso hospitalario y a los seis meses, utilizando dos sistemas analíticos diferentes (para TnIc, los analizadores Access® y Vidas®, y para CK-MB, los analizadores Access® y Vitros®). Resultados: Durante el período de estudio, se incluyeron 484 pacientes con IRC y sospecha de SCA. Se diagnosticó SCA en el 12 % de los pacientes (58/484), mientras que se encontraron otras patologías cardíacas en el 29 % (140/484) y otras patologías no cardíacas en el 59 % (286/484). Para la TnIc del analizador Access® con el VC habitual (≥ 0,5 ng/ml), la sensibilidad fue de 43 % y la especificidad de 94 %, mientras que para el VC propuesto (≥ 0,11 ng/ml), los valores fueron 68 y 83 %, respectivamente. Para la TnIc del analizador Vidas® con el VC habitual (≥ 0,11 ng/ml), la sensibilidad fue de 64 % y la especificidad de 87 %, mientras que para el VC propuesto (≥ 0,06 ng/ml), los valores fueron 75 y 79 %, respectivamente. La sensibilidad y especificidad de ambas CK-MB fueron inferiores comparadas con la TnIc. Conclusión: Los VC propuestos en este estudio para ambas TnIc para el diagnóstico de SCA en pacientes con IRC de grado 3 a 5 son significativamente diferentes de los utilizados para la población general.
Objective: The aim of our study was to evaluate cut-off values for acute coronary syndrome (ACS) diagnosis in patients with chronic renal failure (CRF) for the cardiac biomarkers cardiac troponin I (cTnI) and creatine kinase MB isoenzyme (CK-MB) as compared to the cut-off values proposed by the manufacturers and those frequently used in the laboratory. Method: We performed a prospective study in patients with CRF with a glomerular filtration rate estimated by the MDRD-4 equation <60mL/min and admitted with suspected acute coronary syndrome due to clinical history, physical examination, and electrocardiography. cTnI and CK-MB measurements were assessed upon hospitalisation and six months later using two different analytical methods (for cTnI: Access® and Vidas® analysers, and for CK-MB: Access® and Vitros® analysers). Results: During the study period, 484 patients with CRF and suspected ACS were assessed. ACS was diagnosed in 12% of patients (58/484), while we found other cardiac pathologies (OCP) in 29% of patients (140/484) and other non-cardiac pathologies (ONCP) in 59% of patients (286/484). For cTnI assessed using the Access® analyser with the usual cut-off value (≥0.5ng/mL), sensitivity was 43% and specificity was 94%, while for the proposed cut-off value (≥0.11ng/mL), the values were 68% and 83%, respectively. For cTnI assessed using the Vidas® analyser with the usual cut-off value (≥0.11ng/mL), sensitivity was 64% and specificity was 87%, while for the proposed cut-off value (≥0.06ng/mL), the values were 75% and 79%, respectively. The sensitivity and specificity for both CK-MB were lower compared with cTnI. Conclusion: The cut-off values proposed in this study for both cTnI in patients with CRF (stage 3 to 5) to diagnose ACS are significantly different from that of the general population.
INTRODUCCIÓN
Las enfermedades cardiovasculares (ECV) son la principal causa de muerte en el mundo y también en los pacientes con insuficiencia renal crónica (IRC)1-3, los cuales tienen un riesgo aumentado de presentar síntomas clínicos atípicos4-6 durante un síndrome coronario agudo (SCA) comparado con la población general. Además, la morbilidad derivada de las ECV tiene importancia sociosanitaria y económica, ya que implica el uso de recursos clínicos y terapéuticos costosos y se calcula que el 75-85 % de los pacientes evaluados en Urgencias o ingresados en los hospitales por sospecha de SCA no tienen este diagnóstico final7-8.
Por otra parte, de todos los biomarcadores de daño miocárdico, como la creatina cinasa total (CK), la creatina cinasa MB (CK-MB), la mioglobina, la troponina I cardíaca (TnIc) y la troponina T cardíaca (TnTc), se considera que las troponinas son el pilar sobre el que se apoya la evaluación clínica, la estratificación del riesgo y la indicación terapéutica de los pacientes con SCA que acuden a los Servicios de Urgencias de los hospitales, pero estos biomarcadores pueden estar elevados en los pacientes con IRC en ausencia de un cuadro clínico de isquemia miocárdica como el SCA, por lo que su interpretación puede ser difícil9-14.
En este estudio nos planteamos evaluar valores de corte (VC) para el diagnóstico del SCA en pacientes con IRC para los marcadores cardíacos TnIc y CK-MB diferentes a los recomendados por los fabricantes/distribuidores de los reactivos y que se usan habitualmente en los laboratorios (el VC recomendado por los fabricantes de reactivos es una concentración que se ha obtenido en estudios con pacientes de la población general sin patologías concomitantes).
MATERIAL Y METODOS
Pacientes
Se realizó un estudio prospectivo de pruebas diagnósticas en el Complejo Hospitalario de Ourense, desde enero de 2009 hasta junio de 2010 (período de estudio). La población de estudio estuvo compuesta por pacientes con distintos grados de IRC (de 3 a 5) con los siguientes criterios de inclusión: pacientes con IRC con una tasa de filtración glomerular estimada (FG) con la ecuación MDRD415-16 < 60 ml/min/1,73 m2 que solicitaron consulta hospitalaria por sospecha de SCA durante el período de estudio, en los que se determinó TnIc, CK-MB y creatinina en la evaluación clínica inicial, la cual incluía también la historia clínica, la exploración física y el electrocardiograma. Los criterios de exclusión fueron: pacientes que se trasladaron a otro hospital, los ingresados en psiquiatría y los que se negaron a firmar el consentimiento informado. Todos los pacientes incluidos dieron su consentimiento informado.
Los pacientes se clasificaron en tres grupos según el diagnóstico principal de alta obtenido de la historia clínica: 1) pacientes con SCA (patrón áureo); 2) pacientes con otras patologías cardíacas (OPC), y 3) pacientes con otras patologías no cardíacas (OPNC). Se utilizaron los criterios diagnósticos de SCA de la Sociedad Europea de Cardiología de 200717 y la definición universal de infarto agudo de miocardio (IAM) de 200718, los cuales se mencionan a continuación: el término SCA se refiere al conjunto de síntomas clínicos producidos por isquemia miocárdica aguda, principalmente dolor torácico, por lo que según el electrocardiograma los pacientes se clasifican en dos grupos: a) pacientes con dolor torácico agudo (> 20 minutos) y con elevación persistente del segmento ST (SCAEST) y b) pacientes con dolor torácico agudo pero sin elevación del segmento ST (SCASEST) (este grupo incluye el IAM sin elevación del segmento ST y la angina inestable). La definición universal de IAM del año 2007 indica que existe un IAM cuando un paciente presenta al menos un valor por encima del percentil 99 de los biomarcadores cardíacos (preferiblemente troponina) y al menos uno de los siguientes: síntomas de isquemia miocárdica, cambios electrocardiográficos en el segmento ST, desarrollo de ondas Q patológicas o evidencia por imagen de pérdida de miocardio viable. El grupo OPC incluyó pacientes en los que se diagnosticó cualquier patología cardíaca distinta del SCA. El grupo OPNC incluyó pacientes con cualquier patología no relacionada con el corazón. Aquellos pacientes que presentaban múltiples diagnósticos y que no se podían agrupar adecuadamente en uno de los anteriores no fueron incluidos en el estudio.
El tamaño muestral fue estimado para una prevalencia esperada de IAM del 15 % según datos de estudios previos y consultas bibliográficas. Con la consideración de un error α de 0,05 y una precisión ± 4 % para un nivel de seguridad del 95 %, se calculó un tamaño muestral de 484 unidades muestrales (pacientes). En el Complejo Hospitalario de Ourense se reclutaron de forma consecutiva los casos hasta llegar a alcanzar la muestra calculada.
El estudio se realizó en dos fases consecutivas: fase I o período de reclutamiento de pacientes, en la que se recogían las variables clínicas de la historia clínica, así como las variables analíticas del programa intralaboratorio (Omega 2000), y fase II o período de seguimiento, en la que se realizó un seguimiento telefónico y analítico de los pacientes a los 6 meses desde su ingreso en el estudio. Las variables clínicas incluidas fueron las siguientes: género, edad, tabaquismo, diabetes mellitus, hipertensión arterial sistémica, antecedente de infarto de miocardio o angina, terapia crónica previa al ingreso (aspirina, betabloqueantes, inhibidores de la enzima de conversión de angiotensina, estatinas), dolor torácico, dolor abdominal, disnea, síncope, mareo, electrocardiograma de 12 derivaciones al ingreso, diagnóstico principal de alta, motivo de alta (curación o éxitus) y tiempo de estancia hospitalaria.
Marcadores bioquímicos
Las variables analíticas incluían TnIc, CK-MB y creatinina, las cuales se midieron al ingreso hospitalario y a los 6 meses. Otros datos recogidos, solo al ingreso hospitalario, fueron las concentraciones de colesterol, triglicérido, colesterol en lipoproteínas de alta densidad, colesterol en lipoproteínas de baja densidad y hemoglobina.
Todas las pruebas se determinaron en suero en tubos BD Vacutainer®, excepto la hemoglobina, para la que se utilizó sangre total. Los biomarcadores cardíacos TnIc y CK-MB fueron medidos utilizando dos sistemas analíticos diferentes: para la TnIc los analizadores Access® (Izasa) y Vidas® (BioMérieux), y para la concentración en masa de CK-MB (CK-MBm) el analizador Access® (Izasa) y para la actividad enzimática de CK-MB (CK-MBact) el analizador Vitros® (Johnson & Johnson).
El reactivo Access AccuTnI®, fabricado por Beckman-Coulter, es un ensayo inmunoenzimático quimioluminiscente de dos posiciones (sandwich) para la determinación cuantitativa de los niveles de TnIc. Su límite de detección es 0,02 ng/ml, el límite superior de referencia (LSR) o percentil 99 es 0,04 ng/ml y el VC recomendado por el fabricante para IAM es ≥ 0,5 ng/ml.
Vidas® Troponin I Ultra es un reactivo fabricado por BioMérieux, que permite una valoración de la TnIc humana en suero mediante el método inmunoenzimático tipo sandwich en una etapa a una detección final en fluorescencia. Su límite de detección y el LSR es 0,01 ng/ml, y el VC recomendado por el fabricante para la detección de IAM es ≥ 0,11 ng/ml.
El reactivo Access CK-MB®, fabricado por Beckman-Coulter, es un ensayo inmunoenzimático quimioluminiscente de dos posiciones (sandwich) para la determinación cuantitativa de la CK-MBm. El valor declarado por el fabricante para el LSR es 6,3 ng/ml, y el límite de detección es 0,1 ng/ml.
La CK-MBact medida mediante el método del analizador Vitros®, fabricado por Johnson & Johnson, utiliza el sistema de química en fase sólida Vitros. El LSR es 24 U/l y el límite de detección es 1 U/l.
La determinación de creatinina se realizó con el analizador Synchron LXi-725®, fabricado por Beckman, y que utiliza el método de Jaffé (reactivo de picrato alcalino) mediante espectrocolorimetría cinética química; su límite de detección es 0,1 mg/dl y sus valores de referencia están en el intervalo de 0,5-1,3 mg/dl. El FG se ha estimado según la ecuación MDRD415,16.
Análisis estadístico
La estadística descriptiva de las variables estudiadas se realizó según su carácter: las variables cuantitativas se expresaron como media o mediana, y las variables cualitativas como frecuencias y porcentajes. Para la comparación de medias, medianas y proporciones, se utilizaron las pruebas de ANOVA, Kruskal-Wallis y prueba Z, respectivamente. Siempre que fue posible se utilizaron estadísticos paramétricos. En todos los casos se consideró un riesgo de primera especie alfa de 0,05 (intervalo de confianza [IC] del 95 %). Se consideraron diferencias estadísticamente significativas valores de p < 0,05. Las pruebas estadísticas y los gráficos se realizaron utilizando el programa de análisis estadístico SPSS v. 15.
RESULTADOS
Características de la población de estudio
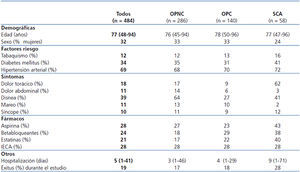
Durante el período de estudio se incluyeron 484 pacientes con IRC, en los que se determinaron biomarcadores cardíacos por sospecha de SCA. Se excluyeron del estudio seis pacientes: dos por traslado a otro hospital, uno por presentar insuficiencia renal aguda, dos por tener FG > 60 ml/min/1,73 m2 y otro por ser un caso repetido. El 68 % (331) eran hombres y el 32 % (153) eran mujeres (p = 0,046); los pacientes presentaban una mediana de edad de 77 años (IC 95 %: 48-94 años).
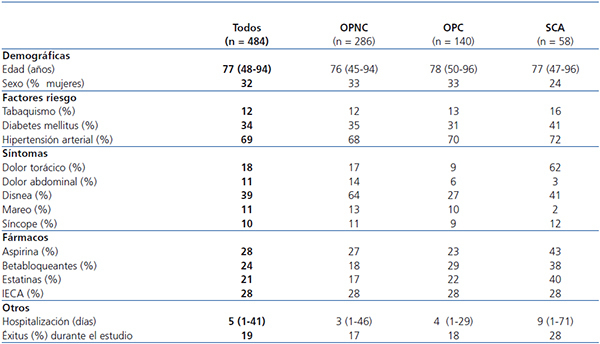
Los pacientes se dividieron en 3 grupos según su diagnóstico principal: grupo SCA, grupo OPC y grupo OPNC. Se identificó SCA en el 12 % de los pacientes (58/484), mientras que en el 29 % de los pacientes (140/484) se encontraron OPC y el 59 % (286/484) tuvo OPNC. En la tabla 1 se muestran las variables clínicas medidas en todos los pacientes y por grupos. En el grupo SCA, se realizó coronariografía únicamente en el 32,7 % de los pacientes y se utilizó con menor frecuencia a medida que aumentaba el grado de IRC.
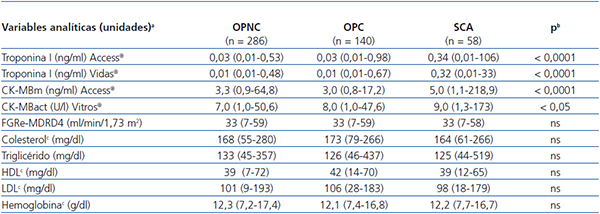
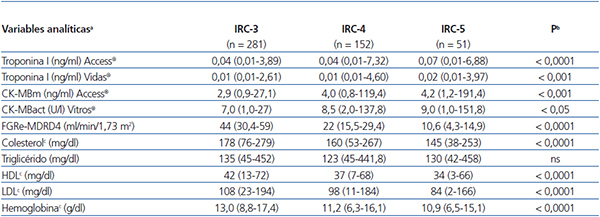
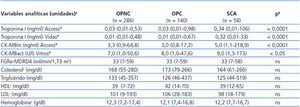
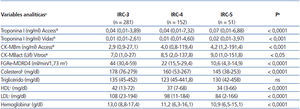
Los resultados de las variables analíticas se muestran en la tabla 2 (por grupos) y la tabla 3 (por grado de IRC). La mediana de los biomarcadores cardíacos medidos en la primera determinación en el analizador Access® en los pacientes del grupo SCA fueron: para TnIc de 0,34 ng/ml (IC 95 %: 0,01-106 ng/ml) y para CK-MBm de 5 ng/ml (IC 95 %: 1,1-218,9 ng/ml), mientras que para la TnIc del analizador Vidas® fue 0,32 ng/ml (IC 95 %: 0,01-33 ng/ml) y para la CK-MBact del analizador Vitros® fue 9 U/l (IC 95 %: 1,3-173 U/l). En algunos pacientes del SCA, la concentración inicial de TnIc o CK-MB estaba por debajo del VC (incluso normal), pero esta se elevó en las siguientes determinaciones. En los pacientes del grupo OPC, se encontraron los siguientes resultados con la TnIc del analizador Access®: valores normales de TnIc en el 62 %, valores de TnIc en la zona gris (elevados entre el percentil 99 pero por debajo del VC habitual) en el 32 % y valores de TnIc elevados por encima del VC habitual en el 6 %, mientras que utilizando la TnIc del analizador Vidas® los resultados fueron 57, 25 y 18 %, respectivamente. En los pacientes del grupo OPNC, utilizando la TnIc del analizador Access®, se encontraron resultados normales de TnIc en el 71 %, resultados de TnIc en la zona gris en el 25 % y resultados elevados de TnIc por encima del VC habitual en el 4 %, mientras que al utilizar la TnIc del analizador Vidas® los resultados fueron 74, 13 y 13 %, respectivamente. Según el grado de IRC, se clasificó a la población de estudio en pacientes con IRC grado 3, 4 y 5, por lo que dichos resultados se muestran en las tabla 3. El 58 % de los pacientes (281) tenía un FG en el intervalo de 30-59 ml/min/1,73 m2, lo cual se corresponde con el estadio 3.
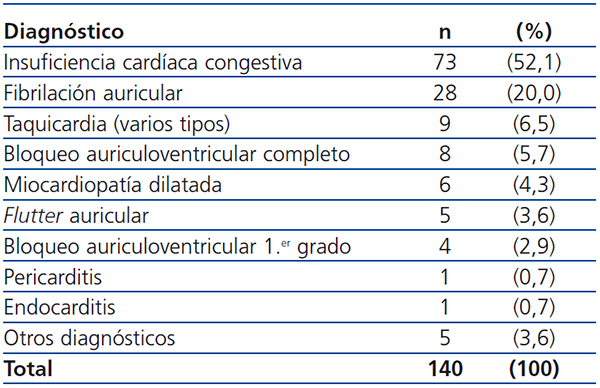
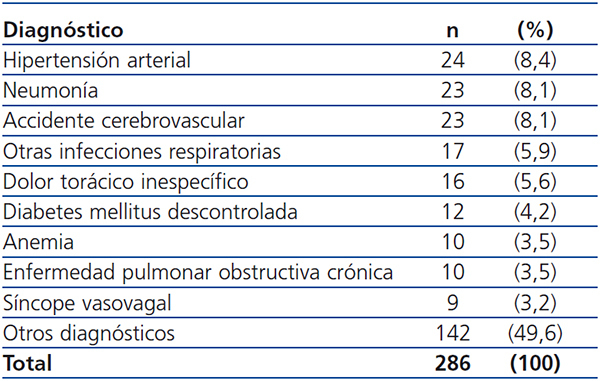
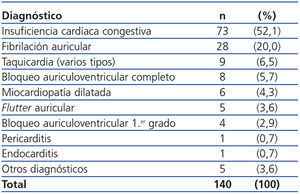
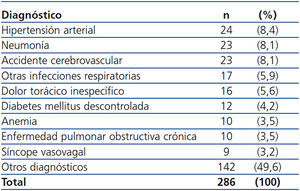
Los diagnósticos principales más frecuentes encontrados en la población de estudio fueron: insuficiencia cardíaca congestiva (15 %), infarto de miocardio sin elevación del segmento ST (6,6 %), fibrilación auricular (5,8 %) e hipertensión arterial (5 %). En la tabla 4 se muestran los diagnósticos del grupo OPC y en la tabla 5 los del grupo OPNC. La duración del ingreso hospitalario tuvo una mediana de 5 días (IC 95 %: 1-41 días). La mortalidad de los pacientes de nuestro estudio fue del 19 % (91 pacientes) y las principales causas de mortalidad fueron: insuficiencia cardíaca congestiva en el 20,9 % e IAM en el 12 %. En siete pacientes (1,4 %) no fue posible su localización ni por teléfono ni por correo para realizar su seguimiento a los seis meses.
Resultados del seguimiento
Durante el seguimiento de los pacientes a los 6 meses después del ingreso en el estudio, se obtuvieron los datos del estado de salud y de los reingresos hospitalarios por IAM mediante una entrevista telefónica en 386 pacientes que estaban vivos (en 7 pacientes no fue posible su localización) y, de los pacientes que fallecieron, se habló por teléfono con los familiares de 40 pacientes (el total de éxitus del estudio fue de 91 pacientes, pero 51 fallecieron durante el ingreso hospitalario). Once pacientes (12 %) murieron por IAM (en dos casos hubo reingresos por IAM durante el seguimiento). Los resultados del seguimiento analítico a los 6 meses (en 226 pacientes) fueron los siguientes: se encontraron valores por encima del LSR en 34 pacientes (15 %) para la TnIc del analizador Access® (5 del grupo SCA, 14 del grupo OPC y 15 del grupo OPNC), en 42 pacientes (18 %) para la TnIc del analizador Vidas® (7 del grupo SCA, 16 del grupo OPC y 19 del grupo OPNC), en 14 pacientes (6 %) para la CK-MB del analizador Access® (4 del grupo SCA, 6 del grupo OPC y 4 del grupo OPNC) y en 7 pacientes (3 %) para la CK-MB del analizador Vitros® (1 del grupo SCA, 3 del grupo OPC y 3 del grupo OPNC), pero todos se encontraban asintomáticos; en el resto de los pacientes se encontraron valores normales para todos los marcadores cardíacos.
Según la distribución de los datos de la TnIc inicial del analizador Access®, la mediana de la TnIc fue mayor en los pacientes que fallecieron (0,08 ng/ml) que en los pacientes que no fallecieron (0,03 ng/ml) (p < 0,0001), y para la TnIc del analizador Vidas® se encontraron resultados similares, ya que la mediana de la TnIc fue mayor en los pacientes que fallecieron (0,05 ng/ml) que en los pacientes que no fallecieron (0,01 ng/ml) (p < 0,0001).
Con respecto a los resultados de CK-MB, la mediana de la CK-MB al inicio del estudio en el analizador Access® fue mayor en los pacientes que fallecieron (4,3 ng/ml) que en los pacientes que no fallecieron (3,2 ng/ml) (p < 0,0001), mientras que para la CK-MB al inicio del estudio en el analizador Vitros®, la diferencia entre medianas no es estadísticamente significativa en los pacientes fallecidos y no fallecidos.
Curvas de rendimiento diagnóstico
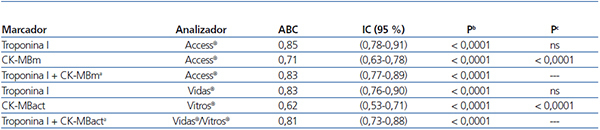
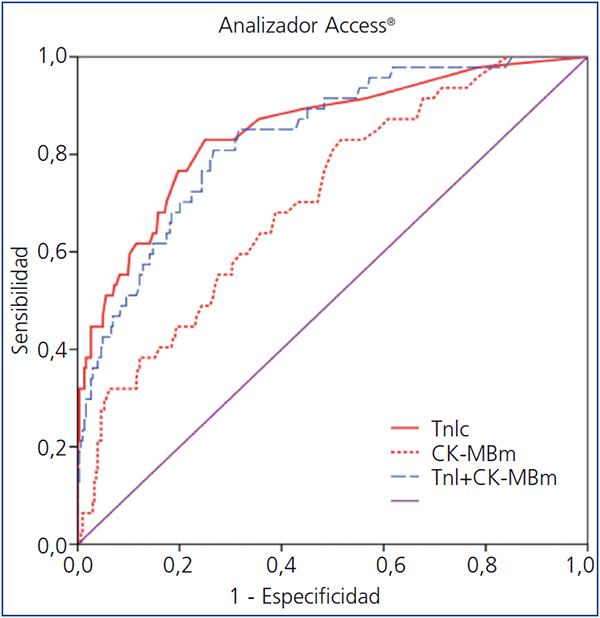
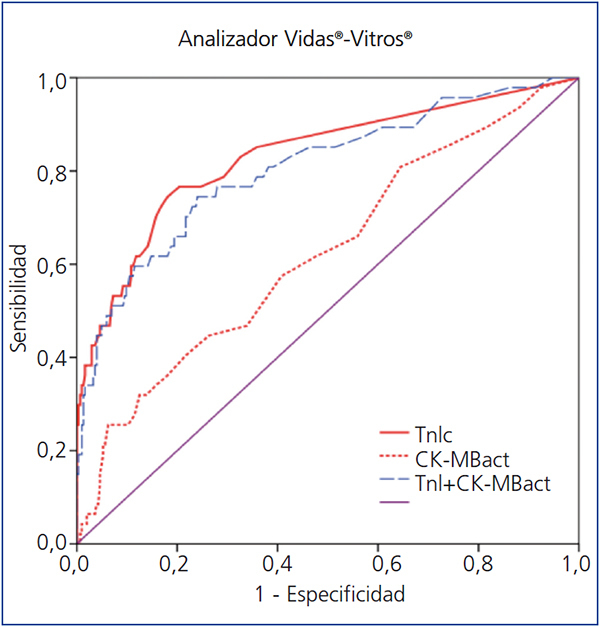
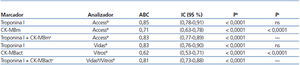
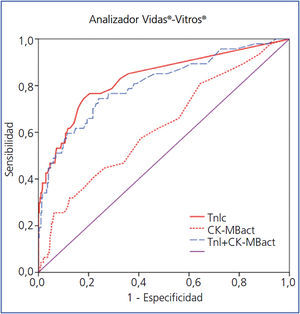
Se han estudiado las curvas de rendimiento diagnóstico (ROC) para las distintas magnitudes por los dos métodos. Los resultados de los marcadores cardíacos utilizados se presentan en la tabla 6. Las TnIc de ambos analizadores tienen mayor área bajo la curva que la CK-MB masa y CK-MB actividad.
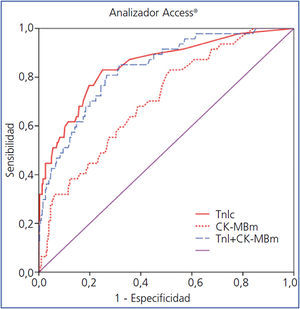
En la figura 1 se comparan las curvas ROC de la TnIc y CK-MB del analizador Access®, y en la figura 2 se comparan las curvas ROC de la TnIc del analizador Vidas® y de la CK-MB del analizador Vitros®.
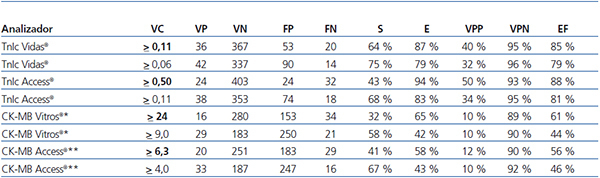
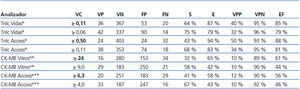
La elección de un VC requiere un conocimiento detallado de las decisiones médicas derivadas del resultado de la prueba. El abordaje de un VC óptimo19 excede al diseño del presente trabajo, por lo que se ha propuesto un VC que mejore la sensibilidad de la detección del SCA en estos pacientes y permitir beneficiarse de terapias tempranas disponibles. La exploración de las curvas ROC para TnIc, así como para CK-MB masa y CK-MB actividad, permiten proponer los siguientes VC: el nuevo VC que se propone para la TnIc del analizador Access® es ≥ 0,11 ng/ml, ya que tiene una mejor sensibilidad (68 %), y para la TnIc del analizador Vidas® es ≥ 0,06 ng/ml, con una sensibilidad de 75 % (ambas son mejores que la sensibilidad encontrada utilizando el VC actual en cada laboratorio) (tabla 7).
Para la CK-MB, el nuevo VC que se propone para la CK-MB del analizador Access® es ≥ 4 ng/ml, con una sensibilidad de 67 %, y para la CK-MB del analizador Vitros® es ≥ 9 U/l, con una sensibilidad de 58 % (mejor sensibilidad en ambos casos que la actual).
DISCUSIÓN
Existen diferentes VC posibles que se pueden obtener con cualquier ensayo de troponina y son: 1) LSR, que se refiere al percentil 99 de los resultados de troponina de una población de referencia; 2) valor del coeficiente de variación (CV) en el 10 %, que es la concentración de troponina con la que la imprecisión del ensayo es del 10 %, y 3) VC basado en la curva ROC (del fabricante), que es un procedimiento estadístico por el cual se determina una concentración para cada ensayo, la cual maximiza su sensibilidad y especificidad clínica, comparada con el patrón áureo (gold standard)20. Las guías internacionales17,18 han definido que una concentración de troponina elevada es aquella que se encuentra por encima del percentil 99 de una población de referencia sana, por lo que se considera un resultado anormal, pero el valor del percentil 99 depende de las características de dicha población21, ya que se ha observado que las concentraciones de troponinas tienden a aumentar en personas mayores de 60 años22 o en sujetos aparentemente sanos pero con ECV no detectada, por lo que la mayoría de los laboratorios aceptan los VC que indican los fabricantes del reactivo (basado en curvas ROC) o emplean los límites de referencia publicados en la literatura. Se ha recomendado que se utilicen ensayos de troponina con un control de calidad apropiado y con una imprecisión total óptima (CV ≤ 10 %) en el valor del percentil 99, lo cual sí se cumple con los ensayos de troponinas ultrasensibles; pero la mayoría de los ensayos de troponina que se utilizan en la actualidad tienen una imprecisión intermedia (CV del 10 al 20 %) en el percentil 99 e incluso algunos tienen un CV > 20 %23.
Nuestra propuesta es utilizar un VC de TnIc para diagnosticar IAM en pacientes con IRC diferente del que se utiliza para la población general, con una mejor sensibilidad y por encima del percentil 99, ya que el SCA es una patología letal y los pacientes con IRC son una población de alto riesgo cardiovascular, por lo que para la TnIc del sistema Access® el VC que se propone es ≥ 0,11 ng/ml, cuyo rendimiento diagnóstico es 68 % de sensibilidad y 83 % de especificidad, mientras que para la TnIc del sistema Vidas® el VC que se propone es ≥ 0,06 ng/ml, cuyos valores de rendimiento diagnóstico son 75 y 79 %, respectivamente. Debido a que la TnIc tiene mejor rendimiento diagnóstico, consideramos que la CK-MB (masa o actividad) no debería solicitarse de forma conjunta con la TnIc para el diagnóstico de IAM, ya que aumenta los costes, y podría emplearse fundamentalmente para diagnosticar reinfarto de miocardio24 y en los hospitales que no dispongan de técnicas analíticas para el análisis de troponina.
La estrategia de disminuir el VC incrementa el número de casos diagnosticados de IAM25, pero permitiría a los pacientes con IRC beneficiarse de una terapia temprana (conservadora o invasiva) que mejore el pronóstico. En el estudio de Lin et al.26 en pacientes con sospecha de SCA se encontró que la prevalencia de IAM fue de 13,5 % si se usaba el VC calculado con la curva ROC, de 17 % si se usaba el valor del CV de 10 % y de 25 % si se utilizaba el valor del percentil 99.
El VC habitual de TnIc para el diagnóstico de IAM del analizador Access® (TnIc ≥ 0,5 ng/ml) presenta una sensibilidad y una especificidad para la población general declarada por el fabricante del reactivo de 96 y 94 %, respectivamente, mientras que en nuestro estudio con este VC se obtuvo una sensibilidad de 43 % y una especificidad de 94 %; en un estudio retrospectivo previo de nuestro grupo de investigación, para el mismo VC se obtuvo una sensibilidad de 70 % y una especificidad de 92 % en pacientes con IRC27. Por otra parte, el VC habitual de TnIc para diagnosticar IAM con el ensayo de BioMérieux (analizador Vidas®) es ≥ 0,11 ng/ml, con una sensibilidad de 76 % y una especificidad de 94 % (declarada por el fabricante del reactivo), mientras que en nuestro estudio se obtuvo una sensibilidad de 64 % y una especificidad de 87 %, por lo que, aparentemente, los VC de ambas TnIc obtenidos en la población general tienen menor rendimiento diagnóstico en estos pacientes con IRC.
El diagnóstico precoz utilizando el percentil 99 de TnIc, cada vez más bajo con los ensayos actuales y con los ensayos de troponinas ultrasensibles, permite la identificación más rápida de pacientes con IAM, pero también es importante decir que cualquier daño de las células miocárdicas puede causar liberación de troponinas a la circulación, por lo que una gran variedad de patologías pueden asociarse con valores de troponinas elevadas y no siempre por causas isquémicas, de tal forma que hay que distinguir clínicamente la causa de la elevación de troponina para tratarla y debe tenerse en cuenta, ya que es un factor pronóstico de eventos adversos en estos pacientes28-32. Las causas de elevación de troponinas en ausencia de SCA pueden dividirse en 3 grupos: 1) enfermedades cardíacas (ya sea con lesión miocárdica o con aumento del tamaño cardíaco); 2) enfermedades no cardíacas (trastornos de órganos específicos o trastornos generales), y 3) causas metodológicas33. De igual manera, las causas de elevación de CK-MB no relacionada con SCA se dividen en 4 grupos: 1) liberación de CK no miocárdica; 2) daño cardíaco distinto del IAM; 3) eliminación sérica disminuida de CK-MB (hipotiroidismo), y 4) causas metodológicas34. En nuestro estudio, las principales causas de elevación de TnIc en el grupo OPC fueron: insuficiencia cardíaca congestiva y fibrilación auricular, mientras que en el grupo OPNC fueron la IRC y la hipertensión arterial. En los pacientes con IRC y ausencia de SCA, la frecuencia con la que se encuentran elevados los marcadores cardíacos bioquímicos depende del marcador y del sistema analítico utilizado, variando para la TnIc entre el 4 y el 21 %, y para la TnTc entre el 17 y el 75 %1,28-29. Choy et al.12 registran un aumento inespecífico de los valores de TnIc en el 15 % y de CK-MB en el 4 %.
Las troponinas cardíacas, a pesar de que pueden estar elevadas de forma inespecífica en la IRC, ayudan a diagnosticar el SCA (en combinación con el cuadro clínico y el electrocardiograma) y aportan información pronóstica en estos pacientes, por lo que su interpretación correcta es necesaria para llevar a cabo un tratamiento adecuado.
Entre las limitaciones del estudio están la falta de evaluación del tiempo entre el inicio de la sintomatología referida por el paciente y el momento en que se extrajo la muestra para la determinación de los biomarcadores cardíacos, ya que en muchos pacientes fue difícil obtener con certeza el tiempo de evolución de los síntomas, principalmente dolor torácico y disnea, por lo que decidimos no incluir esta variable.
Otra limitación es la falta de independencia del patrón áureo de los biomarcadores cardíacos. La TnIc representa dicho patrón para los marcadores bioquímicos de daño miocárdico y se incluye en la definición universal de IAM de los consensos internacionales18, además de los datos clínicos y electrocardiográficos, por lo que al ser una herramienta en el diagnóstico de IAM, en pacientes con síntomas clínicos atípicos o con electrocardiogramas no diagnósticos, puede influir de forma importante en el momento de realizar dicho diagnóstico.
Las conclusiones de nuestro estudio son las siguientes: 1) la TnIc es el marcador de daño miocárdico de elección en los pacientes con IRC (tiene un mejor rendimiento diagnóstico que la CK-MB y el análisis combinado de ambos marcadores no incrementa el rendimiento diagnóstico en estos pacientes), y 2) los VC propuestos en el estudio para ambas TnIc para el diagnóstico de SCA en pacientes con IRC de grado 3 a 5 son significativamente diferentes de los utilizados para la población general. En este estudio, el VC propuesto para la TnIc del analizador Access® es ≥ 0,11 ng/ml, el cual aumenta la sensibilidad diagnóstica un 25 % (de 43 % con el VC habitual ≥ 0,5 ng/ml a 68 % con el nuevo VC). Para la TnIc del analizador Vidas®, el VC propuesto es ≥ 0,06 ng/ml, el cual aumenta la sensibilidad diagnóstica un 11 % (de 64 % con el VC habitual ≥ 0,11 ng/ml a 75 % con el nuevo VC). Al disminuir el VC de TnIc, aumenta la sensibilidad para diagnosticar SCA, pero también aumenta el número de falsos positivos.
FINANCIACIÓN
Este proyecto de investigación forma parte de la tesis doctoral de Larry M. Flores Solís, titulada Troponina I cardíaca y creatina cinasa MB en pacientes con insuficiencia renal crónica, y fue financiado por el Ministerio de Educación mediante la Beca del Programa Nacional de Formación de Profesorado Universitario (FPU), con número de referencia AP2005-2762.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Características clínicas de los pacientes por grupos (n = 484)
Tabla 2. Comparación de características analíticas de los pacientes por grupos (n = 484)
Tabla 3. Comparación de características analíticas de los pacientes por grado de insuficiencia renal crónica (n = 484)
Tabla 4. Diagnósticos principales en el grupo Otras Patologías Cardíacas (OPC)
Tabla 6. Areas bajo la curva de rendimiento diagnóstico de troponina I cardíaca y creatina cinasa MB
Tabla 7. Evaluación de distintos valores de corte para la troponina I cardíaca (analizadores Vidas y Access) y para la creatina cinasa actividad* o masa** (para los analizadores Vitros y Access)
Figura 1. Comparación de áreas bajo la curva de troponina I cardíaca (TnIc) y de concentración en masa de creatina cinasa MB (CK-MBm) frente a la combinación de ambos en el analizador Access
Figura 2. Comparación de áreas bajo la curva de troponina I cardíaca (TnIc) y de actividad enzimática de creatina cinasa MB (CK-MBact) frente a la combinación de ambas en los analizadores Vidas-Vitros
Tabla 5. Diagnósticos principales en el grupo Otras Patologías No Cardíacas (OPNC)