La gammapatía monoclonal de significado renal incluye todas las enfermedades renales causadas por una inmunoglobulina monoclonal secretada por un clon de célula B no maligno. Por definición, los pacientes con gammapatía monoclonal de significado renal no cumplen criterios de mieloma múltiple y la alteración hematológica es generalmente considerada gammapatía monoclonal de significado incierto. No obstante, la dolencia que pueden causar a nivel renal puede ser importante, requiriendo un tratamiento específico. El espectro de la gammapatía monoclonal de significado renal es amplio, incluyendo una entidad reciente como la nefropatía C3. El desarrollo de una nefropatía C3 en el contexto de una gammapatía monoclonal de significado renal tras el trasplante renal no es frecuente y hasta el momento ha sido poco descrita. A continuación presentamos 3 casos de nefropatía C3 asociados a una gammapatía monoclonal de aparición de novo tras el trasplante renal.
Monoclonal gammopathy of renal significance includes all renal disorders caused by a monoclonal immunoglobulin secreted by a non-malignant B-cell clone. Patients with MGRS do not, by definition, meet criteria for multiple myeloma, with haematological disorders generally considered to be monoclonal gammopathy of undetermined significance. Nevertheless, the renal involvement can be serious and require specific treatment. Monoclonal gammopathy of renal significance is associated with a wide spectrum of disorders, including the recently discovered C3 glomerulopathy. Development of C3 glomerulopathy in the context of monoclonal gammopathy of renal significance after kidney transplantation is uncommon and very few cases have been published to date. We report on three cases of C3 glomerulopathy in the context of de novo monoclonal gammopathy after kidney transplantation.
La gammapatía monoclonal es la proliferación de células de la estirpe linfocitos B que da lugar a una inmunoglobulina o fragmento de ella (cadena ligera o cadena pesada) monoclonal. Diferentes condiciones hematológicas pueden producir una gammapatía monoclonal: gammapatía monoclonal de significado incierto, mieloma múltiple, plasmocitoma, macroglobulinemia de Waldeström, leucemia linfática crónica y linfomas1.
La gammapatía monoclonal de significado incierto consiste en la presencia de una gammapatía monoclonal sin malignidad asociada pero puede ser el precursor de dolencias malignas como el mieloma múltiple o el linfoma. La tasa de progresión descrita es de un 1% por año2. La gammapatía monoclonal de significado incierto es una entidad muy frecuente, que se presenta en un 3% de la población mayor de 50 años3. Para su diagnóstico son necesarios 3 criterios: componente monoclonal inferior a 3g/dL, menos de un 10% de células plasmáticas en la médula ósea y no evidencia de afectación orgánica4.
La gammapatía monoclonal por sí misma puede dar diferentes patologías no relacionadas con la masa clonal sino con características propias de la proteína monoclonal, dando lugar a lo que se denomina gammapatía monoclonal de significado clínico. Los órganos que se pueden afectar con más frecuencia son: riñón, sistema nervioso, piel, ojo…5
La gammapatía monoclonal de significado renal (GMSR), por tanto, incluye todas las enfermedades renales causadas por una gammapatía monoclonal (sin enfermedad neoplásica asociada). El espectro de la GMSR es muy amplio e incluye una entidad reciente como es la nefropatía por C36–8. La aparición de esta enfermedad tras el trasplante renal ha sido hasta la fecha poco descrita. A continuación presentamos 3 casos de nefropatía por C3 de novo tras el trasplante renal en el contexto de una GMSR.
Exposición de casosCaso 1Mujer de 66 años de edad con enfermedad renal crónica estadio v secundaria a PQRAD por mutación del gen PKD1. Inició hemodiálisis a los 48 años. Cinco años más tarde recibe un primer trasplante renal de donante cadáver, realizándose inmunosupresión de inducción con prednisona, tacrolimus y micofenolato mofetilo. Se consigue una correcta función del injerto renal con una creatinina sérica entorno a 100-120umol/L y sin proteinuria. A los 7 años tras el trasplante renal (junio 2012) se evidencia aparición de proteinuria de 3g/día junto con un leve deterioro de la función renal. Por este motivo se realiza biopsia renal que demuestra glomerulonefritis proliferativa mesangial y endocapilar global y difusa siendo la inmunofluorescencia (IF) negativa. Ante este resultado se inicia tratamiento con IECA consiguiéndose estabilizar la proteinuria y la función renal durante 2 años pero posteriormente empeora rápidamente la función renal y se incrementa la proteinuria hasta 6g/día. Se realiza nueva biopsia renal que evidencia glomerulonefritis proliferativa endocapilar generalizada con una IFTA del 20% siendo la IF positiva por C3 en asas y mesangio, haciéndose el diagnóstico de nefropatía C3. Ante este diagnóstico se realiza proteinograma que muestra componente monoclonal IgA lamda (cuantificación: 3g/L) con PBJ negativo y razón cadenas ligeras K/L en suero normal. El aspirado de médula ósea evidencia un 4% de células plasmáticas. Se realiza también dosificación del complemento que resulta normal y el estudio genético del complemento no evidencia mutaciones. En este momento la paciente presenta una función renal muy deteriorada por lo que no se realiza ningún tratamiento específico y requiere reinicio de diálisis.
Caso 2Paciente de 75 años con enfermedad renal crónica estadio v de causa no filiada (sin proteinuria). Inició diálisis peritoneal a los 59 años. Tras 5 años recibe un primer trasplante renal de donante cadáver, realizándose inmunosupresión de inducción con timoglobulina, prednisona, micofenolato mofetilo y tacrolimus diferido. Se consigue una correcta función renal con creatinina sérica de 130-150umol/L sin proteinuria. Tras 6 años del trasplante, aparece proteinuria de 1g/día con función renal estable por lo que se realiza biopsia renal. Esta demuestra una glomerulonefritis proliferativa mesangial y endocapilar segmentaria y difusa no pudiéndose establecer el diagnóstico definitivo debido a la falta de glomérulos para poder hacer la IF. Se inicia tratamiento con IECA, consiguiendo estabilización de la proteinuria. Tres años más tarde incrementa bruscamente la proteinuria hasta 5g/día y se deteriora la función renal hasta creatinina sérica de 200umol/L. Ante esta situación se realiza nueva biopsia renal que demuestra glomerulonefritis proliferativa mesangial y endocapilar generalizada con IFTA del 20% e IF que demuestra depósitos de C3 mesangiales y subendoteliales, haciéndose el diagnóstico de nefropatía C3. Ante este diagnóstico se realiza proteinograma que evidencia componente monoclonal IgM kappa (cuantificación: 2,5g/L) con PBJ negativo y razón cadenas ligeras K/L en suero normal. El aspirado de médula ósea evidencia un 2% de células plasmáticas. La dosificación del complemento resulta normal y el estudio del complemento no demuestra mutaciones pero sí presencia de anticuerpos antifactor H. Se decide realizar tratamiento con rituximab (dosis única de 1g) con buena respuesta inicial, estabilizándose durante unos meses la proteinuria y la función renal pero posteriormente empeora la misma, requiriendo iniciar hemodiálisis.
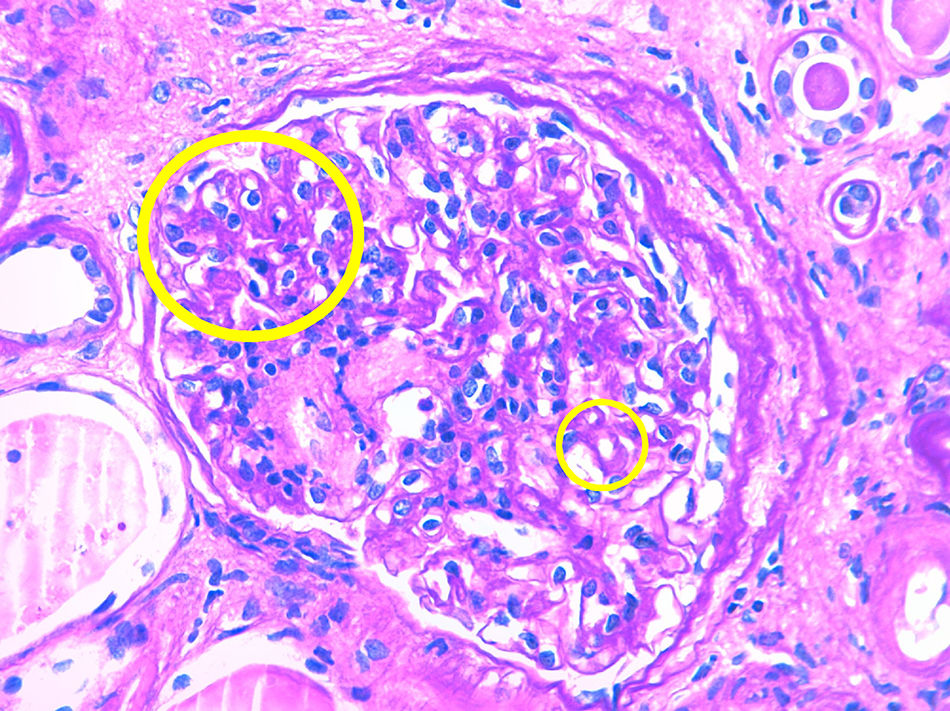
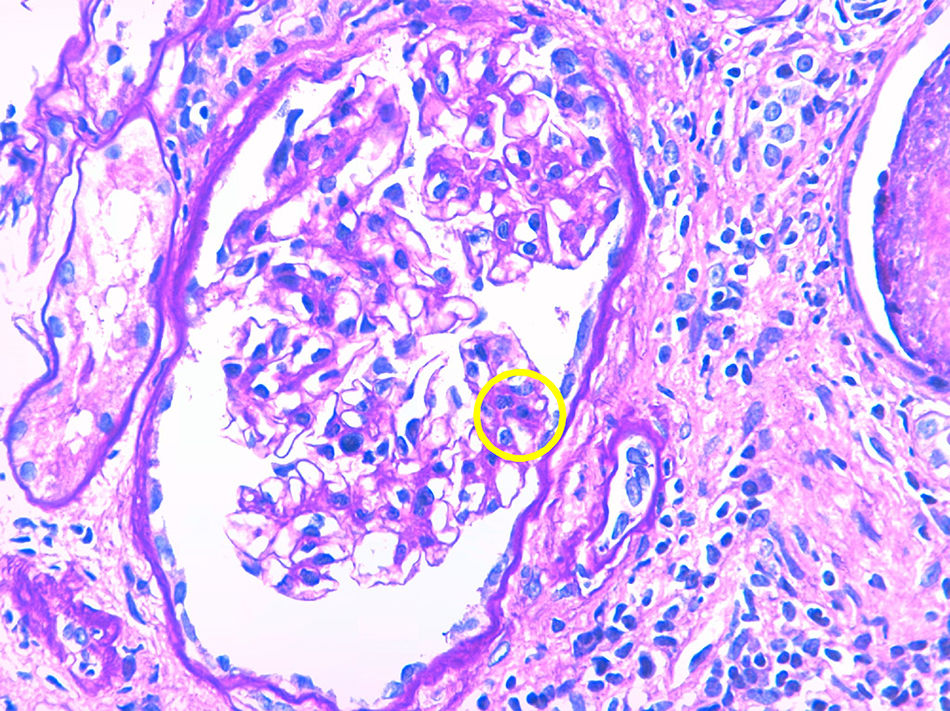
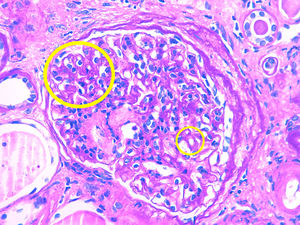
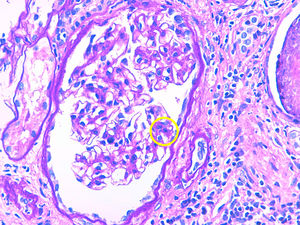
Caso 3Paciente de 56 años con enfermedad renal crónica estadio v de causa no filiada (sin proteinuria). Inició hemodiálisis a los 49 años. Tras 6 años recibe un primer trasplante renal de donante cadáver, realizándose inmunosupresión de inducción con timoglobulina, prednisona, micofenolato mofetilo y tacrolimus diferido. La función del injerto renal mejora hasta creatinina sérica de 160-170umol/L sin proteinuria. Al año postrasplante aparece una proteinuria de 1,5g/día con una biopsia que evidencia rechazo celular agudo borderline con IFTA moderada. Se decide mantener inmunosupresión en rango alto y se inicia tratamiento con IECA, manteniéndose la proteinuria estable. Cuatro años más tarde incrementa la proteinuria de manera muy severa hasta 9g/día sin síndrome nefrótico y la función renal se deteriora rápidamente hasta creatinina sérica de 300umol/L. Se realiza biopsia renal que evidencia glomerulonefritis proliferativa mesangial y endocapilar focal y segmentaria con IFTA del 50 y 30% de esclerosis glomerular. La tinción de Rojo Congo resulta negativa. La IF evidencia depósito granular grosero de C3 en asas y mesangio, haciéndose por tanto, el diagnóstico de nefropatía C3. Ante este diagnóstico se realiza proteinograma que muestra componente monoclonal IgG kappa (cuantificación: 1,6g/L) con una razón cadenas ligeras K/L en suero normal y un aspirado de médula ósea con un 5% de células plasmáticas. La dosificación del complemento resulta normal y el estudio genético del complemento negativo. Por importante IFTA e esclerosis glomerular en la biopsia y dado que la función renal empeora rápidamente no se realiza ningún tratamiento específico y la paciente reinicia hemodiálisis (tabla 1 y figs. 1 y 2).
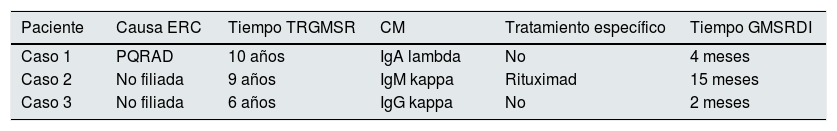
Datos clínicos relevantes
| Paciente | Causa ERC | Tiempo TRGMSR | CM | Tratamiento específico | Tiempo GMSRDI |
|---|---|---|---|---|---|
| Caso 1 | PQRAD | 10 años | IgA lambda | No | 4 meses |
| Caso 2 | No filiada | 9 años | IgM kappa | Rituximad | 15 meses |
| Caso 3 | No filiada | 6 años | IgG kappa | No | 2 meses |
CM: tipo de componente monoclonal; Tiempo GMSRDI: tiempo desde el diagnóstico de la GMSR hasta el inicio de diálisis (años); Tiempo TRGMSR: tiempo des del trasplante renal hasta el diagnóstico de la GMSR (años).
La GMSR incluye todas las formas de afectación renal causadas por una inmunoglobulina monoclonal secretada por un clon no maligno de célula B (sin enfermedad neoplásica asociada). La afectación renal es muy diversa y puede ser en algunos casos muy severa. Implica una elevada morbilidad por lo que es importante realizar un diagnóstico precoz6–8. En cuanto a la patogenia, la afectación renal se puede producir por 2 mecanismos. Por un lado, el mecanismo directo, que es debido al depósito de la inmunoglobulina o cadena de inmunoglobulina monoclonal a nivel del glomérulo o el túbulo. Este sería el mecanismo por el cual se produce la amiloidosis AL, la enfermedad por depósitos de cadenas ligeras o las glomerulonefritis fibrilar e inmunotactoide. El otro mecanismo es un mecanismo indirecto que consiste en que la gammapatía monoclonal produce una disregulación de la vía alterna del complemento provocando una activación continuada de esta vía. En este caso, cuando las lesiones producidas son a nivel glomerular tenemos la nefropatía C3 que incluye la glomerulonefritis C3 y la enfermedad por depósitos densos y cuando las lesiones son a nivel vascular tenemos el SHU atípico6.
Centrándonos en la nefropatía C3, la principal hipótesis diagnóstica radica en que la proteína monoclonal interferiría con las proteínas que regulan la función del complemento, principalmente el factor H. La proteína monoclonal actuaría como un autoanticuerpo contra el factor H, provocando su inhibición y dando lugar a una activación continua de la vía alterna del complemento que causaría el daño glomerular9.
Tanto en la glomerulonefritis C3 como en la enfermedad por depósitos densos se produce una proliferación mesangial, membranoproliferativa y endocapilar con depósitos granulares de C3 a nivel glomerular y sin depósitos de inmunoglobulina. La diferencia entre las 2 entidades se observa en la microscopia electrónica en donde en el caso de la glomerulonefritis C3 se observa algún depósito granular a nivel subendotelial, subepitelial o en mesangio y en cambio en la enfermedad por depósitos densos se ven depósitos densos en mesangio e infiltrando la membrana basal glomerular10.
La forma de aparición de estas patologías suele ser mediante proteinuria. Esta con frecuencia puede progresar a rango nefrótico. En caso de no realizar ningún tratamiento específico, posteriormente se produce un deterioro progresivo de la función renal, llevando en poco tiempo a requerir tratamiento sustitutivo renal. El diagnóstico se realiza mediante biopsia renal siendo imprescindible la realización de la IF y a ser posible también la microscopia electrónica.
En cuanto al tratamiento de la GMSR, hasta el momento actual se tiene poca experiencia por lo que todavía no está estandarizado. Dicho tratamiento está basado en la utilización de quimioterápicos. En la práctica clínica habitual, en ocasiones, resulta complicado convencer a los hematólogos de realizar este tipo de tratamientos ante la ausencia de un proceso neoplásico de base. Lo más aceptado en el momento actual es en caso de que el componente monoclonal sea IgM utilizar rituximab con o sin ciclofosfamida asociada, y en caso de que el componente monoclonal sea IgA o IgG, bortezomib asociado o no a ciclofosfamida. No obstante, es evidente que es necesario tener más experiencia en estas patologías para establecer pautas de tratamiento definitivas y para conocer el pronóstico a largo plazo de estas entidades con estos tratamientos6,8.
Por nuestra experiencia, realizar un diagnóstico precoz es básico para poder aplicar un tratamiento específico eficazmente. En el caso 1 y 3 debido a que cuando se realiza el diagnóstico la función renal ya está muy deteriorada no se realiza ningún tratamiento específico. En el caso 2, debido a que en la biopsia se observa poca fibrosis y teniendo en cuenta que el componente monoclonal es IgM se decide realizar tratamiento con rituximab, consiguiéndose una respuesta parcial y temporal al tratamiento, probablemente por su aplicación ya tardía.
En cuanto a la posibilidad de nuevo trasplante de los pacientes que han perdido el injerto por esta patología se podría realizar, pero con un seguimiento muy estrecho en el postrasplante tanto por la posibilidad de recidiva de la enfermedad renal como por la posibilidad de progresión a malignidad de la gammapatía.
ConclusionesLa GMSR en forma de nefropatía C3 tras el trasplante renal ha sido poco descrita hasta el momento actual. Suele manifestarse en forma de proteinuria nefrótica con posterior deterioro de la función renal, pudiendo llevar a la pérdida del injerto en poco tiempo. En este contexto, es muy importante realizar el diagnóstico precozmente con el objetivo de aplicar un tratamiento quimioterápico específico en fases iniciales de la enfermedad. No obstante, todavía no están bien definidas las pautas de tratamiento más adecuadas para cada situación clínica determinada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.