El 4-10% de los pacientes incidentes en diálisis portan un injerto renal no funcionante y hasta en el 32% de los casos, según las series, se requiere la realización de trasplantectomía por diversas causas. La mortalidad de estos pacientes es significativamente mayor que la de aquéllos con injerto funcionante o en terapia renal sustitutiva sin injerto previo. Se han sugerido como indicaciones actuales de trasplantectomía el síndrome de intolerancia al injerto, la pérdida precoz de éste, la presencia de proteinuria grave, pielonefritis recurrentes o neoplasia y el síndrome de inflamación crónica. El síndrome de inflamación crónica se presenta en enfermos con elevación de los marcadores de inflamación (proteína C reactiva), anemia con resistencia al tratamiento con estimuladores de la eritropoyesis y marcadores de desnutrición en su contexto. Esta situación de inflamación está provocada por el injerto y revierte tras la trasplantectomía, como han demostrado varios estudios. Hemos revisado la literatura publicada al respecto, las indicaciones de trasplantectomía, o embolectomía, sus ventajas e inconvenientes; la incidencia del síndrome de intolerancia al injerto y la fisiopatología del síndrome de inflamación crónica, así como el algoritmo de manejo terapéutico propuesto actualmente.
Approximately 4%-10% of incident patients on dialysis have a non-functioning kidney graft, and according to series, as many as 32% require transplantectomy for a variety of reasons. Mortality in these patients is significantly higher than in those with a functioning graft or on renal replacement therapy without having received a graft. Graft intolerance syndrome, early graft loss, severe proteinuria, recurring pyelonephritis or neoplasia, and chronic inflammation syndrome have all been proposed as indications for transplantectomy. Chronic inflammation syndrome occurs in patients with high levels of inflammatory markers (C-reactive protein), anaemia resistant to treatment with erythropoiesis stimulators, and malnutrition markers. This inflammatory state is provoked by the graft, and reverts when a transplantectomy is performed, as several studies have shown. We have reviewed the medical literature published on this topic, the indications for transplantectomy and embolectomy, their advantages and disadvantages, the incidence of graft intolerance syndrome, and the pathophysiology of chronic inflammation syndrome, as well as the currently proposed therapeutic management algorithm.
INTRODUCCIÓN
El 4-10% de los pacientes incidentes en diálisis portan un injerto renal no funcionante1; hasta en el 32% de los casos, según las series, se requiere la realización de trasplantectomía por diversas causas. Aproximadamente el 13% de los pacientes trasplantados en el año 2006 habían recibido un segundo injerto, por lo cual las decisiones terapéuticas en este grupo de pacientes, incluida la indicación de trasplantectomía, tienen potenciales consecuencias2. Estos pacientes pueden presentar un síndrome de intolerancia inmunológica caracterizado clínicamente por fiebre, sin proceso infeccioso de base, hematuria, dolor y aumento del tamaño del injerto. Esta situación, como la pérdida precoz del injerto (en el primer año postrasplante), constituye una indicación clara de trasplantectomía o embolización, según los casos3. Sin embargo, cada vez es más frecuente la presencia de un síndrome de inflamación crónica en aquellos pacientes con pérdida tardía del injerto (más de 12 meses postrasplante) que permanecen en tratamiento renal sustitutivo (TRS). Esta situación de inflamación, junto a la desnutrición íntimamente relacionada, aumenta los episodios de infección y eventos cardiovasculares de estos enfermos y condicionan su mayor tasa de mortalidad4-6. A ello deben sumarse otras complicaciones inherentes a la disminución de la inmunosupresión. La trasplantectomía, sin embargo, no está exenta de complicaciones potencialmente graves, por lo que se debe valorar, siempre que no existan contraindicaciones, la realización de embolectomía7,8.
INDICACIONES DE TRASPLANTECTOMÍA
Las indicaciones actuales de trasplantectomía son el síndrome de intolerancia al injerto, pérdida precoz de éste, presencia de signos de inflamación crónica y otras, como proteinuria grave, infecciones urinarias o pielonefritis recurrentes y neoplasia. También, la nefropatía asociada a la infección por poliomavirus es una causa emergente de pérdida de función del injerto renal, que podría constituir una nueva indicación de trasplantectomía (incluyendo ureterotomía) tras el fallo del injerto atribuible a esta causa.
Síndrome de intolerancia al injerto
Entre el 30 y el 40% de los pacientes que vuelven a diálisis con un injerto no funcionante desarrollan intolerancia inmunológica al disminuir la inmunosupresión. La mayoría de los episodios ocurren en el primer año, describiéndose un riesgo acumulado del 28, 38 y 40% a los 6, 12 y 24 meses respectivamente9. Esta intolerancia se manifiesta por la presencia de febrícula, malestar general, astenia, hematuria, dolor o incremento del tamaño del injerto, todo ello en ausencia de infección sistémica. En caso de fiebre aislada, también debe descartarse la insuficiencia adrenal, ya que son pacientes tratados largo tiempo con esteroides. Madore et al. describen que los sujetos con historia previa de varios episodios de rechazo tienen mayor riesgo de desarrollar intolerancia10. Estos autores concluyen que una disminución más lenta de la inmunosupresión, así como la continuación indefinida de ésta a dosis bajas, disminuye los episodios de intolerancia y la necesidad de trasplantectomía. Inicialmente se relacionó con el tipo de inmunosupresión previa; así, los pacientes tratados con ciclosporina tienen mayor riesgo. Un estudio retrospectivo unicéntrico describe una incidencia de trasplantectomía en el 4% de los pacientes tratados con azatioprina y prednisona frente al 21% de los tratados con ciclosporina11; otros centros publican nefrectomías hasta en el 63% de los pacientes tratados con ciclosporina + azatioprina + prednisona frente al 27% de los tratados con azatioprina + prednisona10. Los regímenes de inmunosupresión actuales incluyen en la mayoría de los pacientes el uso de un anticalcineurínico (generalmente tacrolimus) con prednisona y un antimetabolito (habitualmente micofenolato de mofetilo). No se ha encontrado relación concluyente entre la inmunosupresión y el síndrome de intolerancia al injerto. El tratamiento de este síndrome se ha basado en la administración de indometacina (25-50 mg/12 h por vía oral) y prednisona (5-10 mg/día por vía oral), pero constituye una indicación establecida de trasplantectomía o embolización siempre que no existan contraindicaciones.
Fallo precoz del injerto
La pérdida del injerto durante el primer año constituye una indicación establecida de trasplantectomía, ya sea por el riesgo de rotura de éste por trombosis vascular o rechazo hiperagudo/agudo o por las complicaciones técnicas (infección de lecho quirúrgico, linfocele, desinserción ureteral, rotura vesical, etc.).
Fallo tardío del injerto
Tras el primer año, la pérdida de la función del injerto presenta las siguientes indicaciones de trasplantectomía: el síndrome de intolerancia inmunológica ya mencionado, la presencia de neoplasia, las pielonefritis recurrentes o proteinurias extremas tras la vuelta a diálisis. Merece una mención aparte la indicación de trasplantectomía por la presencia de un síndrome de inflamación crónica atribuible al injerto no funcionante12,13. El síndrome de inflamación crónica se caracteriza por la presencia de anemia, resistencia a la terapia con estimuladores de la eritropoyesis, aumento de marcadores de inflamación (proteína C reactiva [PCR], ferritina, velocidad de sedimentación globular) y disminución de marcadores de nutrición (albúmina).
En diversos estudios de pacientes en TRS (tanto en hemodiálisis como en diálisis peritoneal), se objetiva que los niveles de PCR de pacientes fallecidos o afectos en el seguimiento de un evento cardiovascular son significativamente superiores a los de los no afectos14. Asimismo, el grupo de pacientes en TRS que mostraba niveles más elevados de interleuquina 6 asociaba una mortalidad significativamente más alta15.
Los pacientes con parámetros de malnutrición tienen mayor riesgo de mortalidad y hospitalización por cualquier causa. Entre los pacientes en TRS, un índice de masa corporal y/o colesterol bajos se asocian con mayor mortalidad16-18. Se postula que esta malnutrición viene condicionada por el estado inflamatorio; algunas citoquinas como el factor de necrosis tumoral alfa promueven procesos catabólicos e inducen anorexia16,19. Dado que los niveles bajos de albúmina y/o niveles elevados de PCR se asocian a un incremento de la mortalidad por cualquier causa y a un aumento de los eventos cardiovasculares, algunos autores proponen la realización de trasplantectomía en estos pacientes, comunicando un riesgo de un 32% menos de mortalidad por cualquier causa en pacientes nefrectomizados (hazard ratio: 0,68; intervalo de confianza al 95%: 0,63-0,74)20, si bien es cierto que en este estudio las poblaciones comparadas no fueron homogéneas (los pacientes sometidos a nefrectomía eran significativamente más jóvenes y sanos que los no nefrectomizados), ni tampoco se midió la repercusión a largo plazo, el incremento del número de infecciones y/o eventos cardiovasculares o del mantenimiento de la inmunosupresión en el grupo de pacientes no nefrectomizados21.
El grupo del Hospital Clínico San Carlos de Madrid publicó en el año 2004 un estudio de 43 pacientes que vuelven a diálisis tras la pérdida del injerto; todos presentaban signos de inflamación crónica, y en aquellos que se sometieron a trasplantectomía se objetivó una mejoría de los parámetros de anemia y nutrición a los seis meses de la cirugía que los equiparaba a los demás pacientes en diálisis12.
MANTENIMIENTO DE LA INMUNOSUPRESIÓN
Las ventajas de mantener in situ el injerto renal no funcionante, como conservar la diuresis residual, la producción de eritropoyetina e hidroxilación del calcidiol (funciones estas que se pierden progresivamente al reiniciar diálisis), deben ser valoradas adecuadamente frente a los riesgos descritos de provocar intolerancia inmunológica o un estado de inflamación crónica con efectos deletéreos para los pacientes. Algunos estudios no concluyentes sugieren que el mantenimiento de la inmunosupresión, en un intento de preservar la función renal residual, aumenta la esperanza de vida de los pacientes22. Una pauta aceptada de disminución de inmunosupresión consiste en suspender bruscamente la administración del antimetabolito (azatioprina o micofenolato), con reducción cada semana de un 25% de la dosis del anticalcineurínico o inhibidor de mTOR, y retirar cada mes 2,5 mg de la dosis de esteroides, vigilando la aparición de insuficiencia suprarrenal secundaria9.
Diversos trabajos han descrito el riesgo aumentado de infección y de eventos cardiovasculares en pacientes en diálisis que permanecen de forma crónica con dosis bajas de inmunosupresión. Smak Gregoor et al., en un estudio retrospectivo de 197 pacientes en diálisis con dosis bajas de inmunosupresión (prednisona/azatioprina/ciclosporina) frente a pacientes sin inmunosupresión, encontraron unas tasas de infección de 1,7 frente a 0,5 episodios/paciente/año, siendo el riesgo de mortalidad 3,4 veces mayor en aquellos en los que no se retiraba la inmunosupresión23.
Deberían considerarse los efectos secundarios del uso crónico de corticosteroides: aumento del riesgo de infección, diabetes, cataratas, osteoporosis y la aparición de insuficiencia suprarrenal con la reducción o interrupción de los corticoides, efectos que ocurren hasta en el 30% de los casos. En escasas ocasiones se presenta crisis addisoniana; por el contrario, muchos pacientes pueden presentar síntomas inespecíficos como fatiga, mialgias, artralgias, pérdida de peso, leve hipercalcemia y eosinofilia24,25. No están claramente establecidas la dosis ni la duración de la retirada de corticoides; se han comunicado desde unas pocas semanas hasta 9 meses o más, dependiendo de las dosis previas y la duración de la terapia.
TRASPLANTECTOMÍA FRENTE A EMBOLIZACIÓN
La trasplantectomía es una técnica invasiva asociada a efectos adversos potencialmente graves; sin embargo, la mortalidad asociada a la técnica disminuyó significativamente tras la aparición de la ciclosporina, del 73 al 38%26, y del mismo modo se redujo la incidencia de complicaciones graves del 20 al 10%27. En estudios recientes, la mortalidad asociada a este procedimiento ha disminuido significativamente, del 0,7 al 5%28-29. Las complicaciones más frecuentes son el sangrado y la infección de la herida quirúrgica. Según Johnston et al., los riesgos son más elevados en las nefrectomías tras pérdida precoz del injerto, que se relacionan con complicaciones del mismo injerto más que con la técnica en sí, siendo el riesgo de muerte y sepsis menor en los pacientes con indicación de trasplantectomía tardía. Estos autores describen varios factores asociados a la realización de trasplantectomía (tanto temprana como tardía): la edad menor de 40 años, la presencia de más de 3 incompatibilidades del sistema HLA y la reinclusión en lista de espera en el primer año tras la pérdida de función del injerto31. Sin embargo, Madore et al. encuentran que el único factor relacionado significativamente con la realización de trasplantectomía tanto precoz como tardía es la existencia de dos o más episodios de rechazo agudo10.
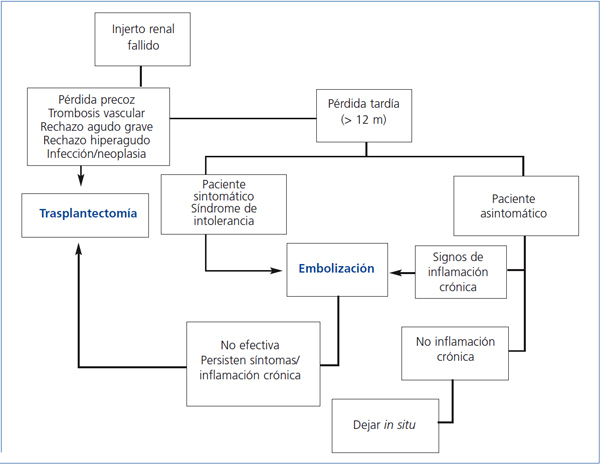
Por otro lado, la embolización usando etanol o esferas de polivinilo, seguidas de la inserción de coils metálicos, es un procedimiento menos invasivo, asociado con una menor estancia hospitalaria y menor tasa de complicaciones que la nefrectomía. Está contraindicada en casos de infección sobreañadida, neoformación del injerto o alto riesgo de rotura de éste (complicaciones quirúrgicas o rechazo grave). La complicación más frecuente es el síndrome posembolización, caracterizado por fiebre, dolor local, hematuria, náuseas y vómitos, que en caso de persistir más allá de las primeras 72 horas obliga a descartar la presencia de vascularización del injerto y la persistencia de intolerancia inmunológica. Pérez Martínez et al. describen, en una serie de 7 pacientes en diálisis sometidos a embolización del injerto, una mejoría de los parámetros de anemia e inflamación tras el procedimiento8. El algoritmo terapéutico actualmente propuesto1 tras la pérdida de función del injerto se recoge en la figura 1.
ASPECTOS INMUNOLÓGICOS. CONTROVERSIAS
Un aspecto aún controvertido de la realización de trasplantectomía o embolización del injerto no funcionante es la formación de anticuerpos anti-HLA (niveles de anticuerpos preformados [PRA]) tras el procedimiento y su implicación en la supervivencia de futuros trasplantes. Se sugiere que el mantenimiento del injerto no funcionante atraparía como una «esponja» los anticuerpos formados, lo que unido a la continuación del tratamiento inmunosupresor evitaría la formación de nuevos anticuerpos contra éste, condicionando la existencia de menores niveles de anticuerpos circulantes pretrasplantectomía30.
En dos series de pacientes retrasplantados se describen niveles de PRA > 30%, con mayor frecuencia en aquellos sometidos a trasplantectomía previa, 57 vs. 33% y 60 vs. 30%32. Asimismo, Gourlay et al. examinan 52 pacientes retrasplantados, describiendo con mayor frecuencia un PRA > 50% en aquellos pacientes sometidos a trasplantectomía (54 vs. 15%)33. Un estudio reciente comparativo, de pacientes retrasplantados con o sin nefrectomía previa, mostró un incremento significativo del PRA en el primer grupo, que se asoció con un aumento significativo de disfunción primaria del injerto y de rechazo agudo, así como una menor supervivencia de éste34. En un subgrupo de pacientes con donantes añosos (mayores de 65 años) o que presentaban mayor número de trasplantes previos (dos o más), la supervivencia de los injertos fue peor si habían sido sometidos a trasplantectomía previa35. Michael Knight et al. describen igualmente un aumento significativo de anticuerpos circulantes tras trasplantectomía, tanto de Clase I como de Clase II, que son específicos de donante, y también que cuanto más corto es el intervalo entre el fallo del injerto y la trasplantectomía (< 10 meses) mayor es el incremento de éstos36. Otros autores, sin embargo, no demuestran un aumento significativo de los niveles de PRA, ni mayor incidencia de rechazo o peor supervivencia del injerto en pacientes nefrectomizados y, aun reportando un aumento significativo de éstos tras la trasplantectomía, no lo relacionan con la supervivencia del injerto37.
Para algunos autores esto es sólo un fenómeno transitorio y el porcentaje de pacientes inmunizados desciende a lo largo del tiempo hasta igualarse con el de los pacientes no nefrectomizados27. Johnston et al. describieron dos tipos de comportamiento tras la nefrectomía en función de la tasa de anticuerpos anti-HLA previa; los pacientes nefrectomizados con un PRA menor del 30% antes del primer trasplante tienen un PRA previo al retrasplante significativamente mayor que los no nefrectomizados, y aquellos pacientes con un PRA mayor del 30% antes del primer trasplante no presentan diferencias significativas en el PRA en el retrasplante, estén nefrectomizados o no31.
Existe igualmente la controversia respecto a que una mayor sensibilización modifica la supervivencia de un segundo injerto. Sumrani et al. describen que la nefrectomía antes del retrasplante se asocia con una mayor incidencia de disfunción primaria del segundo injerto y una menor supervivencia al año32. Otros autores encuentran que la trasplantectomía tras pérdida precoz del injerto se asocia con menor riesgo de pérdida del segundo injerto (relacionada con un descenso de muerte con injerto renal funcionante, más que con una mejoría de la supervivencia del injerto), ocurriendo a la inversa en la trasplantectomía tras pérdida tardía de éste31. Para Yagmurdur et al., aquellos pacientes retrasplantados sometidos a nefrectomía previa que permanecen durante más tiempo en diálisis éste es el factor que determina una menor supervivencia del injerto38. Sin embargo, Ahmad et al. no encontraron diferencias en la supervivencia de los injertos ni de pacientes que habían sido sometidos a hemodiálisis previo al retrasplante37. En este sentido, recientemente se ha descrito que, con las nuevas y más sensibles técnicas de determinación de anticuerpos específicos de donante («luminex single antigen assay»), un porcentaje importante de pacientes con determinaciones de anticuerpos pretrasplante por CDC o ELISA negativos resultaron positivos. El mayor número de rechazos y fallos del injerto en el retrasplante se documentó en los pacientes con trasplantectomías tempranas (< 6 meses) y en los que recibieron injertos de donantes añosos39.
La decisión de efectuar una trasplantectomía o embolización del injerto no funcionante tras la vuelta a diálisis debe individualizarse, considerando todos los factores anteriormente expuestos. Sería recomendable la monitorización de los anticuerpos preformados con los nuevos y más sensibles métodos antes y después de la nefrectomía, así como, antes del retrasplante, ayudar a seleccionar el donante y la terapia inmunosupresora idónea para aquellos pacientes de mayor riesgo.
CONCLUSIONES
A pesar de la escasa evidencia médica acumulada sobre la actitud a tomar con los enfermos que portan injertos no funcionantes en su vuelta a diálisis, está claramente establecida la indicación de trasplantectomía ante la presencia del síndrome de intolerancia al injerto, rechazo hiperagudo, procesos neoplásicos u otros que comporten elevado riesgo de rotura de éste. El síndrome de inflamación crónica, con parámetros de anemia y desnutrición que no puedan explicarse por otras causas, constituiría hoy en día una nueva indicación de trasplantectomía, dadas sus implicaciones pronósticas (aumento de morbimortalidad) en estos pacientes. El mantenimiento del tratamiento inmunosupresor no es aconsejable por llevar asociado un incremento en la tasa de infecciones y eventos cardiovasculares. Siempre que no existan contraindicaciones, se debería plantear la embolectomía frente a la trasplantectomía, por ser un procedimiento menos invasivo, asociado a menor tasa de complicaciones y reducción de la estancia hospitalaria. En cualquier caso, es aconsejable individualizar la indicación de la trasplantectomía en estos pacientes, monitorizando el nivel de anticuerpos anti-HLA tras el procedimiento. Se hacen necesarios más estudios controlados y de mayor tamaño muestral que ayuden a unificar criterios en el manejo de estos enfermos.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Algoritmo terapéutico tras pérdida de función del injerto renal