Introducción: El calcio (Ca) es uno de los elementos fundamentales a tener en cuenta en los pacientes en diálisis, dada su relación con el riesgo cardiovascular. Con la introducción de los modernos quelantes del fósforo no cálcicos y de los calcimiméticos, hemos visto variar la calcemia prehemodiálisis, en los últimos años, de 9,5-10,5 a 8,4-9,5 mg/dl. Para valorar de una forma más precisa las variaciones del Ca durante la sesión de hemodiálisis e individualizar su prescripción, el objetivo del estudio fue comparar diferentes concentraciones de Ca en el baño de diálisis, valorando el balance pre y poshemodiálisis y sus implicaciones en el control del metabolismo fosfocálcico. Pacientes y métodos: Se incluyeron 98 pacientes con una edad media de 59,3 ± 15 años, 68 hombres y 30 mujeres. Cada paciente se sometió a dos sesiones de hemodiálisis variando únicamente la concentración de Ca del baño, una sesión con Ca 2,5 mEq/L (grupo Ca25) y otra con Ca 3,0 mEq/L (grupo Ca30). Se determinaron los niveles de Ca, fósforo (P) y paratohormona (PTH) pre y poshemodiálisis, registrando la medicación relacionada. Además se dividieron los pacientes en cuatro subgrupos según los niveles de calcemia prediálisis en Ca < 8,5, 8,5-9,0, 9,0-9,5 y > 9,5 mg/dl para realizar un análisis más individualizado. Resultados: No se observaron diferencias en los valores prediálisis de Ca, 8,81 ± 0,65 (Ca25) y 8,88 ± 0,61 (Ca30); P, 4,01 ± 1,3 (Ca25) y 4,19 ± 1,2 (Ca30); y PTH, 352 ± 288 (Ca25) y 369 ± 310 (Ca30). Con el baño Ca25, el Ca y la PTH posdiálisis no se modificaron significativamente, mientras que con el Ca30 se observó un incremento significativo del Ca a 10,2 ± 0,6 (p < 0,001) acompañado de un descenso de la PTH (181 ± 227, p < 0,001). No obstante, cuando se analizaba el baño Ca25 por subgrupos de Ca prediálisis (< 8,5 mg/dl [30,6%], 8,5-9,0 [31,6%], 9,1-9,5 [23,5%] y > 9,5 mg/dl [14,3%]), se apreció un aumento del Ca posdiálisis en los subgrupos < 8,5 (p < 0,001) y 8,5-9,0 (p < 0,01), sin cambios en el subgrupo 9,1-9,5, y un descenso del Ca posdiálisis cuando los valores iniciales eran > 9,5 mg/dl (p < 0,01). Con el baño Ca30 se apreció un aumento del Ca posdiálisis en todos los subgrupos (p < 0,001) acompañado de un descenso de la PTH posdiálisis (p < 0,01). Un 42% de los enfermos tomaban calcimiméticos, un 47% paricalcitol y un 32% captores de fósforo con Ca, sin relacionar estos fármacos con el comportamiento del Ca pre y posdiálisis estudiados con ambos baños. Conclusión: La prescripción del Ca del baño de diálisis necesita una individualización basada en los valores pre y posdiálisis de Ca y la necesidad de obtener incrementos, descensos o no variaciones en el calcio posdiálisis en relación con la situación clínica del metabolismo fosfocálcico del enfermo.
Calcium is one of the key elements to consider in patients on dialysis due to its relationship with cardiovascular risk. The introduction of non-calcium-based phosphate binders and calcimimetics has changed the setting for pre-dialysis serum calcium in recent years from 9.5-10.5mg/dl to 8.5-9.5mg/dl. To assess more accurately the changes in calcium (Ca) during haemodialysis sessions and to individualise prescriptions, the aim of this study was to assess the intradialytic changes of two different dialysate Ca concentrations before and after hemodialysis and their implications in controlling calcium-phosphate metabolism. Patients and method: We analysed 98 patients with a mean age of 59.3±15 years, 68 of which were men and 30 women. Each patient received two HD sessions with two different dialysate Ca concentrations: 2.5mEq/l (Ca25 group) or 3.0mEq/l (Ca30 group). Pre- and post-dialysis Ca, phosphorus (P) and PTH were determined, and associated medications were recorded. For a more individualised analysis, patients were divided into four subgroups of Ca<8.5mg/dl, 8.5-9.0mg/dl, 9.0-9.5mg/dl, and >9.5mg/dl, according to pre-dialysis serum calcium levels. Results: There were no differences in pre-dialysis values of Ca: 8.81±0.65 (CA25) and 8.88±0.61 (CA30), P: 4.01±1.3 (CA25) and 4.19±1.2 (CA30), or PTH: 352±288 (CA25) and 369±310 (CA30). Post-dialysis Ca and PTH did not change significantly with CA25 dialysate, although there was a significant post-dialysis Ca increase to 10.2±0.6 (P<.001) accompanied by a decrease in post-dialysis PTH (181±227, P<.001) with CA30. However, with CA25 dialysate, when different subgroups of pre-dialysis Ca were analysed: <8.5mg/dl (30.6%), 8.5-9.0mg/dl (31.6%), 9.1-9.5mg/dl (23.5%) and >9.5mg/dl (14.3%) we observed a Ca increase during the session in the <8.5 (P<.001) and 8.5-9.0 (P<.01) subgroups. Ca was unchanged in the 9.1-9.5 group and Ca decreased when the initial Ca values were >9.5mg/dL (P<.01). A Ca increase (P<.001) and a decrease in PTH (P<.01) were observed in all subgroups with CA30 dialysate. A total of 42% of patients were taking calcimimetics, 47% paricalcitol, and 32% calcium-based phosphate binders, although these drugs were not linked with pre- or post-dialysis Ca levels in or dialysate treatment. Conclusion: We concluded that the prescription of Ca dialysate needs to be individualised based on pre- and post-dialysis Ca values and the need for an increase, decrease, or no changes in post-dialysis calcium in relation to the clinical condition of the patient’s phosphorous-calcium metabolism.
INTRODUCCIÓN
La enfermedad cardiovascular es la causa más frecuente de muerte en pacientes con enfermedad renal crónica, con 30 veces más riesgo de mortalidad respecto a la población general, en gran parte debido a la calcificación vascular y de tejidos blandos1. El debate sobre cuál es la concentración más adecuada de calcio (Ca) en el dializado en pacientes que realizan hemodiálisis (HD) sigue abierto; probablemente no existe la concentración ideal2.
En los años sesenta, con el inicio de las técnicas de diálisis se empleaban arbitrariamente concentraciones de Ca de 2,5 mEq/l (1,25 mmol/l) por su similar concentración respecto al Ca sérico, observándose que los pacientes absorbían poco Ca y terminaban con hipocalcemia. Con el reconocimiento de la relación entre hipocalcemia e hiperparatiroidismo (HPT) a finales de dicha década, se recomendó el uso de concentraciones de 3,5 mEq/l, que se mantuvieron durante largo tiempo como el estándar de elección por el adecuado control del HPT3,4.
Con el uso de captores de fósforo (P) cálcicos y la introducción del calcitriol en el tratamiento de los pacientes en HD, se observó un aumento de los episodios de hipercalcemia, lo que llevó a una revaloración a la baja de las concentraciones de Ca en el baño de diálisis a 2,5-3,0 mEq/l5. Posteriormente, la introducción de los captores de P no cálcicos y de los calcimiméticos varió el escenario de la calcemia prediálisis. Así, las guías K/DOQI6 recomendaron objetivos de Ca entre 8,4-9,5 mg/dl y posteriormente las KDIGO7 sugirieron niveles de Ca acordes a la normalidad de cada laboratorio. Estos objetivos fueron recogidos en las guías de manejo de las alteraciones del metabolismo óseo-mineral en los pacientes con enfermedad renal crónica de la Sociedad Española de Nefrología8.
Para valorar de una forma más precisa las variaciones del Ca durante las sesiones de HD e individualizar su prescripción en el líquido de diálisis, en el presente estudio se compararon diferentes concentraciones de Ca en el líquido de diálisis, los cambios pre y poshemodiálisis y sus implicaciones en el control del metabolismo fosfocálcico.
PACIENTES Y MÉTODOS
Estudio prospectivo de intervención con 98 pacientes en HD, 68 hombres y 30 mujeres, de 59,3 ± 15 años (intervalo 24-68), en programa crónico durante 42,6 ± 49 meses. La etiología de su enfermedad renal crónica era de 17 pacientes con nefropatía diabética, 14 con poliquistosis renal, 21 con nefropatía isquémica, 5 con nefropatía tubulointersticial, 16 con glomerulonefritis crónica; causas urológicas: 4; otras causas: 6 pacientes; 15 no filiadas.
Los pacientes se dializaron con monitores 4008 S o 5008 (Fresenius), el 86% con hemodiafiltración on-line (HDF OL) posdilucional y el resto (14%) con HD de alto flujo, dializadores helixona de 1,4-1,8 m2 o poliamida de 2,1 m2; tiempo de diálisis: 317 ± 86 minutos (intervalo: 150-480 min); flujo sanguíneo: 411 ± 32 ml/min (350-500 ml/min); flujo de baño: 612 ± 146 ml/min (400-800 ml/min); volumen convectivo: 23,5 ± 14 l (intervalo: 0-55 l).
A cada paciente le fueron realizadas dos sesiones en las que sólo se variaba la concentración de Ca en el baño, 2,5 mEq/l (grupo Ca25) o 3,0 mEq/l (grupo Ca30), en la sesión intermedia de la semana, con un intervalo entre ambas sesiones de una semana, sin cambiar los parámetros de HD restantes. Se aleatorizó el orden de sesión con Ca 2,5 o Ca 3,0 mEq/l. En cada una de las sesiones de HD se realizó analítica para Ca, P y parathormona (PTH) intacta prediálisis (extracción directamente del paciente) y posdiálisis, extrayéndose de la toma arterial tras esperar un minuto con el flujo sanguíneo a 50 ml/min. La PTH se analizó con reactivo de la casa DiaSorin®. El coeficiente de variación de la determinación del Ca era del 1,64%, y para el P, del 1,98%. No se realizaron correcciones para los valores de calcemia posdiálisis por hemoconcentración o cambios en las concentraciones de albúmina.
Se recogió también la medicación de cada paciente relacionada con el metabolismo Ca-P (calcimiméticos, paricalcitol y captores de P).
Los resultados se expresaron como la media aritmética ± desviación típica. Para el análisis de la significación estadística de parámetros cuantitativos se ha empleado el test de la t de Student para datos pareados o no pareados, o el test de ANOVA para datos repetidos (prueba de Newman-Keuls). Se ha considerado estadísticamente significativa una p < 0,05.
RESULTADOS
Se analizaron en total 196 sesiones, que fueron bien toleradas, sin observar ningún episodio de hipotensión, hipertensión o arritmia atribuible al cambio del Ca en el baño.
La media de Ca prediálisis fue de 8,81 ± 0,65 mg/dl para el grupo Ca25, y de 8,88 ± 0,61 mg/dl para el grupo Ca30. La media de P prediálisis fue de 4,01 ± 1,3 y 4,19 ± 1,2 mg/dl para el grupo Ca25 y Ca30, respectivamente. La media de PTH prediálisis fue de 352 ± 288 y 369 ± 310 pg/ml, respectivamente.
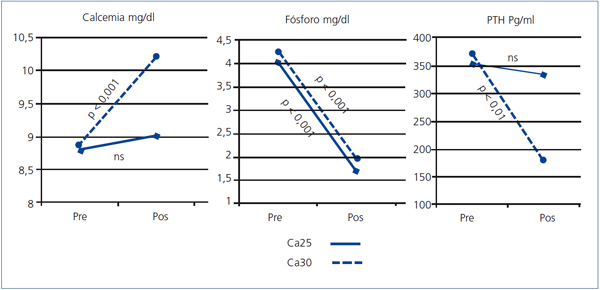
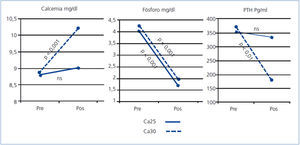
Como se puede ver en la figura 1, los valores de Ca pre y posdiálisis en el grupo Ca25 no presentaron diferencias significativas, mientras que en el grupo Ca30 se apreció un incremento significativo. El P posdiálisis se redujo significativamente de forma similar en los grupos Ca25 y Ca30.
Las variaciones en el Ca durante la sesión de diálisis se acompañaron de cambios en orden inverso en la PTH. Para el grupo Ca25, la PTH posdiálisis no presentó variaciones significativas, 352 ± 287 pg/ml prediálisis frente a 332 ± 289 pg/ml posdiálisis. En el grupo Ca30, con una media de PTH prediálisis de 369 ± 311, se redujo a 181 ± 227 pg/ml posdiálisis (p < 0,001), producto de la inhibición producida por la mayor calcemia posdiálisis en este grupo de tratamiento (figura 1).
Análisis por subgrupos: balance individualizado del calcio
Con el objetivo de caracterizar de una manera más individualizada los resultados, se dividieron los pacientes según los valores de Ca prediálisis y se reanalizaron los datos con los siguientes subgrupos: Ca < 8,5 mg/dl (subgrupo 1), Ca entre 8,5-9,0 mg/dl (subgrupo 2), Ca 9,0-9,5 mg/dl (subgrupo 3) y pacientes con Ca > 9,5 mg/dl (subgrupo 4).
Grupo Ca25
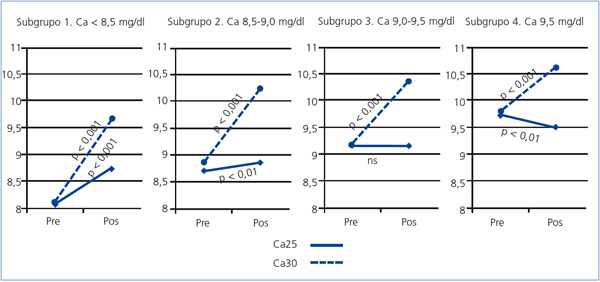
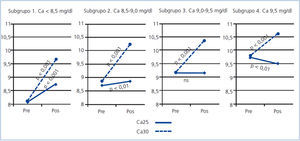
Subgrupo 1 (Ca < 8,5 mg/dl), n = 30. Partiendo de un Ca de 8,07 ± 0,44, la calcemia posdiálisis se incrementó a 8,74 ± 0,41 mg/dl, p < 0,001 (figura 2).
De los 30 pacientes de este subgrupo, 25 (83,3%) presentaron un aumento del Ca posdiálisis, 2 (6,7%) se mantuvieron estables y los 3 restantes (10%) presentaron un descenso al final de la diálisis.
Subgrupo 2 (Ca 8,5-9,0 mg/dl), n = 31. La media de Ca prediálisis, 8,75 ± 0,17, se incrementó a 9,01 ± 0,48 mg/dl posdiálisis, p < 0,01 (figura 2).
De los 31 pacientes de este subgrupo, 19 (61,3%) mostraron un incremento del Ca posdiálisis, 2 (6,4%) permanecieron sin cambios y 10 (32,3%) presentaron una disminución del Ca posdiálisis.
Subgrupo 3 (Ca 9,0-9,5 mg/dl), n = 23. No se encontraron diferencias significativas entre el Ca pre y posdiálisis (figura 2).
De los 31 pacientes de este subgrupo, 9 (39,1%) presentaron un incremento del Ca final, 3 (13%) no mostraron cambios y 11 (47,8%) presentaron una disminución del Ca posdiálisis.
Subgrupo 4 (Ca > 9,5 mg/dl), n = 14. El Ca prediálisis, 9,77 ± 0,22, disminuyó ligeramente a 9,33 ± 0,41 mg/dl posdiálisis, p < 0,01 (figura 2).
Para este subgrupo, sólo en un paciente (7,1%) aumentó el Ca final, en otro (7,1%) no se mostraron cambios y los demás (85,7%) presentaron una reducción del Ca final.
El P se redujo en todos los subgrupos de forma similar, independientemente de los niveles prediálisis de Ca de cada subgrupo.
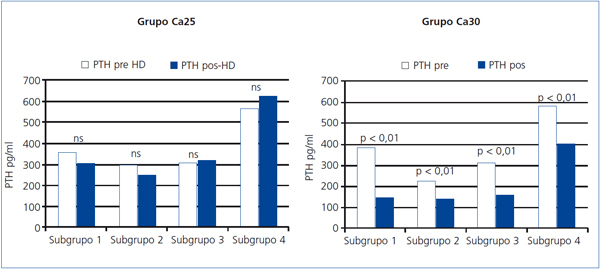
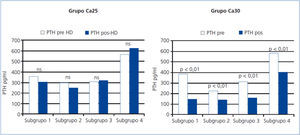
Las variaciones en la PTH pre y posdiálisis en los cuatro subgrupos no mostraron cambios significativos (figura 3).
En el subgrupo 4, pacientes con calcemias prediálisis más altas presentaron también niveles de P y PTH más elevados, reflejando que es el subgrupo de más difícil control de metabolismo fosfocálcico.
Grupo Ca30
Cuando el Ca utilizado en el líquido de diálisis fue de 3,0 mEq/l, todos los subgrupos mostraron un incremento significativo del Ca posdiálisis (figura 2). Estas diferencias eran menores en los subgrupos que partían de valores más elevados de Ca prediálisis: incrementos del 19,2%, 16,3%, 13,0% y 7,5% en los subgrupos 1, 2, 3 y 4, respectivamente.
En los 4 subgrupos este incremento del Ca posdiálisis se acompañó de una reducción significativa de los valores PTH posdiálisis (figura 3).
En el caso del P, al igual que en el grupo Ca25, se redujo en todos los subgrupos de forma similar.
Influencia de la medicación
Con objeto de valorar si la medicación para el control del metabolismo fosfocálcico influía sobre el comportamiento del Ca durante la sesión de HD, analizamos los pacientes en función de si recibían o no paricalcitol (100% endovenoso), cinacalcet y captores de P con aporte de Ca.
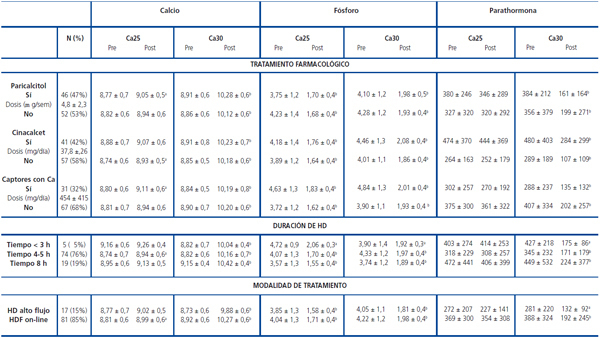
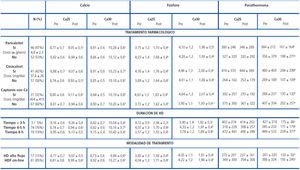
En la tabla 1 se pueden observar los niveles de Ca, P y PTH pre y posdiálisis en los pacientes que recibían paricalcitol, cinacalcet o captores cálcicos. Se puede observar la poca influencia de tomar o no esta medicación en las variaciones de la calcemia durante la sesión de diálisis; se muestra cómo el principal determinante de los cambios en la calcemia era la concentración de Ca del líquido de diálisis.
Influencia de la duración de diálisis
Respecto al tiempo de diálisis, el 76% de los pacientes se dializaron durante 4-5 horas, el 19% recibieron 8 horas de diálisis (esquema de diálisis larga nocturna), y el 5% restante, menos de 3 horas (esquema de diálisis diaria).
Los pacientes que se dializaron menos de 3 horas mostraron valores prediálisis de Ca similares a los que lo hicieron 4-5 o más de 8 horas, con valores de Ca posdiálisis similares, 9,26 ± 0,4 vs. 8,94 ± 0,6 y 9,13 ± 0,5 mg/dl (no significativa [ns]) cuando los pacientes se dializaban en el grupo Ca25. Cuando se dializaban con Ca30, el Ca posdiálisis se incrementó de forma significativa independientemente de la duración de diálisis (tabla 1). Por tanto, se observa que el tiempo de diálisis tiene poca influencia en los cambios de calcemia durante la sesión de diálisis y que los cambios intradiálisis de Ca dependen de la elección de la concentración de Ca del líquido de diálisis y, en menor medida, de los valores de Ca prediálisis.
Influencia de la modalidad de diálisis
Respecto a la modalidad de tratamiento, un 14% de los pacientes se dializaron con HD de alto flujo, y un 86% con HDF OL, con un volumen de reinfusión de 24,1 ± 14 litros.
En la tabla 1 se puede observar los niveles de Ca, P y PTH pre y posdiálisis separados por ambas modalidades de tratamiento. Se puede observar asimismo la poca influencia de dializarse con HD o HDF OL en las variaciones de la calcemia durante la sesión de diálisis, mostrando de nuevo cómo el principal determinante fue la concentración de Ca del líquido de diálisis.
DISCUSIÓN
La homeostasis del metabolismo del Ca y el P y el control del HPT secundario representan aspectos muy importantes en la insuficiencia renal y en los pacientes en diálisis. El aumento del P sérico y del producto Ca x P es reconocido como un factor de mortalidad por el aumento del riesgo cardiovascular en esta población9.
La elección adecuada de la concentración de Ca en el dializado resulta crucial en el manejo de los pacientes en diálisis; el balance positivo de Ca se asocia con calcificaciones vasculares, mientras que la pérdida puede desencadenar HPT y disminución de masa ósea10.
En la actualidad se dispone comercialmente de tres presentaciones de Ca para los baños de HD: Ca 1,25 mmol/l (2,5 mEq/l), Ca 1,5 mmol/l (3,0 mEq/l), Ca 1,75 mmol/l (3,5 mEq/l). No hay consenso sobre cuál es el contenido ideal de Ca en el líquido de diálisis; probablemente no existe la concentración ideal2. Las concentraciones bajas de Ca (1,25-1,50 mmol/l) tienen como ventaja que reducen el riesgo de hipercalcemia, permiten el uso de vitamina D y captores de fósforo cálcicos y evitan la enfermedad ósea adinámica11. Dentro de las desventajas, se ha descrito una peor tolerancia hemodinámica11, mayor predisposición a arritmias11,12 y estímulo de la PTH con el desarrollo de HPT secundario de novo o empeoramiento en los pacientes que ya lo presentan13, 14. Las concentraciones altas de Ca ofrecen un mejor control de HPT secundario, pero con el riesgo de hipercalcemia si al paciente no se le sigue de forma estrecha2,11.
Históricamente se comenzaron a utilizar concentraciones de Ca de 2,5 mEq/l por su similar concentración al Ca sérico, pero se observó que los pacientes absorbían poco Ca y presentaban frecuentes cuadros de hipocalcemia. Con el reconocimiento de la relación entre hipocalcemia e HPT, a finales de los años sesenta se promulgó el uso de concentraciones de 3,5 mEq/l, que se mantuvieron durante largo tiempo como el estándar de elección por el adecuado control del HPT y el descenso de casos de hipocalcemia15.
Con la introducción del calcitriol, mejorando la absorción de Ca a nivel intestinal, y el cambio gradual de captores de P cálcicos que sustituyeron el aluminio, se observó una ganancia excesiva de Ca con el riesgo de las complicaciones previamente comentadas. Todo ello, sumado a una mayor prevalencia de la enfermedad ósea adinámica que se relacionó con los balances positivos de Ca, llevó a que en las últimas décadas se recomendara el uso de líquido de diálisis con concentraciones de Ca 2,5 mEq/l16.
Las recomendaciones de las guías clínicas de manejo del metabolismo fosfocálcico han evolucionado en los últimos años a tenor de los nuevos conocimientos y los diferentes estudios. Las K/DOQI aconsejaban el uso de Ca 2,5 mEq/l en el año 2003; dos años después las mismas guías recomendaban el uso de baños con Ca 2,5 mEq/l en pacientes tratados con quelantes a base de Ca, y el uso de líquidos con Ca 3,0 mEq/l para aquellos pacientes que no reciben sales cálcicas, teniendo en cuenta los niveles de Ca sérico y el uso o no de análogos de vitamina D6. Las guías KDIGO en el año 2009 dejan la decisión a criterio del clínico, pues no dan criterios exactos de recomendación de una u otra concentración de Ca7.
En el presente trabajo hemos analizado los pacientes según su calcemia prediálisis, como punto de partida de la individualización, valorando cómo la elección de un líquido de diálisis de Ca25 o Ca30 repercutía sobre el Ca y la PTH posdiálisis. En el grupo Ca25 se comprobó que los pacientes con calcemias prediálisis más bajas presentaron un discreto incremento en el Ca posdiálisis con tendencia a la supresión de la PTH; los pacientes con Ca prediálisis entre 8,5 y 9,5 mg/dl mantuvieron estables los valores de Ca y PTH pre y posdiálisis, mientras que los pacientes con Ca inicial > 9,5 mg/dl presentaron un discreto descenso del Ca posdiálisis con una tendencia al aumento de la PTH. Sin embargo, en el grupo Ca30 se observó un incremento del Ca posdiálisis con una marcada reducción de la PTH, siendo estas diferencias más destacables en los subgrupos que partían con valores más bajos de Ca prediálisis. Las presentes observaciones del comportamiento del Ca posdiálisis y su estrecha relación con los cambios de PTH posdiálisis sugieren que la determinación del Ca posdiálisis podría ser una herramienta fácil, práctica y asequible para evaluar las variaciones intradiálisis de Ca y PTH que permitirían valorar de una forma individualizada la repercusión de la prescripción dialítica y, concretamente, de la concentración de Ca del líquido de diálisis.
No obstante, hay que ser cautos en la interpretación de los resultados posdiálisis tanto del Ca como de la PTH y hay que tener en mente la cinética del Ca17. Durante el proceso dialítico, se producen varios cambios que afectan al Ca posdiálisis, como las variaciones en el Ca unido a proteínas relacionadas con los cambios de pH, bicarbonato y otros iones; la hemoconcentración y, finalmente, el proceso de rebote o reequilibrio intercompartimental posdiálisis, que podría durar hasta 180 minutos tras finalizar la diálisis. En este sentido, varios estudios han observado un incremento del HPT a medio o largo plazo cuando se utiliza de forma generalizada un Ca de 2,5 mEq/l. Al Aly et al.18 y Fernández et al.19 mostraron cómo los pacientes dializados con baños de Ca25 presentaban niveles de PTH más elevados a largo plazo, con un aumento de los casos de HPT hasta del 75%. Asimismo, Molina et al.20 compararon a medio plazo el cambio de Ca líquido de diálisis de 2,5 mEq/l a 3,0 mEq/l observando que, en ausencia de hipercalcemia o excesiva supresión de PTH, los pacientes tratados con concentración de Ca en el líquido de dializado 3,0 mEq/l mejoraron el control del HPT sin riesgo de hipercalcemias graves.
Las técnicas convectivas de HDF OL utilizan el mismo líquido de diálisis como líquido de sustitución y, por tanto, al contener Ca, influyen también en el control del Ca. En este estudio hemos observado que, cuando se utiliza un Ca25, no se presentan cambios en el Ca final entre los pacientes que se dializan con HD o HDF OL. Cuando se utiliza un baño de Ca30, el incremento en el Ca final es ligeramente más elevado en modalidad de HDF OL que en HD, 15,1 vs. 13,2% respectivamente, con una reducción similar de la PTH (50,5 vs. 53,0%). Por tanto, la modalidad de diálisis tendría poca o ninguna influencia sobre las variaciones del Ca intradiálisis. Malberti et al.21 sostienen estos resultados mostrando los pocos cambios observados al comparar HD con HDF, a pesar de que en este estudio observaron un ligero balance negativo de Ca iónico tanto en HD como en HDF.
Es importante destacar que la dinámica del comportamiento del equilibrio Ca-P-PTH está en constante movimiento, y el hecho de escoger uno u otro Ca del líquido de diálisis deberá ser una decisión acorde a la tendencia del comportamiento del paciente y sus analíticas evolutivas; no se aconseja tomar decisiones sobre determinaciones aisladas sin tener en cuenta el contexto del paciente. En este sentido, es de destacar en los últimos años la mejora en el control del metabolismo fosfocálcico, gracias a la incorporación de los tratamientos con paricalcitol y cinacalcet22. El efecto de estos fármacos se produce esencialmente durante el período interdiálisis; en el presente estudio se ha observado la poca influencia sobre los cambios intradiálisis de la calcemia o de la PTH cuando analizamos si recibían o no estos fármacos.
En resumen, la individualización en la elección de la concentración de Ca del líquido de diálisis es una prescripción a tener en cuenta para el adecuado control de la calcificación en los pacientes en diálisis, que depende de la situación clínica, dinámica e individual de los pacientes renales crónicos. La valoración de la calcemia prediálisis, así como la determinación de la calcemia posdiálisis, pueden ser de gran ayuda para la individualización del líquido de diálisis.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Influencia del tratamiento farmacológico, duración de diálisis y modalidad de diálisis sobre el metabolismo fosfocálcico, sobre el calcio pre y posdiálisis
Figura 1. Comparación de la calcemia, fosforemia y parathormona intacta pre y posdiálisis en los grupos baño de diálisis de Ca25 y Ca30 analizados
Figura 2. Comparación de la calcemia pre y posdiálisis, en los grupos de baño de diálisis Ca25 y Ca30, en los diferentes subgrupos de calcio prediálisis
Figura 3. Comparación de los valores pre y posdiálisis de parathormona analizados en los grupos de baño de diálisis Ca25 y Ca30 en los diferentes subgrupos de calcio prediálisis