Varios países europeos disponen de programas de donación tras parada cardiaca controlada (cDCD). Veintidós centros participan en el grupo GEODAS, cuyos resultados clínicos presentamos desde una perspectiva nefrológica.
MétodosEstudio multicéntrico retrospectivo observacional con inclusión sistemática de todos los trasplantes renales (TR) procedentes de cDCD, siguiendo protocolos locales de extracción e inmunosupresión.
ResultadosSe incluyó a 335 donantes tras cDCD (edad media 57,2 años) fallecidos mayoritariamente por eventos cardiovasculares. Se analizan 566 receptores (edad media de 56,5 años; el 91,9% con primer trasplante renal), con una mediana de seguimiento de 1,9 años. La terapia de inducción fue casi universal (timoglobulina 67,4%; simulect 32,8%) con mantenimiento con prednisona-MMF-tacrolimus (91,3%) o combinaciones con mTOR (6,5%). El tiempo medio de isquemia fría (CIT) fue 12,3h. Hubo un 3,4% de fallo primario del injerto (n=19), asociado fundamentalmente al tiempo de isquemia fría (solo el CIT ≥ 14h se asoció a fallo primario del injerto). La función retrasada del injerto (DGF) fue 48,8%. Los factores de riesgo para la DGF fueron: CIT ≥ 14h OR 1,6, procedencia de hemodiálisis (vs. diálisis peritoneal) OR 2,1 y edad del donante OR 1,01 (por año). Veintiún pacientes fallecieron con injerto funcionante (3,7%), con una supervivencia de paciente e injerto (censurada para muerte) al segundo año del 95% y del 95,1%, respectivamente. El filtrado glomerular estimado al año de seguimiento fue 60,9ml/min.
ConclusionesEl CIT es un factor modificable para mejorar la incidencia del fallo primario del injerto en trasplante renal procedente de cDCD. El trasplante renal con cDCD tiene mayor incidencia en la función retrasada del injerto, pero igual supervivencia de paciente e injerto que la referencia histórica para donación en muerte encefálica. Los resultados son satisfactorios para continuar promoviendo este tipo de donación.
Many European countries have transplant programmes with controlled donors after cardiac death (cDCD). Twenty-two centres are part of GEODAS group. We analysed clinical results from a nephrological perspective.
MethodsObservational, retrospective and multicentre study with systematic inclusion of all kidney transplant recipients from cDCD, following local protocols regarding extraction and immunosuppression.
ResultsA total of 335 cDCD donors (mean age 57.2 years) whose deaths were mainly due to cardiovascular events were included. Finally, 566 recipients (mean age 56.5 years; 91.9% first kidney transplant) were analysed with a median of follow-up of 1.9 years. Induction therapy was almost universal (thymoglobulin 67.4%; simulect 32.8%) with maintenance with prednisone-MMF-tacrolimus (91.3%) or combinations with mTOR (6.5%). Mean cold ischaemia time (CIT) was 12.3h. Approximately 3.4% (n=19) of recipients experienced primary non-function, essentially associated with CIT (only CIT ≥ 14 h was associated with primary non-function). Delayed graft function (DGF) was 48.8%. DGF risk factors were CIT ≥ 14 h OR 1.6, previous haemodialysis (vs. peritoneal dialysis) OR 2.1 and donor age OR 1.01 (per year). Twenty-one patients (3.7%) died with a functioning graft, with a recipient and death-censored graft survival at 2-years of 95% and 95.1%, respectively. The estimated glomerular filtration rate at one year of follow-up was 60.9 ml/min.
ConclusionsCIT is a modifiable factor for improving the incidence of primary non-function in kidney transplant arising from cDCD. cDCD kidney transplant recipients have higher delayed graft function rate, but the same patient and graft survival compared to brain-dead donation in historical references. These results are convincing enough to continue fostering this type of donation.
El trasplante renal (TR) es la mejor opción terapéutica dentro del modelo integrado de tratamiento sustitutivo renal1,2. En España, la tasa de donación en 2017ha sido 46,9 por millón de población (pmp): el TR representa la primera modalidad de tratamiento sustitutivo renal con un 53% de los pacientes. Esto se ha conseguido en gran medida gracias a la aceptación de nuevos perfiles de donantes. Sin embargo, en el año 2011 la donación en muerte encefálica (DBD, según sus siglas en inglés) se había estabilizado y los 2.229 TR realizados no parecían suficientes para los 4.524 pacientes que se mantenían en lista de espera3. En aquel momento, se promovía el uso de órganos procedentes de donantes con criterios expandidos y la donación en asistolia no controlada (ncDCD) para mejorar el acceso al TR. El modelo de ncDCD, puesto en marcha en nuestro país en 1992, tiene una organización e infraestructura compleja y, por tanto, está limitado a unos pocos hospitales3. Al mismo tiempo, varios países europeos disponían de programas de donación tras parada circulatoria controlada (cDCD), con resultados satisfactorios4,5.
En 2011, la Organización Nacional de Trasplantes (ONT) impulsó, en colaboración con hospitales y sociedades científicas, un plan institucional para promover la donación tipo 3 de Maastricht, en la que el donante presenta muerte circulatoria controlada en el entorno hospitalario (cDCD)6.
En 2012 se ponen en marcha estos programas en varios hospitales y pronto se publican las experiencias de las primeras series de casos7. En ese mismo año, el grupo de trabajo de trasplante de la SEN (SENTRA) promueve un estudio cooperativo entre hospitales que se incorporan a este modelo de donación (estudio GEODAS-3). Este artículo describe y analiza dicha experiencia en el marco de referencia nacional8.
MétodosDiseñoAnálisis retrospectivo multicéntrico de una base de datos en la que se incluyen sistemáticamente todos los receptores de un TR de cDCD en los 22 hospitales participantes que se fueron incorporando a medida que iniciaban el programa. El primer centro comienza con el modelo de cDCD en enero de 2012 y se incluyen pacientes hasta diciembre de 2016. Este proyecto fue aprobado por el Comité de Ética de Investigación del Hospital Puerta de Hierro, ha sido auspiciado por el grupo de trabajo de trasplante de la Sociedad Española de Nefrología (SENTRA) y forma parte de las líneas de proyecto de la REDinREN ISCIII 016/009/009 (Work Package 6).
Recogida de variablesCada centro dispone de su propio proceso para la extracción y preservación de órganos con laparotomía ultrarrápida, rápida con canalización antemortem y perfusión fría, o perfusión normotérmica con oxigenación por membrana extracorpórea (ECMO). No existe un protocolo de inmunosupresión único, aunque la inducción con anticuerpos monoclonales o policlonales es la norma, según las recomendaciones de las guías clínicas vigentes. Cada centro dispone de una base de datos de estructura idéntica para la recogida de la información y seguimiento clínico que se va completando de forma prospectiva. Periódicamente se integran y depuran con rutinas lógicas, de rango y consistencia interna, en la coordinación central. Se ha seguido un principio de inclusión sistemática de todos los casos que reciben un órgano procedente de donación cDCD, generado en un hospital del grupo o en uno externo. Nuestro objetivo es el seguimiento de los TR realizados en los hospitales del grupo y, por tanto, los riñones enviados a otros centros no se incluyen en el análisis.
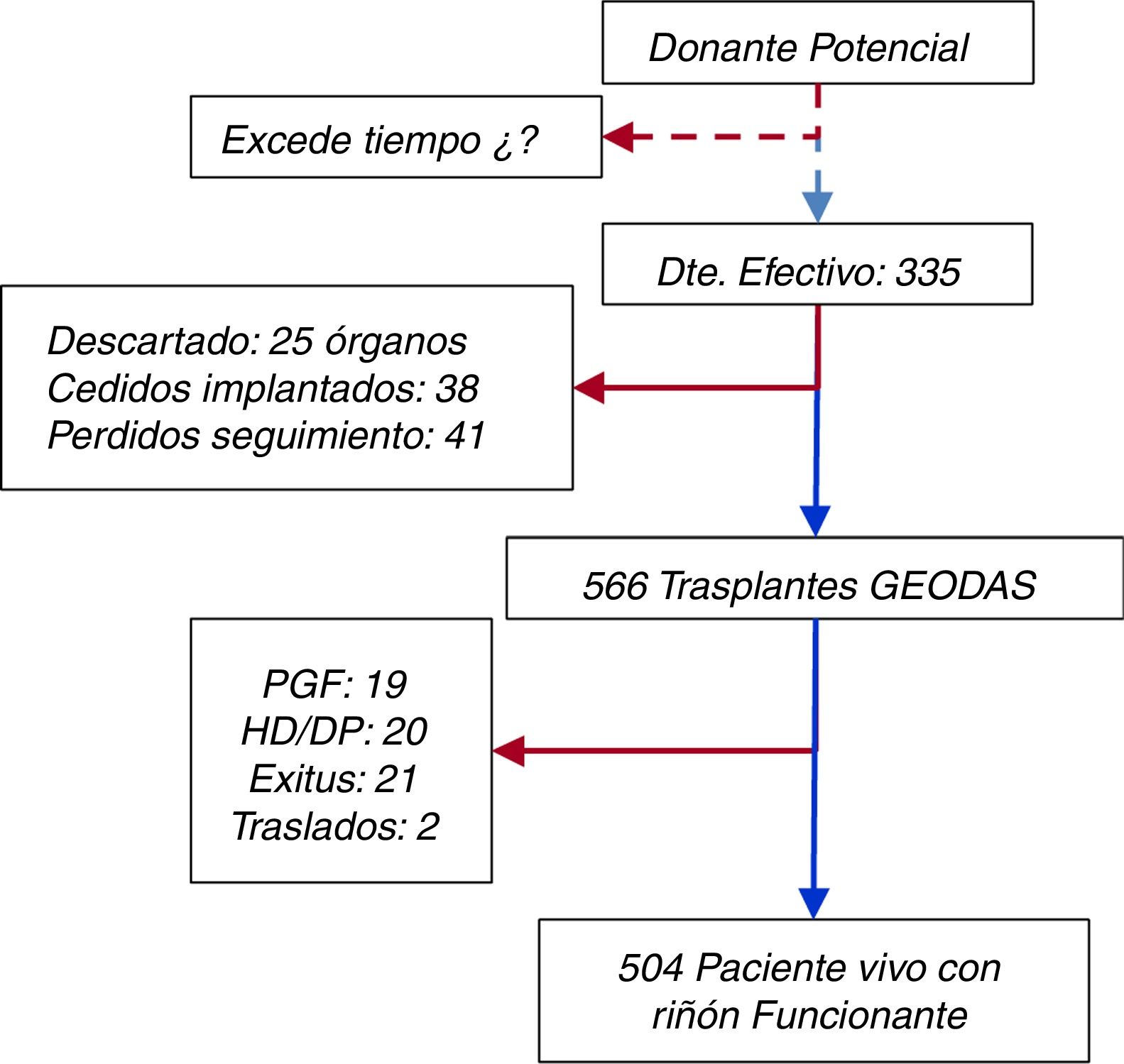
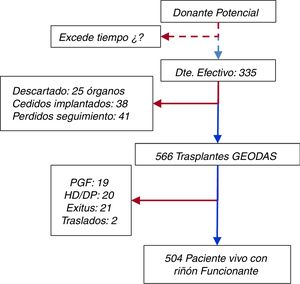
DefinicionesLas definiciones de los eventos clínicos son las siguientes: a) fallo primario del injerto (PNF), definido como injerto que nunca llega a funcionar; b) función retrasada de injerto (DGF), definida como la necesidad de al menos una sesión de hemodiálisis en la primera semana postrasplante9; c) función renal al año, calculada en forma de filtrado glomerular estimado mediante la fórmula Modified Diet Renal Disease-4 (MDRD-4) y d) supervivencia del paciente con injerto funcionante y de injerto censurada por muerte del paciente mediante curvas de Kaplan-Meier. Los pacientes son seguidos hasta su fallecimiento o fracaso del injerto. La figura 1 ilustra el diagrama de flujo de pacientes.
Análisis estadísticoLas variables cuantitativas se muestran como media y desviación estándar (DE) o mediana e intervalo intercuartílico (IQR), según sigan o no una distribución normal. Las variables categóricas se expresan como frecuencia o porcentaje. Se realizan comparaciones entre grupos mediante el test de t de Student para comparación de medias y el de chi-cuadrado para comparación de porcentajes. En todos los casos, se considera diferencia significativa cuando p<0,05. El punto de corte óptimo para la variable tiempo de isquemia fría (CIT) se analizó mediante curvas ROC (receiver operating characteristic), buscando el equilibrio entre sensibilidad y especificidad. El análisis de supervivencia se realizó mediante curvas de Kaplan-Meier. Además, realizamos un análisis univariante mediante regresión logística binaria para evaluar los factores de riesgo asociados a la aparición de eventos clínicos: PNF y DGF. En el análisis multivariante se incluyen todas aquellas variables con valor p<0,10 en el univariante, así como otras variables clínicamente relevantes para controlar sesgos de confusión. Los resultados de los modelos se muestran como odds ratio (OR) con su intervalo de confianza al 95%. La base de datos está diseñada en Access® (Microsoft Inc, EE. UU.) y el análisis estadístico se realiza con Stata v14 (StataCorp 2015, College Station, TX, EE. UU.).
ResultadosDescripción de los donantes y del proceso de donaciónEn total se incluyó a 335 donantes cDCD en su mayoría varones (69,1%) y con una edad media de 57,2 años (DE 12,0; rango 2-86). Los donantes estaban ingresados en las unidades de cuidados críticos por diversos motivos y habían alcanzado una situación irreversible con una decisión firme de su equipo clínico habitual de suspensión de las medidas de soporte vital. La enfermedad causante, la comorbilidad y el estatus serológico se resumen en la tabla 1. Los donantes tenían una creatinina sérica (Crs) media de 0,7mg/dl (DE 0,4; rango 0,3-2,1). Se realizaron biopsias preimplante en un 36,7% de los casos.
Características basales de los donantes, receptores y datos relevantes del proceso del trasplante
| Donantes | n=335 |
|---|---|
| Edad en años, media (DE) | 57,2 (12,0) |
| Hombre (%) | 69,1 |
| Donante con criterios expandidos (%) | 45,9 |
| Causa de muerte cardiovascular (%) | 55,3 |
| Receptores | n=566 |
|---|---|
| Edad en años, media (DE) | 56,5 (12,0) |
| Edad>65 años (%) | 24,1 |
| Hombres (%) | 68,4 |
| Diabetes mellitus (%) | 32,1 |
| Evento cardiovascular previo (%) | 10,8 |
| Etiología de la ERC (%) | |
| Glomerulonefritis | 17,5 |
| Nefropatía hipertensiva | 12,2 |
| Nefropatía diabética | 13,8 |
| Intersticial | 11,1 |
| Poliquistosis | 14,5 |
| Otras | 10,3 |
| Desconocida | 20,7 |
| Terapia renal previa (%) | |
| Hemodiálisis/diálisis peritoneal | 75,4 / 19,7 |
| Trasplante en prediálisis | 4,9 |
| Tiempo previo en diálisis en años, mediana (IQR) | 2,02 (1,19-3,57) |
| Pacientes sin trasplante previo (%) | 91,9 |
| Características del trasplante | |
|---|---|
| Número de incompatibilidades HLA, media (DE) | 3,9 (1,3) |
| Isquemia fría en horas, media (DE) | 12,3 (6,5) |
| Isquemia caliente en minutos, media (DE) | 26,5 (15,6) |
| Inducción (timoglobulina/basiliximab) en % | 67,4/32,6 |
| Seguimiento en años, media | 1,9 |
DE: desviación estándar; DM: diabetes mellitus; DP: diálisis peritoneal; ERC: enfermedad renal crónica; HD: hemodiálisis; HLA: antígeno leucocitario humano; IQR: intervalo intercuartílico.
El protocolo inicial limitaba la edad a 65 años, pero se fueron ampliando los criterios progresivamente. Un 24,1% de los donantes tenían una edad superior a los 65 años y un 45,9% cumplían los criterios para ser considerados donantes con criterios expandidos (edad>60 años o>50 años con 2de 3factores de riesgo (hipertensión arterial, causa de muerte cardiovascular o Crs>1,5mg/dl). En cuanto al proceso de extracción/preservación, se realizó laparotomía rápida con preservación estática en frío en un 61%, canulación antemortem con catéter de triple luz y perfusión fría en un 16% y, en el resto, perfusión normotérmica con oxigenación extracorpórea. La extracción fue solo renal en el 64,7% de los casos y multiorgánica en el resto. La tendencia evolutiva a lo largo del tiempo ha sido hacia el incremento de las extracciones multiorgánicas, casi testimoniales el primer año, y progresivamente hacia un mayor uso de los modelos de perfusión con máquina, aspecto que recoge también la memoria de actividad de la ONT10.
El enfoque del presente análisis se centra en los resultados clínicos y es eminentemente nefrológico y no del proceso de donación, más propio de la coordinación del trasplante. Por ello, no disponemos de información sobre la tasa de negativas familiares, los donantes potenciales no efectivos, la rentabilidad en la consecución de otros órganos ni datos precisos del proceso previo a la extracción: duración del periodo agónico, isquemia templada funcional, evolución de la presión arterial o saturación de oxígeno postextubación. Los informes anuales de la ONT recogen detalladamente esta información10.
En total se obtuvieron 670 riñones procedentes de 335 donantes; del total de injertos renales extraídos, 38 se cedieron y trasplantaron en otros centros, 25 se cedieron y no se pudieron trasplantar (se desconoce la causa) y 41 se perdieron en el seguimiento. Al final, se implantaron 566 riñones en los hospitales trasplantadores del grupo GEODAS (fig. 1).
Descripción de los receptores y el proceso de trasplanteSe incluyó a 566 receptores, en su mayoría varones (68,4%) con una edad media de 56,5 años (DE 12,0; rango 19-83), de los que el 24,1% fueron mayores de 65 años. Las características basales se recogen en la tabla 1. Para la mayoría (91,9%) fue el primer TR, para el resto, el segundo (7,3%) o incluso el 3.° o el 4.° (0,9%). En su mayoría fueron receptores de bajo riesgo inmunológico (ninguno con tasa de anticuerpos mayor del 90%) y con baja compatibilidad HLA.
El tratamiento inmunosupresor incluyó terapia de inducción en casi todos los casos (99,7%), que se reparte entre Timoglobulina® (Sanofi, Francia) y Simulect® (Novartis, Suiza) con un 67,4% y un 32,6%, respectivamente. Se asoció triple terapia de mantenimiento con prednisona, micofenolato de mofetilo/ácido micofenólico y tacrolimus en un 91,3% o prednisona, inhibidor del mTOR y tacrolimus en un 6,5%, ajustando al perfil de riesgo inmunológico según el protocolo local.
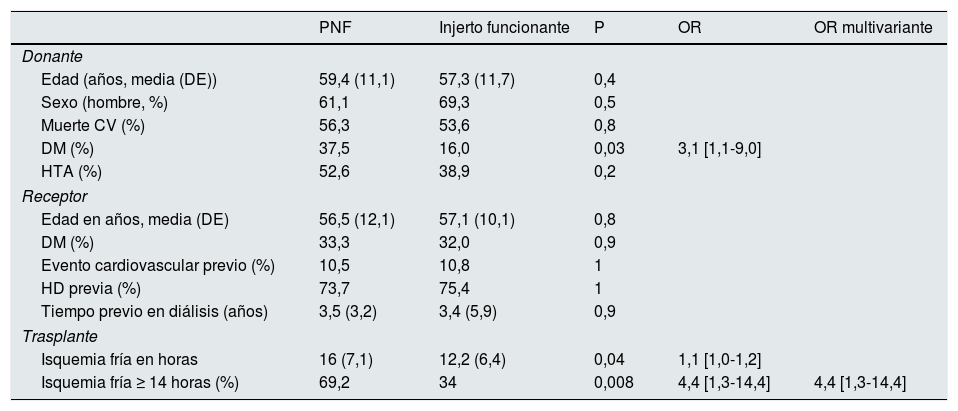
En cuanto a la función del injerto, 19 pacientes (3,4%) presentaron un injerto nunca funcionante. La evolución de los 19 injertos renales contralaterales a los que hicieron PNF fue: 2 DGF, 4 sin seguimiento en nuestro grupo y 13 sin complicación inicial. Los receptores que presentaron PNF provenían de un donante mayor, con mayor comorbilidad y con un CIT más prolongado (16,0 vs. 12,2; p=0,04). En el modelo multivariante, solo el CIT ≥ 14h se asoció con una OR de 4,4 para PNF (tabla 2).
Características del donante y receptor según la función inicial del injerto. Análisis uni- y multivariante mediante regresión logística de los factores de riesgo asociados a PNF
| PNF | Injerto funcionante | P | OR | OR multivariante | |
|---|---|---|---|---|---|
| Donante | |||||
| Edad (años, media (DE)) | 59,4 (11,1) | 57,3 (11,7) | 0,4 | ||
| Sexo (hombre, %) | 61,1 | 69,3 | 0,5 | ||
| Muerte CV (%) | 56,3 | 53,6 | 0,8 | ||
| DM (%) | 37,5 | 16,0 | 0,03 | 3,1 [1,1-9,0] | |
| HTA (%) | 52,6 | 38,9 | 0,2 | ||
| Receptor | |||||
| Edad en años, media (DE) | 56,5 (12,1) | 57,1 (10,1) | 0,8 | ||
| DM (%) | 33,3 | 32,0 | 0,9 | ||
| Evento cardiovascular previo (%) | 10,5 | 10,8 | 1 | ||
| HD previa (%) | 73,7 | 75,4 | 1 | ||
| Tiempo previo en diálisis (años) | 3,5 (3,2) | 3,4 (5,9) | 0,9 | ||
| Trasplante | |||||
| Isquemia fría en horas | 16 (7,1) | 12,2 (6,4) | 0,04 | 1,1 [1,0-1,2] | |
| Isquemia fría ≥ 14 horas (%) | 69,2 | 34 | 0,008 | 4,4 [1,3-14,4] | 4,4 [1,3-14,4] |
DE: desviación estándar; DM: diabetes mellitus; HTA: hipertensión arterial; OR: odds ratio; PNF: fallo primario de injerto.
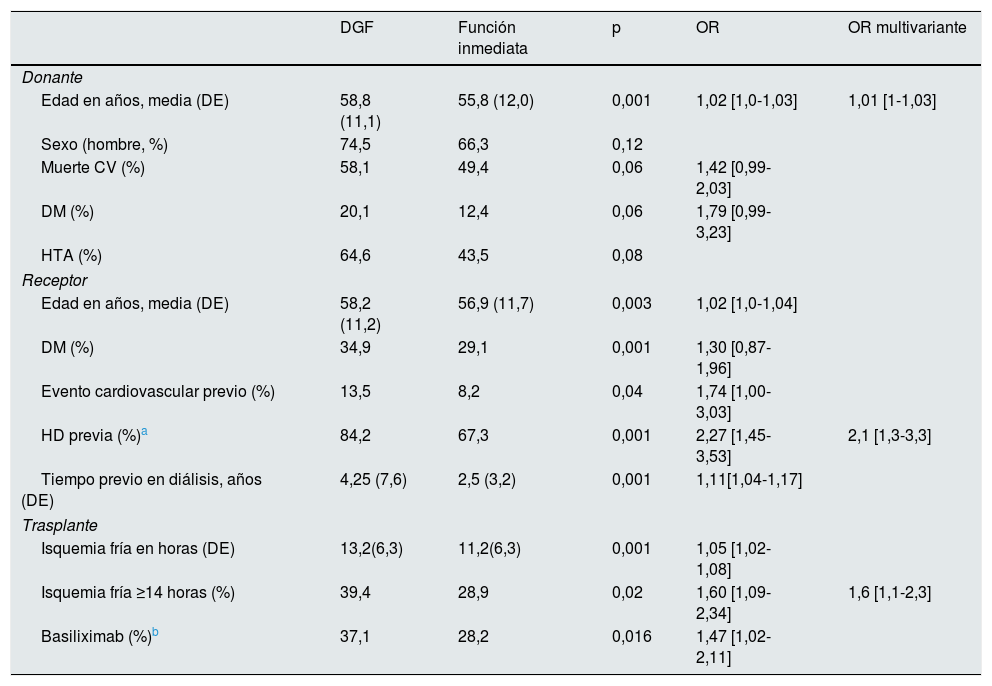
El 48,8% de los receptores desarrolló DGF, con una mediana de 9,5 días en tratamiento con hemodiálisis (rango: 1-94 días; IQR 5-15). Los pacientes que presentaron DGF eran mayores y más comórbidos, con mayor tiempo en diálisis y habían recibido órganos de donantes más añosos y comórbidos, con CIT más prolongados. El uso de basiliximab se asoció a DGF con más frecuencia, pero esta variable desapareció en el modelo multivariante. Los factores asociados a DGF en el análisis multivariante fueron: CIT ≥ 14h (OR 1,6 [1,1-2,3]), el tipo de tratamiento sustitutivo renal previo con hemodiálisis (vs. diálisis peritoneal, OR 2,1 [1,3-3,3]) y la edad del donante (por año, OR 1,01 [1-1,03]). No se observaron diferencias en cuanto al resto de las variables (tabla 3).
Características del donante y receptor según la función inicial del injerto. Análisis uni- y multivariante mediante regresión logística de los factores de riesgo asociados a función retrasada del injerto
| DGF | Función inmediata | p | OR | OR multivariante | |
|---|---|---|---|---|---|
| Donante | |||||
| Edad en años, media (DE) | 58,8 (11,1) | 55,8 (12,0) | 0,001 | 1,02 [1,0-1,03] | 1,01 [1-1,03] |
| Sexo (hombre, %) | 74,5 | 66,3 | 0,12 | ||
| Muerte CV (%) | 58,1 | 49,4 | 0,06 | 1,42 [0,99-2,03] | |
| DM (%) | 20,1 | 12,4 | 0,06 | 1,79 [0,99-3,23] | |
| HTA (%) | 64,6 | 43,5 | 0,08 | ||
| Receptor | |||||
| Edad en años, media (DE) | 58,2 (11,2) | 56,9 (11,7) | 0,003 | 1,02 [1,0-1,04] | |
| DM (%) | 34,9 | 29,1 | 0,001 | 1,30 [0,87-1,96] | |
| Evento cardiovascular previo (%) | 13,5 | 8,2 | 0,04 | 1,74 [1,00-3,03] | |
| HD previa (%)a | 84,2 | 67,3 | 0,001 | 2,27 [1,45-3,53] | 2,1 [1,3-3,3] |
| Tiempo previo en diálisis, años (DE) | 4,25 (7,6) | 2,5 (3,2) | 0,001 | 1,11[1,04-1,17] | |
| Trasplante | |||||
| Isquemia fría en horas (DE) | 13,2(6,3) | 11,2(6,3) | 0,001 | 1,05 [1,02-1,08] | |
| Isquemia fría ≥14 horas (%) | 39,4 | 28,9 | 0,02 | 1,60 [1,09-2,34] | 1,6 [1,1-2,3] |
| Basiliximab (%)b | 37,1 | 28,2 | 0,016 | 1,47 [1,02-2,11] | |
DE: desviación estándar; DGF: función retrasada de injerto; DM: diabetes mellitus; DP: diálisis peritoneal; HD: hemodiálisis; HTA: hipertensión arterial; OR: odds ratio.
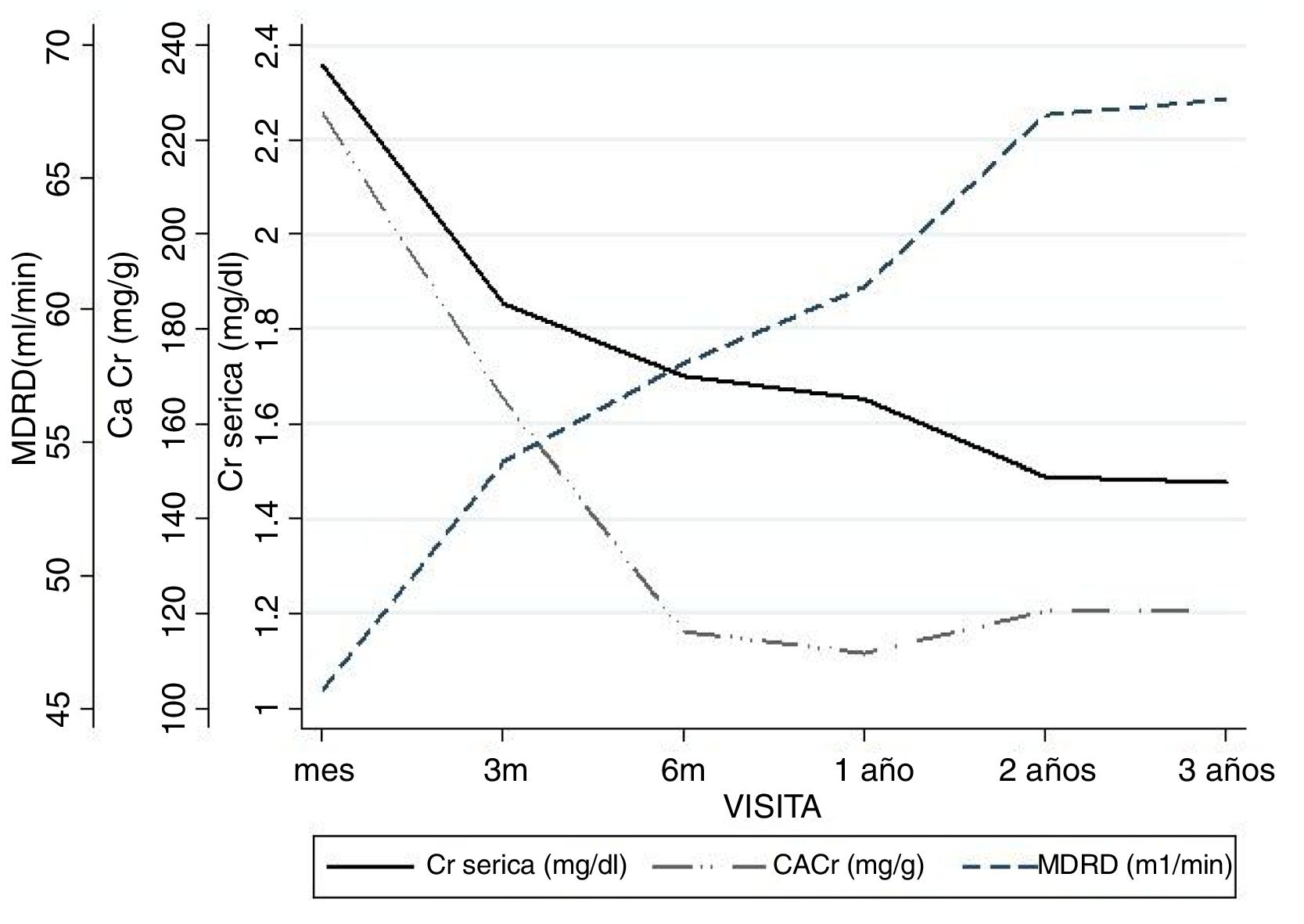
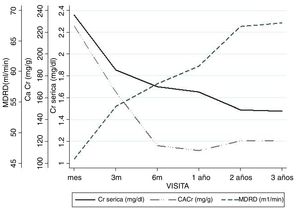
La función renal estimada por MDRD-4 al año fue de 60,9ml (DE 24,1). La evolución de la Crs, del filtrado glomerular estimado y de la proteinuria se detallan en la figura 2.
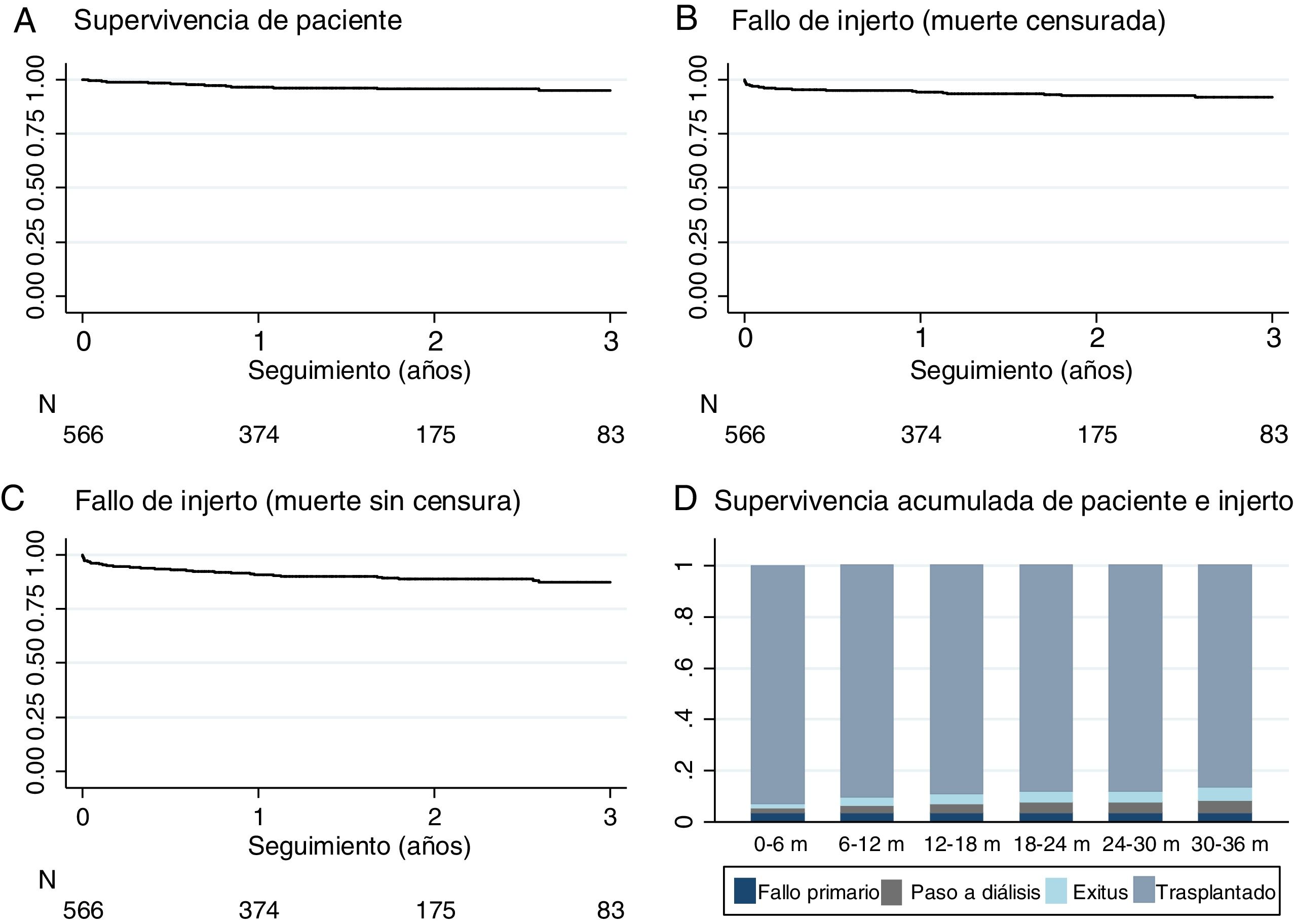
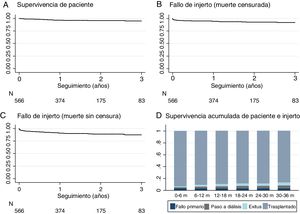
El seguimiento medio fue de 1,9 años, con un rango entre 3 y 60 meses. Al final del estudio, 21 pacientes (3,7%) habían fallecido con injerto funcionante por la siguientes causas: cardiovascular (n=10), infección (n=4), tumor (n=2) u otros (n=5). Un 6,7% regresaron a diálisis (6% a hemodiálisis y 0,7% a diálisis peritoneal) bien por PNF o por fallo del injerto durante el seguimiento y solo se perdió el seguimiento por traslado del 0,4% (fig. 1). La supervivencia del paciente, estimada con curvas de Kaplan-Meier, fue del 96,6% al año y del 95% a los 2años (fig. 3A). La tasa de supervivencia del injerto renal con muerte censurada fue de 97,6% al año y de 95,1% a los 2años y se reduce a 94,2 y a 91,7%, respectivamente si se incluyen los PNF (fig. 3B). Solo el 3,4% (n=19) de los riñones que llegaron a funcionar inicialmente presentaron un fallo definitivo del injerto durante el seguimiento, que precisaron reiniciar diálisis.
DiscusiónEl presente trabajo es el primer análisis multicéntrico sobre una muestra amplia de todo el territorio español que permite analizar resultados clínicos del TR con órganos procedentes de donación cDCD. Por ello, sirve de referencia para la comparación de resultados y para la promoción de este modelo de donación. Los buenos resultados iniciales comunicados de modo preliminar por algunos centros se confirman con el presente análisis7,8.
Los casos de TR con utilización de cDCD han pasado de representar menos del 2% de todos los donantes en 2012 a un 26% en 201710. Con esta estrategia se ha alcanzado la cifra de 46,9 donantes pmp y de 12 cDCD pmp, lo que nos sitúa a la cabeza del ranking internacional10.
La incidencia descrita de PNF y DGF se encuentra dentro de los márgenes de las publicaciones de otros países con mayor trayectoria. Los modelos de referencia más relevantes para este tipo de TR son los europeos de Reino Unido11 y de los Países Bajos5 y el modelo más lejano de los Estados Unidos de América12. Un reciente metaanálisis compara 3.014 TR realizados con órganos procedentes de cDCD con más de 80.000 de DBD y establece un riesgo de DGF de más del doble (OR 2,74 [2,04-3,68]13. Para estas comparaciones internacionales, es importante revisar detalles diferenciales en los modelos de gestión, protocolo de donación e inmunosupresión y los perfiles de donantes y receptores14. En nuestro país, se ha generalizado la utilización de este tipo de donantes, de forma que, a finales de 2016, 72 centros estaban gestionando ya donación cDCD6,10. Sin embargo, los modelos de referencia externa comentados tienden a agrupar la experiencia en centros más seleccionados. Las publicaciones de Estados Unidos de América se refieren a un tipo de donante con una edad casi 7 años inferior y con un porcentaje de no aceptación del órgano de un 50% para los donantes mayores de 65 años15. La experiencia de 13 años recientemente publicada en Reino Unido presenta una edad media para el donante parecida a la nuestra11, pero nuestro rango es más amplio e incluye donantes añosos, de hasta 83 años, con valores de Cr superiores a 2mg/dl.
En efecto, el protocolo inicialmente definido para la donación cDCD limitaba la edad a 65 años, con función renal normal y baja comorbilidad6. Sin embargo, hemos constatado una ampliación progresiva de los criterios de selección una vez completada la curva de aprendizaje, lo que nos lleva a que uno de cada 4 donantes tenga una edad superior a 65 años y casi la mitad cumpla los requisitos clásicos que definen el donante con criterio expandido. Los resultados precoces de PNF y DGF no presentan cambios en los distintos análisis realizados cada año, por lo que asumimos que la potencial mejoría al superar la curva de aprendizaje se compensa con la liberalización de los criterios de selección y la aceptación del donante subóptimo10.
No obstante, existen análisis de registros autonómicos que demuestran que el riesgo de mortalidad de seguir en lista de espera es mayor que el de recibir un órgano de un donante con criterio expandido, por ejemplo, de mayores de 65 o incluso de 75 años16,17.
El proceso fisiopatológico de daño por isquemia-reperfusión es distinto en cDCD que en DBD18, lo que justifica una mayor incidencia de DGF. El proceso de agonía previo a la parada cardíaca conlleva un tiempo de isquemia caliente que no puede ser evitada, y que se añade a los mecanismos de daño al órgano en DBD18. En el caso de DCD no controlada, la primera isquemia caliente es mucho más extensa, lo que justifica que la DGF sea casi la norma10. En nuestro estudio, la DGF se produce en uno de cada 2casos, pese al uso sistemático de terapias de inducción y a la introducción retrasada de tacrolimus como estrategia de protección renal en algunos centros. Hemos identificado el CIT como el factor de riesgo modificable más relevante y se establece un límite de horas para el aumento significativo del riesgo. Los informes anuales de la ONT han reportado un aumento en el uso de las máquinas de perfusión del donante con ECMO que alcanza el 30% en 201610. La definición del evento DGF limita la comparación entre estudios. En nuestro caso, DGF se define como necesidad de hemodiálisis en la primera semana post-TR, lo que podría justificar la mayor incidencia observada en nuestra serie, ya que se pueden incluir casos de DGF con una sola sesión de hemodiálisis por sobrecarga hídrica de difícil manejo. Por ello, es posible que la menor incidencia de DGF en pacientes sin diálisis previa al TR (TR anticipado) o procedentes de diálisis peritoneal se deba en parte a una mayor función residual y a un acceso menos inmediato a la sesión de hemodiálisis urgente. Este hallazgo es una constante en otros trabajos19,20.
Por otro lado, aunque los casos de PNF se deben fundamentalmente a problemas de conservación o quirúrgicos, nuestro estudio muestra que el CIT es el factor de riesgo modificable más importante. Las estrategias de reducción de los eventos precoces (PNF y DGF) deben enfocarse a la mejora de los sistemas de conservación del órgano y a la reducción del CIT. Por ese motivo algunos autores recomiendan reducir al mínimo este tiempo, enviando uno de los riñones a otro hospital próximo, para conseguir así la implantación casi simultánea de ambos órganos dentro de un CIT inferior a las 12 h21.
En el estudio local previamente publicado5, no encontramos que la DGF tenga un impacto en la supervivencia posterior del órgano. Un reciente estudio de gran potencia estadística compara parejas de receptores de un mismo donante en los que un receptor desarrolla DGF y el otro, función inmediata. Este análisis sobre casi 30.000 TR elimina los factores de confusión del donante. El riesgo de fallo del injerto durante el primer año aumenta en los que presentan DGF (HR 3,75 [3,31-4,24]) y aún más en los que tienen algún rechazo agudo añadido a DGF (HR 8,16 [4,72-14,10]). Este efecto pierde fuerza en los años siguientes, con un riesgo de 1,16 (1,02-1,31) y 1,19 (0,59-2,23). Por otro lado, la DGF supone un problema diagnóstico y de manejo importante, ya que mantiene la incertidumbre diagnóstica, obliga a realizar biopsias precoces y ajustes de inmunosupresión, prolonga el ingreso y aumenta el coste por proceso19.
La función renal alcanzada el primer año se sitúa en la frontera de los 60ml/min, un valor muy razonable para esperar una buena supervivencia a medio y largo plazo. Nuestro estudio no permite comparar con los resultados de la donación DBD, pero un reciente análisis del registro autonómico andaluz constata que la función renal alcanzada al año es mejor en los trasplantes procedentes de donantes DBD que de los DCD (Crs 1,79±0,9mg/dl vs. 1,46±0,5 en DBD; p<0,001)22.
Aunque recogemos casos con un seguimiento de hasta 5 años, nuestra media solo nos permite analizar la supervivencia hasta el segundo año. Los datos de supervivencia del paciente y del órgano censurada por muerte con injerto funcionante son similares a los de los registros para DBD10. El análisis de los factores de riesgo para supervivencia quedan fuera de este primer estudio y los realizaremos cuando podamos obtener conclusiones sólidas basadas en un seguimiento más prolongado.
Las principales limitaciones del presente estudio son el seguimiento medio de 2 años y la ausencia de un protocolo común para la extracción y preservación del órgano, así como para la pauta de tratamiento inmunosupresor. Sin embargo, hemos incluido más de un tercio de todos los TR con órganos procedentes de cDCD10 y disponemos de un tamaño muestral suficiente para que los datos representen adecuadamente la situación general en España. La implicación directa de los clínicos en el diseño de la base de datos y en la recogida de información es garantía de la calidad de la información.
Algunos autores advertían del riesgo de que la donación cDCD acabase anticipándose a la DBD, con lo que no se conseguiría un verdadero incremento de órganos11,20. Aunque este análisis queda fuera del marco del estudio GEODAS-3, podemos utilizar la referencia de las memorias de la ONT para confirmar que el modelo de cDCD ha supuesto un incremento neto de donantes sin reducción de las tasas de donación DBD10, algo que confirma el modelo de Reino Unido después de 13 años11. Este trabajo representa adecuadamente la realidad del TR con el modelo de donación cDCD y contribuye a su promoción y a la implantación en el resto de los centros trasplantadores de nuestro país.
ConclusionesLos programas cDCD se han extendido por presentar una complejidad organizativa abordable y permiten aumentar la tasa de donación sin comprometer la DBD. La curva de aprendizaje parece estar superada, con resultados similares a los reportados por países con larga tradición. El CIT es el factor de riesgo modificable más relevante. En espera de un análisis de supervivencia de órgano y paciente a más largo plazo, disponemos de resultados propios y actuales que apoyan el desarrollo de esta estrategia conjunta.
FinanciaciónEste proyecto está auspiciado por el Grupo SENTRA de la SEN, la RedinRen 16/009/009 RETYC ISCIII, la Fundación Renal Iñigo Álvarez de Toledo y una beca colaborativa de Novartis, Astellas y Sanofi a través del Instituto de Investigación Sanitaria Puerta de Hierro-Segovia Arana.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de interés.
Relación de centros que integran el grupo GEODAS:
Hospital Universitario Puerta de Hierro (Madrid), Hospital del Mar (Barcelona), Hospital Universitario Germán Trías y Pujol, Hospital Universitario Carlos Haya (Málaga), Hospital Universitario La Fe (Valencia), Hospital Universitario Reina Sofía (Córdoba), Hospital Universitario Puerta del Mar (Cádiz), Hospital General Universitario Gregorio Marañón, (Madrid), Hospital Universitario Cruces (Bilbao), Hospital Universitario de Vall d́Hebron (Barcelona), Hospital Universitario Clinic de Barcelona, Hospital Universitario Bellvitge (Barcelona), Hospital Universitario Marqués de Valdecilla (Santander), Hospital Universitario de Albacete, Hospital Universitario Miguel Servet (Zaragoza), Fundación Puigvert (Barcelona), Clínica Universidad de Navarra, Hospital Universitario Clínico San Carlos (Madrid), Complexo Hospitalario Universitario A Coruña, Hospital Universitario de La Paz (Madrid), Hospital Universitario Dr. Peset (Valencia), Fundación Jiménez Díaz (Madrid).