El aumento de la supervivencia de los pacientes con cistinosis y la propia complejidad de la enfermedad explican la necesidad de implementar un proceso de transición guiada desde la medicina pediátrica hasta la del adulto, que permita garantizar el continuum asistencial y posibilite el empoderamiento del paciente desde el cuidado tutelado al autocuidado.
MétodosRevisión bibliográfica, opinión de expertos, encuestas anónimas a pacientes, familiares y asociaciones.
ResultadosElaboración de un documento de transición coordinada, con propuestas concretas por especialidades y de mejora de la adherencia terapéutica y del autocuidado del paciente. El nefrólogo desempeña un papel clave en la transición en la cistinosis debido a la afectación renal que domina la patología y porque la mayoría de los pacientes han recibido un trasplante renal antes de la edad adulta.
ConclusiónSe presenta un documento que establece unas recomendaciones y un cronograma para guiar la transición de los adolescentes y adultos jóvenes con cistinosis en nuestro ámbito.
Improved outcome and longer life-expectancy in patients with cystinosis, and disease complexity itself, justify planning a guided-transition of affected patients from Pediatrics to adult medicine. The aims of the process are to guarantee the continuum of care and patient empowerment, moving from guardian-care to self-care.
Methodsreview of articles, expert opinion and anonymous surveys of patients, relatives and patient advocacy groups.
Resultselaboration a new document to support and coordinate the transition of patients with cystinosis providing specific proposals in a variety of medical fields, and adherence promotion. Nephrologists play a key role in transition due the fact that most cystinotic patients suffer severe chronic kidney disease, and need kidney transplantation before adulthood.
Conclusionwe present a document providing recommendations and suggesting a chronogram to help the process of transition of adolescents and young adults with cystinosis in our area.
Los avances médicos han transformado la cistinosis de una enfermedad históricamente fatal en el niño1,2 a una enfermedad crónica en el adulto3, con una expectativa de vida prolongada4. Sin embargo, globalmente, la transferencia de los pacientes jóvenes a los servicios de adultos ha conllevado interrupciones en el cuidado médico5, un seguimiento inapropiado y un empeoramiento de la enfermedad6. El reconocimiento de los múltiples factores que explican este fenómeno ha puesto de manifiesto la necesidad de implementar programas específicos para la transición de adolescentes con cistinosis a la medicina del adulto7,8.
La cistinosis es una enfermedad rara (ER) grave y sistémica1 causada por mutaciones en el gen CTNS (17p13) que alteran la síntesis de cistinosina y conducen al depósito de cristales de cistina intralisosomal en todas las células del organismo2,9,10. Con una incidencia de 1/100.000-200.000 recién nacidos1, la cistinosis se caracteriza por la afectación renal precoz que evoluciona a insuficiencia renal, depósito de cristales en la córnea y por otras manifestaciones extrarrenales de carácter progresivo11. El control de la enfermedad requiere un régimen terapéutico estricto y complejo1,5,6, así como una rigurosa y periódica monitorización de los niveles de cistina intraleucocitaria durante toda la vida del paciente9,11,12.
En el pasado, la cistinosis era una enfermedad exclusivamente pediátrica y los pacientes fallecían prematuramente en insuficiencia renal al final de la primera década1,4. Actualmente, la disponibilidad de un tratamiento específico con cisteamina2,13 y el éxito de los programas de trasplante renal (TxR) pediátrico14,15 han extendido el pronóstico vital de los pacientes más allá de los 50 años4. Por ello, una cifra creciente de adolescentes y adultos jóvenes con cistinosis está accediendo a los servicios de adultos, donde el número de expertos en esta patología rara es muy escaso16. Además, en muchos casos, se ha observado un deterioro clínico no esperado después de este cambio, por lo que es preocupante constatar que el avance clínico logrado en el paciente pediátrico suele atenuarse en el adulto. Existen diversos factores de riesgo que confluyen y explican este fenómeno como son: a) las dificultades inherentes al cuidado de un adolescente-adulto joven con patología crónica, habitualmente trasplantado renal5,6 y con un riesgo elevado de pérdida del injerto7; b) la falta de experiencia y familiaridad de los especialistas de adultos con esta ER4; c) la progresión de la afectación extrarenal16; d) el fenómeno de la «no adherencia» terapéutica, que es elevado en este colectivo de pacientes5,17, y e) la carencia de profesionales expertos cercanos al domicilio de los pacientes8. Como solución, se han propuesto estrategias sanitarias en ER, entre otras, la referencia a centros expertos18,19.
La cistinosis representa el paradigma de ER que precisa una transición guiada. Por las características y las singularidades de la enfermedad3-5, los pacientes se enfrentan a dificultades únicas en el proceso de transferencia a los servicios de adultos6,7,20, que suele seguir una pauta general21. Actualmente en España se estiman 60 pacientes con cistinosis, de los que un 30% son niños, un 17% adolescentes y el resto son adultos que, en algunos casos, continúan siendo atendidos en las unidades pediátricas. Urge pues implementar estrategias sanitarias orientadas a la educación del paciente en la enfermedad, a la promoción de su autocuidado y a la organización y el apoyo a su inserción en la medicina del adulto17. Este documento pretende ser una herramienta práctica de soporte a los profesionales sanitarios que facilite la planificación coordinada de la transición de los pacientes con cistinosis en nuestro entorno sanitario.
MetodologíaEl trabajo que presentamos es el resultado de diferentes estrategias metodológicas que llevó a cabo el Grupo T-CiS.bcn: 1) búsqueda bibliográfica en PubMed con las palabras clave «cistinosis», «transición», «adolescente», «trasplante renal» y «adherencia»; 2) encuesta directa a los propios integrantes del grupo T-CiS.bcn para identificar las necesidades y los retos de la transición en el propio entorno sanitario y favorecer la implementación de estrategias de mejora; 3) testimonios anónimos de pacientes con cistinosis y familiares del Grupo Cistinosis de España (www.grupocistinosis.org), representados por la Asociación para la información y la investigación de las enfermedades renales genéticas en España (AIRG-E; www.airg-e.org).
Marco teórico: estrategias sanitarias en enfermedades raras en la Unión EuropeaLa Unión Europea define una enfermedad como rara o minoritaria cuando afecta a ≤ 5 por 10.000 habitantes. Existen ≈ 8.000 ER diferentes que afectan a un 8% de la población. La mayoría presenta enfermedades ultrarraras, es decir, con una frecuencia ≤ 1 por 100.000, lo que condiciona que estos pacientes sean especialmente vulnerables y se encuentren aislados21. La Comisión Europea ha definido y adoptado estrategias de prevención, diagnóstico y tratamiento en ER, con el objetivo de mejorar el acceso y la equidad de los pacientes afectados, y en definitiva mejorar su calidad de vida. Las políticas sanitarias de cada estado miembro de la UE se elaboran sobre la base de las siguientes Recomendaciones del Consejo22:
| 1. | Elaborar y adoptar planes de acción y estrategias en ER sobre la base de los sistemas de salud y servicios sociales de cada país |
| 2. | Definir, codificar y elaborar registros de ER |
| 3. | Investigar en ER |
| 4. | Identificar centros expertos (CE), crear redes europeas de ER basadas en la atención sanitaria multidisciplinar y difundir su conocimiento |
| 5. | Centralizar la experiencia en ER: guías de buenas prácticas clínicas, programas formativos en diagnóstico y tratamiento de las ER, facilitar el acceso a los medicamentos huérfanos y a los informes de valoración clínico-terapéutica |
| 6. | Promover el empoderamiento de las asociaciones de pacientes (AP) con participación en el desarrollo de políticas sanitarias y acceso a la información actualizada en ER |
| 7. | Garantizar la sostenibilidad, es decir, el mantenimiento de la información, la investigación y las estructuras sanitarias a largo plazo |
Para cumplir con la recomendación n.°4, el Comité de Expertos en Enfermedades raras de la Unión Europea (EUCERED) ha definido los siguientes criterios de asignación de un CE21:
| 1. | Volumen de actividad asistencial significativo y capacidad para ofrecer servicios de calidad |
| 2. | Capacidad para ofrecer asesoramiento de expertos y diagnóstico clínico, de elaborar e implementar protocolos clínicos y controles de calidad |
| 3. | Atención sanitaria multidisciplinar |
| 4. | Alto nivel de experiencia y de especialización, avalado por publicaciones, becas, cursos de formación |
| 5. | Alta contribución a la investigación |
| 6. | Implicación en seguimiento epidemiológico: registros de pacientes |
| 7. | Interrelación y colaboración con otros centros de excelencia. Participación en redes de investigación |
| 8. | Capacidad de interacción con las AP |
| 9. | Servicio de asesoramiento |
| 10. | Demostradas capacidades para el seguimiento clínico de los pacientes |
España aprobó la Estrategia en ER del Sistema Nacional de Salud en junio del 200923. Así mismo, la Federación Española de Enfermedades Raras (FEDER; www.enfermedades-raras.org) actúa en representación de los 3 millones de personas afectadas por una enfermedad poco frecuente en España.
¿Qué es la transición?La transición es un proceso planeado, anticipado y coordinado, cuya finalidad es preparar y trasladar al paciente pediátrico desde el cuidado tutelado a una unidad de adultos, donde asumirá la responsabilidad de su autocuidado24. La fase de transición será gradual y progresiva, ajustada a la madurez individual del paciente, que con frecuencia no corresponde a la edad oficial de traspaso. Este proceso deberá garantizar al paciente la prestación sanitaria adecuada y continuada durante el cambio7,25.
¿Por qué es importante la transición?La ausencia de estrategias organizativas en transición ha supuesto, con frecuencia, empeoramientos no predictibles de la salud de los pacientes24,25. Históricamente, se observaron complicaciones muy graves en pacientes jóvenes con enfermedades crónicas al poco tiempo de ser transferidos a servicios de adultos26, especialmente en TxR, siendo frecuente la pérdida del injerto8. De hecho, se admite que los adolescentes y adultos jóvenes con TxR representan el colectivo con peor pronóstico27 y que habitualmente los adolescentes por sí mismos no tienen capacidad de llevar a cabo con garantías de éxito el proceso de la transición a adultos. Frente a la tentación de culpar al paciente de esta situación, es importante considerar que la organización del sistema sanitario no se adapta a las necesidades y particularidades de este colectivo26, en el que es frecuente la disociación entre la edad cronológica y el proceso madurativo físico y psicológico, habitualmente retrasado, que no suele finalizar hasta después de los 25 años. Así mismo, muchos pacientes presentan cierto grado de discapacidad que les impide una autonomía individual plena7,28.
Particularidades de la cistinosisEn el caso de los pacientes adolescentes con cistinosis, la transferencia a los especialistas de adultos resulta aún más difícil por las características propias de la enfermedad que es sistémica y progresiva1,3, lo que explica su gran impacto en el desarrollo físico y personal5,16,19,20, asociado frecuentemente a significativa dependencia y discapacidad3,29-32. Es importante resaltar que los pacientes alcanzan la edad adulta gracias a los cuidados individualizados y la atención multidisciplinar recibidos en la etapa pediátrica, que deberán continuar en la edad adulta17. Esta necesidad de mayor atención sanitaria que otros pacientes20,25 explica que la transición de los adolescentes con cistinosis represente un gran reto no solo para los afectados, sino también para sus familias y para el equipo de profesionales sanitarios involucrados en su cuidado18,19. Las características de los pacientes cistinóticos adolescentes con enfermedad renal crónica (ERC) se describen a continuación1,3,5,16,29-33:
| 1. Retraso madurativo disarmónico: |
| – Desarrollo físico retrasado como mínimo 2-3 años |
| – Madurez emocional más avanzada que la que le corresponde a su edad en algunas áreas (aprendizaje adquirido por la enfermedad) y retraso madurativo en otras |
| – Desarrollo cerebral incompleto (se estima que finaliza a los 25 años) |
| 2. Afectación progresiva y sistémica de la enfermedad (talla baja, deformidades articulares, hipotiroidismo, diabetes mellitus, infertilidad, afectación ocular, alteraciones cognitivas y del sistema nervioso central, miopatía distal, afectación cardiovascular) |
| 3. Gran dependencia de un tratamiento médico complejo y de un cuidado hospitalario |
| 4. Problemas con la adherencia terapéutica: polimedicación, número elevado de dosis, efectos adversos y específicos de TxR |
| 5. Dificultad en la aceptación del padecimiento de una enfermedad crónica de por vida, con enfermedad renal severa y discapacidad. Proceso activo de concienciación. |
| 6. Sentimiento de aislamiento y exclusión de su grupo de edad |
| 7. Agotamiento psicológico por el impacto de la enfermedad |
| 8. Dificultades en la escolarización y aprendizaje: retraso académico y problemas en las relaciones sociales, siendo frecuente el «bulling» |
El proceso de la transición debe hacerse individualizado, por etapas y progresivamente. El momento adecuado debe ser acorde con la madurez individual del paciente y su predisposición al cambio7,8,20:
| ¿Cuándo? |
| Sólo debe hacerse tras un periodo de transición dedicado a preparar al adolescente-adulto joven y a la unidad receptora mediante la información necesaria para el cuidado de la enfermedad |
| Programada: iniciar el proceso en la preadolescencia (12-14 años) |
| En un momento de estabilidad clínica y emocional |
| ¿Cómo? |
| Individualizada para cada paciente |
| Progresiva |
| Consensuada con el paciente y su familia y de acuerdo con los equipos sanitarios de pediatría y adultos |
| Después de completar la etapa escolar obligatoria |
| Facilitar al joven información de forma gradual |
| Contar con la participación y apoyo del entorno familiar y de las amistades directas |
| Introducir al paciente al nuevo equipo médico antes del cambio mediante una visita informal |
| Proceso dirigido por «líderes de transición» de las unidades de pediatría y adultos |
| Contar con un plan de transición definido |
| Identificar al gestor de casos/coordinador del proceso |
| Contar con el soporte de grupos focales de pacientes |
| Tener en cuenta los planes terapéuticos de las distintas especialidades médicas |
| Proporcionar al paciente herramientas de soporte para autogestión de la enfermedad |
| Tener en cuenta factores económicos |
El objetivo del plan de transición es dirigir el proceso de transferencia del paciente según un plan terapéutico establecido, continuado e ininterrumpido, con eficacia y seguridad. En general, se distinguen 3 etapas cronológicas que abarcan la preadolescencia (12-15 años), la adolescencia (16-18 años) y el adulto joven (19-25 años), y que corresponden respectivamente a las fases de: 1) elaboración e inicio del plan de transición; 2) capacitación del paciente en autocuidado y autorresponsabilidad, y 3) transferencia propiamente dicha25 (tabla 1).
Competencias y habilidades del paciente necesarias para la transición
| Etapas | Preadolescente 12-15 años | Adolescente 16-18 años | Adulto joven 19-25 años |
|---|---|---|---|
| Planificación/iniciación en la transición | Capacitación del paciente | Transferencia | |
| Enfermedad | Saber qué padece y explicar brevemente en qué consiste la cistinosis | Saber explicar con mayor detalle la enfermedad, describir la afectación multisistémica | Profundizar en los conocimientos de la enfermedad, su potencial afectación multisistémica y sus complicaciones |
| Reconocer el grado de afectación individual | Reconocer los síntomas | ||
| Medicación | Conocer el nombre de los fármacos, la dosis diaria y el horario establecido | Profundizar en el conocimiento de los fármacos: indicación, preparación, conservación, efectos secundarios, riesgo de autonomía, interacciones medicamentosas e inicio en los circuitos de farmacia | Autonomía en la preparación y toma de la medicación con mínima supervisión del cuidador |
| Participar en la preparación y toma de la medicación supervisada por el cuidador | Autonomía en la preparación y toma de la medicación con la supervisión del cuidador | Autonomía en los circuitos de farmacia | |
| Conocer los beneficios de la correcta administración y los riesgos de la no adherencia | Profundizar en los beneficios de la correcta administración y los riesgos de la no adherencia | Responsabilidad plena en el buen cumplimiento terapéutico | |
| Hábitos de vida y prevención | Iniciarse en el conocimiento de hábitos de vida saludables (dieta, ejercicio físico), conductas de riesgo y sexualidad | Conocer y promover hábitos de vida saludables. Educar sobre conductas de riesgo (drogas y alcohol), enfermedades de transmisión sexual y embarazo no deseado | Profundizar y promover hábitos de vida saludables, ausencia de conductas de riesgo, salud sexual y consejo reproductivo |
| Relación con el equipo asistencial | Conocer al personal asistencial de referencia pediátrico | Iniciar contacto con el equipo de adultos (sesiones, talleres, asociaciones, mentores) | Conocer al equipo asistencial de referencia de adultos, los diferentes especialistas y los diferentes niveles asistenciales que participan en el proceso (trabajador/a social, atención primaria…) |
| Empezar a participar en la consulta e iniciarse en la comunicación con el equipo asistencial | Actitud proactiva con el equipo asistencial siendo capaz de expresar dudas y de realizar preguntas | Autonomía en la comunicación con el equipo asistencial |
Modificado de Cooley et al.25
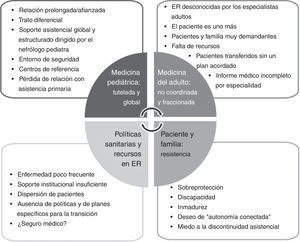
La identificación de las barreras es un paso fundamental para reconocer las fortalezas del paciente y su entorno, y mejorar la coordinación y el compromiso entre todos los interlocutores. El paciente infantil es atendido por el nefrólogo pediátrico, que es quien centraliza la atención de la afectación sistémica5,6,18. Esta asistencia tutelada y coordinada en pediatría cambia completamente al llegar a la medicina del adulto, donde es frecuente que el paciente sea atendido por múltiples profesionales, no conectados entre sí y focalizados en su propia especialidad19. El resultado es lo que se denomina «cuidado fragmentado», con efecto negativo en la calidad y la continuidad asistencial, y que es percibido por el paciente como un retroceso en la atención que recibe, generándose pérdida de confianza en el equipo asistencial y resistencia al cambio18. Este escenario se agudiza por la escasa dotación de recursos asignados a las ER. El resultado queda reflejado en la figura 1 donde se presentan las barreras de la transición en la cistinosis, que son comunes a muchas de las ER.
¿Cómo es percibida la transición por cada uno de los agentes implicados?A través de encuestas realizadas a pacientes y familiares se ha obtenido información del impacto de la enfermedad y su actitud respecto a la transición17,33-36.
- a.
Impacto físico: los pacientes se sienten diferentes, sobre todo por su estatura, los efectos secundarios de la enfermedad y del tratamiento.
- b.
Impacto psicológico: en las relaciones personales, en su autonomía y en su vida social. Son dependientes de la familia para su cuidado y la enfermedad entorpece su desarrollo individual. Sentimientos ambivalentes de sobreprotección y agradecimiento a su entorno. Miedo al rechazo. Discriminación escolar y laboral frecuente. Mayor depresión y ansiedad que en otras patologías crónicas37.
- c.
Desarrollo de estrategias y actitudes positivas: adaptación a la enfermedad, con un estilo de vida saludable, deseo de crecimiento personal y aprecio de la vida.
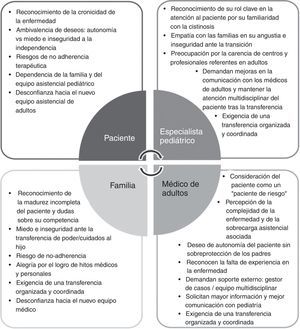
La figura 2 resume las actitudes y las percepciones de los pacientes con cistinosis y del grupo T-CiS.bcn respecto a la transición.
¿Cuáles son los requerimientos de la transición en cistinosis?Principales agentesEn la cistinosis, como en otras ER crónicas, la transición requiere de la implicación activa e integrada de distintos interlocutores, siendo el paciente el agente principal y núcleo sobre el que gira todo el proceso asistencial20,24,34. Dado que la enfermedad es progresiva, con el tiempo se incorporan nuevos agentes de transición: el equipo hospitalario pediátrico, la familia, la asociación de pacientes, el gestor de casos, el equipo hospitalario de adultos y de atención primaria.
El equipo de transición está integrado por el grupo de nefrología pediátrica, nefrología de adultos —mayoritariamente el equipo de trasplante—, y otros especialistas no nefrólogos —oftalmólogo, endocrinólogo, neurólogo, gastroenterólogo…— implicados en el cuidado del paciente según su afectación extrarrenal. Así mismo en este proceso deben participar los profesionales de enfermería especializada en transición, dietistas, psicólogos, asistente social y especialistas de farmacia.
El gestor de casos constituye uno de los pilares de la transición9,38. Este profesional, habitualmente de enfermería especializada (en trasplante, en ER, etc.) se crea para facilitar la coordinación entre los distintos especialistas dentro de un mismo hospital, entre hospitales diferentes y con otros niveles asistenciales. Su función es ser el nexo de unión entre los especialistas y el paciente y su familia para garantizarles una correcta coordinación asistencial y un apoyo emocional y soporte guiado durante la transición. Deberá estar integrado en los 2 equipos hospitalarios asistenciales pediátrico y adulto, para optimizar el trabajo multidisciplinar y garantizar la asistencia continuada y el seguimiento del paciente de modo ágil y eficaz7,24,25.
Algunas experiencias de transición implementadas con éxito han contado con la participación de los denominados «líderes de transición», psicólogos y/o trabajadores sociales, incluso pacientes adultos jóvenes, cuya función es establecer nexos entre el equipo médico y el paciente, integrarlo en la unidad, reforzar su autoestima y confianza con el nuevo equipo asistencial y dar el soporte necesario para superar las dificultades de tener una enfermedad crónica en una etapa tan compleja como la adolescencia7,8.
Además de la transición entre los equipos hospitalarios de un centro o de distintos hospitales conectados, en ER como la cistinosis es imprescindible desarrollar una estructura de trabajo en red para garantizar una buena comunicación entre los CE y las unidades de seguimiento local del paciente. Ello revertirá en las actuaciones dirigidas desde los CE por el gestor de casos y evitará desplazamientos innecesarios del paciente y su familia. Este trabajo en red no solo beneficiará al paciente, sino también al sistema sanitario, puesto que la información compartida incrementará el conocimiento de la cistinosis en distintos niveles asistenciales y, en consecuencia, mejorará el diagnóstico y el seguimiento clínico de los pacientes.
Aunque la atención del paciente con cistinosis se desarrolla fundamentalmente en un entorno hospitalario, al llegar a la edad adulta, los equipos de atención primaria adquieren un papel progresivo de soporte del paciente mediante la adscripción a programas de cronicidad con beneficios en la prescripción médica, atención domiciliaria, transporte sanitario, asistencia social y de discapacidad, entre otros39.
En las ER las AP tienen un papel muy relevante y comparten un objetivo común20: aunar voces y representatividad ante los responsables de las instituciones sanitarias y gubernamentales para demandar una atención orientada a las necesidades específicas y prioritarias de la cistinosis. Además, y no menos importante, la asociación surge de la necesidad de acompañamiento, apoyo y cercanía de las familias ante el diagnóstico y para servir de enlace con otros pacientes y familias facilitando la información adecuada, la educación sanitaria y en la medida de lo posible, promover la investigación en cistinosis. Existen ejemplos del beneficio de la implicación de las AP en el cuidado de su enfermedad38.
¿Qué facultativo debe coordinar la transición en cistinosis?Los servicios de nefrología pediátrica y de adultos deben ser los responsables de planificar, organizar, coordinar, llevar a cabo y monitorizar la transición y la transferencia de los adolescentes y adultos jóvenes con cistinosis19,40. Es sobradamente conocido que el riñón es el primer órgano afectado en cistinosis y que condiciona la morbilidad y el pronóstico del paciente. Todavía en edad pediátrica, la mayoría de los pacientes progresan a la ERC terminal (ERCT) de forma precoz4,16, en parte debido a que el tratamiento con cisteamina no consigue una remisión de la afectación renal4, mientras que es excepcional que exista una afectación extrarrenal de la cistinosis con mayor morbilidad que la nefropatía1,5,6. Esto justifica que sea el nefrólogo el agente responsable de coordinar la transición al liderar la patología más severa en el periodo de la transición41,42.
Más de un 80% de los pacientes con cistinosis que son transferidos a los servicios de adultos son portadores de TxR, de ahí que la transferencia sea dirigida habitualmente al nefrólogo encargado de trasplante renal3,35. Una minoría de pacientes llegará al servicio de nefrología de adultos en diálisis o bien presentará un cuadro de ERC progresiva, con requerimientos terapéuticos característicos de la enfermedad19.
Es comprensible la poca familiaridad de los nefrólogos de adultos con la cistinosis dada su escasa prevalencia; representa aproximadamente el 0,5% de las causas de ERC y el 0,1% del total de pacientes > 20 años en tratamiento renal sustitutivo4,15. Por ello es imprescindible una comunicación adecuada y una actitud positiva entre los servicios pediátricos y de adultos para organizar la transición.
Plan o programa de transición en NefrologíaEl éxito de la transición reside en la elaboración e implementación de un plan de transición que contemple los siguientes elementos clave36:
- –
Edad adecuada: flexible en función del estado de salud del paciente y de su desarrollo físico y personal, de su grado de autonomía y de si la unidad de adultos está preparada para recibirlo.
- –
Periodo de preparación anticipado para dotar al paciente de las competencias necesarias para su autocuidado, educación en la enfermedad y en la independencia gradual de sus padres o cuidadores.
- –
Proceso coordinado: entre el equipo clínico pediátrico y de adultos. Orientado a la inserción del paciente en el programa de seguimiento del adulto liderado por el interlocutor clave: el gestor de casos.
- –
Hospital receptor: el paciente con cistinosis deberá controlarse en el ámbito hospitalario dotado de un programa de seguimiento de trasplante renal.
- –
Nefrólogo de adultos referente: con capacitación e interés en la enfermedad que ofrezca un entorno de confianza al paciente.
- –
Estructura administrativa: para la gestión del seguimiento multidisciplinar.
- –
Atención Primaria: reforzar la interrelación entre niveles asistenciales.
- –
Programa de control de calidad del proceso en las distintas etapas.
El cuidado de salud del paciente con cistinosis está ligado a la atención hospitalaria de alta complejidad. No existe un modelo único de transición y concurren distintos escenarios posibles desde donde se transfiere el paciente pediátrico:
- 1.
Hospital infantil integrado en un hospital general de alta complejidad en el que habitualmente el paciente no cambia de centro, lo que favorece la continuidad asistencial.
- 2.
Hospital infantil monográfico que obligadamente debe transferir a sus pacientes a un centro de adultos distinto, pero que habitualmente suele ser un hospital concreto ubicado en la proximidad con el que existen alianzas o colaboraciones previas, lo que facilita la interrelación entre los equipos asistenciales.
- 3.
Hospital infantil que, independientemente de sus características, transfiere al paciente a otro hospital de referencia de un área geográfica alejada, según el domicilio del paciente. En este supuesto las dificultades son mayores, lo que refuerza la necesidad de disponer de un plan de transición establecido.
En todos los casos, se valorarán el interés del paciente y su familia, y otros criterios de índole personal.
- a.
Circuito:
- 1.
Asesorar al paciente que alcanza la edad de transición y activar el protocolo de modo individualizado (visitas de seguimiento con el gestor de casos para el refuerzo de la educación sanitaria).
- 2.
Aplicar criterios de elección del centro de derivación en base a: domicilio del paciente, decisión del paciente y existencia de CE o de referencia próximos.
- 3.
Identificar al nefrólogo de adultos más idóneo para ser el receptor del paciente con cistinosis de acuerdo con la organización del servicio y los recursos disponibles.
- 4.
Establecer la comunicación entre el gestor de casos en el hospital pediátrico y el homólogo en el servicio receptor de adultos.
- 5.
Elaboración de un plan concreto de transición de nefrología pediátrica a nefrología de adultos adaptado individualmente al paciente y al hospital, que constará en:
- –
Reunión informativa (presencial, telefónica, correo electrónico) entre nefrólogos pediatras-gestor de casos-nefrólogo de adultos, dirigida a establecer contactos entre equipos y a consolidar un relación duradera
- –
En la medida de lo posible, favorecer una visita conjunta de los 2 equipos (última o penúltima previa a la transferencia) para eliminar barreras y facilitar el paso a las consultas externas de nefrología de adultos. En el caso de barreras geográficas, potenciar el trabajo en red.
- –
- 6.
Asegurar que el circuito de farmacia se adapta a la nueva situación y que el paciente dispone de la medicación específica suficiente hasta su incorporación al centro receptor.
- 7.
Transferencia propiamente dicha del paciente.
- 8.
Seguimiento y monitorización de la transición para garantizar la continuidad asistencial y detectar desviaciones del protocolo y dificultades no previstas. La duración de este periodo estará consensuada por los 2 equipos, recomendándose que se prolongue durante el primer año que resulta ser el periodo más crítico, o hasta que esté instaurada una rutina de seguimiento en el centro de adultos.
- 9.
Control de calidad del modelo de transición, incluyendo un registro de los pacientes transferidos y actualización periódica del protocolo de transición.
- 1.
- b.
Documentación imprescindible: informe médico del nefrólogo pediátrico y de todos los especialistas que hayan estado implicados en el cuidado del paciente. Incluirá la siguiente información:
- –
Diagnóstico clínico (edad de diagnóstico, características clínicas, diagnóstico genético).
- –
Antecedentes personales significativos (incluyendo alergias e intolerancias, calendario vacunal).
- –
Curso clínico del paciente durante la edad pediátrica (problemas activos, problemas resueltos, complicaciones graves, tanto renales como extrarrenales).
- –
Tratamiento farmacológico: plan terapéutico actualizado, niveles de fármacos, monitorización terapéutica específica (niveles de cistina intragranulocitaria) e informe de adherencia terapéutica.
- –
Resumen de la última visita y copia de las últimas pruebas realizadas.
- –
Recomendaciones de seguimiento clínico por especialidad19:
- –
Calendario de citación actualizado por especialidades.
- –
Documento de citación con información completa para el paciente y la familia (día y hora de visita, profesional, datos de contacto).
- –
Identificación del especialista receptor.
- –
Solicitud cursada de las pruebas complementarias requeridas para la siguiente visita.
- –
- –
El Grupo de trabajo T-CiS.bcn ha elaborado las siguientes recomendaciones de transición del adolescente y adulto joven con cistinosis, con el objetivo de complementar las recomendaciones de seguimiento multidisciplinar de estos pacientes en la medicina del adulto, tal y como se indicó la primera fase del documento consenso sobre la atención integral de la cistinosis19.
Se aportan planes específicos en las patologías más prevalentes en la fase de transición: nefrología, oftalmología, endocrinología y neurología (tablas 2-5), recomendaciones para mejorar la adherencia terapéutica (tabla 6) y recomendaciones para favorecer el autocuidado del paciente (tabla 7).
Recomendaciones para la transición a nefrología de adultos
| Contactar | Consulta de Trasplante Renal del Hospital |
| Opcional: según la situación clínica del paciente consulta de ERC o unidad de diálisis | |
| Identificar al especialista adecuado que sea el responsable de hacer el seguimiento, valorar si existe un nefrólogo referente de enfermedad renal hereditaria y/o rara | |
| Criterio de derivación | Edad: criterio individualizado, pero preferente a los 18 años |
| Documentación para el especialista receptor | |
| 1. Información sobre la enfermedad | Opcional: recomendaciones para la atención integral de la cistinosis del grupo T-CiS.bcn19 |
| 2. Informe médico del paciente | |
| Anamnesis detallada | ||
|---|---|---|
| Datos antropométricos (peso y talla), presión arterial | ||
| Trasplante renal | Diálisis crónica | Enfermedad renal crónica |
| Antecedentes | ||
| Fecha | Fecha de inicio | Estadio de enfermedad renal crónica y ritmo de progresión |
| Tipo de trasplante (preventivo o posdiálisis) | Tipo de diálisis (hemodiálisis o diálisis peritoneal) | Situación activa en lista de espera de trasplante renal o no, y sus causas |
| Características del donante (vivo o cadáver, HLA, serologías) | Lugar de tratamiento (hospital, centro, domicilio) | Características del paciente (HLA, serologías, otros riesgos) |
| Características del receptor (HLA, serologías, otros riesgos) | Acceso vascular (fístula arterio-venosa, catéter), fecha y complicaciones relacionadas | Diuresis cuantificada, función renal residual y presencia o no de Síndrome de Fanconi activo |
| Informe quirúrgico (características del injerto, evolución inicial del trasplante) | Situación activa en lista de espera de trasplante renal o no, y sus causas. Características del receptor (HLA, serologías, otros riesgos) | |
| Biopsia del injerto (de protocolo o electiva, fecha y hallazgos) | Prescripción de diálisis y eficacia (Ktv) | |
| Anticuerpos antidonante | Diuresis residual cuantificada, función renal residual y presencia o no de síndrome de Fanconi activo | |
| Eventos | ||
| Episodios de rechazo, disfunción renal aguda, hipertensión arterial, afectación cardiovascular, dislipidemia, diabetes, enfermedad ósea | Episodios de disfunción renal sobreañadida, hipertensión arterial, afectación cardiovascular, dislipidemia, diabetes, enfermedad ósea | Episodios de disfunción renal sobreañadida, hipertensión arterial, afectación cardiovascular, dislipidemia, diabetes, enfermedad ósea |
| Plan terapéutico | ||
| Pauta de inmunosupresión: | Efectos terapéuticos y secundarios de los fármacos prescritos | Efectos terapéuticos y secundarios de los fármacos prescritos |
| – Inicial | Tratamiento específico con cisteamina y niveles de cistina intragranulocitaria | Tratamiento específico con cisteamina y niveles de cistina intragranulocitaria |
| – Cambios significativos y causas | Otros tratamientos | Otros tratamientos |
| – Actual | Adherencia terapéutica | Adherencia terapéutica |
| – Niveles de mantenimiento de inmunosupresores | ||
| – Efectos secundarios de los inmunosupresores y otros fármacos asociados | ||
| Tratamiento específico con cisteamina y niveles de cistina intragranulocitaria | ||
| Otros tratamientos | ||
| Adherencia terapéutica | ||
| Pruebas complementarias |
| Última analítica |
| Ecografía renal |
| Fondo de ojo |
| Monitorización ambulatoria de presión arterial |
| Ecocardiograma |
| Afectación extrarrenal de la cistinosis |
| Asistencia coordinada con otros especialistas |
| Valoración psicosocial |
| Minusvalía y discapacidad |
| Educación/autonomía laboral |
| Situación familiar, social y legal |
| 3. Control de seguimiento del paciente |
| Aplicar las guías KDIGO (www.kdigo.org) o las recomendaciones de las sociedades científicas de Nefrología sobre el seguimiento de los pacientes trasplantados renales, o en diálisis o con enfermedad renal crónica prediálisis |
| 4. Control de adherencia al tratamiento oftálmico-tópico y sistémico con cisteamina y a otros fármacos prescritos |
Recomendaciones para la transición a oftalmología de adultos
| Contactar | Unidad de Córnea y Superficie Ocular del Servicio de Oftalmología del hospital |
| Identificar al especialista en córnea que sea el responsable de hacer el seguimiento | |
| Criterio de derivación | Edad: criterio individualizado |
| Documentación para el especialista receptor | |
| 1. Información sobre la enfermedad | Opcional: Recomendaciones para la atención integral de la cistinosis del grupo T-CiS.bcn19 |
| 2. Informe médico del paciente | |
| 3. Control del paciente | |
| En adolescencia (16-18) | Controles cada 6 meses |
| En adultos | Controles anuales |
| 4. Recomendaciones de seguimiento óptimo periódico | |
| Biomicroscopía con lámpara de hendidura | Para valorar córnea y segmento anteriora |
| Es interesante recoger en cada exploración, de forma detallada, la distribución de los cristales en la córnea, especificando si solo se depositan en la periferia o de forma difusa y si se localizan en epitelio, estroma y/o endotelio. Dicha información permitirá realizar un mejor seguimiento posterior | |
| Medir presión intraocular | |
| Exploración del fondo de ojo bajo midriasis | |
| 5. Recomendaciones en circunstancias excepcionales | |
| Electrorretinograma fotópico y escotópico | Si el paciente refiere problemas en visión nocturna o si el fondo de ojo está alterado |
| Fondo de ojo a los 2-3 meses de inicio de tratamiento con determinados fármacos (hormona del crecimiento, anticonceptivos orales…) | Si el paciente está en tratamiento con fármacos que se han descrito asociados al síndrome de seudotumor cerebri secundario y si presenta cefalea |
| Urgencia oftalmológica | Si el paciente refiere disminución de visión severa y/o aguda, dado que esta clínica no es característica de esta patología |
| 6. Tratamiento oftálmico tópico19 | Solución salina de cisteamina 0,55%. Solución viscosa de cisteamina 0,55%. Máximo 4 veces al día. |
| Una gota 10-12 veces al día | |
| 7. Control de adherencia al tratamiento oftálmico-tópico y sistémico con cisteamina y a otros fármacos prescritos | |
La presencia de cristales de cistina en la córnea es universal y es la principal diana ocular en cistinosis.
Tomado de Ariceta et al.19.
Recomendaciones para la transición a endocrinología de adultos
| Contactar | Servicio de Endocrinología |
| Identificar al especialista adecuado que sea el responsable de hacer el seguimiento; valorar si existe un endocrinólogo referente de enfermedad hereditaria y/o minoritaria | |
| Criterios de derivación | |
| Edad | Criterio individualizado |
| Estado puberal a la transferencia | Tanner IV o inferior o antecedentes de retraso puberal (Inicio puberal: ♂>14 años; ♀> 12 años) |
| Si recibe tratamiento con: | Tiroxina, insulina, GH o testosterona |
| Alteración analítica en los parámetros endocrinológicos de seguimiento19: | T4L, TSH, glucemia, HbA1c, GH, IGF-1, testosterona, LH, FSH |
| Deseo gestacional | |
| Documentación para el especialista receptor | |
| 1. Información sobre la enfermedad: | Opcional: Recomendaciones para la atención integral de la cistinosis del grupo T-CiS.bcn19 |
| 2. Informe médico del paciente | |
| 2.1. Datos clínicos | |
| • Evolución pondoestatural | Peso, talla y percentil de peso y talla en última visita (idealmente una copia escaneada de la gráfica de peso y talla) y edad ósea |
| • Evolución puberal | Estado maduración de Tanner en el momento de la transferencia |
| • Si presenta diabetes | Datos relativos al estudio de complicaciones crónicas y otros factores de riesgo vascular |
| 2.2. Datos analíticos (último valor/fecha) | |
| • T4L, TSH | |
| • Glucemia, HbA1c | |
| • GH, IGF-1 | |
| • ± test de secreción GH | |
| • Testosterona, LH, FSH | |
| 2.3. Tratamiento hormonal sustitutivo | |
| (VB/fecha VB/fecha inicio tratamiento/preparado y dosis/cambios recientes dosis/pruebas funcionales) | |
| • Tiroxina | |
| • Insulina | |
| • GH | |
| • Testosterona | |
| 3. Control de adherencia al tratamiento oftálmico-tópico y sistémico con cisteamina y a otros fármacos prescritos | |
VB: valor basal previo al tratamiento.
Recomendaciones para la transición a neurología de adultos
| Contactar | Servicio de Neurología |
| Identificar al especialista adecuado que sea el responsable de hacer el seguimiento; valorar si existe un neurólogo referente de enfermedad hereditaria y/o minoritaria | |
| Criterio de derivación | Edad: criterio individualizado |
| Documentación para el especialista receptor | |
| 1. Información sobre la enfermedad: | Opcional: Recomendaciones para la atención integral de la cistinosis del grupo T-CiS.bcn19 |
| 2. Informe médico del paciente | |
| Información sobre la presencia de problemas neurocognitivos, conductuales y de rendimiento escolar | Casi el 50% de los menores de 18 años presentan alteraciones en el rendimiento cognitivo global con repercusión en el proceso de escolarización, identificándose problemas en la atención, las funciones ejecutivas, el lenguaje, la memoria, las funciones perceptivas, visuoespaciales y visuoconstructivas, así como en el control motor cognitivo voluntario |
| Últimas exploraciones neuropsicológicas | Valorar el rendimiento cognitivo global y reportar la presencia o no de ansiedad, depresión y alteraciones conductuales |
| Última evaluación de la fuerza muscular | Manual MRC y cuantitativa de la fuerza muscular en las manos medida mediante dinamómetros validados |
| En caso de presencia de miopatía distal, se aportará el grado de repercusión funcional en las actividades de la vida diaria | |
| Último informe de la función motora oro-facial, deglutoria y de la función respiratoria | Reportar episodios de broncoaspiración o neumonías de repetición |
| Últimas pruebas de neuroimagen | Reportar calcificaciones, pérdida de volumen cerebral u otras anomalías |
| Cuantificar el grado de atrofia cerebral | |
| 3. Control de adherencia al tratamiento oftálmico-tópico y sistémico con cisteamina y a otros fármacos prescritos | |
MRC: Medical Research Council scale.
Recomendaciones para mejorar la adherencia terapéutica en transición
| Métodos de valoración de la adherencia terapéutica46,47 |
| 1. Métodos directos |
| Monitorización de los niveles de cistina intragranulocitaria (a las 6h posdosis Cystagon®)9,12 |
| • Buen control terapéutico:<1 nmol ½ cistina/mg de proteína |
| • En pacientes no tratados con cisteamina los niveles suelen ser > 1,5 |
| • Este método puede estar influenciado por factores individuales de absorción del fármaco, extracción y condiciones de envío de la muestra19 |
| Valoración depósitos de cistina en córnea |
| • En cada exploración con lámpara de hendidura, recoger de forma detallada la distribución de los cristales en la córnea, especificando si solo se depositan en la periferia o de forma difusa y si se localizan en epitelio, estroma y/o endotelio |
| 2. Métodos indirectos |
| Entrevista personal con el paciente (evaluar siempre la adherencia durante la consulta) |
| Cuestionario de adherencia |
| Registro de dispensación de medicación del Servicio de Farmacia Hospitalaria |
| Recuento de medicación sobrante del paciente en cada dispensación |
| Uso de dispositivos electrónicos y aplicaciones informáticas específicas para el registro de las administraciones |
| Medidas de mejora de adherencia terapéutica40-42,44-49 |
| 1. Identificar factores de riesgo que afectan a la adherencia y aplicar medidas correctivas en lo posible |
| Factores intrínsecos al paciente y socioeconómicos |
| Factores relacionados con la enfermedad |
| Factores relacionados con el tratamiento |
| Barreras de organización sanitaria |
| 2. Promover la educación en sanitaria del paciente, los beneficios del tratamiento y las consecuencias de la no adherencia |
| 3. Promover el soporte del entorno del paciente con implicación familiar y de la asociación de pacientes |
| 4. Implementar medidas directas de detección de no adherencia |
| 5. Implementar medidas indirectas de detección de no adherencia |
| 6. Implementar medidas directas de soporte al cumplimiento terapéutico |
| Acordar los planes terapéuticos con el paciente y revisarlos en cada visita |
| Informar sobre los efectos secundarios del tratamiento y sobre las intervenciones para paliarlos |
| Simplificar el tratamiento en la medida posible |
| Planificar y adaptar la medicación a la rutina diaria |
| Facilitar información escrita de la medicación planificada |
| Implementar medidas para evitar olvidos |
| Poner la medicación en un sitio visible |
| Utilizar alarmas digitales, recordatorios en dispositivos móviles |
| Utilizar organizadores de fármacos o blisters semanales |
| Tener una reserva de dosis localizable para cubrir olvidos de tomas (cartera, despacho, coche) |
| Establecer programas de seguimiento farmacoterapéutico y atención farmacéutica |
| 7. Favorecer la continuidad asistencial y programación de visitas periódicas. Seguimiento telefónico del paciente que no siguen el régimen de visitas |
| 8. Identificar y asignar el «coordinador/gestor de casos» que coordine la transición y asesore debidamente al paciente |
| 9. Crear un equipo médico multidisciplinar: programar reuniones periódicas de comité de expertos para el seguimiento de los pacientes |
| 10. Desarrollar programas de atención multidisciplinar que contemplen la prevención, la detección y las intervenciones de mejora del cumplimiento terapéutico |
| 11. Desarrollar protocolos de transición del paciente a equipos adultos que contemplen la prevención, la detección y las intervenciones de mejora del cumplimiento terapéutico |
| 12. Promover una buena relación entre el paciente/cuidador y el equipo asistencial |
| 13. Implementar programas de transición protocolizados a la medicina del adulto |
| Planificación de la visita médica: |
| Revisar mi calendario de visitas |
| Revisar mi botiquín de cistinosis y si necesito renovar mis recetas |
| Comprobar si tengo nueva documentación de otros especialistas desde la última visita médica |
| Acudir a las extracciones analíticas programadas y comprobar si incluyen determinación de niveles de cistina (recuerda haber tomado el Cystagon® 6 horas antes de la extracción) |
| Revisa si tengo alguna otra prueba complementaria antes de la visita médica |
| Acudir al servicio de farmacia para la recogida de medicación programada |
| Antes de la visita médica: |
| Escribe las preguntas y/o dudas que quieras hacer al equipo médico |
| Anota los síntomas y problemas de salud que hayas tenido desde la última consulta (desde cuándo, cómo se me pasa, qué cosas hacen que empeore) |
| Anota los controles de tensión arterial y de la glucosa si tu médico te lo ha indicado |
| Durante la visita: |
| No tengas miedo de preguntar tantas veces como consideres necesarias para aclarar tus dudas |
| Anota la información que quieras recordar |
| Pregunta por el resultado de tus análisis, incluyendo los niveles de cistina y pruebas médicas |
| Pide al médico o enfermera que te den su valoración de los resultados y de cómo estás |
| Asegúrate que has entendido bien las instrucciones que te da el médico de los cambios de tratamiento |
| Comprueba que llevas el nuevo tratamiento por escrito y las recetas actualizadas |
| Antes de terminar la visita: |
| Comprueba que llevas anotado la fecha de la próxima cita |
| Asegúrate que tienes los datos de contacto del equipo médico (teléfono y e-mail) |
| Infórmate si hay novedades de la enfermedad, conferencias de interés o reuniones de la asociación de pacientes |
| Al llegar a casa: |
| Comprueba que entiendes los cambios de tratamiento que te han indicado |
| Prepara el botiquín semanal de acuerdo al tratamiento actualizado |
| Anota en la agenda cuando es la próxima visita |
| Archiva los nuevos documentos |
| Solicita una visita con tu médico de familia para explicarle el contenido de la visita y los cambios realizados |
| Dosier de Cistinosis: |
| Prepárate un archivador para ir guardando tu documentación de modo ordenado |
| Documentos a incluir: |
| 1. Agenda de visitas médicas |
| 2. Agenda de contactos: |
| Hospital: teléfonos citaciones, médicos especialistas, enfermera/o-gestora/or de casos |
| Centro de Atención Primaria |
| Asociación de pacientes |
| Otros teléfonos de interés |
| 3. Informes médicos ordenados por fecha y por especialista |
| 4. Carnet de vacunación |
| 5. Registro de alergias, si las hay |
| 6. Documentos recibidos de consultas, exploraciones, analíticas… |
| 7. Control de recetas |
| 8. Control de medicación |
Adaptación de “Information prescription for patients with cystinosis” – Queen Elisabeth Hospital Birmingham, con la autorización de Mr. Steven Wise-Renal Metabolic Disease Nurse Specialist50.
Los niveles de cistina intraleucocitaria ≤ 1 nmol hemicistina/mg proteína constituyen el indicador de buena adherencia a cisteamina oral y, en consecuencia, de eficacia terapéutica. El problema de la no adherencia emerge durante la adolescencia y se acentúa generalmente durante el periodo de transición a las unidades de adultos, afectando tanto al tratamiento como a la adherencia clínica (pérdida de citas a consultas y pruebas complementarias). La no adherencia a la cisteamina se relaciona con un peor pronóstico y una mayor progresión de la enfermedad renal y extrarrenal4,19,43. No obstante, la adherencia subóptima al tratamiento no es un fenómeno restringido a esta enfermedad y se ha observado en TxR y en otras enfermedades crónicas17,44.
Confluyen distintos factores de riesgo que afectan a la adherencia terapéutica en cistinosis, como son la pauta posológica estricta, los problemas de tolerancia, los posibles efectos secundarios y un tratamiento complejo con múltiples medicaciones. Otras consideraciones no menos importantes y no exclusivas de cistinosis son: el conocimiento limitado sobre la enfermedad, la falta de motivación, la transición inadecuada a adultos y el impacto en la calidad de vida8,45. Otro factor es que la afectación neuropsicológica y la discapacidad de los pacientes cistinóticos se superponen a una inmadurez neurocognitiva que pueden afectar aún más su capacidad de gestionar la enfermedad crónica41.
La valoración de la adherencia al tratamiento es imprescindible en el seguimiento clínico del paciente. Una estimación de cumplimiento terapéutico debe incorporarse a la anamnesis del paciente de forma rutinaria con una actitud abierta y positiva que permita corregir posibles desviaciones de la prescripción46,47. Es recomendable pues que los distintos profesionales implicados valoren el grado de adherencia e intervengan activamente con medidas de mejora40,44-49 (tabla 6).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.