La enfermedad cardiovascular (ECV) y renal en la mujer presentan factores de riesgo propios relacionados con el estatus hormonal y los antecedentes obstétricos que deben tenerse en cuenta. Las complicaciones del embarazo, como la preeclampsia (PE), pueden revelar predisposiciones subclínicas a padecer enfermedades futuras que ayuden a identificar a aquellas mujeres que puedan beneficiarse de nuevas oportunidades para la prevención de la ECV y la enfermedad renal crónica.
Materiales y métodosRevisión sobre la PE y su asociación con el desarrollo de ECV y renal futuras.
ResultadosMúltiples estudios han establecido una asociación entre PE y el desarrollo de cardiopatía isquémica, hipertensión crónica, enfermedad vascular periférica, accidente cerebrovascular y enfermedad renal. No se ha aclarado suficientemente si esta relación es de causalidad o está mediada por la presencia de factores de riesgo comunes. Sin embargo, la demostración de fenómenos de disfunción endotelial y microangiopatía trombótica en los embarazos que cursan con PE hace suponer que esta puede dejar una impronta a largo plazo. La identificación precoz de las mujeres que han padecido un embarazo complicado con PE es una ventana de oportunidad para mejorar la salud de la mujer, mediante su seguimiento y la adopción de medidas preventivas adecuadas. Los marcadores bioquímicos de daño oxidativo y la ecografía vascular pueden desempeñar un papel clave en la identificación precoz de este daño arterial.
ConclusionesLa implantación de estrategias preventivas multidisciplinares y específicas puede ayudar a frenar la historia natural de la ECV y renal en las mujeres de riesgo, a través de la modificación de su estilo de vida y del adecuado control de la tensión arterial. Para ello, proponemos una serie de recomendaciones para guiar el estudio de la predicción y prevención de la ECV tras la PE a lo largo de la vida de la mujer.
Cardiovascular (CVD) and chronic kidney disease (CKD) in women have unique risk factors related to hormonal status and obstetric history that must be taken into account. Pregnancy complications, such as preeclampsia (PE), can reveal a subclinical predisposition for the development of future disease that may help identify women who could benefit from early CVD and CKD prevention strategies.
Materials and methodsReview of PE and its association with future development of CVD and CKD.
ResultsMultiple studies have established an association between PE and the development of ischemic heart disease, chronic hypertension, peripheral vascular disease, stroke and CKD. It has not been sufficiently clarified if this relation is a causal one or if it is mediated by common risk factors. Nevertheless, the presence of endothelial dysfunction and thrombotic microangiopathy during pregnancies complicated with PE makes us believe that PE may leave a long-term imprint. Early identification of women who have had a pregnancy complicated by PE becomes a window of opportunity to improve women's health through adequate follow-up and targeted preventive actions. Oxidative stress biomarkers and vascular ultrasound may play a key role in the early detection of this arterial damage.
ConclusionsThe implementation of preventive multidisciplinary targeted strategies can help slow down CVD and CKD's natural history in women at risk through lifestyle modifications and adequate blood pressure control. Therefore, we propose a series of recommendations to guide the prediction and prevention of CVD and CKD throughout life of women with a history of PE.
La enfermedad cardiovascular (ECV) es la primera causa de muerte en la mujer, llegando a una mortalidad del 49% en Europa, 16 veces mayor que la del cáncer de mama (3%)1. Esto genera una gran carga económica y social, así como notables consecuencias físicas y psíquicas para las mujeres y sus familias. Aunque el 80% de los eventos por ECV se pueden prevenir, se estima que está aumentando la tasa de mortalidad en las mujeres, especialmente en edades jóvenes2. A pesar de ello, la importancia de la ECV en la mujer está infraestimada por una falta de concienciación social, debido a la percepción errónea de que está protegida contra la misma. En consecuencia, los recursos preventivos de la ECV en la mujer no se priorizan lo suficiente.
Hay varias razones subyacentes:
- 1)
Tradicionalmente, las mujeres han sido excluidas de los ensayos clínicos, suponiendo de forma errónea que los factores de riesgo cardiovascular (RCV) y las recomendaciones deben ser similares para hombres y mujeres3.
- 2)
La estratificación del RCV es inadecuada. La mayoría de las mujeres menores de 60 años se clasifican en la categoría de riesgo bajo para ECV, incluso en presencia de alta carga de factores de RCV4.
- 3)
El riesgo de ECV en las mujeres está influido por factores específicos como la menopausia precoz o el antecedente de complicaciones del embarazo como la preeclampsia (PE), la diabetes gestacional o el parto pretérmino. Estos factores no se incluyen en la evaluación tradicional de RCV5.
- 4)
Las manifestaciones clínicas de la ECV en hombres y mujeres muestran diferencias que conducen a que la enfermedad y su gravedad sean poco reconocidas en la mujer.
Los síntomas de ECV en las mujeres son a menudo más complejos y multifactoriales que en los hombres6, lo que, junto con la falta de educación, conduce a que la mujer consulte en etapas más avanzadas. En resumen, todas estas observaciones destacan la necesidad de un enfoque orientado a la mujer, incluyendo factores de riesgo y programas de intervención específicos. En esta revisión, destacamos el momento del embarazo, y especialmente el desarrollo de PE, como marcador de la salud cardiovascular.
El embarazo como nuevo paradigma para la identificación del riesgo cardiovascular en la mujerLas mujeres gestantes, sus familias y el personal sanitario enfocan habitualmente el embarazo como una situación transitoria. Una vez que la reciente madre es dada de alta, el foco pasa a ser el recién nacido. Si hubo alguna complicación durante el embarazo (por ejemplo, una PE) se suele mantener una vigilancia hasta que desaparecen los signos y síntomas de enfermedad, confiando en que con ello se restablece la salud de la mujer. Las preocupaciones sobre su impacto en la salud futura suelen limitarse a los efectos potenciales que pueda tener en embarazos posteriores, y se olvida o desconoce su influencia a largo plazo7. Sin embargo, como veremos, la PE afecta a la salud de la mujer durante el resto de su vida.
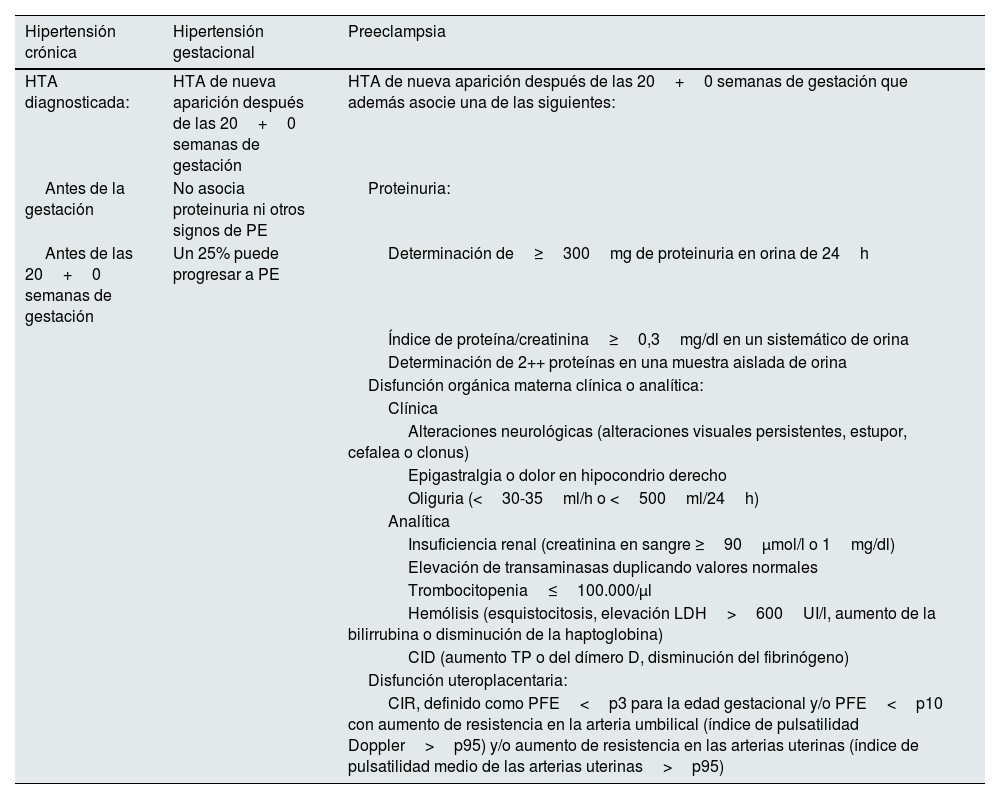
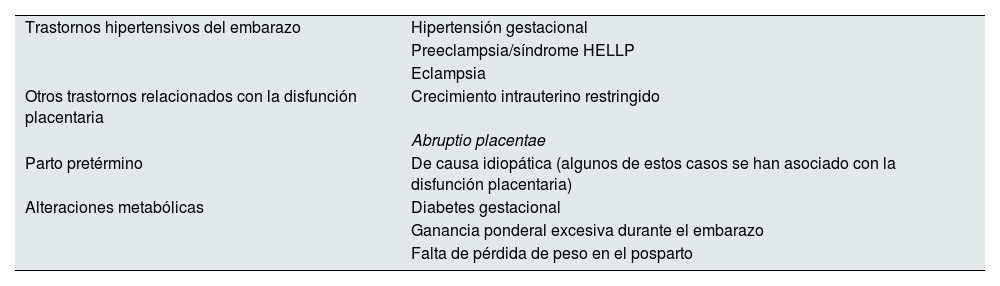
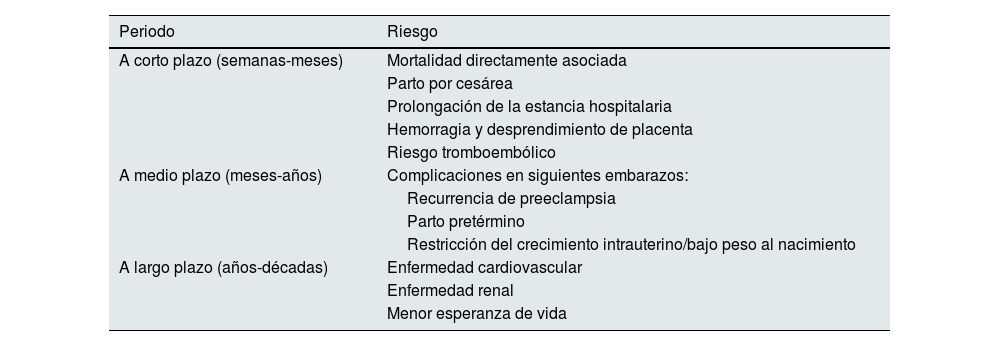
La PE y otros trastornos hipertensivos del embarazo (tabla 1) afectan al 10% de las embarazadas. La PE se encuentra en el pódium de las causas de mortalidad materna, siendo responsable de aproximadamente una de cada 6 muertes en gestantes8 y la primera causa de ingreso en unidades de cuidados intensivos durante el periodo puerperal9. Aunque la hipertensión y otros síntomas clínicos se resuelven habitualmente en las semanas siguientes al parto, sus efectos biológicos se mantienen en el tiempo, predisponiendo a la resistencia a la insulina, la hipertensión, la disfunción endotelial y, en definitiva, al síndrome metabólico10. La PE forma parte de algunas alteraciones gestacionales que han mostrado asociación con el RCV futuro en la mujer, como son otros estados hipertensivos del embarazo, la diabetes gestacional o el parto pretérmino (tabla 2). De todos ellos, la asociación más consistente la muestra la PE11. La ECV y la PE comparten factores de riesgo, como la hiperlipidemia, la obesidad y la propia hipertensión, pudiendo actuar la PE como un factor de refuerzo del riesgo basal alto de estas pacientes12. La PE también ha demostrado aumentar el riesgo de enfermedad renal y de complicaciones en subsiguientes embarazos. La tabla 3 resume sus complicaciones para la madre a corto, medio y largo plazo.
Diagnóstico diferencial de los trastornos hipertensivos del embarazo
| Hipertensión crónica | Hipertensión gestacional | Preeclampsia |
|---|---|---|
| HTA diagnosticada: | HTA de nueva aparición después de las 20+0 semanas de gestación | HTA de nueva aparición después de las 20+0 semanas de gestación que además asocie una de las siguientes: |
| Antes de la gestación | No asocia proteinuria ni otros signos de PE | Proteinuria: |
| Antes de las 20+0 semanas de gestación | Un 25% puede progresar a PE | Determinación de≥300mg de proteinuria en orina de 24h |
| Índice de proteína/creatinina≥0,3mg/dl en un sistemático de orina | ||
| Determinación de 2++ proteínas en una muestra aislada de orina | ||
| Disfunción orgánica materna clínica o analítica: | ||
| Clínica | ||
| Alteraciones neurológicas (alteraciones visuales persistentes, estupor, cefalea o clonus) | ||
| Epigastralgia o dolor en hipocondrio derecho | ||
| Oliguria (<30-35ml/h o <500ml/24h) | ||
| Analítica | ||
| Insuficiencia renal (creatinina en sangre ≥90μmol/l o 1mg/dl) | ||
| Elevación de transaminasas duplicando valores normales | ||
| Trombocitopenia≤100.000/μl | ||
| Hemólisis (esquistocitosis, elevación LDH>600UI/l, aumento de la bilirrubina o disminución de la haptoglobina) | ||
| CID (aumento TP o del dímero D, disminución del fibrinógeno) | ||
| Disfunción uteroplacentaria: | ||
| CIR, definido como PFE<p3 para la edad gestacional y/o PFE<p10 con aumento de resistencia en la arteria umbilical (índice de pulsatilidad Doppler>p95) y/o aumento de resistencia en las arterias uterinas (índice de pulsatilidad medio de las arterias uterinas>p95) |
CID: coagulación intravascular diseminada; CIR: crecimiento intrauterino restringido; HTA: hipertensión arterial; LDH: lactato deshidrogenasa; p: percentil; PE: preeclampsia; PFE: peso fetal estimado; TP: tiempo de protrombina.
Factores de riesgo cardiovascular relacionados con el embarazo que cuentan con evidencia científica de al menos nivel ii-2
| Trastornos hipertensivos del embarazo | Hipertensión gestacional |
| Preeclampsia/síndrome HELLP | |
| Eclampsia | |
| Otros trastornos relacionados con la disfunción placentaria | Crecimiento intrauterino restringido |
| Abruptio placentae | |
| Parto pretérmino | De causa idiopática (algunos de estos casos se han asociado con la disfunción placentaria) |
| Alteraciones metabólicas | Diabetes gestacional |
| Ganancia ponderal excesiva durante el embarazo | |
| Falta de pérdida de peso en el posparto |
Riesgos para la salud de la mujer asociados al padecimiento de una preeclampsia
| Periodo | Riesgo |
|---|---|
| A corto plazo (semanas-meses) | Mortalidad directamente asociada |
| Parto por cesárea | |
| Prolongación de la estancia hospitalaria | |
| Hemorragia y desprendimiento de placenta | |
| Riesgo tromboembólico | |
| A medio plazo (meses-años) | Complicaciones en siguientes embarazos: |
| Recurrencia de preeclampsia | |
| Parto pretérmino | |
| Restricción del crecimiento intrauterino/bajo peso al nacimiento | |
| A largo plazo (años-décadas) | Enfermedad cardiovascular |
| Enfermedad renal | |
| Menor esperanza de vida |
Fuente: Shih et al.63.
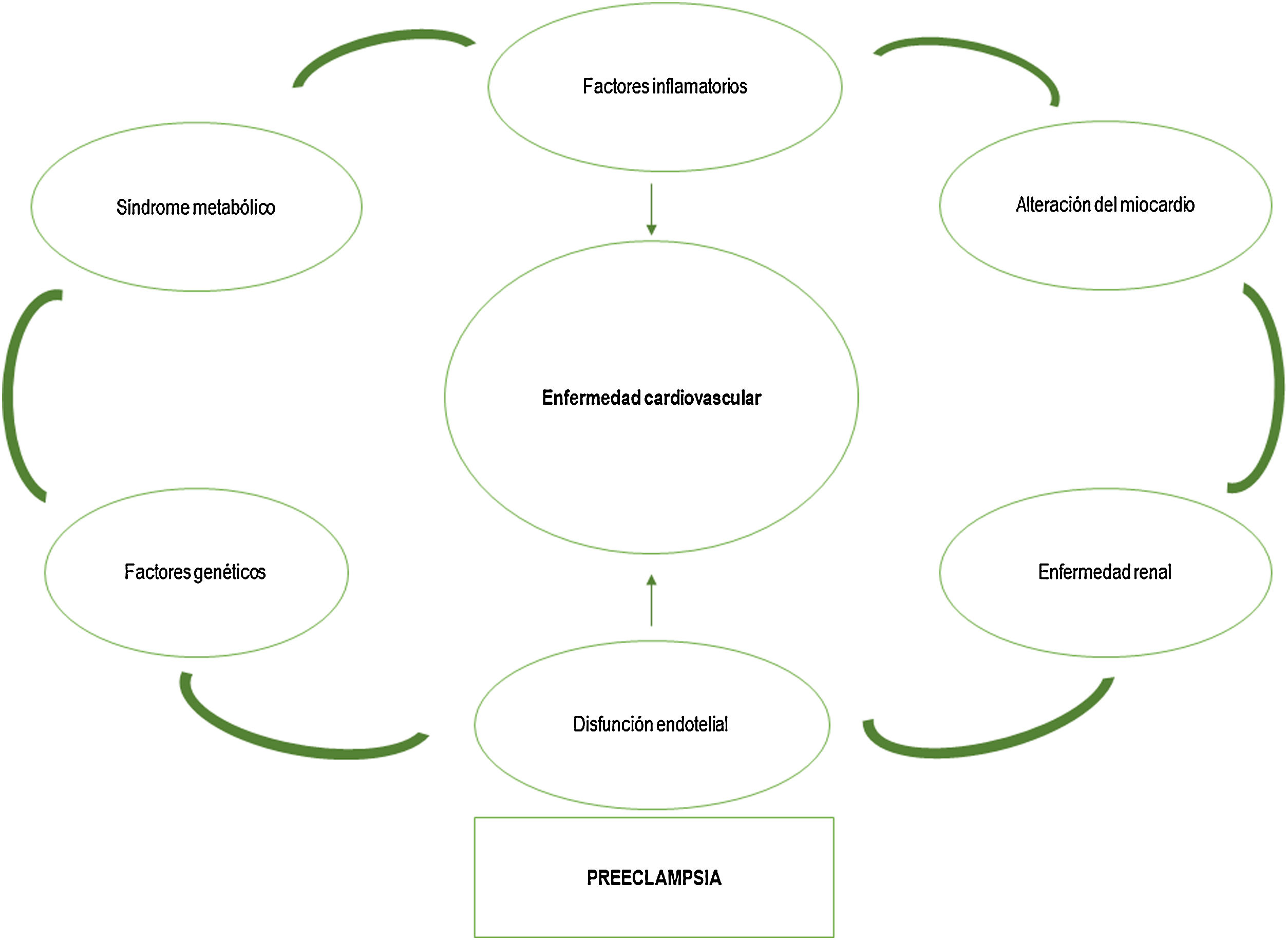
En efecto, en los últimos años se ha difundido el concepto de que las complicaciones del embarazo, como la PE, pueden revelar predisposiciones subclínicas a padecer enfermedades futuras que ayuden a identificar a aquellas mujeres que pueden beneficiarse de nuevas oportunidades para la prevención de enfermedades crónicas13. El embarazo resulta ser una prueba de esfuerzo cardiovascular. Algunas embarazadas pueden exceder el límite de disfunción vascular y desarrollar una PE, lo que demuestra su vulnerabilidad para volver a padecer una PE y para presentar una ECV más adelante. La frecuencia con que una mujer fracasa en esta prueba de esfuerzo y la severidad de este fallo marca el riesgo futuro de ECV (fig. 1). Siguiendo este argumento, si podemos identificar a estas mujeres en riesgo tras un primer embarazo complicado con una PE, podremos poner en marcha programas de cribado precoces para modificar hábitos de vida o iniciar tratamientos que puedan paliar los riesgos en sucesivos embarazos y también para la salud cardiovascular a largo plazo14. Por tanto, nos encontramos ante la posibilidad de convertir un problema en una auténtica ventana de oportunidad para mejorar la salud de la mujer.
Concepto de disfunción placentaria y su relación patogénica con la lesión endotelial a corto y largo plazoEn los últimos años se han producido avances trascendentes en el conocimiento de la patogenia de la disfunción placentaria, responsable de múltiples complicaciones del embarazo íntimamente vinculadas entre sí, especialmente la PE, el crecimiento intrauterino restringido y el abruptio placentae. Además, también se asocia con el parto pretérmino y la muerte intrauterina15.
La etiología de la disfunción placentaria es multifactorial. Diversos condicionantes genéticos, medioambientales, inmunológicos, la mayoría de los factores de RCV (dislipidemia, hipertensión, obesidad, diabetes mellitus) y otras afectaciones orgánicas (lupus eritematoso sistémico, trombofilias, nefropatías) han sido vinculados con ella. Independientemente de su origen último, en la actualidad se ha asentado la «hipótesis angiogénica» que vincula la disfunción placentaria con el daño que aparece en los endotelios maternos a través de un desequilibrio en los procesos de angiogénesis. Así, en respuesta a situaciones de hipoperfusión o hipoxia placentaria, la placenta libera a la circulación materna un exceso del factor antiangiogénico conocido como la forma soluble de la tirosina cinasa-1 similar al fms (sFlt-1, por soluble fms-like tyrosine kinase-1), que bloquea la acción regeneradora de los endotelios que tienen los factores proangiogénicos como el factor de crecimiento placentario (PlGF, por placental growth factor) y el factor de crecimiento endotelial vascular. Este desequilibrio angiogénico desencadena una disfunción endotelial generalizada en la mujer embarazada que ocasiona la aparición de la hipertensión, y daño de los endotelios fenestrados de los órganos diana afectados por la PE, como son el cerebro, el hígado y el riñón16.
En la segunda mitad de los embarazos complicados por una disfunción placentaria puede detectarse en suero materno una elevación del cociente sFlt-1/PlGF desde al menos un mes antes de que aparezcan sus primeros signos y síntomas clínicos. Además, la alteración del sFlt-1/PlGF es mayor en los casos más graves y precoces. Su principal aplicación clínica es la de orientar en situaciones de sospecha de PE pretérmino, con un elevado valor predictivo negativo para la aparición de PE en la siguiente semana (99%) y en las siguientes 4 semanas (94%) cuando el cociente sFlt-1/PlGF es≤3817. Sin embargo, cuando el embarazo se encuentra a término (37-42 semanas), la PE suele cursar con formas más leves y con menor alteración del equilibrio angiogénico18,19. En estos casos de PE tardía, el trastorno placentario es menos acusado y frecuente y, por el contrario, su aparición suele ser el resultado de una combinación de factores predisponentes maternos y una peor función cardiovascular secundaria a la sobrecarga cardiovascular del embarazo, que alcanza su punto álgido en este momento. Esto acaba comprometiendo la perfusión placentaria, dando lugar finalmente a la aparición de una PE20.
Según este modelo, pueden emitirse 2 hipótesis diferentes que justifiquen el daño endotelial y la predisposición a la ECV y renal en las mujeres que han padecido una complicación gestacional relacionada con la disfunción placentaria. Según la primera, este riesgo estaría condicionado por las secuelas del disbalance angiogénico producido durante el embarazo y podría afectar a mujeres sin factores de riesgo pregestacionales. El disbalance angiogénico no solo ha demostrado una alteración endotelial, sino otras alteraciones inmunoinflamatorias que juegan un papel a largo plazo sobre la salud cardiovascular de la mujer, no estando claro si se trata de una afectación permanente en la madre (e incluso en sus hijos) o si puede revertir con el paso de los años21,22. Por otro lado, la hiperactividad simpática, la disminución del volumen plasmático y la disminución de la sensibilidad del barorreflejo, que se han observado también en el posparto, se han postulado como alteraciones autónomas que pueden ser causa de una situación de hipertensión arterial posterior23. En la segunda, tanto la disfunción placentaria como la ECV futura estarían condicionadas por factores de RCV preexistentes, sin la influencia de los desequilibrios angiogénicos del embarazo24. Se espera que nuevos estudios de seguimiento e intervención a largo plazo, que tengan en cuenta el papel del desequilibrio angiogénico en el embarazo, nos aclaren la verdadera relación causal entre la disfunción placentaria y la ECV.
Riesgos a largo plazo tras la preeclampsia y otras complicaciones relacionadas con la disfunción placentariaComplicaciones cardiovascularesSe conoce desde los años 60 que la PE es un factor de riesgo para el desarrollo de hipertensión crónica25, pero su asociación con el RCV a largo plazo no se ha evaluado de forma específica hasta la última década26. En 2011, la American Heart Association incluyó en sus guías de prevención cardiovascular la evaluación de la historia obstétrica de la mujer, donde la presencia de trastornos hipertensivos del embarazo supone un factor mayor de RCV, recomendando un seguimiento estrecho en estas mujeres27.
Múltiples estudios han establecido una asociación clara entre la PE y la ECV, sin embargo, no está claro aún el origen de la misma28. Tanto la PE como la aterosclerosis incluyen en su fisiopatología la activación de monocitos y factores inflamatorios que resultan en una disfunción endotelial. Dentro de la propia gestación, también existen una serie de factores moduladores del riesgo de desarrollo posterior de ECV, siendo mayor el riesgo en mujeres en las que se desarrolla la PE a una menor edad gestacional, cursa de forma más severa, y cuentan con al menos una primera gestación de curso normal, siendo el riesgo acumulativo7.
El impacto reportado de la PE sobre la ECV varía en función de los distintos estudios, ya que los periodos de seguimiento difieren y se utilizan distintas definiciones tanto para PE como para el conjunto de entidades que componen la ECV. En la Tabla Suplementaria 1 se resumen los principales estudios.
El riesgo relativo (RR) de desarrollar hipertensión crónica en el futuro varía entre 3,1 y 3,712, con una media de seguimiento tras el parto de 14 años. Las mujeres que han padecido PE en 2 o más embarazos presentan un riesgo hasta 10 veces mayor de necesitar medicación antihipertensiva en el futuro29.
El riesgo de ECV e infarto en mujeres con historia de PE ha sido confirmado en múltiples estudios epidemiológicos. El RR de cardiopatía isquémica es de 1,5-2,2, tras 10 años del parto30.
También se ha observado que los marcadores subrogados de ECV, como el índice de calcificación de las arterias coronarias, están significativamente elevados en mujeres con historia de PE tras compararlas con mujeres sanas pasados 30 años de los embarazos índice31,32.
Otros componentes adicionales de la ECV, como la insuficiencia cardiaca, la enfermedad arterial periférica y la mortalidad por ECV, duplican su riesgo33, observándose también un incremento significativo de la muerte por accidente cerebrovascular en pacientes con antecedentes de PE34. Asimismo, el antecedente de PE incrementa el riesgo de muerte en pacientes con revascularización coronaria, con un RR ajustado de 1,635.
El riesgo de desarrollar diabetes mellitus en mujeres con antecedente de PE llega a duplicarse36, lo cual aún puede acentuar más el RCV de estas pacientes.
En definitiva, la PE supone un factor de riesgo mayor para el desarrollo de cardiopatía isquémica, hipertensión crónica, enfermedad vascular periférica, accidente cerebrovascular y diabetes mellitus poco valorado en la práctica clínica habitual.
Complicaciones renalesLa PE se ha definido como una enfermedad con afectación renal transitoria y reversible en los 3 meses posteriores al parto. Además, las mujeres con enfermedad renal crónica (ERC) presentan un riesgo considerablemente mayor de desarrollar PE. La nefropatía de la PE es considerada como una endoteliosis glomerular que puede dar lugar a una disfunción glomerular expresada como proteinuria y podocituria37. Habitualmente se desconoce si las lesiones endoteliales que se desarrollan durante la PE revierten, porque normalmente no se realiza una biopsia renal tras el parto. También se desconoce si los niveles de sFlt-1, y otros marcadores que se alteran en la PE, como las citocinas inflamatorias y los autoanticuerpos agonistas del receptor de angiotensina ii tipo 1, siguen alterados en algún grado después del parto. Por otro lado, el desequilibrio de la organización del citoesqueleto podocitario podría provocar también una pérdida de podocitos en la orina y una hipertrofia glomerular compensadora, origen de los cambios de la membrana basal glomerular, del incremento de la matriz extracelular y del desarrollo de la glomeruloesclerosis focal que desembocan en la aparición de proteinuria y ERC38–40.
Existe poca información en la literatura sobre el riesgo de desarrollar ERC después de la PE41. Una revisión sistemática de estudios retrospectivos destacó la asociación entre la PE y la microalbuminuria persistente después del parto. Después de una media de seguimiento de 7,1 años después del parto, el 31% de las mujeres con PE desarrollaron microalbuminuria en comparación con el 7% de las mujeres con embarazos sin complicaciones. Las mujeres con PE grave tuvieron un riesgo 8 veces mayor de desarrollar microalbuminuria. No hubo diferencias en los valores de la creatinina sérica o en el filtrado glomerular renal42. Sin embargo, los criterios de inclusión de este estudio requerían un seguimiento mínimo de solamente 6 meses después del parto, siendo un periodo demasiado corto para evaluar el riesgo de ERC o enfermedad renal crónica avanzada (ERCA). Los resultados reportados por otros estudios con un seguimiento a más largo plazo han sido más contradictorios. Estudios clásicos relacionaban directamente la PE con un riesgo 4 veces superior de desarrollar ERCA dentro de los 10 años posteriores al embarazo43. Sin embargo, el estudio holandés Prevention of Renal and Vascular End-stage Disease ?PREVEND?, que analizó la función renal en mujeres con historia de trastornos hipertensivos durante el embarazo, no observó una mayor proteinuria o incidencia de ERC44.
Para evaluar mejor el riesgo renal a largo plazo de la PE, Covella et al. realizaron una revisión sistemática incluyendo estudios con un seguimiento de al menos 4 años. Esta revisión destacó que el RR de padecer una ERCA era significativamente mayor40 en 110.803 mujeres con PE en comparación con 2.680.929 mujeres como grupo control. Sin embargo, no pudieron dilucidar si el riesgo de ERCA estaba relacionado con la presencia de enfermedades subyacentes que pudieran predisponer al desarrollo de la PE o con la propia gravedad de esta. De forma paralela a lo que ocurre con otras ECV, existen importantes limitaciones en estos estudios retrospectivos para identificar el fenotipo de la paciente con PE que tiene más riesgo de desarrollar una ERCA, ya que los factores de riesgo de la ERC y de la PE se solapan45–47.
Para finalizar, en los últimos años han aparecido diversos estudios que asocian el embarazo con diversas formas de microangiopatía trombótica, incluido el síndrome hemolítico urémico atípico. Estos describen una nueva visión de la implicación de la desregulación de la vía alternativa del complemento en la etiopatogenia del síndrome hemolítico urémico atípico y de una forma de PE conocida como síndrome de hemólisis, elevación de transaminasas y trombocitopenia ?HELLP?. En este sentido, se debería considerar al complemento como un nuevo protagonista en la enfermedad vascular por su implicación directa con el endotelio, y de esta forma, considerar sus alteraciones como un nuevo factor de RCV en la mujer gestante48,49.
Detección precoz de la aterosclerosis subclínica y estrategias preventivas en la mujer con antecedente de preeclampsiaLa aterosclerosis sigue siendo también para la mujer uno de los problemas de salud pública más importantes del mundo occidental. La aterosclerosis está influida por la presencia de factores de RCV, incluida la PE, y resulta crítico identificar estrategias para su prevención y diagnóstico precoz. La imagen puede desempeñar un papel clave, identificando placas ateroescleróticas en estadios precoces. Según las guías de práctica clínica, las técnicas más adecuadas son la cuantificación de calcio coronario mediante TAC y la ecografía vascular. Esta última permite identificar la presencia de placas de aterosclerosis en la pared vascular de una forma sencilla, no invasiva y rápida. Se ha demostrado además que la detección ecográfica de placa está asociada con la aparición de ECV50, con igual precisión que la calcificación coronaria detectada por TAC.
En el estudio poblacional Progression of Early Subclinical Atherosclerosis ?PESA? se está estudiando desde hace 10 años a más de 4.000 individuos de 40-54 años de edad con técnicas de imagen para evaluar la presencia y progresión de aterosclerosis en estadios precoces. Se ha observado que cerca del 50% de las mujeres de 40 a 54 años tienen aterosclerosis subclínica, y el 25% presentan 2 o más territorios arteriales afectados51. Incluso en ausencia de factores de RCV, el 40% de las participantes presentan enfermedad subclínica52. Sin embargo, todas ellas tenían un riesgo bajo según el SCORE europeo. Esta falta de precisión de los scores para predecir ECV en la mujer podría estar relacionada con la falta de análisis de sus factores específicos de RCV.
Existe amplia evidencia que demuestra el beneficio de la prevención de la ECV en estadios precoces. Sin embargo, no se ha implementado sistemáticamente, lo que contrasta con el amplio desarrollo del cribado del cáncer de mama, a pesar de que la mortalidad por ECV en la mujer es mucho mayor. Se han logrado avances significativos en la sensibilización de la importancia de la ECV en la mujer americana a través de iniciativas como Go Red for Women, o la campaña Mujeres por el Corazón, de la Sociedad Española de Cardiología, cuyo objetivo principal es sensibilizar a las mujeres sobre la prevención de las ECV y promover hábitos saludables.
Propuesta para la atención integral de la mujer que ha padecido preeclampsiaComo se ha expuesto, la PE supone un factor de RCV y renal que, una vez identificado, debe propiciar una intervención precoz que ataje el desarrollo y progresión de estas enfermedades. Como punto de partida, resulta fundamental resaltar la importancia de identificar correctamente a aquellas mujeres que desarrollan PE durante la gestación. Para ello, se debe insistir en una correcta toma de la presión arterial (PA) en las visitas obstétricas, muchas veces limitada por la falta de tiempo, de material adecuado o por prácticas incorrectas (como, por ejemplo, el uso de manguitos de tamaño incorrecto, la toma de la PA en decúbito o realizar solo una medición). Se debe prestar especial atención a las cifras tensionales, comparándolas siempre que sea posible con las referencias que se tengan del primer trimestre y su trayectoria a lo largo de la gestación53. En caso de que se observe una tendencia al aumento, se deberán vigilar signos o síntomas de PE, y determinar la proteinuria (valiendo una determinación aislada con índice proteína/creatinina). No obstante, es muy importante tener en cuenta que la PE no siempre se presenta con hipertensión y proteinuria, sino que en ocasiones tiene formas de presentación más heterogéneas. Por ello es esencial mantener siempre un alto grado de sospecha54, pudiéndose en estos casos recurrir a la ayuda de los biomarcadores angiogénicos sFlt-1-PlGF para confirmar o descartar el diagnóstico de PE.
A continuación, proponemos una estrategia de seguimiento que se inicia en el periodo del posparto y que acompañará a la mujer a lo largo de su vida. Se basa en la que hemos puesto en marcha en los últimos años para el seguimiento de los casos de PE precoz, y en la que participan obstetras, nefrólogos y cardiólogos (fig. 2).
En primer lugar, se deben establecer estrategias unificadas para el control de la hipertensión y del riesgo tromboembólico en el puerperio. Los obstetras, nefrólogos y médicos de atención primaria deben seguir cuidadosamente a las mujeres que presenten hipertensión tras el parto y estar familiarizados tanto con los tratamientos antihipertensivos compatibles con la lactancia materna como con la necesidad de realizar tromboprofilaxis. En general, se recomienda introducir medicación antihipertensiva siempre que la PA tras el parto sea>140/90mmHg55,56, y se pueden utilizar en primera línea fármacos como enalapril, nifedipino o labetalol, evitando la alfametildopa por su asociación con la depresión puerperal. Hay que realizar un control ambulatorio estrecho de la evolución de la PA, que en la mayoría de las ocasiones permitirá la retirada paulatina de la medicación antihipertensiva. Aquellas puérperas en las que persista la hipertensión a pesar del uso de antihipertensivos en dosis máximas requerirán de estudios complementarios y de un abordaje multidisciplinar con nefrólogos, anestesiólogos y endocrinólogos para establecer un diagnóstico diferencial. El riesgo de tromboembolismo venoso está aumentado en el puerperio (0,3/1.000 embarazos) y aún más tras padecer PE (1,2/1.000 embarazos)57. No hay consenso entre las diferentes guías clínicas sobre cómo realizar la tromboprofilaxis. Nuestra propuesta es utilizar heparina de bajo peso molecular en dosis profilácticas durante las 2 primeras semanas de puerperio tras PE y aumentar a 6 semanas si se trata de una PE precoz (antes de las 34 semanas) o tras PE y cesárea58.
En segundo lugar, es conveniente ofrecer un asesoramiento preconcepcional dentro del primer año tras el episodio de PE o cuando la paciente lo demande, ya que muchas mujeres que han padecido una PE suelen presentar dudas e incertidumbres respecto a su futuro genésico. El riesgo de recurrencia de la PE en siguientes gestaciones se sitúa en aproximadamente el 15%, aunque puede ser mayor si ha aparecido en más de un embarazo, si condicionó un parto pretérmino o si existen enfermedades predisponentes59. Aunque estas cifras puedan resultar desalentadoras, hay que enfatizar que en la mayoría de los siguientes embarazos la PE no ocurre o no se manifiesta de forma grave y que el uso profiláctico de aspirina en dosis bajas (150mg/d en toma nocturna entre las semanas 12 y 36 de gestación) evita más del 60% de las formas precoces de PE60. En aquellas mujeres con antecedente de PE precoz es recomendable realizar un estudio de trombofilias por si también se pudieran beneficiar de la anticoagulación profiláctica. Aunque se ha propuesto prevenir la recurrencia de PE mediante cambios en el estilo de vida, todavía existen importantes lagunas en el conocimiento sobre su posible beneficio61. No obstante, parece razonable recomendar hábitos de vida saludable y derivar al especialista en caso de que se detecten factores de RCV como hipertensión, obesidad, tabaquismo, diabetes o dislipidemia.
Finalmente, hay que abordar el reto de la prevención de la ECV a largo plazo. Dado que la ECV puede tardar décadas en manifestarse tras la PE, la cuestión que se plantea es: ¿cuándo deben iniciarse las acciones de cribado e intervención? En nuestra opinión, hasta los 50 años se podría realizar una aproximación oportunista por parte de médicos de atención primaria y ginecoobstetras, aprovechando las visitas por otras causas para evaluar factores de RCV. A partir de los 50 años resulta recomendable realizar un asesoramiento específico del RCV y renal, implementar las medidas profilácticas o terapéuticas oportunas y establecer visitas de seguimiento, anuales o adaptadas a cada caso (fig. 2).
ConclusionesEl embarazo supone una prueba de esfuerzo cardiovascular que permite obtener información valiosa sobre el futuro RCV de la mujer. Si bien no se ha establecido una clara causalidad entre PE u otras situaciones de disfunción placentaria y el desarrollo de cardiopatía isquémica, hipertensión crónica, enfermedad vascular periférica, accidente cerebrovascular o enfermedad renal, es innegable la asociación entre ellas. Por tanto, es ineludible concienciar tanto a pacientes como a profesionales de los riesgos futuros y apostar por la creación de programas multidisciplinares para el adecuado seguimiento y prevención de la ECV y renal en las mujeres con estos antecedentes obstétricos.
FinanciaciónEl presente trabajo ha sido financiado por el Instituto de Salud Carlos III con el proyecto «Salud cardiovascular en mujeres con antecedente de preeclampsia precoz» (beca PI19/01579), y por la Sociedad Española de Cardiología, mediante una Beca para Proyectos de Investigación Traslacional en Cardiología (beca TP18/0308).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas
- Open access
- Read in English
- Descargar PDF
- Bibliografía
- Material adicional