Aunque los resultados del trasplante renal (TR) han mejorado sustancialmente en los últimos años, continúa observándose una pérdida crónica e inexorable de los injertos debido principalmente a la muerte del paciente y a la disfunción crónica del TR. Por tanto, los objetivos para optimizar esta situación en la próxima década se centran fundamentalmente en minimizar la tasa de pérdida de injertos renales, mejorar la supervivencia de los pacientes, incrementar la tasa de obtención de órganos y su distribución, fomentar la investigación y la formación de los profesionales sanitarios y la elaboración de registros científicos que proporcionen una información clínica y fiable que nos permita optimizar nuestra práctica clínica en el campo del TR. Con esta perspectiva, esta revisión profundizará en: 1) estrategias para evitar la disfunción crónica y la pérdida del injerto a medio y largo plazo; 2) prolongar la supervivencia del paciente; 3) estrategias para incrementar la donación, mantenimiento y distribución de órganos; 4) promocionar la investigación clínica y básica y la actividad formativa en TR; y 5) el análisis de los resultados en TR mediante la optimización y fusión de los registros.
Although the results of kidney transplantation (KT) have improved substantially in recent years, a chronic and inexorable loss of grafts mainly due to the death of the patient and chronic dysfunction of the KT, continues to be observed. The objectives, thus, to optimize this situation in the next decade are fundamentally focused on minimizing the rate of kidney graft loss, improving patient survival, increasing the rate of organ procurement and its distribution, promoting research and training in health professionals and the development of scientific registries providing clinical and reliable information that allow us to optimize our clinical practice in the field of KT. With this perspective, this review will deep into: (1) strategies to avoid chronic dysfunction and graft loss in the medium and long term; (2) to prolong patient survival; (3) strategies to increase the donation, maintenance and allocation of organs; (4) promote clinical and basic research and training activity in KT; and (5) the analysis of the results in KT by optimizing and merging scientific registries.
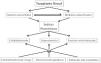
El trasplante renal (TR) representa la mejor alternativa terapéutica en términos de supervivencia para los pacientes con enfermedad renal crónica avanzada1,2, siempre que los pacientes candidatos para TR sean seleccionados adecuadamente. Aunque los actuales resultados del TR han mejorado notoriamente con respecto a épocas previas, sigue observándose la pérdida crónica e inexorable de los injertos aún en las mejores condiciones de partida, como el TR con donante vivo, y la muerte prematura de muchos enfermos con respecto a la población general de similar edad y sexo a pesar de la optimización de la función renal3,4. Por tanto, algunos de los objetivos más acuciantes en el campo del TR para la próxima década se centran en prolongar la supervivencia de los injertos y pacientes e incrementar la actividad de trasplante, mejorando el acceso y la distribución de órganos. Indudablemente, estos objetivos se deben alcanzar a través de la investigación de las incertidumbres clínicas en el campo del TR, de una buena formación del personal sanitario que atiende a estos pacientes y de la recogida y análisis de información clínica y epidemiológica a través de los registros. Obviamente, esto no solo se consigue con una excelente actitud y aptitud de los profesionales en este campo, sino que se debe contar ineludiblemente con el apoyo de las instituciones sanitarias, las sociedades científicas, la Organización Nacional de Trasplantes (ONT) y las estructuras y redes de investigación (fig. 1).
A priori, la práctica clínica diaria nos muestra un escenario clínico desfavorable en el terreno del TR. Independientemente de la elevada mortalidad de los pacientes, otros factores como el incremento paulatino de donantes añosos, la generación precoz de anticuerpos donante-específicos (DSA), la cada vez más frecuente disfunción inmunológica subclínica, la creciente donación en asistolia o la senescencia acelerada de los injertos, podrían ser algunos de los retos que tendrán que ser abordados mediante estrategias multidisciplinares a lo largo de la próxima década con la intención de mejorar los resultados del TR. Por todo ello, para mejorar los resultados en el TR en los próximos años debemos profundizar en los siguientes aspectos: 1) estrategias para evitar la disfunción crónica y la pérdida del injerto a medio y largo plazo; 2) prolongar la supervivencia del paciente; 3) estrategias para incrementar la donación, mantenimiento y distribución de órganos; 4) promocionar la investigación clínica y básica y la actividad formativa en TR; y 5) el análisis de los resultados en TR mediante la optimización y fusión de los registros.
Evitar la disfunción crónica y la pérdida del injertoHemos avanzado sustancialmente en el conocimiento de algunas entidades que potencialmente conducen a la pérdida crónica de los injertos, como el rechazo agudo, pero aun no sabemos con exactitud si la disfunción crónica del injerto (DCI) per se, la cual constituye la segunda causa de pérdida de los mismos tras la muerte del paciente, representa una entidad propia o es producto de un envejecimiento prematuro del injerto secundario a múltiples factores lesivos del mismo tras el implante. Por ello, estrategias diagnósticas y terapéuticas pasadas y emergentes pudieran tener un impacto positivo en la supervivencia de los injertos renales (fig. 2).
En esta línea, la implementación sistemática de las biopsias de protocolo (BP) del injerto, la búsqueda de nuevos biomarcadores serológicos y moleculares de DCI, la identificación de marcadores de senescencia, el diagnóstico de la recurrencia de la enfermedad renal primaria y la detección precoz de la infección por virus BK, así como la aplicación de índices pronósticos, pudieran facilitar la toma de decisiones clínicas y la elaboración de estrategias terapéuticas en aras de mejorar los resultados del TR en términos de supervivencia.
Las BP han permitido demostrar que la inflamación subclínica es muy frecuente (30-40%) tras el TR, aún en pacientes de bajo riesgo inmunológico pre-TR, y esta lesión combinada con fibrosis intersticial y atrofia tubular pudieran mermar la función y la supervivencia del injerto a más largo plazo5–8. Sin embargo, otros autores, utilizando modelos de propensión apropiados, han observado que la supervivencia de los injertos era similar en los enfermos sometidos a BP frente a los que no se les realizaba este procedimiento, tras ocho años de seguimiento9. Por tanto, son necesarios ensayos clínicos controlados que aclaren el beneficio clínico de la realización de BP y el tratamiento de las lesiones inflamatorias subclínicas, especialmente de las lesiones borderline, detectadas a través de las BP. Actualmente, está en marcha un ensayo clínico multicéntrico (Clinicaltrials.gov: NCT04936282) que pretende conocer si el tratamiento de las lesiones inflamatorias borderline con globulina antilinfocítica puede disminuir la aparición de lesiones crónicas y la pérdida de los injertos a medio plazo. De demostrarse un beneficio contundente en la supervivencia de los injertos con la detección y el tratamiento de estas lesiones inflamatorias subclínicas, las BP precoces (tres a seis meses) deberían ser implementadas en la práctica clínica diaria del TR en la próxima década. Asimismo, la detección de lesiones inflamatorias con BP pudiera también ser importante en pacientes con elevado riesgo de disfunción inmunológico post-TR (hipersensibilizados pre-TR, pérdida inmunológica de injerto previo, etc.) o cuando la situación clínica lo requiera en aras de una vigilancia estrecha inmunológica. Estos aspectos, sin duda, despejarían dudas sobre el rendimiento real de la BP en el campo del TR.
Las BP son técnicas invasivas no exentas de riesgos y no todos los grupos las realizan. Por tanto, necesitamos imperiosamente en los próximos años la implementación de biomarcadores para la detección precoz e incruenta de alteraciones inmunológicas o de disfunción precoz del injerto renal en aras de llevar a cabo terapias dirigidas que mejoren la supervivencia de los injertos10,11. En efecto, un punto clave en el manejo de los pacientes con TR es la identificación precoz del daño del injerto antes de que sea irreversible mediante la implementación de biomarcadores en la práctica clínica. Aunque la creatinina sérica y el deterioro de la tasa de filtración glomerular (GFR) hayan sido los biomarcadores más utilizados (a los cuales les debemos gran parte de los éxitos del TR), en la actualidad existe una avalancha de evidencia científica sobre la utilidad de biomarcadores serológicos, tisulares, celulares, moleculares y urinarios, los cuales a través del estudio de la «omicas» (genómica, transcriptómica, proteomica, metabolómica) pudieran permitirnos predecir la evolución de los injertos, conocer los mecanismos patogénicos involucrados en la DCI y personalizar la inmunosupresión. La tabla 1 muestra algunos de los biomarcadores que se han empleado en distintas fases del TR para predecir la función renal retrasada, tolerancia del injerto, daño de isquemia-reperfusión, o la disfunción inmunológica del injerto. Aunque muchos de ellos no se utilizan de rutina en la práctica clínica, su implementación en la próxima década pudiera mejorar, sin duda, los resultados del TR y aproximarnos al ejercicio de una medicina de precisión para tomar las decisiones clínicas más acertadas en este campo.
Algunos de los biomarcadores no invasivos analizados en el trasplante renal
| Pretrasplante | Aplicación clínica | Implementación clínica |
|---|---|---|
| Biomarcadores urinarios derivados de la perfusión del injerto renal (e.g NGAL, acetato, KIM-1, etc.)Vesículas extracelulares | Predecir función renal retrasada y la severidad del daño isquemia-reperfusión | Aun no implementados sistemáticamente en la clínica. Se necesita más evidencia científica de su utilidad |
| Estratificación del riesgo de rechazo post-TR | ELISPOT de células T | Evidencia científica, pero solo implementados en algunos centros de TR |
| ADN libre de células (cfDNA) | Daño isquemia-reperfusión | No usado de rutina |
| Post-trasplante | Aplicación clínica | Implementación clínica |
|---|---|---|
| Creatinina plasmática y deterioro del GFR, determinación del GFR por Iohexol | Supervivencia del injerto, rechazo del injerto | Aplicable en todos los centros de TR |
| Marcadores derivados de la actividad del sistema inmune: | ||
| Quimiocinas urinarias: CXCL9, CXL10, CXCL13 y granzyme | Predictores de rechazo agudo y DCI | No utilizados de rutina en la práctica clínica |
| NGAL (neutrophil gelatinase-associated lipoprotein) sérica | Función renal retrasada | No implementada de rutina en la práctica diaria |
| CD30 soluble | Rechazo agudo | No utilizados de rutina |
| Subpoblaciones linfocitarias (CD14, CD16, monocitos) en sangre y citologías aspirativas del injerto | Rechazo agudo mediado por células T | No empleados de rutina. Solo implementados en algunos centros de TR |
| Detección de anticuerpos anti-HLA por técnica Luminex®Detección incompatibilidades moleculares de HLA-DR/DQ (eplet) | Predictor de rechazo agudo mediado por anticuerpos | Utilizado de rutina en la práctica clínica diaria |
| Transcriptómica en orina: genes CD3ɛ mRNA, CXCL10 mRNA y 18?RNA; MicroRNA circulantes (miR-223-3p, miR-424-3p, miR-145-5p y miRNA-148a)Proteomica y metabolómica urinaria (p. ej., CKD273) | Rechazo agudo mediado por células T y por anticuerpos. DCI (miR-148a) | No utilizados de rutina |
| ADN libre de células (cfDNA) | Predictor de Rechazo agudo, DSA, nefropatía virus BK y toxicidad por ICN | No empleados de rutina |
| Klotho sérico, urinario y tisular | Senescencia del injerto renal | No empleado de rutina |
ADN: ácido desoxirribonucleico; DCI: disfunción crónica del injerto; DSA: anticuerpos donante-específicos; GFR: tasa de filtración glomerular; HLA: antígenos leucocitarios humanos; ICN: fármacos inhibidores de la calcineurina; TR: trasplante renal.
La recurrencia de la enfermedad primaria en el injerto es otro de los grandes retos actuales del TX, lo que explica hasta un tercio de las pérdidas de los injertos12. Muchas glomerulonefritis consideradas de novo post-TX son en realidad recurrencias de la enfermedad primaria glomerular, y no se conocen con exactitud los mecanismos patogénicos que conducen a esta recidiva, ni los factores de riesgo que condicionan una evolución tan desfavorable. En esta línea, el paradigma lo constituye la hialinosis focal y segmentaria (HFS), una entidad que recurre frecuentemente tras el TX (30-50%), especialmente en aquellos pacientes jóvenes que debutan inicialmente con proteinuria masiva, y que pudiera estar generada por mutaciones (30%) en genes específicos (NPHS1, NPHS2, WT1) que afectan a la permeabilidad glomerular13,14. Algunos marcadores urinarios de recurrencia de esta entidad han despertado interés en los últimos años como la Apo A1b modificada. La presencia de esta proteína en orina se ha observado en el 93% de los enfermos que sufrieron una recidiva post-TX de la HFS, mientras que esto solo se observó en el 9% de aquellos con HFS que no presentaron recidivas. Esto confiere a esta proteína una alta sensibilidad y especificidad (93,4 y 91%, respectivamente) para el diagnóstico de recurrencia de HFS. Este sorprendente hallazgo abre una puerta a la esperanza en el manejo post-TX de esta enfermedad15,16. Al mismo tiempo, nos debe hacer reflexionar sobre la conveniencia de potenciar el diagnóstico genético en las unidades de Nefrología.
El diagnóstico precoz de la infección por virus BK puede permitir la reducción de la inmunosupresión y la mejoría de esta entidad en un alto porcentaje de pacientes. La utilización de dosis bajas de fármacos anti-mTOR e inhibidores de la calcineurina (ICN) en ensayos clínicos controlados ha demostrado una menor incidencia de infección BK sin menoscabo de la potencia inmunosupresora17. Esta estrategia pudiera ser extensible a aquellos pacientes que reciban un segundo TR tras la pérdida del primer injerto por esta infección. Al margen de la reducción de la inmunosupresión, no existe una terapia efectiva frente a esta infección. El empleo de brincidofovir ha demostrado ser efectivo para disminuir la replicación viral en células epiteliales humanas18. Por tanto, este fármaco pudiera ser una alternativa de futuro para estos pacientes junto con la administración parenteral inmunoglobulinas.
Tras el TX se produce una pérdida lenta de la función de los injertos. Por tanto, se necesita inexcusablemente la aplicación de índices pronósticos que incluyan factores de riesgo comorbidos y medidas subordinadas de la supervivencia, para estimar con mayor precisión la supervivencia, la calidad del injerto o el riesgo de función renal retrasada (FRR) en aras de tomar las decisiones terapéuticas más acertadas, recomendar estilos saludables de vida e individualizar la inmunosupresión (fig. 3). En este sentido, durante los últimos años se han generado múltiples score de riesgo para perdida del injerto y la FRR que han sido validados interna y externamente, que pudieran ayudar a emprender intervenciones dirigidas que minimicen la tasa de pérdida de injertos tras el TX19,20. En cualquier caso, es posible que sea el momento de implementar las herramientas de la inteligencia artificial (matching learning, redes neuronales, big data) que incorporen infinidad de datos (clínicos, genéticos, factores ambientales y demográficos) para predecir más rigurosamente la evolución de los injertos21,22.
Estrategias terapéuticasDesde la mitad del siglo XX se han desarrollado nuevas estrategias inmunosupresoras dirigidas a disminuir la tasa de rechazos agudos precoces y minimizar las complicaciones relacionadas con el TX con aceptable rendimiento terapéutico. Sin embargo, la supervivencia de los injertos y de los pacientes a más largo plazo no ha llevado un camino paralelo23. En efecto, durante las dos últimas décadas se han ensayado diferentes esquemas terapéuticos para alcanzar tales objetivos sin menoscabo de garantizar la seguridad del paciente (fig. 2). La retirada de esteroides, la minimización o retirada de ICN, la doble minimización de ICN y fármacos anti-mTOR, las nuevas formulaciones de tacrolimus o el empleo de belatacept son algunos ejemplos de estas medidas que pretenden mejorar los resultados del TR a más largo plazo en términos de supervivencia. En este sentido, la retirada precoz de esteroides en pacientes de bajo riesgo inmunológico optimiza el perfil metabólico y cardiovascular, pero esta medida pudiera facilitar la aparición de lesiones crónicas del injerto en los dos primeros años post-TR, especialmente en aquellos enfermos con inflamación subclínica subyacente8. Asimismo, la utilización de dosis reducida de ICN y everolimus ha mostrado ser muy eficaz para prevenir la tasa de rechazos agudos y la aparición de DSA tras los dos primeros años de seguimiento, con una adicional menor tasa de infecciones oportunistas post-TR y potenciales efectos beneficiosos cardiovasculares y antitumorales24. La aplicación de sistemas de predicción proyectada de la supervivencia del injerto (sistema iBOX) ha mostrado que este régimen terapéutico no es inferior a la terapia convencional de un ICN más micofenolato mofetil en términos de supervivencia25. Por tanto, esta estrategia se vislumbra como una alternativa terapéutica segura y eficaz para los próximos años en el campo del TR. La donación tras parada cardiorespratoria constituye en la actualidad el 25-30% de todas las donaciones renales y seguirá incrementándose en los próximos años. Los receptores de estos injertos se podrían beneficiar de recibir inducción (basiliximab o timogobulina), independientemente del riesgo inmunológico. Esto permitiría la administración retrasada de los ICN para minimizar el impacto de la isquemia-repercusión y la función retrasada del injerto. Finalmente, el empleo parenteral de bloqueantes de la co-estimulación como belatacept en pautas sin ICN, ha demostrado que pudiera optimizar la función renal y minimizar la aparición de la disfunción crónica del injerto, al mismo tiempo que garantiza la adherencia terapéutica26. Finalmente, el empleo de tacrolimus de liberación prolongada pudiera permitir un perfil de seguridad similar a otras formulaciones de liberación inmediata sin menoscabo de su potencia inmunosupresora27.
Con todo, estas estrategias terapéuticas se enfrentan en la actualidad a importantes retos clínicos y socio-sanitarios como el desarrollo frecuente de DSA detectados mediante la técnica de Luminex® y la creciente tasa rechazos mediados por anticuerpos, la mayor incidencia de donante longevos, los pacientes más añosos sensibles a los potentes inmunosupresores, o el incremento del gasto sanitario, lo que pudiera poner en peligro la sostenibilidad del sistema sanitario.
¿De qué estrategias disponemos para prolongar la supervivencia de los pacientes?Prolongar la supervivencia del paciente es otro de los grandes retos del TX para los próximos años, a través de minimizar las complicaciones inherentes al TX (cardiovasculares, infecciosas, neoplásicas y metabólicas); implementando documentos de consenso y guías clínicas que ayuden a esta labor; optimizando los múltiples modelos predictivos de supervivencia que se han generado en esta población de riesgo, especialmente en pacientes frágiles; seleccionando y priorizando pacientes en riesgo en lista de espera (LE); y aplicando de nuevas tecnologías para facilitar el manejo clínico de estos enfermos.
Un problema clínico emergente y muy frecuente que condiciona un impacto negativo sobre la supervivencia de los pacientes con TR ha sido la diabetes mellitus post-TR (DMPT). En los últimos años se han diseñado estrategias inmunosupresoras para minimizar esta complicación y se ha profundizado en los mecanismos patogénicos involucrados en el desarrollo de la misma, que descansan básicamente en la inhibición intracelular de la vía m-TOR y la toxicidad de la célula beta pancreática a través de su potencial plasticidad para transformarse en células alfa28–30. Los fármacos inhibidores del co-transportador-2 tubular sodio-glucosa (iSGLT2) y los agonistas del receptor del péptido-1 glucagon-like (GLP-1) han mostrado un claro beneficio cardiovascular y renal en pacientes diabéticos con enfermedad renal crónica31. Por tanto, es esperable que la administración de estos fármacos en los próximos años en enfermos diabéticos con TR pudieran mejorar también el perfil metabólico y cardiovascular de esta población, lo que redundará en unos mejores resultados de la supervivencia. Asimismo, la insulinización precoz tras el TR pudiera prevenir la aparición de la DMPT, pero el precio a pagar puede ser una mayor tasa de hipoglucemias post-TR32. Con todo, se necesitan estudios controlados en estos enfermos que aporten evidencia científica robusta para su implementación clínica.
Asimismo, se han elaborado documentos de consenso y guías clínicas entre sociedades científicas y de redes de investigación para el manejo de las complicaciones infecciosas oportunistas más frecuentes y su prevención en estos enfermos que pudieran contribuir sin duda a incrementar la supervivencia en los pacientes trasplantados en la próxima década33–35. Las recientes lecciones aprendidas del impacto que generó la pandemia por COVID-19 en los pacientes con TX, también hará que en un futuro cercano tomemos las medidas terapéuticas y profilácticas oportunas frente a otras pandemias venideras con el consenso multidisciplinar de otras sociedades científicas.
La predicción de la supervivencia mediante la adecuada incorporación de factores comorbidos y medidas subordinadas en modelos predictivos puede contribuir a tomar las mejores decisiones terapéuticas y mejorar la supervivencia, especialmente en pacientes de riesgo elevado e intermedio. En los últimos 15 años se han elaborado múltiples modelos predictivos, los cuales predicen la mortalidad con elevado índice de concordancia, y todos han sido validados interna o externamente en otras poblaciones19,36. Recientemente, se ha desarrollado un score de predicción de infecciones post-TX a través de simples variables clínicas que facilitará el manejo clínico de estas complicaciones en los primeros meses post-TX37. Adicionalmente, si estos modelos predictivos se elaboran a través de herramientas de inteligencia artificial, incorporando en los diferentes modelos múltiples datos del proceso del TX, obviamente, se optimizará la capacidad de predicción de la supervivencia de los pacientes, lo cual ayudará a establecer esquemas terapéuticos encaminados a disminuir la mortalidad post-TX.
A pesar de la intensa actividad de TR a lo largo del mundo, las LE para TR permanecen estables con el paso de los años38. La mortalidad de los enfermos en LE no es despreciable (8-10% año) y esta se incrementa sustancialmente en los pacientes longevos con mayor comorbilidad39. Por tanto, identificar a los pacientes en riesgo de muerte en LE pudiera contribuir a priorizar a estos pacientes para recibir un injerto renal y, consecuentemente, ayudar a mejorar la supervivencia. En esta línea, en un estudio europeo realizado en 3.857 pacientes listados para TX entre 1984-2012, se elaboró un modelo de riesgo compuesto que incluía cuatro variables clínicas (edad>50 años, la presencia de un catéter central al inicio de la diálisis y un índice de Charlson>3), usando modelos estadísticos robustos como el análisis de riesgos competitivos para predecir la mortalidad de estos pacientes, de manera que el riesgo de muerte se incrementaba significativamente en cada nivel de riesgo40. Indudablemente, la futura aplicación de métodos de inteligencia artificial también mejorará sustancialmente la capacidad de predicción en estos pacientes.
Por otra parte, la detección de la fragilidad en los enfermos en LE para TR pudiera ser también muy útil en la práctica clínica para identificar pacientes en riesgo de muerte precoz y optimizar su situación en LE mediante programas de prehabilitación multidisciplinar desarrollados para tal fin que incluyen fisioterapia, medidas nutricionales y apoyo psicológicos durante el periodo de LE. Estos programas pudieran mitigar los efectos de la fragilidad y la mala condición física post-TR, y con ello mejorar los resultados de supervivencia en estos enfermos41,42. Finalmente, la identificación de pacientes en LE en riesgo de desarrollar DMPT pudiera ser también una medida adicional para evitar, no solo la comorbilidad, mientras permanecen en LE, sino durante su evolución post-TR.
Todo ello, nos lleva a la reflexión sobre el aprovechamiento de nuevas tecnologías en el campo del TR a semejanza de otros países de nuestro entorno, como la consultoría virtual, el desarrollo de aplicaciones informáticas para garantizar la adherencia, el cumplimiento terapéutico y las interacciones medicamentosas, la generación de dispositivos electrónicos para la monitorización y control en LE o institucionalizar sistemáticamente la consulta de enfermedad renal crónica avanzada para optimizar el manejo de los pacientes con función renal muy deteriorada antes de la realización del TR. En efecto, en pacientes con pérdida importante de la función del injerto, el manejo adecuado de la inmunosupresión y las comorbilidades asociadas a la enfermedad renal crónica pudiera disminuir la mortalidad de esta población mientras esperan una segunda oportunidad de TR43,44.
¿Cómo podemos incrementar la obtención de órganos y mejorar su asignación?Se hacen muchos trasplantes renales en el mundo. Concretamente, según los datos del Global Observatory on Donation and Transplantation (GOTD) en el 2019, se realizaron en el mundo más de 100.000 TX de los cuales el 37% fueron TX con donante de vivo, pero esto solo cubriría el 10% de las necesidades actuales de TX a nivel mundial. Por tanto, se necesita imperiosamente aumentar la actividad de TX a través de potenciar la donación en asistolia, incrementar el TX con donante de vivo, promocionar el TX anticipado, así como mejorar la política de intercambio de órganos y optimizar herramientas clínicas e histológicas para el descarte de órganos. Expongamos algunos argumentos que apoyan estas estrategias.
Un reciente estudio observacional multicéntrico realizado en Inglaterra, que revisó una década de experiencia con donación en asistolia, demostró que no hubo diferencias ni en la supervivencia del injerto ni en la supervivencia del paciente entre la donación de muerte encefálica y la donación tras la parada cardiaca tipo III tras 10 años de seguimiento, lo cual abre una puerta más para ampliar el pool de donantes en nuestros pacientes e incrementar la actividad de TX45.
El TR con donante vivo ofrece mejores resultados que el TR con donante fallecido como se ha demostrado en diferentes estudios observacionales46. Sin embargo, la actividad de TR con donante vivo no se ha modificado sustancialmente en los últimos años. Por el contrario, se ha observado un descenso preocupante de esta actividad, incluido nuestro país. Ante este escenario se creó un grupo de trabajo formado por diferentes equipos de TR de la geografía nacional, expertos en TR de la Sociedad Española de Nefrología (S.E.N.), de la Sociedad Española de Trasplante (SET) y la ONT. Este grupo diseñó un cuestionario de autoevaluación sobre la actividad de TR con donante vivo que fue cumplimentado por las 33 unidades de TR de donante vivo activas en España, con la intención de identificar potenciales causas que condicionaran el descenso de la actividad de este tipo de trasplantes en España y su posible relación con la gestión del proceso de donación de vivo. De esta manera, se identificaron debilidades, amenazas, fortalezas y oportunidades (análisis DAFO) de esta actividad, que han permitido elaborar recomendaciones específicas dirigidas a mejorar cada una de las fases del proceso de donación en vida47. Cabe esperar que este documento pudiera contribuir a mejorar la actividad del TR con donante vivo en nuestro país.
Por otra parte, dado el riesgo de mortalidad que imprime la permanencia en diálisis, el TR anticipado puede optimizar los resultados en términos de supervivencia en aquellos enfermos en los que se prevea larga permanencia en diálisis (grupo sanguíneo B, jóvenes, hipersensibilizados, etc.). En este sentido, un estudio observacional realizado a través de la base de datos del registro francés de trasplantes de órganos con más de 22.000 pacientes, mostró que el TR anticipado ofrece mejor supervivencia que permanecer en diálisis, incluido periodos cortos de tiempo (< 6 meses)48. Presumiblemente, esto pudiera aclarar muchas dudas sobre la conveniencia de priorizar esta actividad ante cualquier tiempo de permanencia en diálisis.
Las LE han incrementado en muchos países de nuestro entorno y, como era de esperar, esto aumenta la morbi-mortalidad de los pacientes candidatos a un TR. Por tanto, los sistemas de asignación pudieran ayudar a garantizar la utilidad de los injertos y la equidad en el acceso a los mismos, lo que redundaría en una reducción del número de pacientes prevalentes en LE. Aunque se han identificado escalas dicotómicas para una correcta asignación como la presencia o no de donante expandido o la cuantificación de pacientes hipersensibilizados mediante la determinación del panel reactive antibodies (PRA), las escalas continuas como el Kidney Donor Profile Index (KDPI) o el cálculo del Estimated Post-Transplant Survival (EPTS) pudieran mejorar la selección y asignación de órganos49,50. Con todo, estos sistemas de asignación tienen moderada capacidad para discriminar entre similares donantes, lo cual puede conducir a imprecisiones en la asignación. Es por ello, que sofisticados programas de matching entre donante-receptor constituyen nuevos retos de futuro que pudieran incrementar la disponibilidad de los injertos y la equidad en la asignación tras la donación.
En la figura 4 se propone un algoritmo para la asignación de órganos, tratamiento inmunosupresor y seguimiento posterior en pacientes en LE, combinando el nivel de sensibilización humoral y celular frente a los antígenos leucocitarios humanos (HLA), y el grado de incompatibilidad HLA entre donante-receptor, a partir de las evidencias científicas que indican los diferentes grados de riesgo inmunológico post-TR51–53. La sensibilización humoral se evaluará mediante el PRA; la sensibilización celular se determinará mediante el ensayo ELISPOT, y la incompatibilidad HLA utilizando tanto el nivel antigénico como el molecular. A título de ejemplo, un paciente con un PRA negativo más un ensayo ELISPOT negativo junto con un grado de incompatibilidad bajo, sería susceptible de una terapia inmunosupresora disminuida. Las restantes combinaciones de la estratificación propuesta nos indicarían los regímenes de inmunosupresión y el seguimiento post-TR más apropiado acorde al algoritmo propuesto. Asimismo, en receptores con PRA>90% que no encuentran donantes en programas de intercambio, en presencia de un DSA, sería también recomendable valorar el tratamiento desensibilizante pre-TR (plasmaféresis, imlifidasa, inmunoglobulinas, etc.). Independientemente de la valoración del riesgo inmunológico, la implementación de otros algoritmos en función del binomio edad donante-receptor o las características de donante y receptor también podrían facilitar la asignación de órganos para TR y con ello, mejorar los resultados de supervivencia.
Algoritmo para la asignación de injertos, esquema inmunosupresor y monitorización post-TR acorde al riesgo inmunológico pre-TR.
DSA: anticuerpos anti-HLA donante específicos; IS: inmunosupresión; PAR: anticuerpos reactivos frente al panel; TR: trasplante renal.
aBaja inmunosupresión incluye tacrolimus más micofenlato mofetil o dosis minimizadas de tacrolimus y everolimus, o monoterapia con tacrolimus, sin inducción ni prednisona de mantenimiento.
bModerada inmunosupresión: prednisona, tacrolimus y micofenolato mofetil o ácido micofenólico con o sin inducción con basiliximab. Como alternativa prednisona y dosis reducidas de tacrolimus y everolimus.
cIntensa inmunosupresión: Inducción con timoglobulina o Grafalón® más triple terapia prednisona, tacrolimus y micofenolato mofetil o ácido micofenólico.
dSeguimiento convencional post-TR acorde a las características del centro y del paciente
eLlevar a cabo de manera individualizada la vigilancia de la adherencia terapéutica, biopsias de protocolo y uso de biomarcadores específicos de disfunción inmunológica.
Finalmente, las estrategias de inducción de tolerancia, el desarrollo de la nanomedicina, la generación de órganos bioartificiales a través de la edición y clonación de genes para optimizar el xenotrasplante, la terapia celular mediante macrófagos reguladores o la utilización de stem cells para la obtención de órganos funcionantes, son algunas de las apasionantes estrategias de futuro para incrementar el pool de órganos y reducir las LE de nuestros pacientes54,55. Con todo, estos procedimientos tienen ventajas y limitaciones, y muchos están en fases de experimentación alejadas aun de la aplicación en humanos. Por ello, necesitamos un trabajo multidisciplinar y un esfuerzo colectivo para que esto se convierta en realidad en la década futura.
Investigación y formación de los profesionales sanitarios en trasplante renalInvestigaciónNuestro país está a la cabeza de la actividad trasplantadora en el mundo, pero la actividad investigadora clínica y básica en el campo del TR no lleva un camino paralelo, como ocurre en otros países europeos de nuestro entorno. En esta línea, desde el Instituto de Salud Carlos III (ISCIII) se ha promocionado e incentivado la investigación en las enfermedades renales, a través de la creación de las Redes de Investigación, donde se inició su recorrido la Red de Investigación Renal (RedInRen), la cual contemplaba dos grandes programas desde su financiación por el ISCIII: la enfermedad renal crónica y el trasplante renal. Concretamente, el programa de TR lo constituían 16 grupos de TR con investigadores clínicos y básicos repartidos por toda la geografía nacional, que desarrollan una importante actividad investigadora condensada en tres grandes bloques de trabajo. Estos bloques o paquetes de trabajo (workpackge) están coordinados por sus líderes respectivos y aglutinan la investigación puntera en el terreno clínico y básico del TR. La inmunosupresión personalizada, la evaluación de la respuesta humoral y el estudio de las complicaciones post-TR representan la cabecera de la mayor parte de la investigación que se realiza en España en el campo del TR a través de la RedInRen. Actualmente, el ISCIII ha reformulado recientemente las antiguas Redes de Investigación transformándola en Redes de Investigación Cooperativa Orientadas a Resultados en Salud (RICORS) donde, obviamente, se han incorporado los grupos de investigación de las enfermedades renales que han pertenecido previamente a la RedInRen, incluidos aquellos grupos con líneas más específicas en el campo del TR56. Al margen de las iniciativas individuales y de las Redes de Investigación, la investigación médica española también se vehiculiza a través de los Institutos de Investigación dependientes del ISCIII que dan cabida a numerosos grupos pertenecientes a los mismos y que, a través de las instituciones sanitarias o de las universidades correspondientes, llevan a cabo una intensa y prolífica actividad investigadora en el campo de las enfermedades renales y el TX.
Formación permanente de los profesionales sanitariosPotenciar la formación en trasplante es otro de los grandes retos para la próxima década en el campo del TX a través de cursos formativos, talleres en metodología y estadística, espacios para la formación del personal sanitario en reuniones científicas y congresos, becas de formación o estancias en centros de excelencia, pero obviamente para alcanzar este objetivo se necesita inexcusablemente el apoyo de la industria farmacéutica, las sociedades científicas y la administración sanitaria. La Sociedad Española de Trasplante (SET) está comprometida con este cometido desde sus orígenes y prueba de ello lo constituye el proyecto Prometeo, el cual está dedicado a profundizar en los temas claves del TR donde participan diferentes grupos nacionales con intensa actividad en TR para generar evidencia, especialmente en aquellos apartados donde existe un vacío de conocimiento.
Optimizar la recogida de la información mediante registrosEn general, los registros de una actividad médica o quirúrgica aportan datos clínicos y epidemiológicos esenciales para conocer el estado de salud de la población y la calidad y el coste de los servicios médicos, orientando a los gestores sanitarios a establecer prioridades y estrategias específicas en la planificación sanitaria de diferentes entidades clínicas, incluido el TR57–61. En efecto, los registros nos permiten observar la práctica clínica real, nos aportan datos clínicos y epidemiológicos esenciales (incidencia, prevalencia, supervivencia), así como indicadores de calidad y proporciona información y asesoramientos a agencias sanitarias, incrementando el nivel de evidencia62–65. Representan, por tanto, una actividad científico-asistencial que contribuye a mejorar los resultados en cualquier área de la Medicina, incluido el TR.
Existen algunas cuestiones esenciales en el campo del TR como los resultados de supervivencia, la actividad del TR donante vivo, las políticas de obtención de órganos y las estrategias de distribución de los mismos, o las políticas de priorización de pacientes en LE para TR, que solo se pueden contestar adecuadamente si tenemos una información precisa y veraz recogida en los registros, dado el largo tiempo requerido para la obtención de los end-point clínicos y el elevado consumo de recursos que requieren. Muchos registros internacionales y nacionales de TR proporcionan una información muy útil sobre aspectos esencialmente epidemiológicos como el número de pacientes en LE, las características de los donantes o el volumen de TR realizados, pero no todos aportan información pormenorizada sobre los resultados del TR en términos de supervivencia o sobre el rendimiento de los programas de TR. En esta dirección, los registros científicos y epidemiológicos tienen la obligación de proporcionar información sobre la trayectoria de los programas de TR y los datos de supervivencia, evitando con ello controversias derivadas de publicaciones específicas de algunos programas66. Con estas premisas, los informes de los registros de TR pueden ser utilizados con garantías y credibilidad por las agencias reguladoras, centros de TR, compañías de seguros, asociaciones de pacientes e instituciones sanitarias. Por ejemplo, gracias a la información recogida en los registros hemos podido conocer el verdadero alcance clínico y epidemiológico que ha originado la pandemia por COVID-19 en los pacientes renales, incluidos los pacientes en LE y con TR, a lo largo del mundo67–71. Pero, indudablemente, para alcanzar algunos de estos objetivos, los registros deben de elaborarse a través de procesos sistemáticos estandarizados y ajustarse a las normas de calidad establecidas con el empleo de potentes y fiables herramientas estadísticas. En otras palabras, necesitan inexcusablemente análisis estadísticos apropiados y potentes en aras de generar datos clínicos fehacientes. Es este sentido, es recomendable seguir una guía (checklist) con los pasos a seguir para el análisis adecuado de registros y estudios observacionales, especialmente cuando se utilizan modelos de regresión. Esto puede constituir una herramienta muy útil para el análisis e interpretación de los registros72.
Por otra parte, los registros pueden incrementar el nivel de evidencia complementándose con los ensayos clínicos, los cuales tienen en ocasiones importantes limitaciones de índole poblacional para proporcionar conclusiones contundentes. Esto sin duda, puede proyectar a los registros a la escala jerárquica más alta de la evidencia. Actualmente, existe una pléyade de ejemplos de grandes publicaciones científicas en todo el mundo derivada de registros nacionales, especialmente del registro americano, que detectan problemas de salud y factores de riesgo para la supervivencia de injertos y pacientes con TR38,40,59,60,73.
En nuestro país contamos con registros muy valiosos, como el de Donación y Trasplante de la ONT, los registros autonómicos de diálisis y TR y los registros de trasplantes de las diferentes sociedades científicas, los cuales han resultado muy útiles a la comunidad científica de nuestro país. Sirva como ejemplo la valiosa información aportada por el registro de la ONT-SEN sobre los aspectos epidemiológicos y evolutivos de los pacientes renales, incluidos los enfermos con TR, que sufrieron recientemente el azote de la pandemia por COVID-1969. Sin duda, la integración de los diferentes registros de trasplantes de la comunidad científica de un país pudiera incrementar la calidad y credibilidad de los mismos. Por otra parte, cuestiones de carácter socio-sanitarias o administrativas que conlleven la fragmentación de los registros científicos de un país, pudieran debilitar la validez y contundencia de los mismos. El empleo de sistemas diferentes o incompatibles en la recogida de información y un ingente consumo de tiempo y recursos apoyan la debilidad de esta estrategia y no garantizan la precisión ni la cumplimentación de los datos. Por tanto, se hace absolutamente necesaria la integración de toda la información en un registro único liderado y custodiado por la ONT, donde participen los integrantes de registros autonómicos y las sociedades científicas, que garantice una información fiable y creíble a la comunidad científica y a la población general. En paralelo, esto puede permitir comparaciones epidemiológicas entre comunidades y otros registros internacionales.
ConclusionesEn la próxima década debemos de afrontar algunos retos para mejorar aún más, si cabe, los resultados del TR en términos de supervivencia.
Algunas estrategias para reducir la tasa de pérdida de los injertos y reducir la mortalidad en LE y tras el TR pudieran contribuir a prolongar la supervivencia de estos enfermos.
El incremento de la actividad del TR con donante vivo, la donación en asistolia, el trasplante anticipado y en un futuro no muy lejano, la generación de órganos bioartificiales a través de la edición-clonación de genes o la terapia celular pudieran garantizar la utilidad de los injertos y la equidad en el acceso a los mismos, lo que permitiría una reducción del número de pacientes en LE.
La investigación de excelencia en el campo del TR y una adecuada formación de los profesionales sanitarios facilitaría la implementación de estrategias para mejorar los resultados de supervivencia.
Los registros de TR son de mucha utilidad porque nos permiten identificar factores de riesgo en esta población y facilitan contrastar la información con otros registros nacionales e inter-nacionales, pudiendo contribuir a establecer estrategias que mejoren los resultados del TR.
FinanciaciónEste estudio fue apoyado en parte por el Ministerio de Economía, Industria y Competitividad de España del Instituto de Salud Carlos III (FIS PI17/02043), cofinanciado por el Fondo Europeo de Desarrollo Regional-FEDER, RETICS (REDINREN, RD16/0009, RD16/0009/0006).
Conflictos de interésLos autores declaran no tener ningún conflicto de intereses.