Sr. Director:
La poliquistosis renal autosómica dominante (PQRAD) es una enfermedad hereditaria producida por mutaciones en los genes pkd1 y pkd2 que codifican las poliquistinas 1 y 21. La enfermedad suele progresar más rápidamente en los pacientes con afectación del pkd1, aunque existe gran variabilidad interindividual, incluso dentro de una misma familia. Es más, la progresión en un mismo paciente no es lineal y en ocasiones puede acelerarse. Entre las explicaciones para esta variabilidad fenotípica se contempla la existencia de mutaciones de diversa gravedad, la carga genética del individuo, la necesidad de un segundo hit genético y el impacto de factores ambientales o tercer hit2. De la hipótesis del segundo hit se deduce que la enfermedad poliquística es fenotípicamente dominante pero molecularmente recesiva, de tal manera que, para que una célula tubular origine un quiste, es precisa una segunda mutación somática en el segundo gen pkd1 o pkd2, además de la mutación genética heredada. Con respecto al tercer hit, existe evidencia en modelos animales de que la inflamación puede contribuir a la progresión de la cistogénesis. El factor de necrosis tumoral (TNF), la citoquina proinflamatoria por excelencia, disminuye la expresión de poliquistina 2 en ratones3,4. Comunicamos la evolución de la función y del volumen renal en un paciente con PQRAD tratado durante más de un año con anticuerpos neutralizantes anti-TNF por otra enfermedad.
CASO CLÍNICO
Varón de 35 años diagnosticado de espondilitis anquilosante HLA B27 positiva en 2011. Una ecografía abdominal mostró múltiples quistes hepáticos y renales. Riñón derecho de 18 cm e izquierdo de 19 cm. Ante ausencia de historia familiar de enfermedades quísticas, se diagnostica de enfermedad poliquística por mutación de novo.
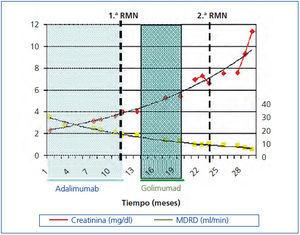
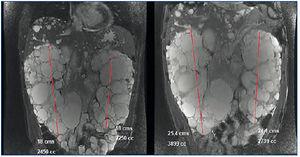
En marzo de 2011 inicia tratamiento con adalimumab (Humira®) 40 mg cada 15 días. En ese momento presenta: hemoglobina (Hb) 12,4 g/dl, creatinina (Cr) 2,3 mg/dl, filtrado glomerular estimado (FGe) MDRD (Modification of Diet in Renal Disease) 34 ml/min/1,73 m2, proteinuria de 10 mg/dl. En septiembre de 2011 muestra: Cr 3,24 mg/dl, FGe MDRD 23 ml/min/1,73 m2, proteinuria 1,78 g/24 h (figura 1). Se suspende el tratamiento en enero de 2012 por el desarrollo de polineuropatía y púrpura. En febrero de 2012 una resonancia magnética nuclear (RMN) demuestra riñón derecho de 18 cm (volumen de 2450 ml) y riñón izquierdo de 18 cm (2250 ml). En abril de 2012 se inicia Golimumab (Simponi®) 50 mg cada cinco semanas. Se administran seis dosis y se suspende en septiembre de 2012, al referir el paciente un llamativo aumento del diámetro abdominal y hernia umbilical que se relaciona directamente con la administración del fármaco. En diciembre de 2012 se administra una última dosis. En marzo de 2013, una nueva RMN demuestra riñón derecho de 25,4 cm con un volumen de 3899 ml y riñón izquierdo de 24,1 cm con un volumen de 2739 ml (figura 2) y discreto aumento en mucha menor cuantía de los quistes hepáticos.
DISCUSIÓN
La PQRAD no tiene un tratamiento específico. Sin embargo, se están estudiando varias aproximaciones terapéuticas diseñadas a partir de hallazgos en modelos experimentales y de observaciones clínicas. El ensayo TEMPO 3:4 observó que tolvaptán reducía la velocidad de crecimiento de los quistes y la pérdida de filtrado glomerular5. Previamente se había observado que los vaptanes enlentecían la progresión de la cistogenesis murina6. En ensayos clínicos el inhibidor de mTOR (mammalian Target of Rapamycin) sirolimus no detuvo el crecimiento de los quistes renales y everolimus disminuyó la velocidad de crecimiento, pero no el deterioro de la función renal7,8. De nuevo el racional partió de estudios preclínicos en animales9. El ensayo ALADIN demostró que la somatostatina de larga duración enlentecía el crecimiento de los quistes10. La elección de la somatostatina se basó en un caso clínico. Una mujer con PQRAD recibió tratamiento con somatostatina para un adenoma hipofisario y mejoró su nefropatía quística11. En este sentido, observaciones en un solo paciente pueden orientar sobre la posible utilidad de una maniobra terapéutica. En ratones pkd2 +/- el TNF aumentó la cistogénesis y el etanercept la redujo3. El TNF disminuyó la poliquistina 2 funcionante por debajo de un umbral crítico, como consecuencia del incremento de expresión de la proteína FIP23. Resulta así de particular interés la evolución del paciente que reportamos durante el tratamiento con anti-TNF para una enfermedad concomitante. Durante este período la PQRAD progresó rápidamente. El FGe cayó con una pendiente de –1,1 ml/min/mes de forma homogénea en el tiempo (y el volumen de los riñones aumentó una media de 71 % [1938 ml]). Esta velocidad de progresión es muy superior a la de los pacientes tratados con placebo en ensayos clínicos recientes (tabla 1)5,7,8,10,12. En contra de la observación experimental3 y de la esperanza puesta en la posible eficacia de las terapias anti-TNF4, no hubo evidencia de efecto terapéutico, al menos en este estadio de la enfermedad. Al tratarse de un solo caso clínico, no es una observación definitiva. De hecho, se puede argumentar que la existencia de una enfermedad inflamatoria sistémica pudo contribuir a acelerar la enfermedad. Sin embargo, el tratamiento anti-TNF fue efectivo para controlar la actividad de la espondilitis anquilopoyética.
En conclusión, comunicamos el caso de un paciente con PQRAD tratado con anti-TNF por una enfermedad reumatológica concomitante, cuya enfermedad renal progresó rápidamente. Este caso clínico argumenta en contra de la eficacia de los anti-TNF para tratar la PQRAD humana.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Aumento del volumen renal en pacientes asignados al grupo placebo en grandes estudios observacionales y ensayos clínicos y en el paciente reportado
Figura 1. Evolución de la función renal a lo largo de 29 meses.
Figura 2. Imagen comparativa del tamaño renal en las resonancias magnéticas nucleares de 2012 (izquierda) y 2013 (derecha).