Sr. Director:
La aparición de un púrpura de Henoch-Schönlein (PHS) postrasplante es poco frecuente y está descrito como una recidiva1,2. Existen pocos casos descritos de un PSH de novo postrasplante3. La recidiva de la glomerulopatía es la tercera causa de pérdida del injerto después de 10 años de trasplante4. Reportamos el caso de un paciente con antecedentes de macrohematuria y glomerulopatía, que a los 2 años del trasplante presentó púrpura vascular, dolor abdominal y alteraciones urinarias. Se discute la indicación de la biopsia renal, su resultado, la conducta terapéutica y la evolución.
CASO CLÍNICO
Hombre de 61 años, de raza blanca. Macrohematuria e hipertensión arterial después de infección orofaríngea a los 21 años. Punción biópsica renal (PBR) a los 31 años, en Australia (desconoce resultado). En diciembre de 2006, a los 57 años, inicia diálisis peritoneal.
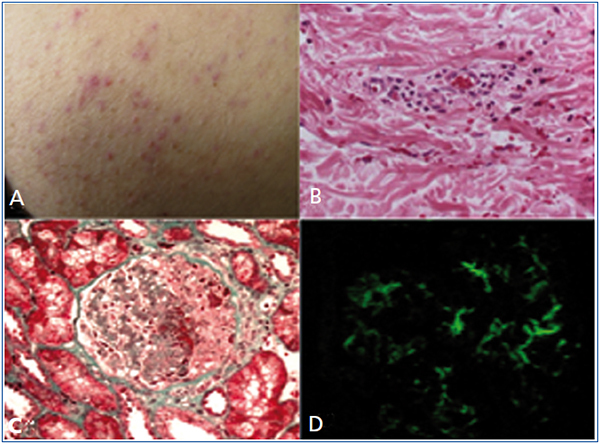
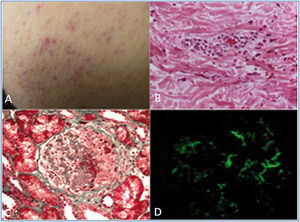
En abril de 2008 recibe trasplante renal de donante cadavérico. Creatininemia al alta de 0,8 mg/dl y sin proteinuria. Inmunosupresión: ciclosporina, micofenolato mofetilo (MMF) y prednisona. A los 26 meses del trasplante, aparece tos seca, sensación febril, dolor y distensión abdominal. Previamente al ingreso nota pápulas eritematovioláceas en miembros inferiores y glúteos. Al examen: faringe congestiva. Pápulas de 1 a 3 mm, eritematovioláceas, que no desaparecían a la compresión en muslos, glúteos y plantas (figura 1 A). Dolor a la palpación de epigastrio. Injerto sin dolor ni aumento de su tamaño.
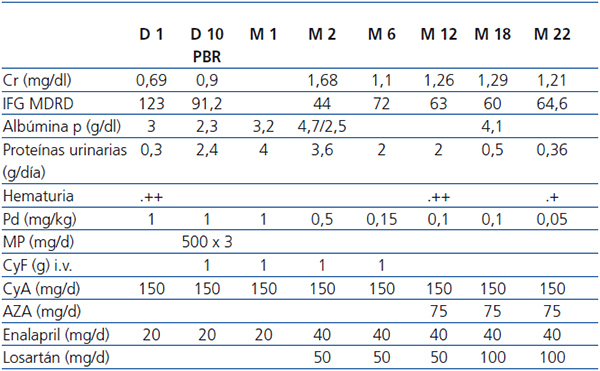
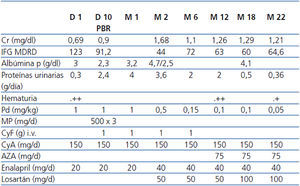
Los datos de laboratorio se resumen en tabla 1. Negativo para virus de la hepatitis B y C, virus de la inmunodeficiencia humana, anticuerpos antinucleares y anticuerpos anticitoplasma
de neutrófilo. Complemento normal. Sangre oculta en heces por método inmunológico positiva.
La presentación clínica sugiere un PHS. Se realiza biopsia de piel (figura 1 B), siendo la inmunofluorescencia negativa. Se produce aumento progresivo de proteinuria, por lo que se realiza PBR que muestra: glomerulonefritis proliferativa intra y extracapilar con semilunas celulares y fibrocelulares, en su mayoría segmentarias (figura 1 C), que afectan 14/25 glomérulos. Focos de necrosis y leucocitoclasia (figura 1 D). Depósitos mesangiales y pericapilares de IgA predominante.
De acuerdo con las pautas nacionales (www.nefroprevencion.org.uy), se inicia tratamiento con bolos de metilprednisolona 1 g/d x 3 y ciclofosfamida 15 mg/k, mensual x 6, continuando con prednisona 1 mg/k. Se mantuvo ciclosporina 2 mg/k/d y se suspendió MMF. La evolución se muestra en la tabla 1.
A los 22 meses de la aparición de PHS, creatininemia de 1,21 mg %, proteinuria 0,32 g/d, hematíes + en orina.
Moroni et al.1 y Han et al.2 describen un riesgo de recurrencia de PHS, que varía entre 0 y 61 %, con mayor recurrencia en donante vivo emparentado.
Thervet et al.5 describen en nefropatía por inmunoglobulina A (NIgA) la recurrencia histológica (depósitos de IgA) al año de trasplante en 69 % de los individuos.
Shimizu et al.3 describen un caso de glomerulonefritis extracapilar IgA postrasplante. La presencia de dolor abdominal les sugirió PHS atípico. Salvo esta referencia de diagnóstico dudoso, no está descrita la aparición de novo de PHS postrasplante. En el caso referido, la ausencia de púrpura previa al trasplante sugiere una aparición de novo del PHS.
Araque et al.6 publicaron en 1995 el primer caso de aparición de PHS en paciente no trasplantado, años después del diagnóstico de NIgA. En nuestro caso, la historia previa es sugestiva de NIgA y actualmente presenta un PHS.
La recurrencia del PHS tiene peor pronóstico: 50 % de pérdida del injerto a los 30 meses con respecto a la recurrencia de la NIgA (11 %)2.
El PHS en adultos es más severo y su pronóstico es peor que en los niños. La serie reportada por Pillebout et al.7 (250 casos) refiere que el 25 % de los adultos alcanzan la insuficiencia renal extrema. La función renal inicial y el grado de proteinuria son marcadores de mal pronóstico, así como la necrosis glomerular, y elementos de cronicidad7. Nuestro caso mostraba intenso componente inflamatorio, semilunas celulares y necrosis en más del 50 % de los glomérulos. Soler et al.8 refieren que el empeora el pronóstico renal disminuye la presencia de semilunas.
La discordancia clínica e histológica advierte de la necesidad de contar con PBR en todo paciente adulto que tenga mínimo compromiso renal en el marco del PHS.
En cuanto al tratamiento, la imunosupresión del trasplante no impidió la aparición del PHS. Esto es coincidente con la literatura2,9,10.
Si bien el tratamiento en el PHS es controversial, series pequeñas han mostrado beneficio en el tratamiento agresivo de estos pacientes. Sin embargo, el trabajo de Pillebout publicado en setiembre de 201011, después de que nuestro paciente fuera tratado, plantea que la ciclofosfamida no ofrece un beneficio adicional. En esta serie tenían proliferación extracapilar entre el 37 y el 27 % de los pacientes en cada grupo de tratamiento. Nuestro paciente tenía lesiones activas más severas. El mantenimiento se realizó con azatioprina, dada la escasa utilidad descrita del MMF en la NIgA12,13. Asistimos a una reducción progresiva de la proteinuria, que actualmente es menor de 0,5 g/d, manteniendo una función renal estable.
Los hechos destacables de este caso clínico son:
1. La presentación de novo de un PHS postrasplante a pesar de la medicación inmunosupresora.
2. La necesidad del estudio histológico precoz, dada la discordancia clínico-patológica.
3. La controversia sobre el tratamiento a realizar, conociendo que la evolución del PHS en adultos no es favorable, y que la realización de un tratamiento más agresivo fue recientemente cuestionada por el grupo de Pillebout.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Datos analíticos y del tratamiento realizado
Figura 1. Histología de piel y renal