La enfermedad de Fabry (EF) es un trastorno hereditario causado por una deficiencia de la actividad de la enzima α-galactosidasa A, cuya transmisión está relacionada con el cromosoma X.
ObjetivosLos objetivos del estudio fueron: 1. Cuantificar la presencia de podocitos en pacientes pediátricos con EF y compararla con el valor de la podocituria medida en controles sanos. 2. Determinar en pacientes con EF si una mayor podocituria está relacionada con la albuminuria patológica. 3. Determinar los factores de riesgo asociados con la albuminuria patológica.
MétodosImplementamos un estudio analítico observacional de casos y controles, separados en 2 grupos de acuerdo con la ausencia de enfermedad (grupo control) o con la presencia de enfermedad (grupo Fabry).
ResultadosEstudiamos a 31 pacientes, 11 con EF y 20 controles, con una media de edad de 11,6 años. La diferencia entre el tiempo medio transcurrido desde el diagnóstico de EF hasta la medición de la podocituria (40 meses) y la aparición de la albuminuria patológica (34 meses) no fue significativa (p: 0,09). Los podocitos se identificaron mediante tinción para sinaptopodina y las diferencias medias cuantitativas entre ambas podociturias fueron estadísticamente significativas (p: 0,001). La albuminuria fue fisiológica en 4 de las pacientes Fabry y el riesgo relativo para desarrollar albuminuria patológica de acuerdo con la podocituria fue en el grupo control 1,1 y en el grupo Fabry 3,9, con un coeficiente de correlación entre la podocituria y la albuminuria en el grupo Fabry de 0,8354. Finalmente los 2 factores de riesgo asociados al desarrollo de albuminuria patológica fueron la podocituria (OR 14) y la edad mayor a 10 años (OR 18). No encontramos riesgo significativo ni en el filtrado glomerular (FG) (OR 0,5), ni en el género (OR 1,3). El FG medio se mantuvo dentro de valores normales.
ConclusiónLa detección de podocituria en pacientes pediátricos con EF podría utilizarse como un marcador temprano de daño renal previo y relacionado con la albuminuria patológica.
Fabry disease (FD) is a hereditary disorder caused by a deficiency of α-galactosidase A enzyme activity. The transmission of the disorder is linked to the X chromosome.
ObjectivesThe objectives of the study were: 1. To quantify the presence of podocytes in paediatric patients with FD and compare them with the value of the measured podocyturia in healthy controls. 2. To determine whether a greater podocyturia is related to the onset of pathological albuminuria in patients with FD. 3. To determine the risk factors associated with pathological albuminuria.
MethodsWe performed an analytical, observational study of Fabry and control subjects, which were separated into 2groups in accordance with the absence of the disease (control group) or the presence of the disease (Fabry group).
ResultsWe studied 31 patients, 11 with FD and 20 controls, with a mean age of 11.6 years.
The difference between the mean time elapsed from the diagnosis of FD to the measurement of podocyturia (40 months) and the onset of pathological albuminuria (34 months) was not significant (p=0.09). Podocytes were identified by staining for the presence of synaptopodin and the mean quantitative differences between both podocyturias were statistically significant (p=0.001). Albuminuria was physiological in 4 of the patients with FD and the relative risk to develop pathological albuminuria according to podocyturia was 1.1 in the control group and 3.9 in the Fabry group, with a coefficient of correlation between podocyturia and albuminuria in the Fabry group of 0.8354. Finally, the 2 risk factors associated with the development of pathological albuminuria were podocyturia (OR: 14) and being aged over 10 years (OR: 18). We found no significant risk with regard to glomerular filtrate renal (GFR) (OR: 0.5) or gender (OR: 1.3). The mean GFR remained within normal values.
ConclusionThe detection of podocyturia in paediatric patients with FD could be used as an early marker of renal damage, preceding and proportional to the occurrence of pathological albuminuria.
La enfermedad de Fabry (EF) constituye un desorden hereditario causado por la deficiente actividad de la enzima a-galactosidasa A, se transmite ligada al cromosoma X y afecta más gravemente a hombres que a mujeres.
Estos pacientes desarrollan por completo la enfermedad hacia la quinta década de la vida, sin embargo, su inicio es pediátrico, con síntomas específicos tales como acroparestesias, angioqueratomas, opacidad corneal e hipo- o anhidrosis1.
En al riñón, la acumulación progresiva de glucoesfingolípidos ocasiona alteraciones funcionales de podocitos, células endoteliales, músculo liso y células tubulares. La proteinuria y la insuficiencia renal progresiva son las principales manifestaciones de esta nefropatía2.
El tratamiento se basa fundamentalmente en la terapia de reemplazo enzimático y las medidas generales contra la progresión de la enfermedad renal crónica3.
A pesar de conocer la historia natural de la enfermedad y, específicamente, los cambios anatomopatológicos en la nefropatía de Fabry, el mecanismo inicial inductor de la albuminuria patológica y la consecuente evolución hacia la enfermedad renal crónica aún no están esclarecidos.
Si bien siempre se consideró a la membrana basal glomerular como la principal determinante del proceso de filtración, actualmente se ha visto que es el epitelio visceral de la cápsula de Bowman el que define las características del ultrafiltrado4. En efecto, el podocito tiene una estructura compleja, constituida por un cuerpo y sus prolongaciones primarias de las que se originan los pies o pedicelos, en contacto directo con la membrana basal del capilar glomerular; el espacio entre 2pedicelos constituye una estructura conocida como diafragma de filtración, con poros de 4 a 14nm3.
Si admitimos que el desprendimiento de los podocitos de la membrana basal glomerular y su aparición en la orina (podocituria) es un proceso natural, el cual se ve incrementado ante un daño renal (por ejemplo, la presencia de depósitos de Gb3 en la citoarquitectura podocitaria), entonces deberíamos aceptar la presencia de una podocituria mínima en los individuos sanos y su aumento cuantitativo representaría un hallazgo temprano de la enfermedad glomerular4, que lleva al desprendimiento de los podocitos, con su consecuente aparición en orina5. De este modo, la identificación de podocitos urinarios constituye potencialmente un biomarcador previo a la aparición de albuminuria patológica, tanto en las glomerulopatías primarias como en las secundarias6,7.
El objetivo primario de nuestro trabajo fue estudiar la orina de pacientes pediátricos con EF, para cuantificar la presencia de podocitos, comparándola con el valor de la podocituria medida en niños sanos. Los objetivos secundarios fueron determinar en los pacientes pediátricos con EF si una mayor podocituria se relaciona con la aparición de albuminuria patológica y cuáles son los factores de riesgo potenciales asociados.
Materiales y métodosDiseño del estudioImplementamos un estudio analítico observacional de casos y controles, con una distribución desigual de muestras (A: 2, B: 1) en 2 grupos de acuerdo con la ausencia de enfermedad (grupo control: controles sanos) o con la presencia de enfermedad (grupo Fabry: pacientes con EF).
Fueron incluidos en el protocolo controles sanos y pacientes con EF, entre 5 y 17 años, eutróficos y con filtrado glomerular (FG) mayor a 90ml/min/1,73 m2. Todos con el consentimiento médico aprobado.
Por otra parte, quedaron excluidos los pacientes con diabetes, malnutrición con un puntaje Z<2 DE, obesidad, hiperparatiroidismo, hipertiroidismo, alteraciones primarias del metabolismo, acidosis tubular renal y proteinuria ortostática.
Se retiró del trabajo a los niños que presentaron reducción del FG superior al 20% a partir del ingreso al protocolo y a aquellos que no cumplieron con las indicaciones para la recolección de la muestra.
Variables evaluadasIdentificamos como variables independientes la ausencia de enfermedad (grupo control), la presencia de enfermedad (EF), el género y la edad del paciente al momento del ingreso. Por su parte, las variables dependientes que consideramos fueron el valor de la podocituria, la albuminuria patológica (definida como albuminuria con valores superiores a 20 ucg/min), el tiempo transcurrido en meses desde el diagnóstico de la EF hasta la medición de la podocituria y el tiempo transcurrido desde el diagnóstico de EF hasta la aparición de albuminuria patológica.
Estudios de laboratorioEn el grupo Fabry se determinó en sangre: creatininemia, aclaramiento de creatinina (método de Scwhartz), ionograma, urea.
En orina de 24 h se midió: albuminuria, creatininuria, pH y densidad urinaria.
PodocituriaSe utilizó la misma orina recolectada para estudios de laboratorio (orina recolectada en 24 h) tanto de sanos como de niños con Fabry.
Las muestras fueron procesadas dentro de la hora de emitida, utilizando un volumen de 10mL al que se agregó 1mL de formol buffer al 10% en PB (pH 7,2- 7,4). Fueron centrifugadas a 1.500rpm durante 5 min y se descartó el sobrenadante. Se agregó al sedimento formol buffer al 10% hasta cubrirlo y se mantuvo a temperatura ambiente hasta la realización del estudio.
Se realizó un extendido del sedimento urinario en portas xilanizados de cada muestra.
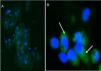
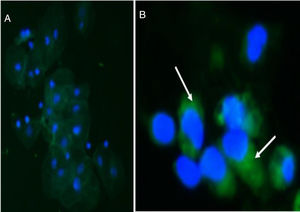
Se realizó una técnica de inmunofluorescencia indirecta en cámara húmeda. En primer lugar, se incubaron las muestras con suero de bloqueo durante 30 min a temperatura ambiente. Luego, sin lavar, se incubó con el anticuerpo primario antisinaptopodina (1:100, ABCAM, Cambridge, RU) utilizado como marcador podocitario toda la noche a 4°C. Posteriormente se realizaron 3 lavados con PBS de 5 min cada uno y se incubó con el anticuerpo secundario IgG Alexa 488 (1:200, ABCAM, Cambridge, RU) durante 2h a temperatura ambiente. Al término de este tiempo de realizaron 3 lavados con PBS de 5 min cada uno y se contracoloreó con DAPI (ABCAM, Cambridge, RU). Las muestras fueron observadas en un microscopio de epifluorescencia Nikon Eclipse E- 200. Se cuantificó el número de células positivas para sinaptopodina en 10 campos 200× para cada muestra a doble ciego (Image Pro Plus 5.1, Media Cybernetics, Silver Spring, MD, EE. UU.).
EstadísticaCálculo del tamaño muestral:
- a)
Porcentaje de pacientes con EF en quienes se estima detectar podocituria (p): 50% y 50% sin la alteración (q)
- b)
IC: 10%
- c)
Error alfa: 0,05, p: 95% (1,96)
- d)
Error estándar: IC/1,96
Tamaño muestral: p×q 50×50=34
ES2 72
La determinación cuantitativa de la variable podocituria se realizó mediante la presentación de datos continuos, con su desvío estándar en cada grupo, y para comparar las diferencias medias cuantitativas de esta variable continua entre los 2 grupos con datos no paramétricos utilizamos el test de Mann-Whitney.
La relación entre el valor de albuminuria y el valor de podocituria se evaluó mediante el coeficiente de correlación de Pearson y analizamos el riesgo de desarrollar albuminuria (variable dicotómica sí/no) en pacientes con y sin podocituria (variable dicotómica sí/no), de acuerdo con el riesgo relativo.
Finalmente para la asociación entre factores de riesgo potenciales presentes y la aparición de albuminuria patológica utilizamos el coeficiente de riesgos proporcionales de Cox. Se estableció como nivel de significación estadística un valor de p <0,05.
Se utilizaron como soportes estadísticos los programas: EPIDAT 3 y GraphPad inStat.
ResultadosSe estudió a 31 pacientes, 11 con EF (5 del género femenino) y 20 controles (12 del género femenino), con una media de edad de 11,6 años (r: 5-17).
La diferencia entre el tiempo medio transcurrido desde el diagnóstico de EF hasta la medición de la podocituria (40 meses) y la aparición de la albuminuria patológica (34 meses) no fue significativa (p: 0,09).
Se detectó la presencia de sinaptopodina en podocitos de pacientes con EF y de pacientes del grupo control (fig. 1) y las diferencias medias cuantitativas entre ambas podociturias fueron estadísticamente significativas (p: 0,001).
Los resultados promedio de los estudios urinarios se muestran en la tabla 1.
Descripción de los controles urinarios realizados en ambos grupos
| Grupo A (control) N: 20 | Grupo B (EF) N: 11 | p | |
|---|---|---|---|
| Media de edad (años) | 11,1 (r: 5-17), | 11,7(r: 5-17) | 0,09 |
| Género M/V | 7/13 | 5/6 | 0,08 |
| Edad media en años de realizado el diagnóstico de la EF | 7,9 (r: 5-11) | ||
| Valor medio de filtrado glomerular (ml/1,73 m2/min) | 102 (DE 8) | ||
| Proteinuria (mg/m2/h) | 1,5 (DE 0,7) | 4,3 (DE 0,5) | 0,05 |
| Albuminuria (ucg/min) | 10 (DE 5,2) | 21(DE 12) | <0,01 |
| Albuminuria patológica (%) | 0 | 64% | <0,001 |
| Podocituria/mg de creatininuria | 0,4 (DE 0,3) | 1,5 (DE 0,8) | <0,01 |
DE: desviación estándar; EF: enfermedad de Fabry.
En el grupo Fabry no todos los pacientes tuvieron albuminuria patológica. De hecho, en 4 de ellos fue normal (tabla 2).
Descripción de las variables recolectadas en el grupo B
| Género | Edad (años) | Podocituria/mg de creatininuria | Tiempo transcurrido desde el diagnóstico de la EF hasta la medición de la podocituria (meses) | Albuminuria (ucg/min) | Tiempo transcurrido desde el diagnóstico de la EF hasta la aparición de la albuminuria patológica (meses) | Mutación | Biopsia renal | Inicio y tiempo de tratamiento enzimático |
|---|---|---|---|---|---|---|---|---|
| Hombre | 17 | 0,5 | 59 | 25 | 59 | A292T | Enero 2012(5 años de tratamiento) | |
| Hombre | 16 | 0,8 | 85 | 33 | 85 | A292T | Sí | Enero 2012 (5 años de tratamiento) |
| Hombre | 10 | 2,3 | 29 | 39 | 29 | L415P | Marzo 2015 (2 años de tratamiento) | |
| Mujer | 15 | 1,1 | 46 | 27 | 29 | A292T | Sí | Febrero 2015 (2 años de tratamiento) |
| Mujer | 12 | 2,2 | 35 | 26 | 23 | T194I | Sí | Febrero 2017 (3 meses de tratamiento) |
| Mujer | 12 | 2,6 | 18 | 17 | 18 | L415P | Octubre 2017 (7 meses de tratamiento) | |
| Hombre | 10 | 1,6 | 9 | 31 | 9 | - | Octubre 2016 (1 año de tratamiento) | |
| Mujer | 5 | 2,5 | 7 | 4 | - | - | ||
| Hombre | 12 | 1,6 | 32 | 6 | - | A292T | Febrero 2015 | |
| Hombre | 12 | 1,1 | 46 | 11 | - | A292T | ||
| Mujer | 8 | 1,9 | 8 | 3 | - | A292T |
n: 11 pacientes. EF: Enfermedad de Fabry.
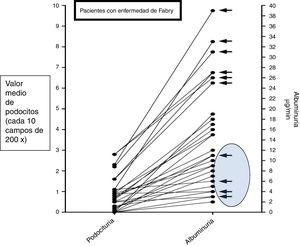
Asociado a estos resultados, el riesgo relativo para desarrollar la albuminuria patológica de acuerdo con la podocituria fue en el grupo control de 1,1 (IC 95%: 0,883-1,112) y en el grupo Fabry de 3,9 (IC 95%: 3,110-4,485), con un coeficiente de correlación entre la podocituria y la albuminuria en el grupo Fabry de 0,8354 (IC 95%: 0,4341-0,9601) (fig. 2).
Finalmente, los 2 factores de riesgo asociados al desarrollo de albuminuria patológica hallados en el modelo de regresión de Cox fueron la podocituria (OR 14; IC 95%: 1,1-20) y la edad mayor a 10 años (OR 18; IC 95%: 1,1-39). No encontramos riesgo significativo ni en el FG (OR 0,5; IC 95%: 0,2-11), ni en el género (OR 1,3; IC 95%: 0,13-13).
Durante todos los controles, el FG medio se mantuvo dentro de valores normales (102ml/min/1,73 m2).
Los 7 pacientes con albuminuria patológica comenzaron con tratamiento nefroprotector (enalapril 0,2mg/kg/día) a partir de las albuminurias patológicas halladas.
DiscusiónEn este trabajo estudiamos a 11 pacientes con EF y a 20 controles. Nuestros resultados indican una relación positiva temprana entre la podocituria y la albuminuria patológica en los pacientes con EF. Hasta la fecha, existen en la población pediátrica muy pocos informes al respecto8,9.
En esta enfermedad, la deficiencia de la actividad de la enzima α-galactosidasa A genera una acumulación lisosomal progresiva de glicoesfingolípidos e induce un daño de la membrana basal con la consecuente aparición de podocitos en orina10.
En efecto, se sabe que los podocitos recubiertos por una sialoproteína del glicocáliz son los principales reguladores del pasaje fisiológico de proteínas y que en el diafragma de filtración están unidos entre sí y con el citoesqueleto de actina, regulando el pasaje proteico11-13. Muchas de las alteraciones en estas estructuras son inducidas por la acumulación lisosomal de Gb3 y pueden manifestarse como borramiento pedicelar, desprendimiento y desarrollo de albuminuria patológica14,15. Si esta secuencia de eventos, al menos inicialmente, está asociada con lo propuesto por Eng16, entonces estaría justificada la búsqueda de la podocituria como un biomarcador adecuado para evaluar el compromiso glomerular precoz. De esta manera, su cuantificación tendría un valor pronóstico relevante, al representar un indicador temprano, no invasivo, de daño renal e incluso preceder a la presencia patológica de la proteinuria. Reforzando esta idea de daño inicial silente, debería valorizarse su control, especialmente en aquellos familiares en los que se ha realizado un diagnóstico enzimático confirmatorio y aún no se detecta otra afectación renal. Su utilidad parece robustecerse con la descripción realizada por Tondel sobre el borramiento podocitario y su desprendimiento ulterior en la mayoría de los niños con EF, de modo que ambos marcadores histológicos han sido categorizados como etapas fisiopatogénicas del daño podocitario precoz17.
Por otra parte, Trimarchi refiere en sus pacientes estudiados y sin tratamiento una alta podocituria con baja proteinuria. En concordancia con estas pruebas, nuestras podociturias decrecen significativamente en el grupo Fabry, sin embargo, estos hallazgos parecen invertirse en los sujetos tratados (los cuales tienen mayor tiempo de daño), lo que indica una relación cambiante entre ambas variables a medida que progresa la enfermedad18.
En términos generales, podemos decir que la magnitud de la podocituria (igualando la podocituria por gramo de creatininuria) presente en la población pediátrica, comparada con los adultos, parece ratificar esta teoría de reducción progresiva podocitaria, no restituida, relacionada con la edad y con la eventual nefropatía existente.
Coherentemente con esta hipótesis, nosotros vimos en los pacientes más jóvenes de nuestro grupo Fabry una concordancia positiva inicial entre la podocituria y la albuminuria, posiblemente relacionada con el tiempo de afectación, evento más evidente tratándose de una población pediátrica y en la que esta asociación puntual se presentó en los niños de menor edad. Esto ratifica, como informó Hughes, un patrón establecido entre la edad y el riesgo de desarrollar daño renal19. Este concepto parece afirmarse en los pacientes con EF, a partir de la similitud entre los tiempos transcurridos hasta la detección de la podocituria y de la albuminuria patológica, y ratificaría la propuesta especulativa sobre el transcurso del tiempo como un condicionante para los cambios cuantitativos entre ambas variables20.
Nosotros, siguiendo las indicaciones habituales frente a la albuminuria patológica, iniciamos tratamiento con enalapril en dosis progresivas y, si bien la respuesta a esta terapéutica no está incluida en el desarrollo del trabajo, podemos mencionar que la mayoría de los pacientes tratados presentaron descenso de sus albuminurias.
Existe consenso general en que la terapia de reemplazo enzimático se debe iniciar precozmente en la enfermedad clásica de Fabry, para atenuar o evitar la nefropatía progresiva y otras complicaciones orgánicas21. Sin embargo, si debemos guiarnos por nuestro grupo de pacientes, el tiempo promedio hasta la medición de los 2 parámetros fisiopatogénicos fundamentales (podocituria y albuminuria) fue demasiado prolongado. Esta situación debería revertirse si pretendemos una intervención terapéutica efectiva y, aunque no existe unanimidad sobre el momento óptimo para su inicio ni se han documentado datos a largo plazo respecto a si la prescripción enzimática prevendría la nefropatía en niños, el uso de un método no invasivo como la podocituria para la detección precoz de daño glomerular podría ser un importante indicador para iniciar el tratamiento específico.
El trabajo muestra determinadas debilidades, especialmente un bajo tamaño muestral y la imposibilidad de correlacionar los estudios realizados con la anatomía patológica. Sin embargo, por otra parte, su originalidad reside en el hallazgo de una analogía positiva temprana entre 2variables tan significativas como la podocituria y la albuminuria en pacientes pediátricos. El propósito final en marcha es establecer la relación secuencial entre ambas variables y determinar cuál sería el intervalo de tiempo de sus apariciones sucesivas, para implementar una precoz terapéutica específica, especialmente beneficiosa en la población Fabry que aún no desarrolló la albuminuria patológica.
En conclusión, nuestro estudio muestra que la detección de podocituria en pacientes pediátricos con EF podría utilizarse como un marcador temprano de daño renal, que precede y se relaciona en forma directamente proporcional con la aparición de albuminuria patológica.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.