Las enzimas metaloproteinasas de matriz (MMP) están involucradas en el remodelado tisular deletéreo asociado al daño de órganos diana de la enfermedad renal. El objetivo de este estudio fue explorar la asociación entre la caída de la función renal y la actividad sistémica de la metaloproteinasa inflamatoria MMP-9 en el paciente hipertenso con enfermedad renal crónica (ERC) leve-moderada.
Material y métodosSe analizaron los niveles plasmáticos de MMP-9 activa, MMP-9 total, su inhibidor tisular (TIMP-1), el cociente MMP-9/TIMP-1 y la interacción entre MMP-9 y TIMP-1 en 37 pacientes hipertensos distribuidos según su tasa de filtración glomerular estimada (TFGe) en 3 grupos:>90, 90-60 y 60-30mL/min/1,73m2.
ResultadosLa MMP-9 total no fue diferente con respecto a la disminución en la TFGe. TIMP-1 estaba significativamente incrementado en los pacientes hipertensos con TFGe entre 60-30mL/min/1,73m2 (p<0,01 versus>90mL/min/1,73m2). Estos resultados fueron apoyados por la disminución significativa de la interacción MMP-9-TIMP-1 observada en los pacientes con TFGe entre 60-30mL/min/1,73m2 (p<0,01 versus>90mL/min/1,73m2). A pesar de la elevación sistémica de TIMP-1 encontramos un incremento significativo de MMP-9 activa en los pacientes hipertensos con TFGe entre 60-30mL/min/1,73m2 (p<0,05 y p<0,01 versus>90 y 90-60mL/min/1,73m2, respectivamente). Los niveles de TIMP-1, MMP-9 activa e interacción proteica MMP-9-TIMP-1 correlacionaron significativamente con el deterioro de la función renal, lo cual no se observó para la MMP-9 total.
ConclusionesLa progresión de la ERC, incluso en estadios donde la caída de la función renal es aún moderada, se asocia con un aumento específico de la actividad MMP-9, lo cual podría considerarse como una potencial diana terapéutica.
Matrix metalloproteinases (MMPs) are involved in deleterious tissue remodeling associated with target organ damage in renal disease. The aim of this study was to study the association between renal dysfunction and activity of the inflammatory metalloproteinase MMP-9 in hypertensive patients with mild-moderate chronic kidney disease (CKD).
Material and methodsPlasmatic active MMP-9, total MMP-9, tissue inhibitor of MMP-9 (TIMP-1), MMP-9/TIMP-1 ratio and MMP-9-TIMP-1 interaction were analyzed in 37 hypertensive patients distributed by estimated glomerular filtration rate (eGFR) in 3 groups:>90, 90-60 y 60-30mL/min/1.73 m2.
ResultsTotal MMP-9 was not different as eGFR declines. TIMP-1 was significantly increased in hypertensive patients with eGFR 60-30mL/min/1.73 m2 (P<.01 versus>90mL/min/1.73 m2). This relates to the significant decrease in the interaction between MMP-9-TIMP-1 observed in patients with eGFR 60-30mL/min/1.73 m2 (P<.01 versus>90mL/min/1.73 m2). Despite the systemic elevation of TIMP-1, active MMP-9 was significantly increased in hypertensive patients with eGFR 60-30mL/min/1.73 m2 (P<.05 and P<0.01 versus>90 and 90-60mL/min/1.73 m2, respectively). TIMP-1, active MMP-9 and MMP-9-TIMP-1 interaction significantly correlate with the decline in renal function, which was not observed with total MMP-9.
ConclusionsThe progression of CKD, even in stages where the decline of renal function is still moderate, is associated with an increase in MMP-9 activity, which could be considered as a potential therapeutic target.
En los últimos años se ha evidenciado que en el paciente hipertenso persiste un elevado riesgo residual tanto cardiovascular (CV) como renal mantenido en el tiempo1,2. En este sentido, estudios realizados por diferentes grupos de investigación3–6 han puesto de manifiesto que el marcador renal clásico de daño de órgano diana, albuminuria, puede aparecer en pacientes hipertensos esenciales incluso bajo tratamiento crónico antihipertensivo con bloqueo del sistema renina angiotensina. Por ejemplo, recientemente se ha demostrado que la disminución de la tasa de filtración glomerular estimada (TFGe) y la presencia de albuminuria se asocia de manera significativa con un incremento sustancial de la presión arterial (PA) sistólica nocturna (probablemente uno de los fenotipos asociados a más riesgo CV), especialmente en aquellos estadios de enfermedad renal crónica (ERC) moderada-severa (estadio 3-5)6. Todos estos datos evidencian que el riesgo renal del paciente hipertenso no se detiene, a pesar del adecuado tratamiento farmacológico y la implementación del mismo cuando es necesario para mantener unas cifras de PA adecuadas.
Las alteraciones histológicas en la ERC asociadas con la presencia de hipertensión son principalmente glomeruloesclerosis, fibrosis intersticial y arteriosclerosis2, todas ellas fácilmente detectables en estadios avanzados de la ERC. Sin embargo, usando biomarcadores específicos detectados a nivel sistémico podríamos detectar procesos de remodelado deletéreo y fibrosis que se asocian a la progresión del daño del eje cardiovasculorrenal en estadios más tempranos de la enfermedad renal. En este sentido, las enzimas metaloproteinasas de matriz (MMP) y sus inhibidores tisulares (TIMP) tienen un papel muy relevante al estar implicados directamente en el remodelado de la matriz extracelular (MEC), mecanismo crucial para el desarrollo y la progresión de la ERC. Además MMP y TIMP funcionan como biomarcadores cuya alteración en sus niveles de concentración y/o actividad sistémica se asocia con procesos inflamatorios y de remodelado deletéreo en el eje cardiovasculorrenal7–12. En concreto, cambios en la actividad de la isoforma MMP-9 inducible están implicados en alteraciones estructurales del túbulo renal y del glomérulo, especialmente en estadios de ERC avanzada donde una importante fibrosis renal aparece13. Sin embargo, mucho menos es conocido sobre la implicación de esta metaloproteinasa inducible MMP-9 en estadios más tempranos de ERC, especialmente dentro de un contexto hipertensivo. Por todo ello, el objetivo de este trabajo fue estudiar de forma comparativa los niveles circulantes totales de MMP-9 y su inhibidor tisular TIMP-1 con el nivel de interacción real entre ambas proteínas y la cantidad de MMP-9 realmente activa en pacientes hipertensos con disminución leve-moderada de la función renal.
MétodosPoblación de estudioEn este estudio se incluyeron 37 pacientes mayores de 18 años y con hipertensión primaria esencial de la Unidad de Hipertensión del Servicio de Nefrología del Hospital Universitario 12 de Octubre de Madrid. Se consideró paciente hipertenso esencial aquel con valores de PA sistólica/diastólica ≥140/90mmHg medida en consulta siguiendo las guías europeas para el manejo de la hipertensión arterial14,15. Los pacientes con diabetes mellitus o hiperaldosteronismo primario se excluyeron del estudio. La TFGe se calculó por medio de la fórmula CKD-EPI16, y los pacientes se distribuyeron de acuerdo a su TFGe en 3 grupos: 1)> 90 ml/min/1,73m2; 2) entre 90 y 60ml/min/1,73m2; y 3) entre 60 y 30ml/min/1,73m22,15. Se determinó la PA en consulta (esfigmomanómetro semiautomático de Omron) y por monitorización ambulatoria de la PA (monitor Spacelabs Healthcare ABPM 90207/17). Todos los pacientes firmaron el consentimiento informado antes de su inclusión en el estudio. El estudio se aceptó por el Comité de Ética del Hospital Universitario 12 de Octubre y se realizó siguiendo los principios de la Declaración de Helsinki.
Valoración de la concentración de enzima metaloproteinasa de matriz-9 total, su inhibidor tisular-1 y enzima metaloproteinasa de matriz-9 activa mediante ensayo por inmunoabsorción ligado a enzimasLa concentración plasmática de MMP-9 y TIMP-1 total se determinó mediante kits comerciales de ensayo por inmunoabsorción ligado a enzimas (ELISA) siguiendo las especificaciones del fabricante (Quantikine®, R&D Systems). Según las especificaciones del fabricante el ELISA para la MMP-9 humana total (DMP900) tiene una sensibilidad de 0,156ng/ml con un coeficiente de variabilidad intraensayo de 2,3% e interensayo de 7,5%. Del mismo modo, el ELISA para el TIMP-1 humano total (DTM100) tiene una sensibilidad de 0,08ng/ml y un coeficiente de variabilidad de 4,4% y 4,2% intra e interensayo, respectivamente. La estimación de la interacción entre MMP-9 y TIMP-1 se determinó de forma indirecta calculando el cociente MMP-9/TIMP-1. La cantidad de MMP-9 activa en las muestras plasmáticas de los pacientes se determinó mediante un kit comercial específico, con una sensibilidad de 0,005ng/ml siguiendo las especificaciones del fabricante (QuickZyme Biosciences).
Análisis específico de la interacción enzima metaloproteinasa de matriz-9 total-inhibidor tisular-1 por inmunoanálisis mediante tecnología AlphaLISAPara ello se empleó un inmunoanálisis utilizando la tecnología AlphaLISa (PerkinElmer), diseñado y puesto a punto por nuestro grupo de investigación para medir específicamente la interacción proteica entre MMP-9 y TIMP-1 en muestras de plasma (para más detalle ver el protocolo recientemente publicado17).
Análisis estadísticoLas variables continuas se compararon mediante el test «t» de Student o el ANOVA unidireccional con el test de Newman-Keuls, y las variables no paramétricas se compararon con la prueba de Kruskal-Wallis. Las variables categóricas se compararon con el test exacto de Fisher. Las correlaciones se calcularon con el coeficiente de correlación de Pearson. Para el análisis de datos se usó el software GraphPad Prism 6. Los datos se representan como media±error estándar de la media, y la significación estadística se consideró para p<0,05.
ResultadosCaracterísticas demográficas y parámetros bioquímicosEn la tabla 1 se muestran las características demográficas, clínicas y bioquímicas de los pacientes hipertensos esenciales incluidos en este estudio divididos en función del estadio de ERC mediante la TFGe en: 1) TFGe>90ml/1,73min/m2; 2) TFGe 90-60ml/1,73min/m2; y 3) TFGe 60-30ml/1,73min/m2. No hubo diferencias significativas en el IMC, en el colesterol total, ni en los niveles de HDL, LDL o triglicéridos entre los diferentes grupos de pacientes. En la tabla 1 también se muestran los datos de PA medida tanto en oficina, como mediante monitorización ambulatoria de la PA de 24horas, variables que no fueron diferentes entre los 3 grupos de pacientes de estudio. No hubo diferencias significativas por la frecuencia ni por el tipo de medicación antihipertensiva (IECA o ARA) ni hipolipidemiante (estatinas). Las diferencias significativas encontradas fueron en edad (p<0,001), en los niveles de creatinina sérica (p<0,001) y en el cociente albúmina/creatinina (p=0,002).
Características clínicas y bioquímicas de los pacientes incluidos en el estudio
| >90 (n=12) | 90-60 (n=17) | 60-30(n=8) | Valor de p | |
|---|---|---|---|---|
| Género masculino (%, n) | 42 (5) | 59 (10) | 88 (7) | 0,123 |
| Edad (años) | 59,3±9,2 | 62,7±9,0 | 74,6±4,9*,** | <0,001 |
| IMC (kg/m2) | 29,0±4,4 | 28,4±2,4 | 29,7±4,2 | 0,676 |
| TFGe (ml/min/1,73m2) | 97,6±4,6 | 78,1±8,7*** | 45,0±11,1*,**** | <0,001 |
| Creatinina en suero (mg/dl) | 0,708±0,122 | 0,934±0,128*** | 1,514±0,299*,***** | <0,001 |
| Albúmina/creatinina (mg/g) | 31,4 (10-115) | 12,8 (2-41) | 392,1 (64–1.641)** | 0,002 |
| PAS clínica (mmHg) | 129,7±15,7 | 136,2±16,2 | 141,5±30,2 | 0,417 |
| PAD clínica (mmHg) | 81,8±8,8 | 85,6±9,4 | 85,8±16,9 | 0,614 |
| PAS 24h (mmHg) | 125,9±14,7 | 124,1±10,3 | 123,0±10,6 | 0,932 |
| PAD 24h (mmHg) | 79,2±10,6 | 75,7±9,9 | 73,6±9,9 | 0,463 |
| Colesterol (mg/dl) | 180,4±22,9 | 190,5±33,5 | 169,0±25,2 | 0,222 |
| HDL (mg/dl) | 57,8±16,8 | 50,2±12,0 | 48,6±5,8 | 0,207 |
| LDL (mg/dl) | 101,5±23,9 | 115,8±28,8 | 96,8±19,9 | 0,267 |
| Triglicéridos (mg/dl) | 105,8±47,2 | 130,0±62,5 | 117,5±39,0 | 0,491 |
| Estatinas (%, n) | 92 (11) | 65 (11) | 75 (6) | 0,145 |
| IECA (%, n) | 25 (3) | 18 (3) | 13 (1) | 0,770 |
| ARA (%, n) | 58 (7) | 76 (13) | 75 (6) | 0,909 |
Los pacientes han sido divididos en función de su TFGe (ml/min/1,73 m2). ARA: antagonistas del receptor de angiotensina; IECA: inhibidores de la enzima convertidora de angiotensina; HDL: lipoproteínas de alta densidad (high density lipoproteins); LDL: lipoproteínas de baja densidad (low density lipoproteins); n: número de pacientes; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TFGe: tasa del filtrado glomerular estimado.
* p<0,001 vs pacientes con TFGe >90ml/min/1.73m2.
** p<0,01 vs pacientes con TFGe entre 90-60m/min/1.73m2.
*** p<0,01 vs pacientes con TFGe >90ml/min/1.73m2.
**** p<0,05 vs pacientes con TFGe entre 90-60m/min/1.73m2.
***** p<0,001 pacientes con TFGe entre 90-60m/min/1.73m2.
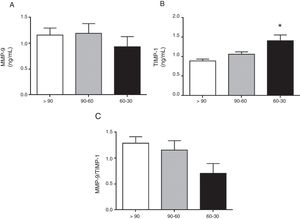
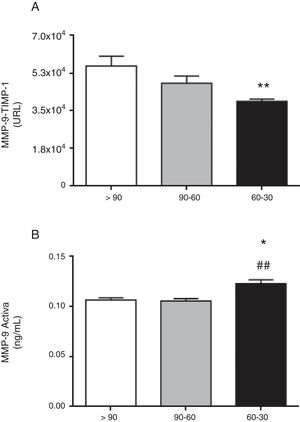
La concentración circulante de MMP-9 total no fue diferente según avanza la ERC en los pacientes hipertensos del estudio (fig. 1A). Por el contrario, la concentración total circulante de su inhibidor tisular TIMP-1 fue significativamente mayor en aquellos pacientes hipertensos que tenían una TFGe entre 60-30ml/min/1,73m2 en comparación con los que tenían una TFGe>90ml/min/1,73m2 (p<0,01[fig. 1B]). El cociente entre los niveles totales de MMP-9 y TIMP-1 detectados, MMP-9/TIMP-1, ampliamente utilizado en la investigación preclínica como estimador indirecto de la actividad MMP-9, no fue diferente entre los pacientes hipertensos de los 3 grupos (fig. 1C). Además, apoyando estos resultados encontramos una disminución significativa en la interacción proteica real entre MMP-9-TIMP-1 a nivel sistémico, medida mediante tecnología alphaLISA, en los pacientes hipertensos con TFGe entre 60-30ml/min/1,73m2 en comparación con aquellos con una TFGe>90ml/min/1,73m2 (p<0,01 [fig. 2A]). Cuando se estimaron de manera específica los niveles circulantes de la isoforma MMP-9 activa se comprobó que eran significativamente mayores en los pacientes hipertensos con TFGe entre 60-30ml/min/1,73 (fig. 2B), en comparación con aquellos con una TFGe entre 90-60ml/min/1,73m2 (p<0,01) o aquellos con una TFGe>90ml/min/1,73 m2 (p<0,05).
Interacción proteica entre MMP-9 y su inhibidor tisular TIMP-1 analizado mediante alphaLISA (A) y MMP-9 activa (B) en las muestras de plasma de los pacientes hipertensos con TFGe>90, entre 90-60 y entre 60-30ml/min/1,73m2.
* p<0,05 vs pacientes con TFGe >90ml/min/1.73m2.
**p<0,01 vs pacientes con TFGe >90ml/min/1.73m2.
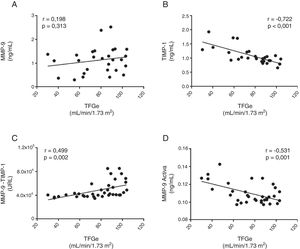
No se observó que existiera correlación entre los niveles circulantes totales de MMP-9 y la disminución de la función renal mediante la TFGe (r=0,198, p=0,313 panel [fig. 3A]). Por el contrario, la TFGe correlacionó de forma negativa y significativa con la concentración total de TIMP-1 (r=–0,722, p>0,001 [fig. 3B]). Además, se observó una correlación significativa y positiva entre la TFGe y la interacción proteica entre MMP-9-TIMP-1 (r=0,499, p=0,002; [fig. 3C]), de tal forma que a medida que la TFGe disminuye existe una menor interacción entre MMP-9 y su inhibidor TIMP-1. Por el contrario, la concentración de la isoforma MMP-9 activa correlacionó de manera significativa y negativa con la TFGe (r=–0,531, p=0,001 [fig. 3D]). Por lo tanto, a medida que la función renal disminuye la cantidad de TIMP-1 se eleva y, a pesar de ser este un inhibidor fisiológico de MMP-9, este no interactúa con esta enzima, favoreciendo que la actividad de esta metaloproteinasa proinflamatoria se vea incrementada. Tras ajustar todos estos parámetros de remodelado por el sexo y/o la edad de los pacientes, solamente los parámetros TIMP-1 total o MMP-9 activa mantuvieron estas correlaciones significativas (tabla 2).
Correlaciones parciales entre la TFGe y las variables de estudio ajustadas por el sexo y/o la edad
| Modelo 1 | Modelo 2 | Modelo 3 | |
|---|---|---|---|
| MMP-9 total | r=0,123; p=0,541 | r=0,135; p=0,503 | r=0,007; p=0,974 |
| TIMP-1 total | r=–0,764; p<0,001 | r=–0,468;p=0,014 | r=–0,545; p=0,004 |
| MMP-9/TIMP-1 | r=0,397; p=0,040 | r=0,255; p=0,199 | r=0,129; p=0,529 |
| Interacción MMP-9-TIMP-1 | r=0,476; p=0,003 | r=0,218; p=0,202 | r=0,143; p=0,411 |
| MMP-9 activa | r=-0,514; p=0,002 | r=–0,471; p=0,006 | r=–0,441; p=0,012 |
Modelo 1: ajustado por sexo; modelo 2: ajustado por edad; modelo 3: ajustado por sexo y edad.
En este trabajo hemos analizado la relación entre la disminución leve-moderada de la función renal y los niveles circulantes de MMP-9 y su inhibidor TIMP-1 en pacientes hipertensos esenciales controlados farmacológicamente. Los resultados que hemos obtenido muestran que la actividad de la MMP-9 (fig. 2B), pero no su concentración total sistémica (fig. 1A), se incrementa a medida que la función renal va disminuyendo (fig. 3C y tabla 2), siendo esta actividad significativamente mayor en los pacientes hipertensos con TFGe entre 60-30ml/min/1,73m2 en comparación con los estadios previos con TFGe entre 90-60 o>90ml/min/1,73m2 (fig. 2B). Sorprendentemente, esta mayor actividad de MMP-9 se acompaña con un incremento sistémico de la concentración de su inhibidor TIMP-1 a medida que la función renal disminuye (fig. 3B), siendo la concentración total de TIMP-1 significativamente mayor en los pacientes hipertensos con TFGe entre 60-30ml/min/1,73m2 en comparación con aquellos con TFGe>90ml/min/1,73m2 (fig. 1B). A pesar de tener más concentración total circulante de TIMP-1 a medida que la función renal disminuye, comprobamos que existía una disminución de la interacción proteína-proteína MMP-9-TIMP-1 (fig. 2B), siendo esta interacción proteica significativamente menor en los pacientes hipertensos con TFGe entre 60-30ml/min/1,73 en comparación con aquellos con TFGe>90ml/min/1,73m2 (fig. 2mA). Estos datos señalan que a pesar de tener más TIMP-1 circulante en los pacientes con TFGe entre 60-30ml/min/1,73m2, este no está ejerciendo su capacidad inhibitoria sobre MMP-9, ya que no está interaccionando con ella, lo cual significa que efectivamente MMP-9 está más libre de su inhibidor TIMP-1, y por lo tanto más activa, a medida que la ERC avanza.
Las enzimas MMP son una extensa familia de endopeptidasas capaces de controlar la síntesis y degradación de los componentes que forman la MEC, regulando de esta forma el proceso de remodelado y fibrosis de diferentes órganos diana, tanto en la enfermedad CV como en la renal18–20. Concretamente, la isoforma MMP-9 es una enzima gelatinasa que se activa fundamentalmente en respuesta a procesos inflamatorios, lo cual tiene como consecuencia la degradación de diferentes componentes de la MEC que son sus sustratos, fundamentalmente colágeno tipo iv y elastina21. La alteración de los componentes de la MEC está implicada en la progresión de la ERC. Estados avanzados de ERC se caracterizan por una pérdida severa de la función renal, acompañados frecuentemente con alteraciones estructurales como la presencia de fibrosis intersticial renal y de glomerulosclerosis22, ambas fácilmente detectables mediantes pruebas histológicas y de imagen. Asociado a este daño estructural existe un patrón diferencial de expresión y/o actividad de biomarcadores implicados en remodelado como la MMP-9. A nivel glomerular, la infiltración de células inflamatorias, la liberación de citoquinas pro-inflamatorias como el factor de necrosis tumoral alfa (TNF-α) y de citoquinas profibróticas como el factor de crecimiento beta (TGF-β), así como la liberación de especies reactivas de oxígeno, incrementan la síntesis y actividad de MMP-9, en una primera instancia como mecanismo compensador para degradar el exceso de síntesis de colágeno, y por lo tanto para evitar la aparición de fibrosis renal13. Sin embargo, según avanza la ERC la actividad de MMP-9 comienza a disminuir, lo cual hace que se agrave aún más el cúmulo de componentes en la MEC, y por lo tanto la fibrosis renal, la cual es ya en este punto de difícil reversión. Sin embargo, ¿qué ocurre con la participación de la MMP-9 en estadios previos de ERC antes de que la disfunción renal sea severa? ¿A partir de qué estadio de desarrollo de ERC la MMP-9 tiene un papel? ¿Podría MMP-9 servir como un biomarcador temprano de remodelado antes que la fibrosis renal sea detectada? En este estudio observamos que MMP-9 se encuentra significativamente más activa en pacientes hipertensos controlados que presentan una TFGe entre 60-30ml/min/1,73m2, en comparación con los estadios previos (90-60 y>90ml/min/1,73m2). Es muy llamativo que no encontremos diferencias en la expresión total circulante de MMP-9 y sí en TIMP-1, lo cual haría pensar que si estimamos de manera indirecta la actividad de MMP-9, utilizando el cociente MMP-9/TIMP-1, este no es diferente, y por lo tanto la MMP-9 no estaría activa en los pacientes que presentan una TFGe entre 60-30ml/min/1,73m2. Sorprendentemente, midiendo adecuadamente la actividad de MMP-9 y la interacción real entre MMP-9 y TIMP-1 con un nuevo ensayo desarrollado por nuestro grupo de investigación8,17 que utiliza la tecnología AlphaLISA®, obtuvimos que los pacientes hipertensos que presentan una TFGe entre 60-30ml/min/1,73m2 tienen significativamente más activa la MMP-9. Estos resultados señalan que probablemente el papel de la MMP-9 se esté subestimando en muchas circunstancias patológicas, ya que en la gran mayoría de estudios de investigación preclínica la actividad de esta enzima no se tiene en cuenta determinándose solamente su concentración total sistémica17. Una mayor actividad de MMP-9 en estadios relativamente tempranos de ERC podría tener una repercusión fisiológica importante, más allá de ser un mecanismo compensador para evitar el cúmulo de depósitos de colágeno y, por tanto, de fibrosis. En este sentido se ha observado que en pacientes que desarrollan albuminuria, así como en modelos experimentales de desarrollo espontáneo de albuminuria en ratas Munich Wistar Frömter, existe un aumento significativo de la actividad circulante y renal de MMP-9, lo cual se relaciona con el fuerte componente de estrés oxidativo asociado a la presencia de albuminuria23. A nivel endógeno, MMP-9 se encuentra bajo el control de su inhibidor tisular TIMP-1, el cual puede ser diana oxidativa en situaciones de incremento sistémico de estrés oxidativo24. En este sentido, estudios recientes han puesto de manifiesto que el desarrollo de albuminuria resistente a la inhibición crónica del sistema renina angiotensina va acompañado del aumento sistémico del TIMP-1 oxidado (oxyTIMP-1), el cual es incapaz de unirse con su diana MMP-9, dejando a esta en libre y permitiendo su activación mantenida8. Ambas condiciones, aumento del estrés oxidativo y activación de MMP-9, podrían tener una repercusión directa en la barrera de filtración glomerular que favorezca la aparición de albuminuria en estadios tempranos de ERC. Esto es debido a que las especies reactivas de oxígeno son capaces de degradar el glicocálix que recubre el endotelio glomerular fenestrado de los capilares del glomérulo, perdiendo de este modo este endotelio su fuerte carga negativa, y por tanto impidiendo la repulsión de cargas con la albúmina25. Al mismo tiempo, este componente de estrés oxidativo favorece la activación de MMP-9, la cual a nivel renal va a actuar fundamentalmente en la membrana basal glomerular (MBG), donde se encuentra de manera mayoritaria su sustrato, el colágeno tipo iv. Esto va a permitir que al dañarse estructuralmente esta barrera, tanto en su parte endotelial como en la MBG, la albumina pueda filtrarse más fácilmente del torrente sanguíneo a la orina.
El presente estudio muestra las siguientes limitaciones: 1) estudio puramente descriptivo; y 2) el número pequeño de pacientes incluidos en el mismo. Por estas razones, estudios prospectivos y con un número de pacientes significativamente mayor son absolutamente necesarios para corroborar estos hallazgos y poder establecer la causalidad del incremento de la actividad MMP-9 en el desarrollo de la enfermedad renal.
En conclusión, en este estudio demostramos que existe una asociación significativa entre disfunción renal y aumento específico de la actividad MMP-9, incluso en estadios donde la caída de la función renal es aún moderada. Además, este estudio demuestra que el papel de la MMP-9 no puede subestimarse, especialmente en estadios tempranos de ERC, y debe ser analizado adecuadamente a través de técnicas bioquímicas y moleculares que pongan de manifiesto su actividad real, más allá del mero análisis de las concentraciones circulantes de MMP-9.
FinanciaciónGRH es investigador Miguel Servet tipo i del ISCIII (CP15/00129). La actividad investigadora de GRH, GAL, MGB y LMR está financiada por el ISCIII (PI11/0243, PI13/01746, PI14/01841, PIE13/00045, PI17/01193, PI17/01093). Este estudio ha sido financiado fundamentalmente por la Fundación SENEFRO, y parcialmente por la Sociedad Española de Cardiología y la Fundación Íñigo Álvarez de Toledo. Los autores Gloria Álvarez-Llamas y Julián Segura son investigadores pertenecientes a la red RETICS/REDINREN del ISCIII.
Conflicto de interesesLos autores de este manuscrito no tienen conflicto de intereses que declarar.