La hemodiafiltración online (HDF-OL) con altos volúmenes de transporte convectivo mejora la supervivencia en los pacientes en hemodiálisis. Se ha propuesto limitar el volumen convectivo en los pacientes diabéticos por la carga de glucosa administrada con el líquido de sustitución. El objetivo del estudio fue analizar la influencia del volumen de sustitución en la evolución del perfil metabólico y la composición corporal de los pacientes diabéticos incidentes en HDF-OL.
Material y métodosEstudio observacional prospectivo en 29 pacientes diabéticos incidentes en HDF-OL posdilución. Basalmente se recogieron datos clínicos y demográficos, parámetros analíticos metabólicos, nutricionales e inflamatorios, y la composición corporal por bioimpedancia espectroscópica (BIS). Cada 4 meses se recogieron parámetros analíticos y el volumen de sustitución medio por sesión, y en 23 pacientes se realizó otra BIS al menos un año después. Se calcularon variaciones de hemoglobina glucosilada (HbA1c), triglicéridos, colesterol total, c-LDL, c-HDL, albúmina, prealbúmina y proteína C reactiva (PCR) al año, 2 años, 3 años y al final del seguimiento. Se calcularon las variaciones cuatrimestrales y anuales como periodos independientes, y se analizaron los cambios de composición corporal.
ResultadosLa edad al inicio fue a los 69,7±13,6 años; el 62,1% eran varones, de 72,3±13,9kg, 1,78±0,16m2, y con 48 (35,5-76) meses en diálisis. El 81,5% recibía insulinoterapia, el 7,4% antidiabéticos y el 51,9% estatinas. El volumen de sustitución medio fue de 26,9±2,9L/sesión y el periodo de seguimiento (tiempo en HDF-OL) fue de 40,4±26 meses.
Se observó una correlación significativa entre el volumen de sustitución medio y un incremento de los niveles de c-HDL (r=0,385, p=0,039) y prealbúmina (r=0,404, p=0,003) a lo largo del seguimiento. El volumen convectivo se asoció a la reducción de los niveles de PCR al año (r=−0,531, p=0,005), a los 2 años (r=−0,463, p=0,046) y al final del seguimiento (r=−0,498, p=0,007). Los pacientes con volumen de sustitución >26,9L/sesión tuvieron mayor descenso en los niveles de triglicéridos y PCR, y un aumento de las cifras de c-HDL. Estos pacientes con >26,9L/sesión finalizaron el estudio con niveles más altos de c-HDL (48,1±9,4mg/dL vs. 41,2±11,6mg/dL, p=0,025) y más bajos de PCR (0,21 [0,1-2,22] mg/dL vs. 1,01 [0,15-6,96] mg/dL, p=0,001), sin diferencias al inicio.
Las comparaciones entre el volumen de sustitución y los cambios analíticos por periodos cuatrimestrales [n=271] mostraron una correlación significativa con un descenso de HbA1c (r=−0,146, p=0,021), al igual que las comparaciones por periodos anuales [n=72] (r=−0,237, p=0,045). Un volumen de sustitución medio anual >26,6L/sesión (29,3±1,7L/sesión vs. 23,9±1,9L/sesión) se asoció a un descenso de HbA1c (−0,51±1,24% vs. 0,01±0,88%, p=0,043). No se observó correlación entre el volumen de sustitución y las variaciones en el peso, IMC o parámetros de la BIS.
Conclusión No existe suficiente evidencia para limitar el transporte convectivo en los pacientes diabéticos en HDF-OL por el contenido de glucosa del líquido de sustitución.
Online haemodiafiltration (OL-HDF) with high convective transport volumes improves patient survival in haemodialysis. Limiting the amount of convective volume has been proposed in patients with diabetes mellitus due to glucose load that is administered with replacement fluid. The objective of the study was to analyse the influence of substitution volume on the evolution of the metabolic profile and body composition of incident diabetic patients on OL-HDF.
Material and methodsProspective observational study in 29 incident diabetic patients on postdilution OL-HDF. Baseline data included clinical and demographic data, laboratory parameters (metabolic, nutritional and inflammatory profile) and body composition with bioimpedance spectroscopy (BIS). Laboratory parameters and mean substitution volume per session were collected every 4 months, and in 23 patients a further BIS was performed after a minimum of one year. Variations in glycosylated haemoglobin (HbA1c), triglycerides, total cholesterol, LDL-c, HDL-c, albumin, prealbumin and C reactive protein (CRP) were calculated at one year, 2 years, 3 years, and at the end of follow-up. Quarterly and annual variations were calculated as independent periods, and changes in body composition were analysed.
ResultsAge at baseline was 69.7±13.6 years, 62.1% were male, 72.3±13.9kg, 1.78±0.16m2, with 48 (35.5-76) months on dialysis. Approximately 81.5% received insulin, 7.4% antidiabetic drugs and 51.9% statins. Mean substitution volume was 26.9±2.9L/session and follow-up period (time on OL-HDF) was 40.4±26 months.
A significant correlation was observed between mean substitution volume and the increase in HDL-c (r=0.385, p=0.039) and prealbumin levels (r=0.404, p=0.003) throughout follow-up. Moreover, substitution volume was correlated with a reduction in CRP levels at one year (r=–0.531, p=0.005), 2 years (r=–0.463, p=0.046), and at the end of follow-up (r=–0.498, p=0.007). Patients with mean substitution volume >26.9L/session had a higher reduction in triglycerides and CRP, and an increase in HDL-c levels. These patients with >26.9L/session finished the study with higher HDL-c (48.1±9.4mg/dL vs. 41.2±11.6mg/dL, p=0.025) and lower CRP levels (0.21 [0.1-2.22] mg/dL vs. 1.01 [0.15-6.96] mg/dL, p=0.001), with no differences at baseline.
Quarterly comparisons between substitution volume and laboratory changes [n=271] showed a significant correlation with a reduction in HbA1c (r=–0.146, p=0.021). Similar findings were obtained with annual comparisons [n=72] (r=–0.237, p=0.045). An annual mean substitution volume over 26.6L/session (29.3±1.7L/session vs. 23.9±1.9L/session) was associated with a reduction in HbA1c (–0.51±1.24% vs. 0.01±0.88%, p=0.043). No correlation was observed between substitution volume and changes in weight, body mass index or BIS parameters.
ConclusionThere is not enough evidence to restrict convective transport in diabetic patients on OL-HDF due to the glucose content of the replacement fluid.
En los últimos años el desarrollo de las técnicas convectivas ha contribuido a numerosos beneficios en los pacientes con enfermedad renal crónica avanzada (ERCA) en hemodiálisis1,2. La hemodiafiltración online (HDF-OL) posdilución se considera la técnica más eficaz al combinar elevados aclaramientos por difusión con altos volúmenes de transporte convectivo3. La utilización de nuevos dializadores, la fabricación online del líquido de diálisis o los monitores y biocontroles que optimizan la tasa de sustitución han permitido mejorar el rendimiento e incrementar el transporte convectivo en los pacientes en HDF-OL.
La cantidad de transporte convectivo parece tratarse de un factor determinante en conseguir estos beneficios: mientras que la mayoría de técnicas de hemofiltración o hemodiafiltración con volúmenes convectivos más bajos no muestran mejorías en la supervivencia respecto a la hemodiálisis de alto flujo, la HDF-OL con volúmenes de sustitución >23L por sesión, >69L por semana o >23L/1,73m2 por sesión ha demostrado una reducción de la mortalidad4-6, que fundamentalmente se debe a una reducción de la mortalidad cardiovascular7,8. Aunque ninguno de los estudios fueron diseñados para evaluar el efecto «convectivo-dependiente», estos beneficios parecen ser más notables cuanto mayor es la dosis de convección9.
Se ha planteado la posibilidad de que el contenido de glucosa del líquido de sustitución pueda suponer un exceso o una carga extra de glucosa que se administra al paciente durante el tratamiento, lo cual sería un factor limitante del volumen de sustitución en los pacientes con intolerancia a los hidratos de carbono o diabetes mellitus10,11. Hasta el momento no existen datos acerca de que la glucosa infundida con las técnicas convectivas contribuya a un peor control metabólico o a empeorar el riesgo cardiovascular en estos pacientes. De hecho, los primeros beneficios que se observaron al incorporar el transporte convectivo con membranas de alto flujo fueron en los pacientes diabéticos12, y los análisis de los estudios en HDF-OL muestran que los resultados en la mejoría de la supervivencia y en la reducción de la mortalidad cardiovascular son independientes de subgrupos incluyendo estos pacientes5,13.
El objetivo de este estudio fue analizar la influencia del volumen de sustitución en la evolución del perfil metabólico y la composición corporal de los pacientes diabéticos con ERCA en hemodiálisis, desde su inicio en HDF-OL.
Material y métodosDiseño. Es un estudio observacional prospectivo llevado a cabo en los pacientes diabéticos incidentes en la técnica HDF-OL posdilución desde su inicio hasta finalizar el año 2016.
Criterios de inclusión. Pacientes mayores de 18 años, con ERCA en tratamiento renal sustitutivo, diagnosticados de diabetes mellitus antes de iniciar HDF-OL, y con pauta de HDF-OL: 3 sesiones semanales de 4h.
Un total de 29 pacientes fueron incluidos en el estudio: 11 pacientes iniciaron HDF-OL como técnica inicial de diálisis tras un periodo de 4 semanas de adaptación en hemodiálisis de alto flujo y 18 pacientes cambiaron de técnica de diálisis (17 desde hemodiálisis de alto flujo y uno desde diálisis peritoneal). Todos firmaron un consentimiento informado, y el estudio cumple con los principios de la última Declaración de Helsinki.
Variables. Basalmente se recogieron datos clínicos y demográficos, el tratamiento con insulina, antidiabéticos y/o hipolipemiantes, parámetros de laboratorio metabólicos, nutricionales e inflamatorios (hemoglobina glucosilada [HbA1c], triglicéridos, colesterol total, c-LDL, c-HDL, albúmina, prealbúmina y proteína C reactiva [PCR]), medidas antropométricas y la composición corporal por bioimpedancia espectroscópica (BIS).
Se recogió el volumen de sustitución y el volumen convectivo (sustitución más ultrafiltración) de cada sesión de HDF-OL y se calcularon los volúmenes medios por sesión cada 4 meses. El volumen de sustitución se ajustó además a la superficie corporal para estandarizar la dosis de convección.
Cada 4 meses se recogieron los parámetros de laboratorio y medidas antropométricas. En 23 pacientes se realizó otro análisis de composición corporal por BIS después de al menos un año de seguimiento.
Se utilizaron monitores 4008 (FMC®), 5008 (FMC®), AK200U (Baxter®), Artis (Baxter®), DBB-07 y DBB-EXA (Nikkiso®) y dializadores de alta permeabilidad FX80 (FMC®), FX1000 (FMC®), Polyflux-210H (Baxter®), Elisio-21H (Nipro®) y un caso de triacetato de celulosa Sureflux-21H (Nipro®) por hipersensibilidad a membranas de helixona. La prescripción del volumen de sustitución fue heterogénea (según la fracción de filtración, un volumen objetivo, controles por presión u otros controles automatizados de la tasa de sustitución) y variable a lo largo del seguimiento, con el objetivo de alcanzar el mayor volumen de sangre procesada y el mayor volumen de sustitución posible. El contenido de glucosa en el líquido de sustitución fue de 100mg/dL.
Las muestras de laboratorio se extrajeron en todos los casos antes de iniciar la segunda sesión de HDF de la semana, después de un periodo interdiálisis de 44h. Las medidas de BIS se realizaron mediante el monitor BCM (Body Composition Monitor®, FMC), también antes de iniciar la segunda sesión de HDF de la semana, tras de un periodo de 5min en reposo en decúbito supino14.
Se calcularon las variaciones de parámetros analíticos en el primer año, a los 2 años, 3 años y al final del seguimiento. Se calcularon variaciones cuatrimestrales y anuales como periodos independientes, y se calcularon las variaciones de composición corporal por BIS en el periodo entre las determinaciones.
En el análisis estadístico se utilizó el programa SPSS 20.0 para Mac. Las variables cualitativas se expresan como frecuencias y/o porcentajes. Se comprobó el modelo de distribución de las variables cuantitativas mediante el test de normalidad de Kolmogorov-Smirnoff. Las variables cuantitativas con distribución normal se expresan como media±desviación estándar y las variables cuantitativas con distribución no normal se expresan como mediana [rango intercuartílico]. Las variaciones de las variables se analizaron como cambios absolutos, relativos (%), y respecto al tiempo transcurrido. La asociación entre variables se realizó utilizando test no paramétricos (Spearman, Wilcoxon, Kruskal-Wallis, Fisher test) por el reducido tamaño de la muestra. Se utilizó el análisis de regresión lineal multivariante modelo «introducir» para evaluar la asociación independiente con las variaciones en el tiempo. Se consideró significativo un valor de p<0,05 con un intervalo de confianza del 95%.
ResultadosLos datos clínicos, antropométricos, de laboratorio y BIS al inicio del estudio se recogen en la tabla 1. El tiempo de seguimiento (tiempo en HDF-OL) fue de 40,4±26 meses (mín: 12, máx: 101; mediana [RIC]: 35 [19,5-63] meses). Al final del estudio, 16 pacientes continuaban en HDF-OL, 2 cambiaron a hemodiálisis de alto flujo, 2 recibieron un trasplante renal, y 9 (31%) habían muerto.
Datos clínicos, antropométricos, de laboratorio y bioimpedancia al inicio del estudio
| Media±DE | |
|---|---|
| Edad (años) | 69,7±13,6 |
| Sexo: varón (%) | 62,1 |
| Tiempo de TRS (meses)a | 48 (35,5-76) |
| Etiología ERC (%) | |
| Nefropatía diabética | 79,3 |
| Enf. vascular renal | 10,3 |
| Enf. glomerular | 6,8 |
| Otras | 3,4 |
| Acceso vascular: FAV (%) | 88,9 |
| Peso (kg) | 72,3±13,9 |
| IMC (kg/m2) | 27,1±5,4 |
| Superficie corporal (m2) | 1,78±0,16 |
| DM tipo 1 (%) | 3,4 |
| DM tipo 2 (%) | 96,6 |
| Insulinoterapia (%) | 81,5 |
| Antidiabéticos orales (%) | 7,4 |
| Dieta y ejercicio (%) | 14,8 |
| Estatinas (%) | 51,9 |
| HbA1c (% / IFCC) | 6,96±1,3 / 52±11 |
| Triglicéridos (mg/dL) | 133,4±58 |
| Colesterol total (mg/dL) | 153,4±37 |
| c-HDL (mg/dL) | 45±14 |
| c-LDL (mg/dL) | 83,1±28,1 |
| Albúmina (g/dL) | 3,82±0,43 |
| Prealbúmina (mg/dL) | 24,9±7,4 |
| PCR (mg/dL) | 1,1 (0,6-1,9) |
| Agua corporal total (L) | 36,7±7,4 |
| Agua extracelular (L) | 17,7±3,1 |
| Agua intracelular (L) | 18,9±4,5 |
| Sobrehidratación (L) | 1,89±1,52 |
| Masa magra (kg) | 29,9±14,3 |
| Índice tejido magro (kg/m2) | 14,5±3,9 |
| Masa grasa (kg) | 21,4±12,7 |
| Índice tejido graso (kg/m2) | 11,6±6,6 |
| Masa adiposa (kg) | 30,5±16,3 |
| Masa celular (kg) | 22,1±8,3 |
c-HDL: colesterol ligado a lipoproteínas de alta densidad; c-LDL: colesterol ligado a lipoproteínas de baja densidad; DE: desviación estándar; DM: diabetes mellitus; ERC: enfermedad renal crónica; FAV: fístula arteriovenosa; HbA1c: hemoglobina glucosilada; IFCC: International Federation of Clinical Chemistry and Laboratory Medicine; IMC: índice de masa corporal; PCR: proteína C reactiva; TRS: tratamiento renal sustitutivo.
El volumen de sustitución medio fue de 26,9±2,9L/sesión (mín: 20,5L, máx: 32,9L) o 26,5±4,2L/1,73m2/sesión (mín: 19,5L/1,73m2, máx: 40,3L/1,73m2). No hubo variaciones significativas del volumen de sustitución a lo largo del seguimiento.
Se observó una correlación significativa entre el volumen de sustitución medio y un incremento de los niveles de c-HDL (r=0,385, p=0,039) y prealbúmina (r=0,404, p=0,003) a lo largo del seguimiento. Además, se encontró una correlación significativa entre el volumen de sustitución y la reducción de los niveles de PCR al año (r=−0,531, p=0,005), a los 2 años (r=−0,463, p=0,046) y al final del seguimiento (r=−0,498, p=0,007). Al ajustar el volumen sustituido a la superficie corporal, también se encontró una correlación significativa con la reducción de los niveles de triglicéridos (r=−0,423, p=0,022).
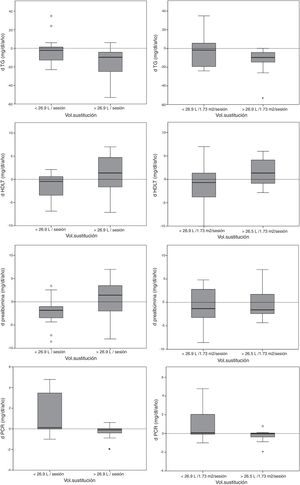
La tabla 2 muestra las diferencias en la evolución de los parámetros de laboratorio y de la composición corporal en los pacientes con un volumen de sustitución por encima o por debajo de la media del estudio. Los pacientes con volumen de sustitución más bajo (<26, 9L/sesión) tenían mayor edad y un seguimiento más prolongado. Los pacientes con volumen de sustitución >26,9L/sesión tuvieron mayor descenso en los niveles de triglicéridos y PCR, y un aumento de las cifras de c-HDL (fig. 1).
Diferencias en la evolución de parámetros de laboratorio y la composición corporal en función del volumen de sustitución
| <26,9L/sesión (n=15) | >26,9L/sesión (n=14) | p (Sig.) | |
|---|---|---|---|
| Vol. sustitución (L/sesión) | 24,69±1,82 | 29,38±1,73 | <0,001 |
| Características basales | |||
| Edad (años) | 76,1±7,8 | 62,7±15,2 | 0,009 |
| Sexo: varón (n) | 9 | 9 | n.s. |
| TRS previa / HDF-OL inicial (n) | 10 / 5 | 8 / 6 | n.s. |
| Tiempo TRSa (meses) | 27±23,2 | 86,6±79,9 | n.s. |
| Tiempo de seguimiento (meses) | 52,8±30,2 | 27,1±11,5 | 0,029 |
| Cambios en los parámetros de laboratorio al final del seguimiento | |||
| HbA1c (%) | −0,55±0,71 | −0,63±1,47 | n.s. |
| TG (mg/dL) | −17,73±47,74 | −41,07±47,15 | 0,146 |
| Colesterol (mg/dL) | −17,27±52,89 | −12,79±32,20 | n.s. |
| c-LDL (mg/dL) | −18±40,16 | −9,21±29,78 | n.s. |
| c-HDL (mg/dL) | −4,8±12,31 | 3,64±10,11 | 0,070 |
| Albúmina (g/dL) | −0,44±0,56 | −0,11±0,67 | n.s. |
| Prealbúmina (mg/dL) | −10,8±10,17 | 1,29±7,48 | 0,003 |
| PCR (mg/dL) | 6,05±14,01 | −0,67±1,19 | 0,007 |
| Cambios anuales en los parámetros de laboratorio | |||
| HbA1c (%/año) | −0,16±0,31 | −0,39±0,86 | n.s. |
| TG (mg/dL/año) | −0,62±14,83 | −23,58±28,41 | 0,010 |
| Colesterol (mg/dL/año) | −2,29±14,74 | −3,19±13,01 | n.s. |
| c-LDL (mg/dL/año) | −5,86±10,75 | −1,21±17,72 | n.s. |
| c-HDL (mg/dL/año) | −2,09±3,75 | 1,87±7,34 | 0,041 |
| Albúmina (g/dL/año) | −0,09±0,22 | −0,08±0,35 | n.s. |
| Prealbúmina (mg/dL/año) | −2,23±3,16 | 1,13±3,87 | 0,016 |
| PCR (mg/dL/año) | 3,99±11,96 | −0,32±0,57 | 0,006 |
| Cambios de composición corporal | |||
| Tiempo entre BIS (meses) | 37,5±27,2 | 25,1±15,5 | n.s. |
| Peso (kg) | 0,063±5,13 | −0,066±6,08 | n.s. |
| IMC (kg/m2) | −0,35±2,08 | −0,22±2,25 | n.s. |
| Agua corporal total (L) | 1,35±2,58 | −1,03±5,86 | n.s. |
| Agua extracelular (L) | −0,01±1,50 | −0,06±2,20 | n.s. |
| Agua intracelular (L) | 1,37±2,79 | −0,92±3,72 | n.s. |
| Sobrehidratación (L) | −0,80±2,14 | 0,40±1,40 | n.s. |
| Masa magra (kg) | 3,64±10,86 | 0,26±11,24 | n.s. |
| Índice tejido magro (kg/m2) | 0,49±2,29 | −0,96±4,02 | n.s. |
| Masa grasa (kg) | −0,18±6,42 | 1,79±10,5 | n.s. |
| Índice tejido graso (kg/m2) | −0,55±3,57 | 0,63±5,20 | n.s. |
| Masa adiposa (kg) | −1,21±8,66 | 2,24±14,21 | n.s. |
| Masa celular (kg) | 1,26±4,35 | −1,98±8,01 | n.s. |
No se encontraron diferencias significativas en los parámetros de laboratorio basales ni en la composición corporal al inicio del estudio entre ambos grupos. Test de Mann-Whitney y Chi cuadrado/test exacto de Fisher, p<0,05.
BIS: bioimpedancia espectroscópica; c-HDL: colesterol ligado a lipoproteínas de alta densidad; c-LDL: colesterol ligado a lipoproteínas de baja densidad; HbA1c: hemoglobina glucosilada; HDF-OL: hemodiafiltración online; IMC: índice de masa corporal; n.s.: no significativo; PCR: proteína C reactiva; TG: triglicéridos; TRS: tratamiento renal sustitutivo.
La edad se correlacionó con un mayor descenso de albúmina sérica cada año (r=−0,515, p=0,004) y al final del seguimiento (r=−0,655, p<0,001), con un mayor descenso de prealbúmina cada año (r=−0,617, p<0,001) y al final del seguimiento (r=−0,673, p<0,001), y con volúmenes convectivos más bajos (r=−0,516, p=0,004).
En el modelo 1 del análisis de regresión multivariante (tabla 3) únicamente se mantiene la edad como predictor independiente de la reducción de prealbúmina a lo largo del seguimiento. En el modelo 2 solo se mantiene la asociación independiente con los niveles de prealbúmina y el peso al inicio del estudio.
Análisis de regresión lineal multivariante para la variación de prealbúmina a lo largo del seguimiento
| Modelo 1 | Coeficientes no estandarizados | Coeficientes tipificados | |||
|---|---|---|---|---|---|
| B | Error típ. | Beta | t | Sig. | |
| (Constante) | 12,497 | 23,682 | 0,528 | 0,602 | |
| Edad | −0,418 | 0,141 | −0,528 | −2,964 | 0,006 |
| Vol. sustitución | 0,432 | 0,647 | 0,119 | 0,667 | 0,510 |
| R2 corregida: 0,300 | |||||
| Modelo 2 | Coeficientes no estandarizados | Coeficientes tipificados | |||
| B | Error típ. | Beta | t | Sig. | |
| (Constante) | 16,007 | 31,911 | 0,502 | 0,624 | |
| Edad | −0,221 | 0,166 | −0,248 | −1,335 | 0,205 |
| Sexo | −3,600 | 4,535 | −0,157 | −0,794 | 0,442 |
| Tiempo de seguimiento | −0,087 | 0,086 | −0,208 | −1,023 | 0,325 |
| Vol. sustitución | −0,212 | 0,826 | −0,046 | −0,256 | 0,802 |
| Prealbúmina basal | −0,570 | 0,245 | −0,396 | −2,326 | 0,037 |
| Prealbúmina 1.er año | 0,362 | 0,320 | 0,184 | 1,130 | 0,279 |
| Peso basal | 0,314 | 0,141 | 0,361 | 2,223 | 0,045 |
| R2 corregida: 0,655 | |||||
Variables independientes del modelo 1: edad, volumen de sustitución. Variables independientes del modelo 2: edad, sexo, tiempo en HDF-OL, volumen de sustitución, prealbúmina basal, variación de prealbúmina en el primer año, peso basal.
Los resultados de p resaltados en negrita son los resultados significativos del análisis estadístico.
Las comparaciones entre el volumen de sustitución y los cambios analíticos por periodos cuatrimestrales [n=271] mostraron una correlación significativa con un descenso de HbA1c (r=−0,146, p=0,021), al igual que las comparaciones por periodos anuales [n=72] (r=−0,237, p=0,045). Un volumen de sustitución medio anual >26,6L/sesión (29,3±1,7L/sesión vs. 23,9±1,9L/sesión) se asoció a un descenso de HbA1c (−0,51±1,24% vs. 0,01±0,88%, p=0,043).
No se observó correlación entre el volumen de sustitución y las variaciones en el peso, IMC o parámetros de la BIS en el periodo entre las determinaciones.
No se encontró relación entre el volumen convectivo y los parámetros de laboratorio o composición corporal al inicio del estudio. Los pacientes con volumen convectivo más elevado (sustitución media >26,9L/sesión) finalizaron el estudio con niveles más altos de c-HDL (48,1±9,4mg/dL vs. 41,2±11,6mg/dL, p=0,025) y más bajos de PCR (0,21 [0,1-2,22] mg/dL vs. 1,01 [0,15-6,96] mg/dL, p=0,001).
Los pacientes en tratamiento con estatinas finalizaron el estudio con niveles más bajos de c-LDL (60,5±29,5mg/dL vs. 80,2±27,8mg/dL, p=0,028), aunque no se encontraron diferencias significativas en la reducción de los niveles en el seguimiento (−21,6±36,6mg/dL vs. −4,1±32,1mg/dL, p=0,186). Un paciente recibía ezetimiba asociada a atorvastatina.
Ningún paciente inició insulinoterapia una vez iniciado el estudio. No se recogieron cambios de dosis ni discontinuación de insulinoterapia a lo largo del seguimiento. No hubo diferencias en la evolución del perfil metabólico-nutricional ni en los cambios de composición corporal en los pacientes con y sin insulinoterapia o antidiabéticos orales (linagliptina).
DiscusiónEl estudio sugiere que los altos volúmenes de sustitución no suponen un empeoramiento del perfil metabólico en los pacientes con diabetes mellitus en hemodiálisis. Asumiendo la infusión de más cantidad de glucosa durante el tratamiento, encontramos una mejoría del perfil metabólico asociada a los altos volúmenes convectivos.
Balance de glucosa en hemodiafiltración online (HDF-OL) posdiluciónEl balance de glucosa a lo largo de una sesión de HDF-OL no solo depende de la glucosa infundida, sino que está condicionada por el transporte a través de la membrana y, fundamentalmente, por la glucemia. De esta manera, existe transporte difusivo (al tratarse de un soluto de bajo peso molecular) y existe pérdida de glucosa por convección con la ultrafiltración (con un coeficiente de cribado cercano a 1 con membranas de alta permeabilidad15), tanto de la ganancia de fluidos del periodo interdiálisis como del exceso de ultrafiltración que ha de reemplazarse en la línea venosa (HDF-OL posdilución).
La concentración de glucosa más utilizada del baño de diálisis y, en el caso de HDF-OL, del líquido de sustitución, es de 100-200mg/dL16,17. Excluyendo la pérdida de glucosa por ultrafiltración que se produce si existe balance negativo, la transferencia de glucosa dependerá de la diferencia de concentración entre la sangre y el líquido de diálisis (con 100mg/dL en nuestro caso): los pacientes con glucemias en torno a 100mg/dL tendrán un balance neutro de glucosa (tanto por difusión como por ultrafiltración y reinfusión del líquido); los pacientes con glucemias >100mg/dL tendrán un balance negativo de glucosa (tanto por difusión como por ultrafiltración y reinfusión del líquido con menor concentración de glucosa que la plasmática) y, por tanto, únicamente los pacientes con glucemias <100mg/dL tendrán un balance positivo tanto por difusión como por convección. Del mismo modo, las pérdidas de glucosa al eliminar la sobrecarga hídrica también serán variables dependiendo de la glucemia (pérdida de 1g/L de UF por cada 100mg/dL de glucemia).
Según este modelo, solo con glucemias <100mg/dL el incremento del volumen de sustitución supone un pequeño aumento en la cantidad de glucosa infundida (por ejemplo, 10g más de glucosa al aumentar de 25 a 35L el volumen de sustitución en una sesión de HDF-OL), pero con glucemias >100mg/dL el aumento del volumen de sustitución supone una mayor eliminación de glucosa por transporte convectivo (al ultrafiltrar un agua plasmática con mayor concentración de glucosa que la infundida). Estos modelos teóricos no tienen en cuenta la variabilidad de la glucemia a lo largo de la sesión, que esta se ve modificada por las concentraciones de glucosa del baño y por múltiples mecanismos externos al tratamiento (hormonales, corticoides, catecolaminas, la ingesta, etc.), ni la interferencia entre los transportes difusivo y convectivo en el dializador.
La hipótesis de que una mayor infusión pueda suponer una mayor carga de glucosa, si bien no apoya la tendencia a reducir el volumen de sustitución por las numerosas ventajas asociadas a los altos transportes convectivos, podría plantear la realización de otros estudios utilizando diferentes concentraciones de glucosa en el baño. Algunos estudios en pacientes no diabéticos en hemodiálisis convencional no encuentran cambios hemodinámicos al eliminar la glucosa del líquido18, y es raro desarrollar hipoglucemias con los baños de diálisis sin glucosa19. Aunque el uso potencial de líquidos de diálisis con concentraciones más bajas pudiera conllevar cambios en el balance de glucosa, deberían evaluarse tanto los cambios osmolares derivados de la menor concentración en el líquido como las modificaciones necesarias en la conductividad (para evitar descensos bruscos en la volemia) o en la concentración de potasio en el baño (al condicionar una menor secreción de insulina y mayor eliminación de potasio), y las consecuencias de estas modificaciones a largo plazo (como un aumento de la transferencia de sodio, o la depleción intracelular de potasio y el incremento en el riesgo de arritmias).
Evolución del perfil metabólicoLa mejoría del perfil metabólico en los pacientes con volúmenes de sustitución más elevados deriva de una reducción de los niveles de triglicéridos y un incremento en las cifras de c-HDL, resultando en un menor índice de aterogenicidad. Sin embargo, hay que destacar que la asociación del volumen convectivo con la evolución del perfil metabólico, aunque clínicamente significativa, parece ser moderada-baja. Probablemente estos cambios están asociados a una menor inflamación sistémica que se observa de forma temprana tras el inicio de la técnica. Mientras que la edad avanzada se relaciona con unos volúmenes convectivos más bajos y explica la mejor evolución de los parámetros nutricionales en los pacientes jóvenes (con un transporte convectivo más elevado), los beneficios en el perfil lipídico e inflamatorio no tuvieron relación con la edad.
A pesar de una mayor infusión de glucosa, los pacientes con altos volúmenes no tuvieron peor control glucémico de la diabetes (HbA1c) ni más hipertrigliceridemia. La asociación entre los altos volúmenes y un descenso de HbA1c al aumentar la muestra (por periodos de tiempo) apunta a un mejor control metabólico en estos pacientes, a pesar de tener una mejor evolución de parámetros nutricionales y de, probablemente, una mayor ingesta dietética.
Estos resultados sugieren que los altos volúmenes no inducen negativos o deletéreos en el control metabólico o la composición corporal de los pacientes diabéticos en HDF-OL, y permiten asumir la infusión de una pequeña cantidad más de glucosa al incrementar el volumen de sustitución.
Mientras que la mayoría de estudios encuentran que el tratamiento farmacológico para el control de los factores de riesgo cardiovascular no es claramente efectivo en la reducción de los eventos o de la mortalidad de los pacientes en diálisis20, varios ensayos clínicos sí encuentran esta mejoría con la HDF-OL. En este sentido, ningún ensayo ha demostrado un claro efecto beneficioso en el manejo de la dislipidemia en la enfermedad renal crónica en diálisis21-23, pero en este caso la propia técnica podría contribuir a la mejoría de estos pacientes, independientemente de la intervención farmacológica planificada anteriormente.
Al igual que los beneficios de la HDF-OL y de los altos volúmenes han sido atribuidos a múltiples mecanismos24 (mejor depuración de toxinas urémicas, menor inflamación, más estabilidad hemodinámica, menor temperatura, etc.), probablemente la mejoría del control metabólico también tenga un origen multifactorial, y no se puede descartar que esta mejoría sea en parte responsable de la reducción del riesgo cardiovascular y la mortalidad. De forma global, no hay suficiente evidencia para elegir una técnica de baja eficacia convectiva en ninguna población de pacientes en diálisis, y tampoco para restringir el transporte convectivo en los pacientes diabéticos en HDF-OL por el contenido de glucosa del líquido de sustitución.
LimitacionesLa principal limitación del estudio es su reducido tamaño muestral para el diseño observacional, que no permite asumir beneficios del transporte convectivo en el perfil metabólico. Por otro lado, varios factores han podido influir en la cantidad de volumen convectivo alcanzado, tanto dependientes del paciente (edad, composición corporal, anemia y hemoconcentración, etc.) como de la utilización de diferentes monitores y dializadores de alta permeabilidad. Otras limitaciones incluyen la variabilidad del periodo de seguimiento, no disponer de los cambios de dosis o la retirada de insulina e hipolipemiantes, y el valor dudoso de los niveles plasmáticos de lípidos o de HbA1c en los pacientes en diálisis.
ConclusiónEn conclusión, no existe evidencia para limitar el transporte convectivo en los pacientes diabéticos en HDF-OL por el contenido de glucosa del líquido de sustitución. La HDF-OL con altos volúmenes de sustitución puede aportar una mejoría del control metabólico en los pacientes diabéticos en HDF-OL, que podría estar contribuyendo al beneficio en el control del riesgo cardiovascular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.