El conocimiento de las vías de señalización implicadas en distintas enfermedades ha permitido avances en el entendimiento del modelo fisiopatológico, diagnóstico y terapéutico de varias enfermedades inflamatorias y autoinmunes. El lupus eritematoso sistémico es una enfermedad autoinmune ampliamente estudiada, la cual puede afectar múltiples órganos, con un importante impacto en la morbimortalidad cuando existe afectación renal. Durante los últimos 10 años ha aumentado el interés sobre el papel de la vía de señalización del TWEAK/Fn14 en la nefritis lúpica al igual que en otros escenarios clínicos. Este artículo realiza una revisión de la literatura del papel de esta vía dentro de la nefritis lúpica, recalca la importancia del TWEAK en orina (uTWEAK) como biomarcador de la enfermedad, indica los resultados favorables obtenidos en la inhibición de la vía del TWEAK/Fn14 como diana terapéutica en modelos experimentales animales publicados en la literatura y muestra su posible utilidad en otros escenarios. Los diferentes ensayos clínicos en curso y otras futuras investigaciones darán un mejor panorama en cuanto al beneficio real del bloqueo de esta vía en el curso clínico de estas enfermedades.
Knowledge of the signalling pathways involved in various diseases has enabled advances in the understanding of pathophysiological, diagnostic and therapeutic models of several inflammatory and autoimmune diseases. Systemic lupus erythematosus is a widely studied autoimmune disease that can affect multiple organs, with a major impact on morbidity and mortality when it involves the kidneys. Over the past 10 years, interest in the role of the TWEAK/Fn14 signalling pathway in lupus nephritis, as well as other clinical settings, has increased. By reviewing the literature, this article assesses the role of this pathway in lupus nephritis, underlines the importance of TWEAK in urine (uTWEAK) as a biomarker of the disease and stresses the favourable results published in the literature from the inhibition of the TWEAK/Fn14 pathway as a therapeutic target in experimental animal models, demonstrating its potential application in other settings. Results of ongoing clinical trials and future research will give us a better understanding of the real benefit of blocking this pathway in the clinical course of several conditions.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune de etiología multifactorial, caracterizada por la formación de inmunocomplejos (antígeno-anticuerpo) que se depositan y localizan en distintos órganos, además de por la activación del sistema del complemento, la infiltración de células inflamatorias en tejidos diana, una hiperreactividad linfocitaria y pérdida en los mecanismos de depuración de inmunocomplejos por parte del sistema retículo endotelial1. La consecuencia en la alteración de la homeostasis dentro del sistema inmune, propia de individuos con LES, es la responsable del daño tisular y la afectación sistémica secundaria. El compromiso renal por LES se presenta en cerca de un 50% de los pacientes en algún momento de la enfermedad y es considerado como un indicador de morbimortalidad2. La nefritis lúpica (NL) se caracteriza por la diversidad en su forma clínica de presentación. El compromiso glomerular secundario contribuye a la aparición de hematuria, proteinuria y al deterioro progresivo de la función renal. Su patrón histológico es dinámico y cambiante, por lo que su conocimiento es de vital importancia en términos de tratamiento y pronóstico.
A pesar de los avances en el conocimiento de la fisiopatología de la enfermedad y del arsenal terapéutico disponible actualmente, las tasas de respuesta (remisión completa+remisión parcial) en NL no superan el 60% en el mejor de los casos2. Cerca de un 25% de los pacientes con afectación renal por LES progresarán a glomeruloesclerosis con requerimiento de terapia de reemplazo renal.
El conocimiento de la vía de señalización TNF-related weak inducer of apoptosis (TWEAK/Fn14) en los últimos años ha permitido establecer cómo esta puede jugar un papel importante dentro del modelo fisiopatológico en la NL. El TWEAK es una glicoproteína de membrana tipo ii que pertenece a la superfamilia del TNF, producida de manera endógena en bajas concentraciones por células del sistema inmune (monocitos-macrófagos) y por células no inmunes en distintos tejidos, por ejemplo (células renales, células endoteliales, membrana sinovial, mucosa intestinal). El Fn14 es una proteína de membrana tipo i que pertenece a la superfamilia de receptores del TNF y cuyo ligando específico es el TWEAK3. Modelos experimentales en animales y posteriormente en seres humanos han mostrado el papel del TWEAK/Fn14 en la NL4. Si bien la vía del TWEAK/Fn14 no es específica de esta entidad, su conocimiento permitirá el desarrollo de futuras intervenciones médicas que modifiquen el curso natural de la enfermedad.
El presente artículo discute el modelo fisiopatológico de la vía del TWEAK/Fn14 en la NL, recalca la importancia del TWEAK en orina (uTWEAK) como biomarcador de la enfermedad, indica los resultados favorables obtenidos en la inhibición de la vía del TWEAK/Fn14 como diana terapéutica en modelos experimentales animales publicados en la literatura y define los parámetros iniciales para futuras investigaciones.
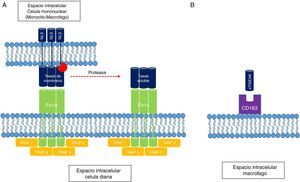
Papel fisiológico del TWEAK/Fn14Estructura molecularComo se mencionó anteriormente, el TWEAK es una glicoproteína de membrana tipo ii de 249 aminoácidos (aa) expresada por células del sistema inmune (monocitos-macrófagos) y células no inmunes, cuya producción endógena y fisiológica es baja. Su dominio extracelular C-terminal es susceptible de proteólisis por proteasas que permiten que la forma soluble de la molécula (sTWEAK) circule libremente. El dominio intracelular N-terminal también posee regiones susceptibles de clivaje por proteasas que facilitan la exposición de secuencias de localización nuclear cuya función hasta el momento es incierta5. Debido a su homología estructural con el TNF, su actividad biológica es dependiente de la formación de trímeros para su unión específica al receptor Fn14 (CD 266). El Fn14 es una proteína de membrana tipo i de 129 aa expresada en bajas concentraciones en las células y que pertenece a la superfamilia de receptores del TNF. Su dominio extracelular N-terminal posee regiones ricas en serina que participan en la unión con su ligando específico, TWEAK. El dominio intracelular C-terminal permite el reclutamiento de proteínas del tipo TRAF (factores asociados al receptor del TNF) que inician la cascada de señalización intracelular. A diferencia de otros receptores de la superfamilia del TNF que reclutan complejos del tipo FADD, TRADD y TRAF, el Fn14 solo recluta complejos del tipo TRAF5 (fig. 1). Esta diferencia es muy importante, pues explica la capacidad apoptótica débil del TWEAK, que solo puede ser mediada por la vía mitocondrial y no por receptores de muerte, propia de la vía extracelular.
A) Interacción TWEAK/Fn14. El receptor Fn14 es capaz de ligar mTWEAK y sTWEAK y facilitar el reclutamiento de dominios del tipo TRAF, que inician la cascada de señalización intracelular. B) El receptor tipo scavenger de macrófagos también es capaz de ligar sTWEAK y facilitar su interiorización dentro del citoplasma.
NLS: secuencias de localización nuclear; sTWEAK: TWEAK soluble.
De igual forma se ha podido establecer cómo el único ligando para el Fn14 es el TWEAK. El receptor tipo scavenger CD 163 expresado por macrófagos tiene la capacidad de ligar TWEAK y facilitar la interiorización y posterior depuración de la forma soluble de la molécula (sTWEAK), por lo que se cree que este mecanismo constituye una vía de regulación negativa del TWEAK/Fn146.
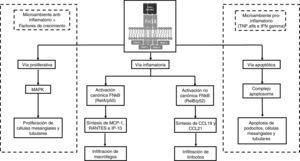
Vías efectoras de señalizaciónUna vez se ha dado la unión del mTWEAK o sTWEAK con su receptor Fn14, la vía de señalización intracelular puede derivar en una de las 3 vías efectoras: la inflamatoria, la proliferativa o la apoptótica (fig. 2). Quizás, la vía mejor caracterizada es la inflamatoria, pues se conocen vías de señalización citoplasmática similares en otras poblaciones celulares. Esta vía efectora depende de la activación canónica o no canónica del factor de transcripción del NF-kB (factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas). La interacción mTWEAK/Fn14 favorece que predominen señales de activación canónica del NF-kB con la formación del heterodímero RelA/p50 en el citoplasma de la célula efectora. De otro lado, la interacción sTWEAK/Fn14 favorece las señales de activación no canónica del NF-kB a través del heterodímero RelB/p525,6. Desde un punto de vista clínico, esta diferencia en la forma de activación del NF-kB no tendría un significado mayor, sin embargo, desde el punto de vista inmunológico, las diferencias en el tipo de genes transcritos y el tipo de células del sistema inmune reclutadas en el tejido diana son fundamentales. La activación canónica temprana del NF-kB (RelA/p50) favorece la síntesis y secreción de la proteína quimioatrayente de monocitos tipo 1 (MCP-1), la quimiocina CCL5 (RANTES) y la quimiocina CXCL10 (IP-10). Este gradiente de quimiocinas permite la infiltración de macrófagos en los tejidos. De otro lado, la activación no canónica tardía del NF-kB (RelB/p52) favorece la síntesis de quimiocinas CCL19 y CCL21, cuyo gradiente facilita la infiltración de linfocitos T en los órganos diana.
Papel del TWEAK/Fn14 en la nefritis lúpica. La unión del TWEAK al receptor Fn14 favorece la activación de una de las 3 vías efectoras, dependiendo del tipo de célula estimulada, el microambiente celular y la señalización intracelular generada.
IP-10: proteína 10 interferón gamma inducible; MAPK: proteincinasas activadas por mitógenos; MCP-1: proteína quimioatrayente de monocitos tipo 1; NF-kB: factor nuclear kappa B.
La activación de las 2vías efectoras restantes como consecuencia de la interacción TWEAK/Fn14 va a depender específicamente del microambiente celular existente. En un ambiente celular en ausencia de inflamación y rico en factores de crecimiento, la vía efectora dominante será la proliferativa. Por el contrario, en presencia de citocinas proinflamatorias (TNF α-IFN γ) predominará la vía efectora apoptótica. Esta diferencia totalmente opuesta en estas 2vías efectoras radica principalmente en las diferentes concentraciones citoplasmáticas de complejos proteicos antiapoptóticos (Bcl2) y proapoptóticos (Bax) respectivamente7. Además, en la vía efectora proliferativa hay un incremento en la actividad de proteincinasas activadas por mitógenos (MAPK) mientras que en la vía efectora apoptótica existe un aumento funcional del complejo apoptosoma (APAF-1, citocromo C, procaspasa 9) que media la muerte celular programada por vía mitocondrial8.
Estos hallazgos en la vía efectora proliferativa han sido mostrados por Sanz et al., en el escenario de hiperplasia renal compensatoria posnefrectomía unilateral, en donde se evidencia proliferación del epitelio tubular renal inducida por TWEAK/Fn149. De igual forma, por Gao et al., en donde la estimulación del TWEAK/Fn14 contribuyó a la proliferación de células renales humanas (mesangiales, podocitarias y epiteliales tubulares) en modelos in vitro e in vivo10.
Papel del TWEAK/Fn14 en la nefritis lúpicaComo ha sido descrito previamente, en estados de reposo celular, en ausencia de estímulos lesivos e inflamatorios, la expresión de TWEAK y Fn14 por parte de los tejidos es baja11. Sin embargo, en fenómenos inflamatorios como en el LES, existe un incremento en la expresión del receptor Fn14 por parte de las células renales, elevación que no es proporcional a la disponibilidad del mTWEAK/sTWEAK, cuyo incremento es menor a pesar de estas condiciones proinflamatorias4. Además, se ha podido establecer como en pacientes con NL existe un incremento en la expresión del Fn14 en 3 tipos de células renales: los podocitos, las células mesangiales glomerulares y el epitelio tubular proximal. Este fenómeno pudiera explicar, en parte, la proliferación mesangial, la podocitopatía y el daño tubular observado en las biopsias de pacientes con afectación renal por LES. La activación de la vía inflamatoria previamente mencionada contribuye a la infiltración de macrófagos y linfocitos a nivel glomerular y tubular, a la citotoxicidad directa mediada por estas células y a la apoptosis mesangial y tubular, eventos que progresivamente favorecen el deterioro de la función renal. Todos estos cambios sumados a la activación del sistema del complemento y al depósito de inmunocomplejos aceleran el daño renal.
En la práctica clínica actual, se dispone de marcadores de actividad de la enfermedad con ciertas limitaciones, dadas su sensibilidad y especificidad reducidas. Desde un punto de vista inmunológico, solo 2marcadores se utilizan de manera regular para realizar el seguimiento de la actividad en NL: los niveles del complemento sérico (C3-C4) y los títulos de anticuerpos antids-ADN12,13. Es así como la investigación en los últimos años se ha centrado en la búsqueda de nuevos biomarcadores capaces de predecir con anticipación las recaídas de la enfermedad, esto con el fin de iniciar esquemas de rescate con un régimen inmunosupresor más agresivo para disminuir el potencial daño ocasionado durante una recaída renal14. La orina, como muestra biológica procedente del filtrado glomerular, puede reflejar de manera directa los fenómenos inflamatorios y citotóxicos que están ocurriendo durante una recaída. Estudios de proteómica en muestras de orina en pacientes con LES y afectación renal han permitido reconocer biomarcadores potenciales que pudieran servir como predictores de actividad de la enfermedad15. De esta manera fue como Mosley et al., mediante análisis proteómico en orina, lograron identificar 2 proteínas como biomarcadores candidatos para distinguir entre NL activa e inactiva, al igual que diferenciar entre recaída y remisión de la enfermedad16.
Xuejing et al., por ejemplo, encontraron cómo, tras el análisis de la orina en 46 pacientes con LES con o sin afectación renal secundaria, los niveles de uTWEAK fueron significativamente más altos en aquellos con NL activa vs. aquellos sin NL activa17. Estos niveles de uTWEAK se correlacionaron de manera directa con el índice de actividad total, índice de actividad glomerular y tubulointersticial, pero no con el índice de cronicidad. Asimismo, hubo una relación significativa entre los niveles de uMCP-1 y la actividad renal por LES.
Otros estudios como el de Schwartz et al. en 2006, en el que estudiaron 2 cohortes de pacientes con LES, la(Ohio SLE Study (OSS) y la Albert Einstein College of Medicine (AECOM) mostraron una correlación directa entre los niveles de uTWEAK y el rSLEDAI, sistema de puntuación utilizado para evaluar el grado de actividad renal en pacientes con LES18. De igual manera y como era de esperarse, hubo una correlación directamente proporcional entre los niveles de uTWEAK y los títulos antids-ADN e inversamente proporcional a los niveles de complemento sérico (C3-C4). Es interesante observar cómo el tipo de terapia inmunosupresora utilizada no influyó en un cambio significativo en los niveles de uTWEAK entre pacientes, quienes recibieron y no recibieron este tipo de medicación, lo que indica, posiblemente, que el arsenal terapéutico disponible en la actualidad no bloquea la vía de señalización TWEAK/Fn14. Este mismo grupo19 mostró como existía una diferencia estadísticamente significativa entre los niveles de uTWEAK, no solo entre pacientes con NL activa e inactiva, sino también respecto a individuos sanos, pacientes con artritis reumatoide (AR) y osteoartritis, por lo que, a pesar de existir un estado inflamatorio en estos otros escenarios clínicos, el uTWEAK pudiera ser un biomarcador más específico del compromiso renal por LES.
Otros biomarcadores en orina en LESNo solo el uTWEAK ha sido identificado como biomarcador potencial en NL. El-Shehaby et al., en 2011, mostraron también cómo niveles de uMCP-1, osteoprotegerina en orina (uOPG) e IL-8 en orina fueron significativamente más elevados en pacientes con NL activa que en aquellos sin NL20. De igual manera, hubo una correlación directa entre los niveles de uTWEAK, uMCP-1, osteoprotegerina en orina y el puntaje del rSLEDAI.
Hutcheson et al.21 evaluaron en 38 pacientes con NL el papel de las adipoquinas, proteínas derivadas del tejido adiposo, tanto en sangre como en orina, y su utilidad como biomarcadores de predicción de la afectación renal por LES. Los autores encontraron que los pacientes con NL tenían mayores niveles séricos de adiponectina, leptina y resistina respecto a los controles sanos. Sin embargo, la resistina en orina fue la única que mostró capacidad de predicción. De todas las adipoquinas evaluadas, solo la resistina en suero se correlacionó de manera directa con indicadores de daño renal (creatinina, BUN e índice proteinuria/creatinuria).
Se han realizado grandes esfuerzos en investigación para identificar la utilidad de estos biomarcadores para predecir no solo el curso clínico de la enfermedad sino también el tipo de variedad histológica del compromiso renal por LES22–24 que, como sabemos, hace parte fundamental dentro del diagnóstico, tratamiento y pronóstico de la enfermedad. Estudios como el de Brunner et al.25, por ejemplo, identificaron cómo la combinación de uMCP-1, la glicoproteína alfa 1 ácida en orina (uAAG) y la ceruloplasmina en orina fueron excelentes biomarcadores para predecir NL proliferativa activa cuando se adicionaba el uso del índice proteinuria/creatinuria como marcador clínico de la enfermedad. De otro lado, encontraron como la lipocalina de gelatinasa de neutrófilos en orina (uNGAL), uMCP-1 en combinación con la depuración de creatinina sérica como marcador clínico, eran predictores de cronicidad en NL y como la glicoproteína alfa 1 ácida en orina, niveles séricos de C4 junto con la depuración de creatinina fueron excelentes predictores de NL membranosa. A pesar de estos hallazgos, a la fecha no existe biomarcador alguno capaz de reemplazar a la biopsia renal como estándar de oro para el diagnóstico del tipo de NL en curso.
La utilidad de otros biomarcadores en orina tanto en el LES como en otras glomerulopatías está fuera del alcance del presente artículo, pero han sido revisados recientemente26,27.
TWEAK/Fn14 en otros escenarios clínicosA partir de la caracterización completa de la vía de señalización TWEAK/Fn14, se ha podido avanzar en líneas de investigación en otros escenarios clínicos distintos al modelo de afectación renal por LES. Sin duda alguna, uno de los campos en donde más se ha avanzado es en el de la enfermedad cardiovascular ateroesclerótica. Al igual que la diabetes mellitus, la enfermedad renal crónica (ERC) es considerada como un factor de riesgo cardiovascular. Fernández-Laso et al.28 encontraron en una cohorte de 1.058 pacientes con ERC estadio 3-5D y sin historia de enfermedad cardiovascular conocida, cómo los niveles de sTWEAK séricos disminuían conforme el estadio de la ERC avanzaba. De igual forma, hallaron que aquellos individuos con reducción en los niveles de sTWEAK tenían mayor engrosamiento de la íntima-media carotídea, tendencia que se mantuvo respecto a la presencia y gravedad de placas ateroescleróticas, calcificadas o no, a este nivel. Una vez se realizó el ajuste de variables por el modelo de regresión logística de Cox, se pudo determinar en esta cohorte de pacientes que los individuos con niveles más bajos de sTWEAK a nivel sérico tuvieron mayor tasa de eventos cardiovasculares fatales y no fatales. Esta reducción en las concentraciones séricas del sTWEAK respecto a la severidad de la lesión endotelial pareciera ser explicada por la mayor unión del sTWEAK al Fn14 expresado por las células endoteliales lesionadas, lo que disminuye significativamente los niveles séricos del sTWEAK medido.
En otro estudio, Akdoğan et al.29 evaluaron en una cohorte de 97 pacientes con ERC estadio 2-3, llevados a cateterismo cardíaco para estratificación invasiva de enfermedad coronaria mediante el puntaje de Gensini (el puntaje máximo de 32 puntos indica oclusión coronaria del 100%), el comportamiento en los niveles séricos de sTWEAK y MCP-1. Es llamativo que encontraran una relación directamente proporcional entre los niveles de sTWEAK, MCP-1 y el puntaje de Gensini obtenido.
Por su parte, Jasiewicz et al.30 evaluaron la relación del TWEAK en otros escenarios cardiovasculares. Este grupo realizó un estudio comparativo entre 26 pacientes con hipertensión pulmonar confirmada mediante cateterismo cardíaco derecho y 24 voluntarios sanos. Sus resultados mostraron cómo individuos con hipertensión pulmonar presentaban mayor expresión del marcador CD 163 (receptor tipo scavenger de macrófagos) y menores niveles séricos de sTWEAK respecto a los voluntarios sanos. La explicación para estos resultados no es del todo clara, pero, como previamente se ha mencionado, por una parte la unión del sTWEAK con el Fn14 pudiera explicar su menor concentración sérica y, por otra, la mayor expresión del receptor CD 163 pudiera estar hablando de una activación de los mecanismos de regulación negativa del TWEAK/Fn14. Sin embargo, estas son solo hipótesis aún sin confirmar.
Dada la homología estructural entre el TNF y el TWEAK, se ha extrapolado el papel protagónico del TNF dentro de la fisiopatología de otro tipo de enfermedades y su relación con la vía de señalización del TWEAK. Dolencias como la enfermedad inflamatoria intestinal (EII), la psoriasis y la AR se caracterizan por los altos niveles de TNF alfa en los tejidos afectados. Se ha descrito, por ejemplo, la expresión del ARN mensajero de TWEAK en la mucosa de pacientes con EII con un incremento exponencial y directo conforme a la actividad de la enfermedad31. De otro lado, Bilgiç et al.32 estudiaron las diferencias en la expresión del TWEAK y otras citocinas (IL-6, IL-23, TNF alfa) a nivel sérico en 45 pacientes con psoriasis crónica y 43 voluntarios sanos. Sus resultados mostraron que sTWEAK, IL-6, IL-23 y TNF alfa en suero fueron significativamente más altos en individuos con psoriasis crónica que en voluntarios sanos, sin embargo, estos no se correlacionaron con la severidad de la enfermedad estimada mediante el PASI (índice de gravedad y área de afectación con psoriasis). En AR se ha encontrado un incremento en las concentraciones de sTWEAK en el líquido sinovial de pacientes con enfermedad activa, además de un aumento en la expresión del RANKL por parte de los sinoviocitos33 y osteoblastos34 inducida por el sTWEAK. Comparativamente con artritis psoriásica, los pacientes con AR activa presentan más altos niveles de sTWEAK, lo que explica, en parte, el potencial daño articular de esta enfermedad35.
Por último, se ha utilizado al sTWEAK como biomarcador en términos de recuperación en la función endotelial posterior al trasplante renal. Yilmaz et al.36 publicaron en 2013 un estudio en el que siguieron durante 6 meses una cohorte de 175 pacientes con trasplante renal. Evaluaron la función endotelial mediante la medición de la dilatación en la arteria braquial a través del flujo medio sanguíneo por técnica doppler al día 0 y día 180 postrasplante. De igual forma, evaluaron el cambio en las concentraciones séricas del sTWEAK durante el mismo periodo de tiempo. Sus resultados mostraron como la mejoría en el flujo sanguíneo doppler se correlacionaba directamente con la normalización en las concentraciones séricas del sTWEAK, posiblemente con relación a su menor unión con el Fn14 expresado por las células endoteliales.
TWEAK/Fn14 como diana terapéuticaSon varios los modelos experimentales en animales y humanos que han evaluado la utilidad del bloqueo de la vía de señalización del TWEAK/Fn14 en varios escenarios clínicos37 (tabla 1). Estudios en animales en los que se indujo daño renal agudo tras sobredosis de ácido fólico han mostrado cómo el bloqueo del TWEAK/Fn14 está relacionado con mejoría en la función renal, reducción de la inflamación intersticial, disminución de la proliferación y muerte tubular38. Estos hallazgos fueron reproducidos también en otro modelo animal de daño renal agudo mediante inducción de lesión renal por isquemia-reperfusión39. En este trabajo, por ejemplo, se demostró adicionalmente una disminución en la fibrosis intersticial renal residual cuando se bloqueó al TWEAK/Fn14.
Modelos experimentales murinos de la vía del TWEAK/Fn14 como diana terapéutica en varios escenarios clínicos
| Autor (año) | Escenario clínico | Metodología | Resultados |
|---|---|---|---|
| Desplat-Jego et al. (2005)45 | Encefalomielitis autoinmune experimental | Anti-TWEAK | Disminución en puntaje de gravedad (40-80%) e infiltración leucocitaria en tejido cerebral |
| Perper et al. (2006)46 | Artritis inducida por colágeno | Anti-TWEAK | Reducción en niveles séricos de mediadores artritogénicos (RANTES, IP-10, MCP-1, CCL4, CXCL1) |
| Zhao et al. (2007)47 | Nefritis inducida en enfermedad de injerto vs. huésped (LES) | Anti-TWEAK | Disminución en expresión de IL-6, MCP-1 e IL-10 a nivel renal y reducción de proteinuria |
| Sanz et al. (2008)38 | Daño renal agudo por sobredosis de ácido fólico | Anti-TWEAK | Disminución de expresión de MCP-1 y RANTES en un 60% en el epitelio tubular renal |
| Sanz et al. (2009)9 | Daño renal agudo posnefrectomía unilateral (modelo no inflamatorio) | Ratones TWEAK-/-(knockout) | Reducción en proliferación y apoptosis tubular, mejoría en la función renal |
| Muñoz-García et al. (2009)48 | Nefropatía inducida por dieta hiperlipidémica | Ratones ApoE-/-(knockout)+Anti-TWEAK | Disminución en expresión de RANTES y MCP-1, infiltración de macrófagos y severidad de lesión renal |
| Hotta et al. (2011)39 | Injuria renal aguda por isquemia reperfusión | Anti-Fn14 | Reducción de citocinas inflamatorias, infiltración de macrófagos-neutrófilos a nivel tubular |
| Xia et al. (2012)40 | Nefritis sérica nefrotóxica | Ratones Fn14+/+ WT (wild type) vs. Fn14-/- KO (knockout) | Reducción de proteinuria, enfermedad tubular y formación de semilunas |
Xia et al. reprodujeron un modelo de nefritis nefrotóxica cuya base inmunológica parte del depósito de inmunocomplejos a nivel glomerular, simulando las condiciones de la NL, para demostrar el curso clínico, paraclínico e histopatológico en una modelo murino al bloquear la vía del TWEAK/Fn1440. Fueron analizados de forma comparativa murinos Fn14+/+ WT (wild type) y Fn14−\− KO (knockout). Los ratones Fn14−/− KO tuvieron menor grado de proteinuria, menor enfermedad tubular y menor formación de semilunas respecto a las cepas que expresaban Fn14. De otro lado, el uso de anticuerpo monoclonal anti-TWEAK inyectado en los ratones que no fallecieron tras la uremia postinoculación de suero nefrotóxico mostraron menor intensidad en la coloración de ácido peryódico de Schiff, menor índice de proliferación (Ki 67+) y menor infiltración de macrófagos a nivel glomerular en cada una de las biopsias analizadas.
A pesar de todos estos efectos potencialmente benéficos del bloqueo de la vía del TWEAK/Fn14 en distintas enfermedades, no todos los estudios han mostrado resultados favorables. Mustafa et al. exploraron en un modelo murino si la ablación génica o farmacológica del TWEAK/Fn14 modificaba los cambios histológicos de la sustancia nigra y estriada en la enfermedad de Parkinson41. Sus resultados no pudieron demostrar reducción en la neurotoxicidad aguda mediada por 1-metil-4-fenil-1,2,3,6-tetrahidropiridina tras la ablación genética del TWEAK y del Fn14.
En humanos, se encuentran en marcha estudios en fase i y fase ii que evalúan el papel del TWEAK/Fn14 como diana terapéutica en AR42, tumores sólidos avanzados43 y NL44. Sus resultados darán un mejor panorama en cuanto a la utilidad del bloqueo de esta vía en estos escenarios clínicos.
Conclusiones y futuras perspectivasMucho se ha avanzado en el conocimiento de la vía del TWEAK/Fn14 dentro del modelo fisiopatológico de varios tipos de enfermedades autoinmunes e inflamatorias. Por ahora, queda claro que el TWEAK/Fn14 está involucrado en los procesos de inflamación, proliferación y apoptosis de podocitos, células mesangiales glomerulares y células epiteliales tubulares de pacientes con afectación renal por LES. A la luz de la evidencia actual podríamos considerar la vía del TWEAK/Fn 14 como un mecanismo necesario pero no suficiente para explicar por completo los fenómenos potencialmente lesivos de este tipo de enfermedades. La utilidad clínica del bloqueo de la vía del TWEAK/Fn 14 evaluada en estudios en curso determinará la importancia real de esta molécula como actor protagónico dentro de la NL y otros escenarios clínicos.
- -
La activación de la vía del TWEAK/Fn14 en la NL contribuye a la infiltración de macrófagos y linfocitos a nivel glomerular y tubular, a la citotoxicidad directa mediada por estas células y a la apoptosis mesangial y tubular.
- -
La via de señalización del TWEAK/Fn 14 participa en la patogénesis de una serie de procesos inflamatorios crónicos tales como la psoriasis, la enfermedad inflamatoria intestinal, la artritis reumatoide y la enfermedad renal crónica terminal, entre otras.
- -
Las concentraciones urinarias de TWEAK se han relacionado con la NL activa y se han correlacionado de manera directa con el índice de actividad total y el índice de actividad glomerular y tubuloulointersticial en la biopsia renal.
- -
El bloqueo de la vía TWEAK/Fn 14 en una diana terapéutica atractiva en la NL y otras enfermedades inflamatorias crónicas con diversos estudios de fase i y fase ii en curso.
Los autores declaran no tener ningún conflicto de intereses.
José A. Gómez-Puerta recibe apoyo de Colciencias (convocatoria 656 de 2014).