Los casos de hemorragia renal que provocan un compromiso para la vida del paciente requieren de una cirugía urgente. Actualmente la cirugía endovascular es el tratamiento de primera elección.
ObjetivoRevisar los pacientes con una hemorragia renal que fueron intervenidos de urgencia mediante una técnica endovascular en nuestro centro. Evaluar las causas de sangrado renal, el tratamiento realizado así como los resultados obtenidos.
Material y métodosRealizamos un estudio retrospectivo de pacientes consecutivos con sangrado renal y que fueron tratados con una técnica endovascular entre junio del 2012 y junio del 2017 en el Hospital Universitari Joan XXIII (Tarragona). Se recogieron los datos demográficos (edad, sexo, comorbilidad) y otras variables relacionadas (mecanismo de la lesión, la estabilidad hemodinámica y si estaba en tratamiento anticoagulante). También se analizaron los hallazgos encontrados en la angio-TAC, el tiempo transcurrido entre el diagnóstico y la realización de la cirugía, la técnica endovascular y el material utilizado, la extensión de parénquima embolizado y los resultados obtenidos.
ResultadosIncluimos a 22 pacientes con una edad media de 63 años (19-85). Las causas de lesión fueron relacionadas con punción de una biopsia renal (n=7,31; 8%), sangrado de tumoraciones malignas renales (n=5; 22,7%), traumatismos (n=4; 18,2%), angiomiolipomas (n=2; 9,1%), sangrado espontáneo (n=2; 9,1%) y complicaciones quirúrgicas (n=2; 9,1%). En todos los casos la técnica endovascular realizada fue la embolización. El material utilizado fue: esferas (9,1%), coils (63,6%), esferas+coils (18,2%), esferas+oclusor (9,1%). En 17 de los casos (77,3%) se llevó a cabo una embolización selectiva y en 5 casos (22,7%) una embolización de todo el riñón. El éxito clínico y técnico fue del 100%. La mortalidad a los 30 días fue del 9,1%.
ConclusiónCreemos que el tratamiento endovascular es una técnica efectiva para el control del sangrado renal y permite, en la mayoría de casos, la preservación de gran parte de parénquima renal.
Renal haemorrhage is a potentially life-threatening event requiring emergency surgery. Endovascular therapy is currently the first-line treatment option.
ObjectivesReview patients with renal haemorrhage who required emergency endovascular therapy at our center. Evaluate the causes of the bleeding, the treatment performed and the clinical outcomes.
Material and methodsWe performed a retrospective analysis of consecutive patients with renal bleeding who underwent endovascular therapy from June 2012 to June 2017 at Hospital Universitari Joan XXIII (Tarragona, Spain). Demographic data (age, gender and comorbidity) and other related variables were collected (mechanism of injury, haemodynamic stability and anticoagulant therapy). We also studied the CT angiography findings, time from diagnosis to surgery, endovascular technique and materials used, extent of tissue embolised and outcomes.
ResultsTwenty-two (22) patients were included with a mean age of 63 (range 19-85). The aetiology of injuries included: renal biopsy (n=7, 31.8%), bleeding from malignant kidney tumour (n=5, 22.7%), trauma (n=4, 18.2%), angiomyolipoma (n=2, 9.1%), spontaneous bleeding (n=2, 9.1%) and surgical complications (n=2, 9.1%). The endovascular therapy technique was embolisation in all cases. The following materials were used: spheres (9.1%); coils (63.6%); spheres + coils (18.2%); and spheres + plug (9.1%). In 17 cases (77.3%), selective embolisation was performed and in five cases (22.7%), embolisation of the whole kidney. Clinical and technical success rates of 100% were recorded. The 30-day mortality rate was 9.1%.
ConclusionWe believe that endovascular therapy is an effective modality for the management of renal bleeding which, in many cases, enables a large part of the renal tissue to be preserved.
El sangrado renal es una urgencia poco común. En ocasiones este puede provocar un compromiso para la vida del paciente, por lo que se requiere de una cirugía urgente. Desde que en 1970 se realizaran las primeras embolizaciones para tratar lesiones de las arterias renales, la utilización de esta técnica como tratamiento primario y como alternativa a la cirugía abierta ha ido en aumento1,2. Ello es debido, fundamentalmente, a que es un procedimiento menos invasivo que permite el control del sangrado renal1,3.
El objetivo principal de este estudio es revisar todos los pacientes que precisaron de un tratamiento endovascular (TEV) urgente por hemorragia renal en el Hospital Universitari Joan XXIII (Tarragona) en los últimos 5 años. Hemos querido evaluar las principales causas de sangrado, la técnica y el material utilizado y los resultados obtenidos.
Material y métodosHecha esta breve introducción debemos pasar a analizar la metodología de nuestro estudio. Para ello haremos referencia a los siguientes aspectos:
- •
En primer lugar, por lo que se refiere a la tipología de este trabajo debemos señalar que hemos realizado un estudio retrospectivo de pacientes consecutivos que, entre junio del 2012 hasta junio el 2017, requirieron de un TEV urgente debido a un sangrado renal activo que les provocó una situación de inestabilidad hemodinámica o bien una anemización aguda (>2mg/dl). Todos los pacientes fueron remitidos desde el servicio de Urología, si bien en todos los casos el TEV fue realizado por el equipo de guardia de cirugía vascular de nuestro hospital. Se excluyeron aquellos pacientes que fueron tratados de forma programada y/o bien que fueron tratados con una cirugía abierta.
- •
Por lo que se refiere a la recogida de datos, en este estudio nos hemos centrado en las siguientes variables: por un lado, los datos demográficos (edad, sexo, comorbilidad). Y, por otro, las variables relacionadas con el mecanismo de la lesión, la estabilidad hemodinámica, si los pacientes estaban bajo tratamiento anticoagulante, los hallazgos encontrados en la tomografía axial computarizada con contraste (angio-TAC) (fístulas, pseudoaneurismas [PSA]), el tiempo transcurrido entre el diagnóstico por angio-TAC y el inicio de la cirugía, la técnica endovascular realizada, el material de embolización utilizado, el tipo de embolización (parcial o total), el éxito técnico y clínico, las complicaciones relacionadas con el procedimiento y la mortalidad a los 30 días posteriores a la intervención.
- •
En cuanto a la definición de éxito técnico del procedimiento, lo consideramos favorable cuando se consiguió el sellado completo del sangrado según la arteriografía de comprobación efectuada al acabar el procedimiento. A su vez, se definió éxito clínico cuando el paciente no precisó de ningún otro procedimiento quirúrgico para conseguir el cese del sangrado.
- •
Para el estudio de la función renal, se estimó el filtrado glomerular (FGe) mediante la fórmula de Cockcroft-Gault4. En cada paciente se calculó el FGe según las analíticas previas (6-12 meses) a la embolización y se compararon con las analíticas posteriores al procedimiento (6-12 meses). Los pacientes que estaban en terapia renal sustitutiva o aquellos que fueron éxitus se excluyeron del análisis. Se definió insuficiencia renal crónica (IRC) cuando el FGe < 60ml/min/1,73 m2. El estudio estadístico de esta variable se hizo con la ayuda del paquete estadístico SPSS. Se analizaron los cambios de la función renal posterior al TEV mediante la prueba de Wilcoxon de los rangos con signos para muestras relacionadas. Se consideró una variación significativa si p<0,05.
Por lo que se refiere a la muestra estudiada, debemos señalar que en el periodo analizado de 5 años se recogieron un total de 22 pacientes que fueron sometidos a un TEV urgente por un sangrado renal activo. Los datos demográficos de la población examinada se reflejan en la tabla 1, en donde se observa que la edad media de los pacientes estudiados es de 63 años, presentando la mayor parte de ellos IRC.
Características de la población estudiada
| Población estudio | Pacientes (%) |
|---|---|
| Edad | |
| Media; rango | 63; 19-85 |
| Sexo | |
| Hombre | 15 (68,2) |
| Mujer | 7 (31,8) |
| Comorbilidad | |
| Hipertensión arterial | 13 (59,1) |
| Dislipemia | 8 (36,4) |
| Diabetes | 4 (18,2) |
| Cardiopatía isquémica | 2 (9,1) |
| Insuficiencia renal crónica | 12 (54,5) |
| Hemodiálisis | 1 (4,5) |
| Enfermedad pulmonar obstructiva crónica | 3 (13,6) |
Debido a la sospecha diagnóstica de hemorragia intraabdominal, a todos los pacientes se les realizó una angio-TAC. En todos ellos se halló un sangrado renal activo. Asimismo, algunos de ellos presentaban también otras lesiones en forma de fístula arteriocalicial (FAC) (9,1%, n=2), fístula arteriovenosa (FAV) (13,6%, n=3) y en forma PSA (9,1%, n=2).
En cuanto a las causas de lesión renal, las más frecuentes estuvieron relacionadas con la punción de una biopsia renal (n=7, 31,8%), el sangrado de tumoraciones renales malignas (n=5; 22,7%) y traumatismos (n=4; 18,2%). Otras menos frecuentes fueron vinculadas a la presencia de angiomiolipomas (AML) (n=2; 9,1%) y complicaciones de cirugías de nefrolitotomía percutánea y nefrectomía parcial (n=2; 9,1%). En otros casos (n= 2; 9,1%), el sangrado fue espontáneo, no se encontró ninguna causa aparente.
Por lo que respecta al estado clínico en que se encontraban los pacientes antes del tratamiento, un total de 13 de ellos (59,1%) se mantuvieron hemodinámicamente estables, el resto (n=9; 40,9%) presentaron un shock hemorrágico. Por otro lado, 19 pacientes (86,4%) presentaron clínica de dolor lumbar, 7 (31,8%) dolor abdominal y 7 (31,8%) presentaron de hematuria macroscópica.
Por lo que se refiere al tratamiento efectuado, previa valoración del paciente y de las lesiones halladas en la angio-TAC, se decidió conjuntamente con el Servicio de Urología realizar un TEV urgente, mediante embolización, para lograr el sellado del sangrado y la resolución de las lesiones vasculares asociadas (FAV, FAC, PSA). De esta forma, en los pacientes diagnosticados de un tumor maligno (n=5; 22,7%) se embolizó todo el riñón afecto mediante el empleo de microesferas y microcoils (n=3; 13,6%) o microesferas y un oclusor (n=2; 9,1%). Al resto de pacientes (n=17; 77,3%) se les realizó una embolización selectiva. En los casos de los sangrados por AML se embolizaron los vasos nutricios con microesferas (n=2; 9,1%) y en el resto de lesiones se embolizó la arteria dañada con microcoils de liberación controlada (CLC) (n= 17; 77,3%).
El tiempo medio aproximado transcurrido entre el diagnóstico por angio-TAC y el inicio de la cirugía fue de 3 h (1-10 h). A todos aquellos pacientes que estaban bajo tratamiento anticoagulante (n= 5; 22,7%), se les revirtió la anticoagulación según las recomendaciones del servicio de Hemostasia.
Finalmente, si nos centramos en los resultados del tratamiento, podemos destacar que en todos los casos se consiguió cohibir el sangrado. Ningún paciente requirió de un segundo TEV, aunque debemos añadir que en uno de los casos se hizo un control arteriográfico a las 12 h del procedimiento debido a que presentó una anemización progresiva. En dicho control no se observaron sangrados activos. Igualmente, queremos destacar que no hubo ningún caso de complicación del acceso vascular. A la vista de estos resultados, podemos concluir que el éxito técnico y clínico fue del 100%.
Para terminar con este apartado podemos referirnos a las complicaciones relacionadas con el TEV que surgieron en nuestro análisis. Debemos mencionar que la mayor parte de los pacientes (n=16 72,7%) presentaron una clínica compatible con el síndrome postembolización, por lo que requirieron de un tratamiento sintomático. Solo uno de los pacientes (4,5%) al que se le realizó una embolización de todo el riñón presentó un absceso perirrenal que requirió en un primer momento de antibioterapia y de la colocación de un drenaje percutáneo y, posteriormente, de una cirugía de nefrectomía.
En cuanto a los efectos de la embolización sobre la función renal, en 3 casos (13,6%) no se pudo estudiar el FGe debido a que 2 de ellos fueron éxitus (tenían IRC) y uno de los casos ya realizaba hemodiálisis en régimen permanente. Por lo que se refiere a los 19 pacientes restantes (87,6%), 9 de ellos ya presentaban IRC (7 con estadio 3 y 2 con estadio 4) con carácter previo al procedimiento. En el seguimiento analítico posterior a la embolización 3 de los pacientes presentaron empeoramiento del FGe (2 de los pacientes en estadio 3 presentaron empeoramiento del FGe pasando a un estadio 4 y uno de los pacientes en estadio 4 entró en el programa de diálisis permanente). Por otro lado, uno de los pacientes con antecedentes de IRC estadio 3 precisó de diálisis eventual, aunque posteriormente las creatininas fueron mejorando hasta presentar un FGe como antes de la cirugía. Un total de 17 pacientes (89,4%) mostraron una función renal mantenida y 5 de los casos (26,3%) presentaron una mejoría del FGe. Al comparar las variaciones de FGe antes y después del TEV se observó un empeoramiento del FGe medio con una diferencia estadísticamente significativa (p = 0,025).
Si nos centramos en el seguimiento debemos destacar que la media fue de 11 meses (rango 12-72 meses). En la primera visita (entre 1 y 2 meses posterior al TEV), a todos ellos se les realizó una TAC simple o una angio-TAC con el objetivo de valorar el sellado completo de la arteria lesionada, hacer un control del hematoma y descartar otras complicaciones relacionadas con el procedimiento. Ninguno de ellos presentaba sangrados activos y en todos los casos se apreció una correcta exclusión de la arteria embolizada. La única complicación hallada en uno de los casos fueron signos de infección del hematoma perirrenal. En las siguientes visitas, la mayoría de los pacientes no requirieron de ninguna otra prueba de imagen. En lo que respecta a la mortalidad a los 30 días del TEV fue de 9,1% (n=2). La causa de los éxitus estuvo relacionada con la neoplasia (tumor renal maligno) que presentaban estos dos pacientes.
DiscusiónEn el apartado de discusión de este trabajo nos centraremos principalmente en tres aspectos diferentes. En primer lugar, en las causas del sangrado renal, en segundo lugar, la justificación de la utilización de la angio-TAC y, por último, el tratamiento y el material empleado. De todos modos, antes de avanzar en nuestra exposición queremos indicar que el presente estudio tiene una serie de limitaciones. La principal es debida a que se trata de un estudio de carácter retrospectivo, por lo que genera un sesgo vinculado a la recogida y análisis temporal de los datos. Otra limitación es que el número de casos incluidos es pequeño debido a que esta patología es poco frecuente. Esto conlleva que no se pueda realizar un análisis estadístico complejo que dé validez a los resultados obtenidos y que debamos tomar los resultados obtenidos con cautela y seguir analizando esta problemática para obtener conclusiones sólidas.
Por lo que se refiere a la etiología del sangrado renal, la doctrina científica ha puesto de relieve que esta puede ser muy diversa5. En relación a nuestro estudio destacaremos solamente las tres causas más frecuentes de nuestra serie:
- En primer lugar, el sangrado producido a raíz de una biopsia renal supone hasta el 58% de riesgo de complicaciones6–9. La mayoría se resuelven con un tratamiento conservador, pero en aquellos casos en que no es efectivo (hasta el 7%) se requiere de un tratamiento quirúrgico9,10. Las complicaciones vasculares más comunes de la biopsia renal son el sangrado en forma de hematoma subcapsular y la hematuria micro- o macroscópica. Menos frecuentes son las lesiones en forma de FAV, FAC y el PSA8–10.
En los últimos años, el aumento de la realización de más biopsias renales en nuestro centro se ha relacionado con un incremento de las consultas por hemorragia renal. En el presente estudio se recogen 7 casos que presentaron sangrado activo y que, en algunos casos, también se acompañaron de PSA (fig. 1), FAV (fig. 2) y FAC. En todos los casos se optó por una embolización selectiva con microcoils de la arteria lesionada. El objetivo del tratamiento fue siempre resolver el sangrado sin provocar grandes zonas de infarto tisular que pudieran empeorar la función renal ya alterada en muchos de los casos.
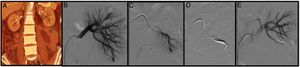
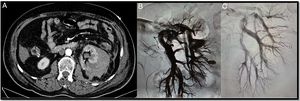
Mujer de 42 años con antecedentes de lupus, prótesis valvular aórtica en tratamiento con dicumarínicos e insuficiencia renal en estudio. Previo al abandono de la anticoagulación se realiza una biopsia renal. A las 6 h de la biopsia presenta un dolor intenso en el flanco izquierdo con anemización severa. Se realiza una angio-TAC donde se objetiva un hematoma retroperitoneal y un pseudoaneurisma (PSA) (flecha) (A). Mediante un acceso femoral derecho y la colocación de un introductor 6F se cateteriza la arteria renal izquierda con la ayuda de un catéter Cobra 5F y una guía (0.014”) con punta atraumática. Seguidamente, se realiza una arteriografía selectiva donde se objetiva el PSA (B y C). Y, por último, se avanza un microcatéter 2, 7 F (Progreat, Terumo®) a través del catéter Cobra hasta llegar a la lesión y se emboliza con microcoils de liberación controlada (Detach-18, Cook®) con un resultado óptimo (D y E).
Paciente de 43 años ingresada en UCI por una hemorragia cerebral de ganglios basales izquierdos en contexto de una hipertensión arterial maligna y por una insuficiencia renal aguda terminal. Se realiza una biopsia renal presentando posteriormente una anemización progresiva. Se hace una angio-TAC (A) donde se observa un hematoma perirrenal (flecha) por lo que se decide realizar una arteriografía con intención de tratar las posibles lesiones.. Mediante una punción femoral derecha y la colocación de un introductor 6F se cateteriza la arteria renal izquierda con la ayuda de un catéter vertebral 4F y una guía (0.014”) con punta atraumática. Seguidamente se cateteriza la arteria renal mediante una técnica coaxial con la ayuda del catéter vertebral 4F y un catéter guía 6F. Se realiza una arteriografía renal donde se observa una fístula arteriovenosa (FAV) (B y C). Se progresa un microcatéter 2.7 F (Progreat, Terumo®) y se emboliza la FAV con microcoils de liberación controlada (Detach-18, Cook®) con un resultado satisfactorio (D).
- En segundo lugar, la hemorragia renal espontánea asociada a tumores renales. Esta representa el 50-60% de las hemorragias retroperitoneales (síndrome de Wünderich), siendo los tumores benignos su causa más frecuente (31%), seguida de los tumores malignos (29%)11.
El AML es el tumor benigno más común. Está compuesto por cantidades variables de tejido adiposo, músculo liso y vasos sanguíneos dismórficos que predisponen al sangrado espontáneo12. Los AML de tamaño superior a 4cm tienen un riesgo de 40-50% de provocar una hemorragia retroperitoneal, por lo que es recomendado realizar una cirugía electiva5,12. Actualmente, el tratamiento de elección suele ser el TEV. De este modo, la cirugía abierta se reserva únicamente para los TEV fallidos o en casos de incertidumbre diagnóstica (cuando no se descarta un tumor maligno).
En relación a los 2 pacientes tratados en nuestra serie, presentaban tumores de gran tamaño, uno de 7,1cm y el otro 5,6cm. Atendiendo a que el AML es un tumor hipervascularizado formado por pequeños vasos, se optó por realizar una embolización selectiva con partículas irreabsorbibles (microesferas) con el objetivo de ocluir los vasos más pequeños que componen el AML y sus arterias nutricias (arterias interlobares).
Por otro lado, se trataron 5 pacientes con sangrado por tumores malignos de adenocarcinomas de células claras (3 casos), metástasis renal (un caso) y de liposarcomas (un caso). Considerando globalmente la historia y pronóstico de los pacientes, en todos estos casos se decidió realizar una embolización de todo el riñón afecto. Al igual que los AML, los tumores malignos se encuentran hipervascularizados, por lo que, en primer lugar, se emplearon partículas irreabsorvibles (microesferas) para conseguir la oclusión de los vasos más pequeños y distales y, posteriormente, coils u oclusores para el sellado de los vasos de mayor tamaño (fig. 3).
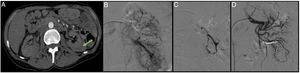
Paciente de 84 años diagnosticado de adenocarcinoma renal acude a urgencias por dolor abdominal y lumbar con shock hemorrágico. Se realiza una angio-TAC donde se ve un sangrado del tumor maligno con un extenso hematoma retroperitoneal (A). Mediante un acceso femoral derecho y la colocación de un introductor 6F se cateteriza la arteria renal izquierda con la ayuda de un catéter Cobra 4F y una guía (0.014”) con punta atraumática. Seguidamente se cateteriza la arteria renal mediante una técnica coaxial con la ayuda del catéter vertebral 4F y un catéter guía 6F. Se realiza una arteriografía inyectando contraste manual por el catéter guía y se observa la gran tumoración con zonas de sangrado activo (B). Seguidamente desde el catéter vertebral que es colocado en el ostium de cada arteria segmentaria se emboliza el lecho distal con la inyección de microesferas (300-500μm). Y, por último, las arterias segmentarias y la arteria renal se emboliza con coils (Azur, Terumo®) de liberación controlada (C).
- En tercer lugar, el sangrado por traumatismo renal. El grado de lesión renal la clasificamos según la escala de la American Association for the Surgery Trauma (AAST)5. El manejo más idóneo de este tipo de lesiones ha sido debatido durante años. Actualmente, parece que la tendencia apunta a realizar un tratamiento conservador para los grados I, II, III, IV siempre y cuando el paciente esté hemodinámicamente estable13. En los casos en que el paciente presente inestabilidad hemodinámica, sangrado persistente, FAV o PSA, se recomienda un TEV. En los grados V (estallido renal/avulsión pedículo) o en lesiones renales con daño asociado en otras vísceras está indicada la cirugía abierta3,14,15.
En nuestro hospital, un total de 4 casos con antecedentes de traumatismo renal fueron tratados de forma endovascular. Según la escala de AAST, 3 de los pacientes presentaban lesiones renales grado III y uno de los pacientes una lesión grado IV. Inicialmente, en 3 de los casos se realizó un manejo conservador que no fue efectivo, por lo que, posteriormente, se hizo un TEV. En uno de los casos se indicó directamente el TEV (debido a que presentaba inestabilidad hemodinámica). Todos los casos fueron tratados con una embolización selectiva mediante microcoils de liberación controlada (fig. 4).
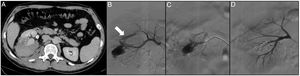
Paciente de 31 años sin ningún antecedente médico-quirúrgico de interés que acude a urgencias por dolor lumbar y hematuria franca. Refiere antecedente de trauma inciso-contuso lumbar derecho hacía 48 h. En la angio-TAC se objetiva una laceración renal derecha, un hematoma retroperitoneal, una lesión de arterial con un sangrado activo, una dilatación pieloureteral derecha con ocupación de la vía urinaria por coágulos (A). Mediante un acceso femoral izquierdo y la colocación de un introductor 6F se cateteriza la arteria renal derecha con la ayuda de un catéter Multiptopósit 4F y una guía (0.014”) con punta atraumática. Se realiza una arteriografía selectiva donde se objetiva un sangrado activo de la arteria segmentaria inferior y una fístula arteriocalicial (flecha) (B). Seguidamente se cateteriza la arteria segmentaria lesionada con un microcatéter 2.7 F (Progreat, Terumo®) (C) y se emboliza con microcoils de liberación controlada (Detach-18, Cook®) consiguiendo la resolución del sangrado y la exclusión de la fístula (D).
En todos los supuestos descritos anteriormente optamos por utilizar la angio-TAC como prueba de imagen diagnóstica de primera opción. La justificación del empleo de dicha técnica podemos encontrarla en los siguientes motivos:
- En los pacientes con un antecedente de traumatismo renal (n=4; 18,2%) la realización de una TAC simple y una angio-TAC en fase arterial y venosa permite definir el grado de lesión según la escala de la AAST. En los casos de los pacientes con policontusiones, la TAC también nos permite descartar daño asociado3,12,13. Para estas situaciones, la ecografía detecta el líquido libre y los hematomas renales, pero no identifica el grado de la lesión del parénquima16.
- En los pacientes con sangrado de AML (n=2; 9,1%), sangrado renal espontáneo (n= 2; 9,1%) y en los casos de sangrado de tumoraciones renales malignas (n=5; 22,7%), la angio-TAC permitió filiar con más exactitud la sospecha diagnóstica de sangrado intraabdominal.
- En los casos de sangrados por complicaciones postoperatorias de cirugías urológicas (nefrolitotomía percutánea y nefrectomía parcial [n=2, 9,1%]), la angio-TAC permitió definir el tratamiento a realizar, o bien cirugía abierta o endovascular (fig. 5).
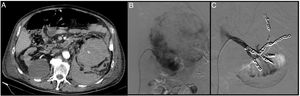
Paciente de 74 años postoperado de una nefrectomía parcial superior izquierda que presenta hematuria franca con anemización progresiva y persistente requiriendo de politransfusiones. La angio-TAC (A) muestra un hematoma retroperitoneal-perirrenal izquierdo con dos imágenes sugestivas de pseudoaneurismas. Mediante un acceso femoral derecho y la colocación de un introductor 6F se cateteriza la arteria renal izquierda con la ayuda de un catéter vertebral 4F y una guía (0.014”) con punta atraumática. Se realiza una arteriografía selectiva donde se objetiva los dos pseudoaneurismas (B). Seguidamente se progresa a través del catéter vertebral el microcatéter 2.7 F (Progreat, Terumo®) hasta llegar a los pseudoaneurismas y se embolizan con microcoils de liberación controlada (Detach-18, Cook®) con un resultado óptimo (C).
- En los pacientes con lesiones por punción de una biopsia renal (n=7; 31,8%), se optó también por hacer una angio-TAC. En estos casos, y después de considerar la ecografía como prueba alternativa. Actualmente creemos que, junto al análisis de los síntomas y controles analíticos, la ecografía puede ser de utilidad para confirmar el diagnóstico de sangrado y, por tanto, eludir el uso del angio-TAC.
Por último, debemos añadir que, debido a la situación vital de los pacientes, en todos los casos se asumieron los riesgos de nefropatía por contraste. Si bien, posteriormente y para mitigar estos riesgos, se inició tratamiento con hidratación de solución salina isotónica y se evitó el uso de fármacos nefrotóxicos.
Finalmente, en lo que concierne a la discusión sobre el tratamiento y materiales utilizados, debemos empezar señalando que, como es sabido, la mayoría de las hemorragias renales (independientemente de su causa) se resuelven con medidas conservadoras (reposo absoluto, reposición de volumen, transfusión de hematíes, reversión de la anticoagulación)3,17. En aquellos casos en los que el tratamiento conservador no es efectivo o hay un compromiso para la vida del paciente es necesaria una cirugía urgente. El TEV es considerado el tratamiento de primera elección debido a que consigue el cese del sangrado y es poco invasivo3,11.
Desde esta perspectiva, y centrándonos en los agentes embolizantes utilizados, queremos señalar que a la hora de elegir el material se tuvieron en cuenta las siguientes características: el tipo de lesión, el tamaño del vaso y la experiencia y la preferencia del operador con el material. En ningún caso se utilizó material biodegradable, debido a que preferimos, en todo lo posible, disminuir el riesgo de reaparición del sangrado, por lo que siempre se emplearon materiales irreabsorvibles. Por otro lado, en todos los casos en los que se utilizaron coils se prefirió que fueran de liberación controlada debido a que creemos que son más seguros y precisos que los coils de liberación no controlada18. En nuestra serie de pacientes, la utilización CLC nos permitió reposicionarlos hasta conseguir la posición y empaquetamiento deseado.
Si analizamos los materiales que otros profesionales utilizan para tratar el sangrado renal, de acuerdo con la bibliografía revisada, vemos que la mayoría de ellos también utilizan microcoils para el sellado de vaso sangrante y también para tratar las lesiones tipo FAV, FAC y en los PSA. Igualmente, siempre realizan una embolización lo más selectiva posible 3,13,19. Sin embargo, en los casos de embolización de tumores renales (malignos o benignos) algunos profesionales suelen emplear otros materiales que, al igual que las microesferas, permiten una difusión más distal del material hacia los vasos de pequeño calibre. Por ejemplo, agentes líquidos (N-butyl-2-cyanoacrylate, Etanol, Ethibloc, Bucrylate, Sotradecol foam, o Lipiodol) u otros tipos de partículas (Etanol, Polyvinyl alcohol, gelfoam)11,12,14,20.
Sin perjuicio de las consideraciones anteriores, debemos mencionar también algunas de las posibles complicaciones derivadas del TEV. Es el caso, por ejemplo, del síndrome postembolización, que ocurre hasta en el 90% de los casos. Este puede cursar con dolor en flanco, fiebre, náuseas, vómitos, leucocitosis y suele iniciarse dentro de los 3 primeros días posteriores a la embolización3,5,12,21. Su tratamiento es sintomático; para ello, se suele administrar analgésicos, antieméticos o antitérmicos. De forma coherente con dicho resultado, en nuestra serie el 73% de los pacientes presentaron clínica compatible con este síndrome.
Otras complicaciones mucho menos frecuentes –que aparecen en menos del 2% de los casos– son la formación de PSA de la arteria empleada como acceso vascular, licuefacción o necrosis del parénquima renal, abscesos, embolización no deseada por migración del material o una embolización incompleta3,12. En nuestra serie, solo se dio una complicación de este tipo. Se trató de un paciente que presentó un absceso debido a la infección del hematoma perirrenal.
Por último, cabe destacar que otra posible complicación derivada de este procedimiento es el empeoramiento de la función renal. A pesar de que los casos de nuestro estudio presentaron un empeoramiento del FGe estadísticamente significativo, la literatura revisada sugiere que hay poco o ningún deterioro significativo en la tasa del filtrado glomerular medio después de una embolización selectiva7,11,12. Esta diferencia puede deberse a que se analizaron conjuntamente los pacientes tratados con una embolización selectiva y a los que se embolizó todo el riñón.
ConclusiónEn algunos casos la hemorragia renal provoca una situación clínica que implica un riesgo de muerte o de secuela funcional grave, por lo que se requiere de una intervención urgente. Debido al estado de elevada morbimortalidad en que se encuentran estos pacientes, creemos que en la mayoría de los casos el tratamiento mínimamente invasivo es la mejor opción para el control de la hemorragia. En nuestra serie hemos podido comprobar cómo el TEV nos permitió resolver el sangrado renal sin conllevar graves complicaciones que una cirugía abierta urgente pudiera ocasionar. Así mismo, la embolización selectiva, en la mayoría de los casos, es posible, lo que permite preservar gran parte del parénquima renal. En consecuencia, consideramos que debemos continuar utilizando las técnicas endovasculares para tratar aquellos pacientes que presentan un sangrado renal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.