Sr. Director:
Comentamos el caso de una mujer de 40 años, exfumadora hasta mayo de 2010, fecha en la que reinicia el hábito. Presenta lupus con afectación articular, hematológica y pericárdica; síndrome antifosfolípido con manifestaciones arteriales (accidente cerebrovascular, estenosis de arteria renal y estenosis de fístula arteriovenosa [FAV]); hipertensión arterial controlada; enfermedad renal crónica (ERC) avanzada secundaria a hialinosis focal y segmentaria (muestra insuficiente para descartar coexistencia de nefritis lúpica V), en hemodiálisis desde 1990. Se le realizó trasplante renal en 1991. Reinicia diálisis en 1998 tras recidiva de enfermedad de base, coincidiendo con gestación. Hiperparatiroidismo terciario grave con regular-mal control de niveles de fósforo durante años (variable cumplimiento terapéutico) y osteoporosis de hueso trabecular (t score –2,5, z score –2,3). Hiperhomocisteinemia. Hiperuricemia. Virus de la hepatitis C oculto con hemosiderosis. FAV humerobasílica derecha actualmente funcionante. Tratamiento habitual: cinacalcet, pepsamar, acetato cálcico, risedronato, ácido fólico, polivitaminínico B1/6/12, omeprazol, alopurinol, carvedilol, hidroxicloroquina y acenocumarol.
ENFERMEDAD ACTUAL
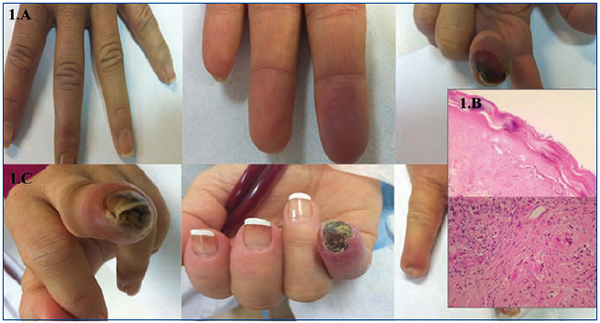
En septiembre de 2009 se sustituye acenocumarol por tinzaparina (antifactor X activado: 0,8-1,2 UI/ml) por hemorragia digestiva alta, permaneciendo con este tratamiento durante un año por diferentes motivos. En noviembre de 2010 acude con lesión violácea en pulpejo de tercer dedo de mano izquierda, contralateral a la FAV (figura 1 A), fría y dolorosa al tacto. Pulso radial normal. La ecografía doppler ipsilateral mostró ligera ateromatosis calcificada de las arterias axilares y braquiales, sin estenosis hemodinámicamente significativa. En las primeras 24 horas se reinicia acenocumarol y se añade nitroglicerina tópica. En 72 horas se consigue INR 4, por lo que se suspende tinzaparina. Al quinto día del inicio del cuadro, acude con dolor intenso en el dedo y evolución tórpida a necrosis cutánea y nueva lesión de similares características isquémicas en segundo dedo ipsilateral. Se inicia tratamiento con antibioterapia y alprostadil ((500 ug i.v.repartidos en 10 dosis). Se suspende dicumarínico añadiendo de nuevo tinzaparina. Se realiza biopsia cutánea, informada como necrosis de tipo isquémico-hemorrágico, trombosis en la microcirculación y fenómeno de leucocitoclastia, indistinguibles de necrosis inducida por cumarínicos o síndrome antifosfolipídico, aislándose un Enterobacter cloacae en el cultivo de la lesión (figura 1 B).
La lesión del segundo dedo regresa rápidamente a la normalidad, pero la del tercero evoluciona a necrosis y curación con pérdida ungueal y amputación parcial con muñón ciego (figura 1 C). La ecocardiografía transesofágica descarta vegetaciones. Los niveles de proteína C resultan descendidos en dos mediciones: 57 % de actividad (n > 70 %). Estudio familiar negativo. Los niveles de proteína S fueron normales. No se realizaron niveles de antitrombina III por estar bajo tratamiento con heparina, ni anticuerpos antitrombina III por no estar disponibles en nuestro centro.
En enero de 2011 se reinicia acenocumarol de forma especialmente lenta y progresiva. A los 13 días del inicio del fármaco, comienza con idéntico cuadro en el quinto dedo de mano contraria (derecha). Se suspende definitivamente el dicumarínico reiniciando tinzaparina (figura 2 A) y regresando la lesión isquémica en pocos días. A la semana, coincidiendo con viaje a zona fría, aumentando el tabaquismo y cuadro infeccioso respiratorio, de nuevo aparece la misma clínica en la misma localización (quinto dedo derecho), precisando de nuevo mórficos y prostaglandina intravenosa. Finalmente evoluciona a necrosis con también pérdida ungueal y muñón ciego (figura 1 C).
En junio de 2011, cuadro similar pero más larvado en tercer dedo de mano derecha, esta vez coincidiendo con hemoglobina 15 g/dl. Se realizan sangrías y se inicia alprostadil, regresando la isquemia. En ecografía Doppler se visualizó marcada amortiguación de la onda espectral de las arterias cubital, radial y mediana justo a partir de la FAV, siendo este hallazgo indicativo de un fenómeno de robo arterial del acceso vascular. No se apreció estenosis en la anastomosis. La arteria braquial, radial, cubital y mediana izquierda presentaban adecuado flujo arterial.
No se decidió cierre del acceso vascular por mejoría de la clínica y agotamiento de otras posibilidades que no fueran catéter. Durante todos los episodios agudos, descendió el flujo arterial hasta 300 ml/min (habitual: 450 ml/min). La dosis de diálisis no se modificó significativamente, con un Kt/V Daugirdas siempre por encima de 1,5 y PRU > 65 %.
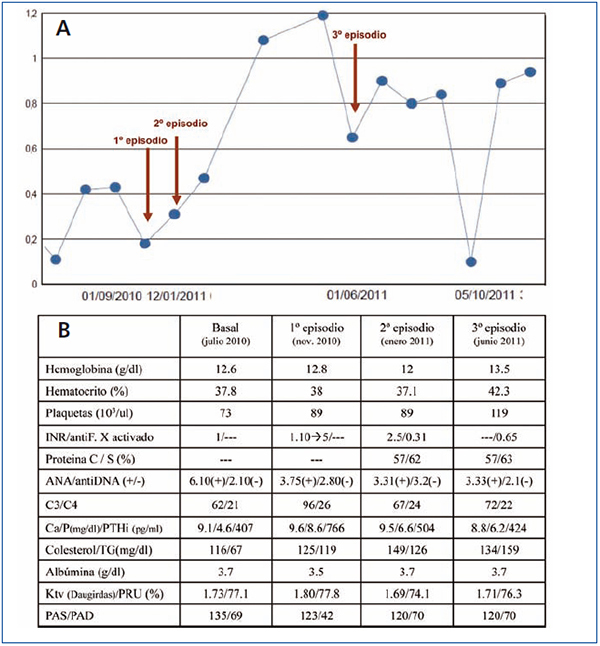
Los parámetros de actividad lúpica (anti-DNA y C3,4) fueron negativos en el primer episodio, y el C3, ligeramente descendido en el segundo y el tercero. No se midieron anticuerpos antifosfolípido por la escasa relación de los niveles con la clínica y por estar bajo terapia anticoagulante (figura 2 B).
DISCUSIÓN
La ERC es considerada, per se, una importante entidad proateroesclerótica. Un mal control del metabolismo calcio-fósforo en el paciente en hemodiálisis aumenta exponencialmente el riesgo vascular, a similar escala que el hábito tabáquico o la diabetes1. De igual manera, LES y SAF y las terapias utilizadas para su tratamiento (esteroides, anticalcineurínicos) contribuyen a la disfunción endotelial que presentan estos pacientes2, además de la reciente asociación de estas enfermedades con la deficiencia o resistencia de la proteína C activada3,4. Pacientes con deficiencia de esta proteína parecen ser más susceptibles a la aparición de necrosis cutánea cuando se añade un dicumarínico5.
Todos estos factores pueden, solos o en combinación, comprometer la perfusión distal. La coexistencia de todos ellos junto al hábito tabáquico, la exposición al frío, la hemoconcentración, la hiperhomocisteinemia y la aparición de robo sanguíneo funcional por parte del acceso vascular pueden constituir una «mezcla explosiva» para la evolución y reincidencia de la necrosis cutánea digital descrita.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Imágenes macro y microscópicas de las lesiones
Figura 2. Datos analíticos