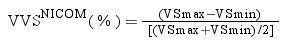El adecuado control del volumen sanguíneo del paciente en hemodiálisis (HD) es esencial al ser un factor de riesgo modificable de morbimortalidad. En el presente estudio proponemos la monitorización hemodinámica continua no invasiva por biorreactancia (Starling™ SV, Baxter) y la caracterización de datos de precarga cardiaca en tiempo real para ayudar a la correcta evaluación de dicho volumen y a la mejora de la tolerancia en HD.
MetodologíaEstudio observacional, prospectivo sobre la relación existente entre los datos de precarga cardiaca y la inestabilidad hemodinámica intradiálisis. Se reclutaron 46 pacientes estables en HD. Se recogieron los datos clínicos, analíticos y de diálisis de todos ellos. El protocolo incluía la realización de una bioimpedancia (BIVA), un ecocardiograma y doppler tisular pre y posdiálisis, y la monitorización de parámetros hemodinámicos durante la sesión.
ResultadosConforme a la definición Fall20, presentaron hipotensión intradiálisis (hTAID) 24 pacientes (51,19%). No encontramos relación entre la hTAID y parámetros analíticos, ecocardiográficos, de BIVA ni con valores de medición del volumen de sangre relativo (BVM). Respecto a la monitorización hemodinámica, el volumen sistólico indexado (VSI) fue menor en los pacientes con hTAID (38,2±0,9 vs. 39,2±1,9; p<0,001). La variación del volumen sistólico (VVS) y la frecuencia cardiaca (FC) fueron superiores en el grupo con hTAID (14,1±0,7 vs. 13,5±0,7; p<0,0001), (70,01±2,1 vs. 68,97±1,1; p<0,0001), respectivamente. El gasto cardiaco indexado (GCI) y las resistencias periféricas indexadas (RTPI) también fueron menores en el grupo con hTAID (2,62±0,09 vs. 2,65±0,13; p<0,05) y (3.201±325 vs. 3.432±231; p<0,05), respectivamente. Los pacientes que comenzaron la sesión con una menor precarga (ΔVS tras infusión de 250cc ≥10%), desarrollaron con mayor frecuencia hTAID (p<0,001).
ConclusionesLa monitorización hemodinámica no invasiva y los datos de precarga pueden constituir una herramienta válida en el manejo del estado de volumen de los pacientes en HD y en la prevención de la hTAID.
Adequate control of patient blood volume in hemodialysis (HD) is essential as a modifiable risk factor for morbidity and mortality. In this study, we propose continuous non-invasive hemodynamic monitoring using bioreactance (Starling™ SV. Baxter) and real-time characterization of cardiac preload data to aid in the accurate assessment of volume status and improvement of tolerance in HD.
MethodologyObservational and prospective study on the relationship between cardiac preload data and intradialytic hemodynamic instability. Forty-six stable HD patients were recruited. Clinical, analytical, and dialysis data were collected from all participants. The protocol included bioimpedance (BIVA), pre- and post-dialysis echocardiography and tissue Doppler, and monitoring of hemodynamic parameters during the session.
ResultsAccording to the Fall20 definition, 24 patients (51.19%) experienced intradialytic hypotension (IDH). We found no relationship between IDH and analytical, echocardiographic, BIVA parameters, or relative blood volume measurement (BVM) values. Regarding hemodynamic monitoring, indexed systolic volume (ISV) was lower in patients with IDH (38.2±0.9 vs. 39.2±1.9; P<.001). Indexed systolic volume variation (ISVV) and heart rate (HR) were higher in the IDH group (14.1±0.7 vs. 13.5±0.7; P<.0001), (70.01±2.1 vs. 68.97±1.1; P<.0001), respectively. Indexed cardiac output (ICO) and indexed peripheral resistances (IPR) were also lower in the IDH group (2.62±0.09 vs. 2.65±0.13; P<.05) and (3201±325 vs. 3432±231; P<.05), respectively. Patients who started the session with lower preload (ΔSV after infusion of 250 cc ≥ 10%) more frequently developed IDH (P<.001).
ConclusionsNon-invasive hemodynamic monitoring and preload data may constitute a valid tool in managing the volume status of HD patients and preventing IDH.
La enfermedad renal crónica (ERC), generalmente de curso silente hasta estadios avanzados, se ha convertido en las últimas décadas en un grave problema de salud pública por el incremento en la incidencia y en la prevalencia, y su elevada morbimortalidad1–4. Su principal causa de mortalidad es la enfermedad cardiovascular. En los pacientes en programa renal sustitutivo representa el 40-50% del total, siendo mucho más elevada respecto a la población general, especialmente entre los más jóvenes5.
Los pacientes en terapia con hemodiálisis (HD) experimentan cambios fisiopatológicos persistentes que afectan negativamente a diferentes órganos. Son fruto de numerosos estresantes sistémicos, tanto hemodinámicos como no hemodinámico. Son combinación del estrés cardiocirculatorio, condicionado por el paso de hipervolemia a hipovolemia, la hipoxemia, el estrés térmico y las alteraciones electrolíticas. Estas situaciones se producen de forma repetitiva, lo que reduce globalmente la perfusión y la oxigenación de los tejidos6,7.
El estrés hemodinámico agudo es inducido fundamentalmente por la ultrafiltración, cuyo objetivo es eliminar el exceso de agua acumulado en el periodo interdiálisis. Los cambios cíclicos de volemia dan como resultado una sobrecarga cardiaca crónica y una disminución aguda de volumen. Aunque descensos leves de volumen intravascular puedan pasar desapercibidos, acaban provocando daño orgánico subclínico que se acumula a lo largo de años de tratamiento. En la mayoría de las sesiones de HD la tasa de relleno vascular o «refilling», no es capaz de compensar la tasa de ultrafiltración, conduciendo a una disminución del volumen sanguíneo efectivo. La falta de compensación, puede precipitar una hTAID. Todo ello contribuye a la relación directa existente entre ultrafiltración e hipotensión y mortalidad8.
Por otro lado, la sobrecarga crónica del volumen extracelular (congestión vascular y tisular) de los pacientes en HD es responsable de la HTA y de otras consecuencias cardiovasculares, también relacionadas con la morbimortalidad, entre las que se incluyen la insuficiencia cardiaca y el edema agudo de pulmón, tan frecuentes en esta población9.
Por todo ello, el adecuado control del volumen es uno de los mayores desafíos clínicos, al ser uno de los factores de riesgo modificables más importantes de morbimortalidad asociados al tratamiento de HD. El estado de volumen del paciente en HD crónica se viene definiendo por dos componentes: el peso posdiálisis y la ganancia interdiálisis. Lograr un peso adecuado al final de las sesiones es considerado como un gran desafío para el nefrólogo10–12.
El pilar en el que se basa la determinación del equilibrio de líquidos en los pacientes en HD sigue siendo la evaluación clínica. Sin embargo, no es infrecuente, la existencia de una sobrecarga de volumen coexistiendo con un examen físico normal. En un intento de optimizar la sensibilidad y la especificidad en la estimación del volumen de líquidos en diálisis ha intensificado la búsqueda de herramientas de evaluación objetiva.
Se han implementado diferentes métodos diagnósticos para optimizar el manejo del volumen para evitar la sobrecarga crónica y la inestabilidad hemodinámica en HD. Caben citar los péptidos natriuréticos, la bioimpedancia espectroscópica (BIVA) y la variación del volumen de sangre relativo (BVM) durante la sessión. A pesar de ello, el problema de establecer el peso seco y de mejorar la tolerancia en las sesiones de HD no está resuelto. Por ello es preciso introducir nuevas exploraciones para solventar la incapacidad de los métodos tradicionales13,14.
En el presente estudio, y con este propósito, proponemos la monitorización hemodinámica continua no invasiva con la medición del gasto cardiaco, el volumen sistólico y las resistencias periféricas, así como la caracterización de datos de precarga cardiaca en tiempo real. Se estudia su relación con el péptido natriurético NT-proBNP, con los parámetros de hidratación medidos por BIVA y con la ecocardiografía transtorácica.
Material y métodosSe trata de un estudio observacional y prospectivo sobre la relación existente entre los datos de precarga cardiaca y la inestabilidad hemodinámica.
Pacientes y recogida de datosSe reclutaron 46 pacientes con ERC en HD desde al menos 3 meses, estables clínicamente (sin eventos cardiovasculares, cerebrovasculares e infecciosos en el último mes y sin neoplasias en progresión), con acceso vascular normofuncionante y parámetros de diálisis adecuados.
El protocolo de estudio fue presentado y aceptado por la comisión de investigación clínica del Complejo Hospitalario Universitario de Toledo.
Tras la firma de consentimiento informado, los pacientes fueron citados para el estudio en la sesión de diálisis de mitad de semana (miércoles o jueves). Debían acudir en ayunas con la medicación de la mañana administrada con anterioridad en su domicilio.
Protocolo de estudioA su llegada al hospital el paciente debía permanecer en cama durante 30min y tras registrar el peso prediálisis se le realizaba una bioimpedancia y un ecocardiograma transtorácico. A continuación, se conectaba a su sesión de diálisis. Todos los pacientes se dializaron con monitores Fresenius 5008 (Fresenius Medical Care, Bad Homburg, Alemania) que disponían de ultrafiltración controlada y módulo para la monitorización en tiempo real del volumen sanguíneo relativo (BVM). La técnica de diálisis empleada fue la de hemodiáfiltración en línea (HDF online) con un dializador de alto flujo (cut-off 78ml/mmHg) y 1,8m2 de superficie (Polisulfona Fresenius. Helixona Fx80®). El flujo de sangre se mantuvo entre 350-400ml/min. El flujo del líquido de diálisis se seleccionó automáticamente por el monitor de diálisis y la temperatura se fijó en 36-36,5°C. Se registraron de rutina parámetros clínicos durante la sesión (peso, presión arterial, frecuencia cardiaca [FC], temperatura y manifestaciones clínicas si las hubiera).
Monitorización hemodinámicaLos pacientes desde 5min antes del inicio de la sesión hasta 10min tras la finalización de la misma, fueron monitorizados hemodinámicamente con el dispositivo de biorreactancia NICOM® (Starling™ SV, Baxter). Se registraron o calcularon de forma continua la FC, la saturación de oxígeno (SatO2) y el aporte de oxígeno (DIO2), y los parámetros funcionales cardiacos, entre los que se incluían el gasto cardíaco indexado a la superficie corporal o índice cardiaco (IC), el volumen sistólico (VS), el volumen sistólico indexado (IVS), las resistencias periféricas totales (TPR) e indexadas a la superficie corporal (TPRI) y el contenido de líquido torácico (TFC: thoracic fluid content). Como parámetro subrrogado de inestabilidad hemodinámica dependiente de volumen se determinó la variación del volumen sistólico (VVS). Se basa en la VVS que se produce con los movimientos respiratorios. Durante la inspiración espontánea la presión intratorácica disminuye y aumenta el retorno venoso aumentando el VS. Durante la espiración se produce el fenómeno contrario. Los valores altos de la VVS indican que el volumen sistólico varía significativamente con los cambios en la precarga (estado de volumen), lo que sugiere que es probable que el paciente responda positivamente a la administración de líquidos. Su interpretación en pacientes en respiración espontánea debe ser cautelosa.
La VVS (Stroke volume variation) determinado con el dispositivo NICOM® se promedió cada 60s. Dentro de este intervalo de tiempo, se seleccionaron los valores máximos y mínimos de VS para cada subsegmento de 15 latidos. Los valores máximos y mínimos finales del VS se determinaron a partir de varios valores máximos y mínimos segmentales de VS en cada ventana de tiempo de 60s. Posteriormente, el VVSNICOM final se calculó como:
Se realizaron dos maniobras de infusión de un bolo de 240cc de líquido on-line. La primera, inmediatamente antes del inicio de la diálisis y la segunda al finalizar la sesión. Basándose en la ley de Frank-Starling, la infusión del bolo se utilizó para la valoración de la precarga cardiaca en función del incremento experimentado por el IVS tras la infusión de volumen15 (fig. 1).
Ley de Frank-Starling. Se expone a modo de ejemplo el incremento del volumen sistólico de un paciente del estudio tras la infusión de 250 cc de volumen (líquido on-line) en situación de pre y posdiálisis.
Fuente: Adaptado de Metha Y. et al.15.
Al finalizar la sesión se realizaba una nueva bioimpedancia y un ecocardiograma, con lo que finalizaba el protocolo de estudio.
Los parámetros hemodinámicos y sus valores de normalidad se reflejan en la tabla 1.
Parámetros hemodinámicos y valores de normalidad
| Parámetro hemodinámico | Fórmula | Valor normal |
|---|---|---|
| Volumen sistólico (VS) | GC/FC×1.000 | 60-100ml/latido |
| Volumen sistólico index (VSI) | VS/Superficie corporal | 33-47ml/latido/m2 |
| Gasto cardiaco (GC) | FC×VS/1.000 | 4,0-8,0l/min |
| Índice cardiaco (IC) | GC/Superficie corporal | 2,5-4,0l/min/m2 |
| Resistencias periféricas totales (RPT) | 80×(PAM)/GC | 800-1.200dynes • s/cm5 |
| Resistencias periféricas totales index (RPTI) | 80×(PAM)/IC | 1.970-2.390dynes • s/cm5/m2 |
| Presión arterial media (PAM) | (PAS+[2×PAD])/3 | 70-105mmHg |
| Δ Volumen sistólico index (ΔVSI) | Cambio VSI tras infusión 250cc suero on-line | ≥10% respondedor volumen<10% no respondedor volumen |
Las variables continuas se expresan como media ± DE o mediana y rango intercuartil (RI) según la naturaleza de las variables. Las variables categóricas se expresan como porcentajes. Como pruebas de independencia utilizamos T-Student, y con 3 o más categorías la comparación de medias se realizó a través del análisis de la varianza ANOVA. Antes de aplicar un test paramétrico se ha aplicado el test de homogeneidad de varianzas de Levene. En los no paramétricos, con 2 categorías utilizamos el test U de Mann-Whitney y con 3 o más grupos la prueba de Kruskal-Wallis. Para comparar los diferentes estados temporales de nuestras variables utilizamos el test no paramétrico de Wilcoxon. Todos los test estadísticos se aplican con un nivel de confianza del 95%. Para realizar los análisis se utilizó el software estadístico IBM SPSS® versión 29.0.
ResultadosDescripción basal de la cohorteEl análisis incluye a 46 pacientes con ERC 5D procedentes de la unidad de HD hospitalaria. El tiempo en tratamiento sustitutivo de los pacientes fue de 7,74 meses (RI: 3,35). La edad media fue de 63,4 años (RI: 22,4). El 69,6% (32) eran varones y el 47,8% (22 pacientes) diabéticos. El índice de comorbilidad de Charlson de la población estudiada fue de 7 (RI: 4). Se expresan en detalle los datos basales de la población estudiada en la tabla 2.
Características generales de los pacientes: valores analíticos y características de las diálisis
| Características generales | |
| Varones, N (%) | 32 (69,6%) |
| Edad, (años) | 63,4 (RI: 22,4) |
| Tiempo en diálisis, (meses) | 7,74 (RI 3,35) |
| Diabetes mellitus, N (%) | 22 (47,83%) |
| Cardiopatía isquémica, N (%) | 12 (26,89%) |
| Enfermedad vascular, N (%) | 8 (17,39%) |
| Insuficiencia cardíaca, N (%) | 11 (23,9%) |
| Índice de Charlson | 7 (RI: 4) |
| Trtamiento β-bloqueantes, N (%) | 18 (39%) |
| Valores analíticos | |
| Hemoglobina, (g/dl) | 11,8±1,5 |
| Hematocrito, (%) | 35,7±4,5 |
| Creatinina, (mg/dl) | 7,7±2,7 |
| Na+, (mEq/l) | 139±3,5 |
| K+, (mEq/l) | 5,2±0,7 |
| Bicarbonato, (mEq/l) | 23,9±3,3 |
| Albúmina, (g/dl) | 3,8±0,4 |
| Ca++, (mg/dl) | 9,2±0,7 |
| P, (mg/dl) | 4,6±1,5 |
| NT-proBNP, (pg/ml) | 8.008±11.031 |
| Troponina I, (ng/ml) | 0,03±0,05 |
| Características de diálisis | |
| Tiempo HD, (min) | 230±15,3 |
| Qb, (ml/min) | 380±35,5 |
| Kt (L), dosis convectiva, (L) | 54,5±8,4/25,4±3,5 |
| Ganancia de peso ID, (L) | 2,5±1,1 |
| Tasa UF, (ml/h) | 0,65±0,21 |
| Uf total, (L) | 1,6±0,84 |
Todos los pacientes fueros dializados en monitores Fresenius 5008, en técnica de HDF on-line con dializador Helixona. Las características de las sesiones de diálisis y los aclaramientos de la técnica se expresan en la tabla 2.
Hipotensión intradiálisisSe utilizaron diferentes criterios para la definición de hipotensión intradiálisis (hTAID). La incidencia de hipotensión varió en función de las diferentes clasificaciones. En nuestro estudio utilizamos la Fall20. Presentaron hTAID 24 pacientes (51,187%) (tabla 3). Los datos de PAS, PAD y PAM, así como los datos relativos a la dosis de diálisis, ganancia de peso interdiálisis y tasas de ultrafiltración se recogen en la tabla 4. No se encontraron diferencias en la incidencia de hTAID al comparar pacientes con o sin diabetes.
Presión arterial pre y posdiálisis y características de la diálisis de pacientes con hipotensión arterial intradiálisis en base a la definición Fall20
| Hipotensión [Fall20] | Sin hipotensión | Valor de p | |
|---|---|---|---|
| PAS preHD, (mmHg) | 157,3±22,5 | 138±17,4 | 0,002 |
| PAD preHD, (mmHg) | 81,2±14 | 77,4±12,2 | 0,32 |
| PAM preHD, (mmHg) | 108,4±12,3 | 97,6±10,6 | 0,004 |
| PAS posHD, (mmHg) | 145,2±27,7 | 145,3±26,9 | 0,99 |
| PAD posHD, (mmHg) | 77,4±14,3 | 80,5±13,9 | NS |
| PAM posHD, (mmHg) | 101,6±16,5 | 102,9±15,7 | NS |
| Tiempo sesión, (min) | 235,8±10 | 227±17,18 | 0,06 |
| Qb, (ml/min) | 378±42 | 381,9±31,4 | 0,7 |
| Dosis KT, (l) | 54,8±9,4 | 54,3±7,8 | 0,8 |
| Dosis convectiva, (l) | 26,1±3,9 | 24,9±3,1 | 0,2 |
| Ganancia peso InterHD, (l) | 2,5±1,3 | 2,6±0,8 | 0,8 |
| Tasa UF, (ml/h) | 0,62±0,24 | 0,67±0,19 | 0,47 |
| Tasa UF, (ml/kg/h) | 5,9±3,1 | 6,3±2,5 | 0,62 |
| UF total (l) | 1,57±0,92 | 1,75±0,76 | 0,43 |
Los resultados en negrita, hacen referencia a los valores estadisticamente significativos.
No encontramos una relación de la hemoglobina (Hb), el calcio, la albúmina, la troponina I y el NTproBNP con la presencia o no de hTAID ni de diabetes. El NTproBNP se relacionó con la presencia de cardiopatía isquémica (15.937±14.224 vs. 5.450±8.593; p=0,007), de enfermedad vascular periférica (18.540±14.705 vs. 5.456±8.388; p=0,002) y de insuficiencia cardiaca (17.142±16.646 vs. 5.439±7.381; p=0,004). La troponina I se relacionó con la presencia de cardiopatía isquémica (0,072±0,07 vs. 0,021±0,019; p=0,001) y de enfermedad vascular periférica (0,091±0,076 vs. 0,021±0,019; p<0,001).
Parámetros BIVALos datos de sobrehidratación (OH), de agua corporal total (TBW), de agua extracelular y el cociente extra/intracelular (E/I), pre y posdiálisis fueron comparables en los grupos con y sin hTAID.
Parámetros BVMTampoco los valores del VSR horarios fueron capaces de discriminar la población que desarrolló una hipotensión durante la diálisis.
Parámetros ecocardiográficosA todos los pacientes se realizó un ecocardiograma transtorácico previo a la sesión de diálisis y al finalizar misma. El volumen telediastólico del ventrículo izquierdo (DTDVI) disminuyó desde la situación de prediálisis a posdiálisis (46,92±7,2 vs. 45,3±7,3mm; p=0,0015). De igual forma se comportaron el volumen telesistólico del ventrículo izquierdo (DTSVI) (31,3±6,2 vs. 30,1±7mm; p=0,011), el tamaño del ventrículo derecho (VD) (38,6±6,3 vs. 37,2±6,1mm; p=0,03), el de la aurícula izquierda (AI) (69±27,7 vs. 61,4±25,2mm; p=0,009) y la masa del VI (205,9±73,7 vs. 186,8±50,8; p=0.016). También se modificaron el TAPSE (21,62±4,9 vs. 20,15±4,6; p=0,0007) y el cociente de las ondas E/A (1,02±0,4 vs. 0,84±0,3; p<0,0001). No hubo diferencias en la fracción de eyección del VI (FEVI), la onda É ni el cociente E/É.
No encontramos diferencias en los parámetros ecocardiográficos al comparar los pacientes que se hipotensaron frente a lo que no lo hicieron. Los datos completos se expresan en la tabla 5.
Parámetros ecocardiográficos pre y posdiálisis según hayan presentado hipotensión arterial intradiálisis o no
| Parámetros ecocardiográficos | Hipotensión [Fall20] | Sin hipotensión | Valor de p |
|---|---|---|---|
| DTDVI preHD | 47,2±8,6 | 46,1±5,5 | 0,6 |
| DTDVI posHD | 46±8,3 | 44,3±6,06 | 0,42 |
| DTSVI preHD | 32,1±7,4 | 30,2±4,9 | 0,34 |
| DTSVI posHD | 31±8,1 | 29,3±5,5 | 0,46 |
| FEVI preHD | 59,8±12,6 | 61,47±10,14 | 0,62 |
| FEVI posHD | 59,7±13 | 62,6±10,6 | 0,41 |
| VD (preHD) | 37,8±7,1 | 39,1±5,2 | 0,51 |
| VD (posHD) | 36±5,8 | 38,5±6,1 | 0,17 |
| AI (cm) preHD | 63,5±28,9 | 67±28,7 | 0,73 |
| AI (cm) posHD | 59,5±22,7 | 62,1±22,7 | 0,76 |
| TAPSE preHD | 21,3±5,3 | 22,2±4,3 | 0,55 |
| TAPSE posHD | 19,9±5,2 | 20,4±3,9 | 0,71 |
| Onda S preHD | 11,13±3,2 | 12,3±2,2 | 0,17 |
| Onda S posHD | 11, 2±2,8 | 11,8±3,3 | 0,57 |
| E/A preHD | 0,9±0,4 | 1,06±0,41 | 0,19 |
| E/A posHD | 0,78±0,28 | 0,93±0,37 | 0,14 |
| E/E’ preHD | 12,4±6 | 12,6±7,7 | 0,93 |
| E/E’ posHD | 11±3,3 | 12,1±8,9 | 0,6 |
| Masa VI preHD | 202, 15±73,1 | 206±77,2 | 0,8 |
| Masa VI posHD | 191,4±60 | 180,02±32,2 | 0,46 |
El volumen sistólico indexado (VSI) globalmente fue mayor en los pacientes sin hTAID (39,2±1,9 vs. 38,2±0,9; p<0,001). A lo largo de la diálisis en el grupo de pacientes sin hTAID el VSI cayó en la primera hora (41±2,1 vs. 38,1±0,6; p<0,0001), recuperándose en las siguientes horas (38,3±0,7 y 39±1,9; p<0,001). En el grupo con hTAID el VSI presentó una caída que se prolongó hasta la última hora de diálisis (38,6±1 [1ªh] vs. 38,2±0,9 [2ªh] vs. 37,7±0,9 [3ªh] vs. 38,5±1,2 [4ªh]; p<0,001) (fig. 2).
Comparación de los parámetros hemodinámicos entre grupos: a) Gasto cardiaco indexado; b) Volumen sistólico indexado; c) Variación del volumen sistólico; d) DOI2: Aporte de O2 en tejidos; e) Saturación de O2; f) Frecuencia cardiaca; g) Contenido de líquido torácico; h) Presión arterial sistólica, diastólica y media, e i) Resistencias periféricas.
Estudiando la VVS en el tiempo, como parámetro de estabilidad hemodinámica, observamos que la VVS fue significativamente superior en el grupo con hTAID (14,08±0,69 vs. 13,53±0,74; p<0,0001).
La FC globalmente fue superior en los pacientes que se hipotensaron (70,01±2,1 vs. 68,97±1,1; p<0,001). En ambos grupos la frecuencia aumento a lo largo de la diálisis, siendo mayor el aumento en el grupo con hemodinámica inestable.
El gasto cardiaco indexado (GCI) fue ligeramente menor en el grupo que desarrolló hipotensión arterial (2,62±0,09 vs. 2,65±0,13; p<0,05). A lo largo de la sesión el gasto cardiaco se mantuvo muy estable a pesar de la caída del VSI, gracias a la compensación producida por el incremento de la FC.
Las resistencias periféricas indexadas (RTPI) fueron menores globalmente en el grupo con hTAID (3.201±325 vs. 3.432±231; p<0,05). Las resistencias no se modificaron en el grupo en los que la PA se mantuvo estable, mientras que en el grupo con hTAID las resistencias periféricas cayeron desde el comienzo de la diálisis (3,856,4±22,6 [1ªh] vs. 3,441,1±228,7 [2ªh] vs. 2,973,1±127,7 [3ªh] vs. 3,028,2±179,9 [4ªh]; p=0,033). Las RTPI no fueron diferentes cuando se compararon pacientes con o sin diabetes.
La saturación de O2 disminuyó en la primera hora de la diálisis en ambos grupos, para a continuación ir mejorando hasta el final de la sesión. No encontramos diferencias entre los grupos con y sin hTAID. El aporte de O2 a los tejidos (DIO2), se mantuvo estable durante la sesión de diálisis sin diferencias entre los grupos con y sin hTAID.
Por último, se determinó el contenido de líquido torácico (TFC). Observamos un incremento del mismo en la primera hora de diálisis, con descenso en las siguientes horas, más acusado y mantenido en el grupo con hTAID.
Parámetros de precarga cardiacaUtilizamos como parámetros de precarga cardiaca el incremento del volumen sistólico tras la infusión de un bolo de 250cc de solución on-line, equiparable a la maniobra del levantamiento de piernas. Dicha maniobra se realizó previo a la diálisis y al final de la misma. El incremento del VS en prediálisis fue del 2,15±7,2% vs. 13,1±8,7% posdiálisis; p<0,001 (fig. 3). Los pacientes que desarrollaron hipotensión durante la sesión, prediálisis presentaban un incremento mayor del VS posbolo frente a los que se mantuvieron con la presión arterial estable (0,17±7,72 vs. 4,12±6,19; p=0,012) (fig. 4) En situación de posdiálisis no hubo diferencia entre ambos grupos (11,9±9,15 vs. 14,36±8,28; p=0,68). Los pacientes que comenzaron y finalizaron la sesión con datos de mayor depleción (ΔVS≥10% tras el bolo), es decir, con una menor precarga, fueron aquellos que presentaban una mayor intolerancia hemodinámica durante la sesión de HD (ꭕ2 (1,N=46)=20,45; p<0,001) y (ꭕ2 (1,N=46)=5,23; p=0,02), respectivamente.
El adecuado control del volumen de los pacientes en HD es uno de los mayores desafíos clínicos para el nefrólogo, al ser uno de los factores de riesgo modificables fundamentales de morbimortalidad asociados al tratamiento de HD. Un inadecuado manejo del volumen puede propiciar una instabilidad hemodinámica y afectar la salud de los pacientes. La comprensión de los factores asociados y sus consecuencias sigue siendo un área de interés y debate en la literatura científica. En las últimas décadas, se han implementado diferentes métodos diagnósticos para optimizar el manejo del volumen en los pacientes en diálisis y evitar la sobrecarga crónica y la hTAID durante las sesiones de HD, incluyendo aplicaciones basadas en inteligencia artificial16,17.
En el presente estudio proponemos la monitorización no invasiva y la caracterización de datos de precarga cardiaca con el propósito de prevenir los efectos deletéreos, tanto de la sobrecarga de volumen, como de la inestabilidad en HD.
Incluimos 46 pacientes de una unidad de HD hospitalaria, abordando de manera integral la complejidad de la interacción entre la HD y la respuesta cardiovascular. Se describen las características de la cohorte, la existencia de hTAID y su relación con parámetros analíticos de HD y ecocardiográficos. Este enfoque integral permite arrojar luz sobre la compleja relación entre la HD y la respuesta cardiovascular, proporcionando información valiosa para la gestión clínica de estos pacientes.
Un 51% de los pacientes presentó hTAID (Fall20). El poder predictivo de eventos cardiovasculares no fatales y de mortalidad global de la hTAID, con las definiciones asintomáticas magnifica la importancia que tienen los episodios de hipotensión independientemente se acompañe o no de sintomatología asociada18. Flythe et al.19 han demostraron el poder predictivo de mortalidad de la definición Nadir90 en pacientes con una PAS prediálisis en torno a los 130mmHg; en nuestro estudio la PAS prediálisis fue superior a los 140mmHg, por lo que decidimos utilizar la definición Fall20 con caídas de la PAS asintomáticas, pero superiores a los 20mmHg en el corto espacio de tiempo de la sesión de HD.
Atendiendo a esta definición, la hTAID no se correlacionó con ninguno de los parámetros analíticos estudiados. Ni los niveles de anemia, ni los valores de péptidos relacionados con la enfermedad cardiovascular (NTproBNP y troponina I) fueron capaces de predecir o discriminar a aquellos pacientes que posteriormente iban a presentar una caída de PAS en la sesión de HD. Sin embargo, y como era de esperar, ambos péptidos si se relacionaron con la presencia de enfermedad cardiovascular en sus diferentes formas. Algunos grupos han descrito una relación directa entre los valores de NTproBNP, la ganancia de peso interdiálisis (GPID) y la UF, siempre que esta fuera superior al 0,6% GPID/h20. En nuestro caso las GPID y las UF fueron menores a las de este estudio lo cual podría explicar la ausencia de hallazgos en este sentido. Por el contrario, Curtis et al.21 postulan que los niveles elevados de NTproBNP en pacientes incidentes pueden identificar a pacientes con una mejor tolerancia dialítica y tolerancia de elevadas tasas de UF. Sin embargo, el resultado de nuestro estudio nos lleva a pensar, al igual que a otros grupos22, que el valor predictivo de los péptidos estudiados está relacionado fundamentalmente con patología estructural y no con fenómenos funcionales agudos, en nuestro caso subclínicos.
En cuanto a los parámetros ecocardiográficos, los DTDVI, DTSVI, el volumen del VD y de la AI disminuyeron entre la situación de prediálisis, de mayor sobrecarga de volumen y precarga, y el momento posdiálisis. Sin embargo, no fue discriminativa entre los que desarrollaron una hTAID y los que no. Dado que la masa del ventrículo izquierdo se calculó a través de la fórmula de Deveraux23 y esta incluye los volúmenes de las cavidades cardiacas, también objetivamos su disminución desde la situación de prediálisis a posdiálisis. De nuevo, los parámetros ecocardiográficos no fueron sensibles para diferenciar el grupo de pacientes con y sin hTAID.
La disfunción diastólica en los pacientes con nefropatía está alcanzando cada vez mayor interés. Su prevalencia se estima entre el 48-73% en los pacientes en diálisis24. La dificultad para detectarla radica en su definición. Se han utilizado para su definición la ratio E/A (<1), y la ratio onda E/e’ (>10). En su diagnóstico no solo incluiría parámetros ecocardiográficos de doppler tisular, sino también clínicos. En la actualidad el interés se centra en la detección de alteraciones precoces y asintomáticas.
Las ondas E y A corresponden a las medidas de las velocidades de llenado pasivo y activo del VI, respectivamente. Dichas velocidades se pueden alterar si la precarga es muy elevada, por lo que la ratio E/A no es suficiente para el diagnóstico como único criterio. Es por ello, que se debe combinar con otras medidas.
En nuestro trabajo, el estudio doppler del anillo mitral, arroja una función diastólica normal en cuanto a la relación de las ondas E/A, que claramente empeora en el ecocardiograma posdiálisis. Este deterioro en la sesión de diálisis podríamos atribuirlo nuevamente a la disminución de los volúmenes de precarga.
Otro de los criterios utilizados para valorar la disfunción diastólica es la relación entre las ondas E/e’. En este caso, aunque no se encontró una diferencia significativa entre la situación pre y posdiálisis, la ratio en ambos casos fue menor de 10, lo que se ha relacionado con un incremento del riesgo de mortalidad cardiovascular25.
Los pacientes con disfunción diastólica, son más susceptibles a fluctuaciones en el volumen ventricular y a la hipovolemia que, aun siendo leve, puede causar hTAID. No encontramos en nuestro estudio diferencias entre la población con hTAID y sin hTAID.
La función sistólica del VD, medida por el TAPSE, también se deteriora en relación con la caída de la precarga tras la ultrafiltración del paciente en diálisis. Nuevamente no encontramos diferencias entre los pacientes que se hipotensaron y los que no lo hicieron.
Probablemente los cambios hemodinámicos entre grupos en ausencia de sintomatología clínica, no fueron suficientemente determinantes de un stuning cardiaco intradiálisis, y podría explicar esta falta de diferencias. El hecho de que la depleción del volumen intravascular, medido a través de la disminución de las cavidades cardiacas y de otros parámetros ecocardiográficos, no sea diferente entre las 2 poblaciones, apoya la naturaleza multifactorial y compleja de la hTAID y la necesidad de continuar explorando otras herramientas que nos ayuden a predecir dichos eventos26.
La monitorización hemodinámica de nuestro trabajo se realizó con un dispositivo no invasivo de biorreactancia. Se registraron los parámetros descritos con anterioridad, minuto a minuto a lo largo de la HD.
Globalmente el VSI fue menor en los pacientes con hTAID. En ambos grupos el VSI cayó en la primera hora, recuperándose en la segunda mitad de la diálisis solo en los pacientes que se mantuvieron estables sin hTAID.
También hubo diferencias en la VVS, siendo mayor en los pacientes que presentaron una caída de la PA. Tal como se describe en la literatura, la VVS es un predictor independiente para desarrollar hTAID27, ya que los pacientes que presentan una mayor VVS tienen una respuesta compensatoria insuficiente a los cambios de volumen intravascular.
El GCI fue mayor en el grupo sin hipotensión, pero en ambos grupos, el de hTAID y el de PA estable, se mantuvo estable a lo largo de la diálisis. A pesar de la disminución del VSI que observamos durante la HD, el aumento progresivo de le FC posibilitó que el GCI se mantuviera estable.
En el grupo con hTAID, las RTPI disminuyeron desde el comienzo de la diálisis, y fueron menores que en el grupo con PA estable. Esta caída de las resistencias, es probablemente uno de los componentes más importantes en el desarrollo de hTAID en nuestro estudio. La distribución de pacientes con o sin diabetes fue igual entre los grupos con y sin hTAID. A pesar de que la disautonomía es frecuente en el paciente diabético, tampoco fueron diferentes las RTPI en presencia o no de la enfermedad.
Otros de los parámetros monitorizados a lo largo de la sesión, están relacionados con «la oxigenación» y fluidos torácicos. La saturación O2 y el DIO2 disminuyen en la primera hora de diálisis para luego recuperarse. El TFC se comporta de forma inversa, aumentando al comienzo de la HD para a continuación disminuir hasta el final de la sesión. Estos resultados los ponemos en relación con los fenómenos de bioincompatibilidad en diálisis, mediada por la activación del complemento, el secuestro de los neutrófilos en los vasos pulmonares y otros factores como la reducción del estímulo respiratorio debido a la eliminación de CO2 y el rápido aumento en el bicarbonato plasmático.
Una parte esencial del trabajo, fue la valoración de la precarga cardiaca previa a la HD y al finalizar la misma. El disponer de una monitorización continua nos permitió realizar la medición del incremento del volumen sistólico tras la infusión de un bolo de 240cc de líquido on-line. La respuesta del VS a esta sobrecarga de volumen intravascular nos sirvió como método para la valoración de la precarga. Clásicamente se consideran dos grupos de pacientes. Los que presentan una baja precarga denominados «respondedores a volumen» en caso de presentar una hTAID (ΔVS≥10%), y los que presentan una elevada precarga o «no respondedores a volumen» (ΔVS<10%) que incluye a pacientes en situación de sobrecarga de volumen intravascular. En nuestro estudio, los pacientes que se hipotensaron tenían una menor precarga prediálisis. Es decir, el equivalente a una situación de menor sobrecarga de volumen intravascular, sin que ello fuera discriminado por los valores de OH, TBW y ECW en la BIVA. Ello probablemente hay que ponerlo en relación con la incapacidad de la BIVA de valorar de forma independiente el volumen intravascular28.
Comparamos los grupos según su respuesta a volumen (ΔVS). Tanto en pre como en posdiálisis, los pacientes considerados «respondedores a volumen», independientemente de la PA que tuvieran en ese momento, fueron los que presentaron hTAID.
Uno de los aspectos más importantes en la práctica clínica habitual de los pacientes en diálisis es la estimación del peso seco, íntimamente relacionado con la tolerancia hemodinámica del paciente en HD. Un ajuste adecuado del peso seco, sigue siendo el mayor reto para el nefrólogo dada su escasa correlación con la exploración física. De ello se deriva la búsqueda constante de herramientas para una adecuada estimación del mismo. Un concepto unificado lo define como «el peso posdiálisis más bajo tolerado y alcanzado mediante un cambio gradual en el peso posdiálisis en el que hay signos o síntomas mínimos de hipovolemia o de hipervolemia»29. Lograr el peso seco utilizando de forma simplista la presión arterial, puede poner en riesgo al paciente y la aparición de esta, no puede considerarse como un marcador de haber alcanzado o sobrepasado el peso seco.
Por este motivo, encontrar nuevos métodos que nos permitan evaluar la situación de volumen de estos pacientes, podría evitar lahTAID, incluso asintomática, minimizando el daño tisular.
En nuestro estudio no hemos encontrado relación con herramientas como la BIVA utilizada ampliamente para la estimación del peso seco. Sin embargo, la monitorización hemodinámica en tiempo real si nos ha permitido la medición de parámetros de precarga que pueden discriminar aquellos pacientes que presentan riesgo de hipotensión.
Un aspecto interesante que también se deriva de la monitorización de la precarga y de la capacidad de discriminar a los pacientes en respondedores a volumen o no, en función de su (ΔVS), es su implicación a la hora de tomar decisiones en cuanto al manejo clínico de estos pacientes. Cuando se presenta una hipotensión en un momento de la sesión de diálisis donde su ΔVS<10%, la estrategia terapéutica debería ser diferente a infundir volumen o de disminuir la tasa de UF ya que lejos de mejorar la PA podría derivar en una sobrecarga de volumen, también deletérea en estos pacientes. Por los datos obtenidos en nuestro estudio, el objetivo del tratamiento sería el de mejorar las resistencias periféricas de este grupo de pacientes. No todas las hipotensiones en diálisis son volumen/dependientes, sino que existe un porcentaje que serían dependientes de aminas o de fármacos vasoconstrictores30.
La limitación más importante del presente estudio, es el pequeño tamaño muestral. Condiciona una menor potencia estadística. Desde el punto de vista clínico, cabe reseñar el empleo de tasas de UF menores de las prescritas habitualmente. En el diseño de este estudio, el objetivo fue valorar los cambios subclínicos en los pacientes que presentaban hTAID, inducidos o no por la ultrafiltración. Probablemente con mayores tasas de UF y la aparición de hipotensiones con síntomas asociados, se podrían haber puesto de manifiesto cambios más evidentes a nivel ecocardiográfico o hemodinámico.
De igual forma son necesarios más estudios con mayor número de pacientes para poder validar la monitorización hemodinámica como herramienta útil para el manejo de volumen y evitar eventos hipotensivos subclínicos.
Concluimos que los métodos clásicos utilizados en la valoración del estado de volumen de los pacientes en diálisis como son los péptidos natriuréticos, la BIS, y el ecocardiograma transtorácico, no han sido sensibles en nuestro estudio en la detección de caídas de la PAS intradiálisis (Fall20). La detección de estos cambios hemodinámicos intradiálisis son de gran importancia por su asociación con morbimortalidad cardiovascular. Demostramos que la monitorización hemodinámica no invasiva y los datos de precarga cardiaca pueden ser una herramienta válida en el manejo del estado de volumen al mostrar una mayor sensibilidad para prevenir caídas de PA subclínicas, y administrar terapéuticas fisiopatológicamente adecuadas y poder mejorar el pronóstico a largo plazo de los pacientes en HD.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran que no presentan conflictos de intereses.