La enfermedad renal crónica (ERC) es un grave problema de salud cuyo impacto clínico, social y económico se incrementa en estadios avanzados. Dapagliflozina es un inhibidor del cotransportador de sodio-glucosa-2 que reduce el riesgo de progresión de la ERC, además de proporcionar beneficios cardiovasculares y reducir la mortalidad por cualquier causa. El objetivo de este trabajo es determinar el impacto clínico y económico a corto plazo de la adición de dapagliflozina a la terapia estándar con inhibidores del sistema renina angiotensina aldosterona (iSRAA) de la ERC en España.
Materiales y métodosSe empleó un modelo de compensación de costes que comparó los costes de los eventos clínicos y farmacológicos por cada 100.000 pacientes con ERC de una cohorte virtual tratada con dapagliflozina añadida a la terapia estándar con iSRAA frente a la terapia estándar con iSRAA sola. Se evaluaron eventos renales (progresión a fallo renal y lesión renal aguda), cardiovasculares (hospitalización por insuficiencia cardiaca [IC]) y mortalidad por cualquier causa. La incidencia de los eventos clínicos por tratamiento se obtuvo del estudio DAPA-CKD y los costes a partir de bases de datos y literatura nacional.
ResultadosEn 3 años, el tratamiento con dapagliflozina reduciría la progresión a fallo renal (−33%; 7.221 vs. 10.767), hospitalización por IC (−49%; 2.370 vs. 4.683) y lesión renal aguda (−29%; 4.110 vs. 5.819). El ahorro asociado a esta reducción de eventos es de 258 millones de euros por cada 100.000 pacientes, de los cuales el 63,4% corresponde a evitar la diálisis en el fallo renal. Considerando los costes de eventos y los costes farmacológicos del tratamiento, el ahorro total neto se estima en 158 millones de euros por cada 100.000 pacientes.
ConclusionesEl retraso de la progresión de la ERC y la reducción de la aparición de eventos clínicos gracias al tratamiento con dapagliflozina podría generar ahorros para el SNS español, incluso teniendo en cuenta el coste incremental del tratamiento farmacológico.
Chronic kidney disease (CKD) is a serious health problem with an increasing clinical, social and economic impact in advanced stages. Dapagliflozin is a sodium-glucose cotransporter-2 inhibitor that reduces the risk of CKD progression, in addition to provide cardiovascular benefits and reduce all-cause mortality. The aim of this study was to determine the short-term clinical and economic impact of dapagliflozin as an add-on to renin-angiotensin-aldosterone system inhibitors (RAASi) standard therapy for CKD in Spain.
Materials and methodsA cost-offset model was used to compare the costs of clinical events and pharmacological per 100,000 CKD patients in a virtual cohort treated with dapagliflozin added to RAASi standard therapy versus RAASi standard therapy alone. Renal (progression to renal failure and acute kidney injury), cardiovascular (hospitalisation for heart failure [HF]), and all-cause mortality events were assessed. The incidence of clinical events by treatment arm was obtained from the DAPA-CKD study, and costs were obtained from national databases and the literature.
ResultsOver 3 years, treatment with dapagliflozin would reduce progression to renal failure (−33%; 7,221 vs. 10,767), hospitalisation for HF (−49%; 2,370 vs. 4,683) and acute kidney injury (−29%; 4,110 vs. 5,819). The savings associated with this reduction in events was €258 million per 100,000 patients, of which 63.4% is due to the avoidance of dialysis for renal failure. Considering the event and pharmacological treatment costs, the total net savings were estimated at €158 million per 100,000 patients.
ConclusionsDelaying progression of CKD and reducing the incidence of clinical events thanks to the treatment with dapagliflozin could generate savings for the Spanish National Health System, even when pharmacological costs are taken into account.
La enfermedad renal crónica (ERC) es un grave problema de salud pública a nivel mundial debido a su elevada prevalencia y al gran impacto clínico, económico y social asociado1–3.
En España, se prevé que esta situación se acentúe en un futuro próximo por el envejecimiento de la población y el incremento de la prevalencia de otros factores de riesgo, como la diabetes mellitus tipo 2 (DM2), la hipertensión arterial o la enfermedad cardiovascular (ECV). En un estudio reciente cuyo objetivo era valorar la carga clínica y económica de la ERC entre 2022 y 2027 en España, se estimó que la prevalencia de la ERC se incrementaría hasta el 11,7% en 2027, equivalente a 5,68 millones de pacientes en España, y que aproximadamente dos tercios de estos tendrían una progresión silenciosa o sin diagnóstico. Además, se estimó que la prevalencia de pacientes en tratamiento renal sustitutivo (TRS) se incrementará en un 14,7%, lo que elevaría aún más el impacto económico asociado a la ERC en el gasto sanitario público en España, hasta los 4.890 millones de euros (€) en 20274.
La progresión de la ERC se asocia con el desarrollo de complicaciones que tienen un gran impacto en la calidad de vida de las personas, así como a nivel social y económico5. La ERC incrementa el riesgo de desarrollo de ECV, como la insuficiencia cardiaca (IC), y se asocia con un mayor riesgo de mortalidad. Las tasas de mortalidad cardiovascular (CV) y por cualquier causa son entre 3 y 13 veces superiores en los pacientes con ERC en categorías G3-G5 comparadas con la población general6,7. Otras complicaciones asociadas son el incremento del riesgo de lesión renal aguda, anemia, alteraciones del metabolismo óseo-mineral y fracturas8. La progresión a fallo renal ocurre en los estadios más avanzados de la ERC y puede requerir iniciar el TRS, lo cual resulta en un aumento del coste asociado por paciente entre 5 y 10 veces9. Por lo tanto, evitar o retrasar la progresión de la ERC puede resultar en importantes beneficios en calidad de vida, sanitarios y económicos10,11.
Dapagliflozina es un inhibidor del cotransportador de sodio-glucosa-2 (iSGLT2) indicado en adultos para el tratamiento de la ERC12. En el estudio Dapagliflozin and Prevention of Adverse Outcomes in CKD (DAPA-CKD)13, se investigó la eficacia y la seguridad de dapagliflozina como complemento de la terapia estándar con inhibidores del sistema renina angiotensina aldosterona (iSRAA) en 4.304 pacientes con ERC (tasa de filtración glomerular estimada [TFGe]≥25 y ≤75ml/min/1,73m2) y albuminuria elevada (cociente albúmina/creatinina [CAC] en orina entre 200 y 5.000mg/g). Dapagliflozina demostró reducir el riesgo de progresión a fallo renal en un 36% (cociente de riesgo [HR]: 0,64; intervalo de confianza del 95% [IC 95%]: 0,50-0,82), y se observó un beneficio sobre el enlentecimiento de la caída crónica de la TFGe en los pacientes tratados frente a placebo, con una diferencia anual media de 1,92ml/min/1,73m2 (IC 95%: 1,61-2,24)14. Además del beneficio sobre la función renal, dapagliflozina demostró frente a placebo un efecto protector sobre la IC y la mortalidad, con una reducción del riesgo relativo de hospitalización por IC o muerte por causas CV del 29% (HR: 0,71; IC 95%: 0,55-0,92; p=0,0089) y del riesgo de mortalidad por cualquier causa del 31% (HR: 0,69; IC 95%: 0,53-0,88)14.
Los análisis de compensación de costes son una herramienta que ayudan a los responsables de la implementación de estrategias y políticas sanitarias a comprender el impacto de una nueva intervención frente a otras estrategias de atención estándar y a tomar decisiones eficientes en sus entornos de actuación15. El objetivo de este trabajo es determinar el impacto clínico y económico a corto plazo asociado al uso de dapagliflozina añadida a la terapia estándar con iSRAAen el tratamiento de la ERC en comparación con la terapia estándar con iSRAA sola, según la perspectiva del Sistema Nacional de Salud (SNS) español.
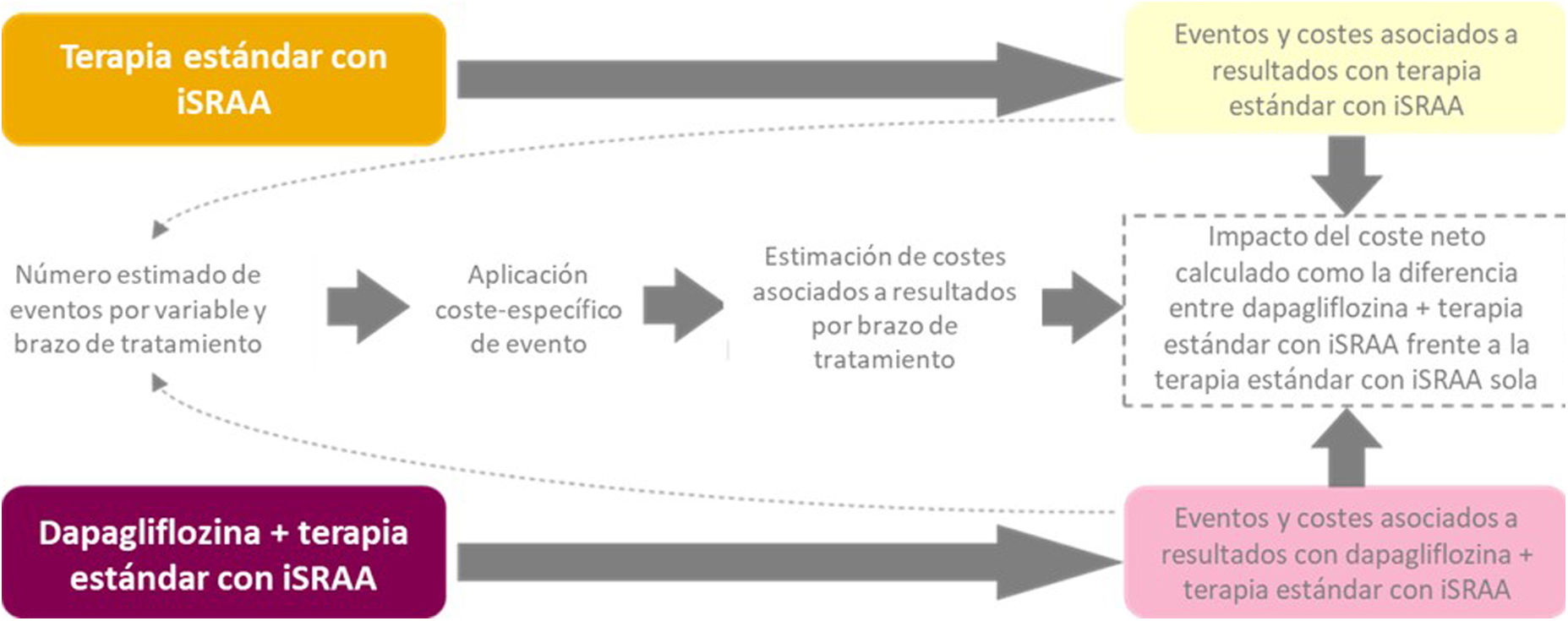
MétodosDiseño del modeloSe emplearon datos de incidencia de eventos a lo largo de 3 años del estudio DAPA-CKD y se trasladaron estos eventos a los costes asociados esperados en el SNS español. Para ello, se utilizó un modelo de compensación de costes (MCC) que compara los costes sanitarios totales de un brazo de intervención frente a un comparador que se utiliza como referencia para determinar el impacto económico de la intervención. Concretamente, se compararon los costes asociados a los eventos clínicos y farmacológicos en un escenario con dapagliflozina como intervención frente a un escenario con placebo como comparador, a partir de los brazos de tratamiento del estudio DAPA-CKD13.
El diseño conceptual del MCC se presenta en la figura 1. El brazo de intervención incluye las consecuencias del tratamiento con dapagliflozina añadida a la terapia estándar con iSRAA (brazo dapagliflozina + terapia estándar con iSRAA), es decir, dapagliflozina añadida al tratamiento con inhibidores de la enzima convertidora de la angiotensina (IECA) o antagonistas de los receptores de la angiotensina II (ARA II). El brazo comparador incluye las consecuencias del tratamiento con solo la terapia estándar con iSRAA (brazo terapia estándar con iSRAA: IECA o ARA II).
Para el modelo, se asumió un horizonte temporal de 3 años en una cohorte virtual de 100.000 pacientes que reflejaba las características de los pacientes incluidos en el estudio DAPA-CKD, es decir, pacientes diagnosticados con ERC, con una TFGe≥25 y ≤75ml/min/1,73m2, y un CAC en orina entre 200 y 5.000mg/g13. Adicionalmente, se analizaron los resultados para cuatro subpoblaciones específicas dentro de la población analizada: pacientes con ERC y DM2 previas, pacientes con ERC sin DM2 previa, pacientes con ERC y una TFGe inicial ≥45ml/min/1,73m2, y pacientes con ERC y una TFGe inicial <45ml/min/1,73m2.
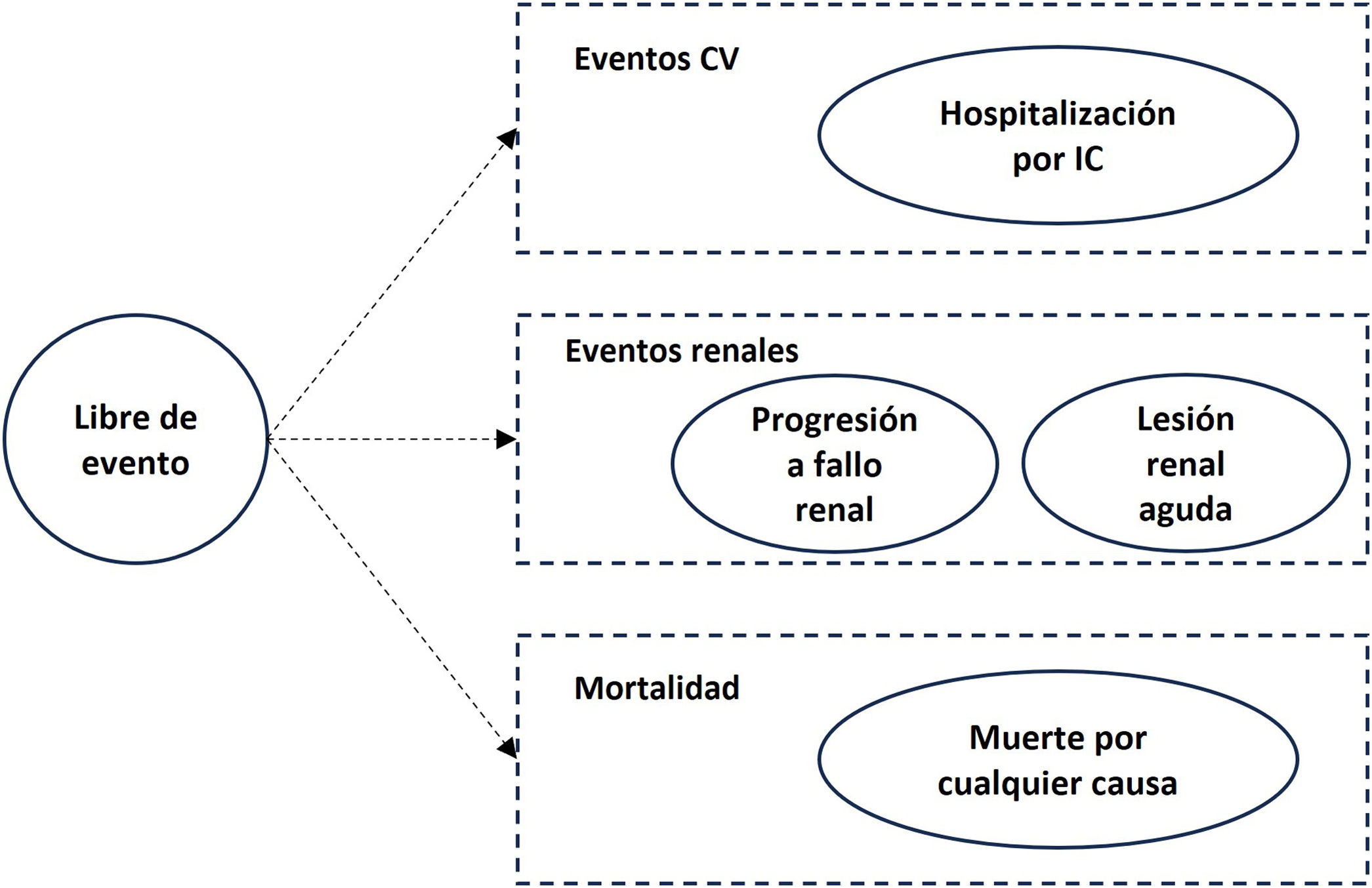
Eventos clínicos y estados de saludLos eventos clínicos se modelizaron a través de diferentes estados de salud (fig. 2). La distribución de los pacientes en cada uno de los estados de salud se estimó a partir de las curvas de supervivencia libre de evento observadas en el estudio DAPA-CKD extrapoladas a lo largo del horizonte temporal mediante distribuciones paramétricas exponenciales, asumiendo que los riesgos son constantes a lo largo del tiempo. Se incluyeron los eventos de progresión a fallo renal, evento de lesión renal aguda, hospitalización por IC y muerte por cualquier causa. Estos eventos se definieron de la misma forma que en el estudio DAPA-CKD. Se consideró un evento de progresión a fallo renal como la pérdida de la TFGe por debajo de 15ml/min/1,73m2 o la necesidad de diálisis crónica o trasplante renal durante más de 28 días. El evento de lesión renal aguda grave se definió como una duplicación de la creatinina sérica comparado con el valor más reciente de creatinina sérica del laboratorio13. La incidencia de los eventos clínicos por tipo y brazo de tratamiento para todas las poblaciones analizadas se obtuvieron del estudio DAPA-CKD14.
Estados de salud del modelo.
Nota: Se consideró un evento de progresión a fallo renal como la pérdida de la TFGe por debajo de 15ml/min/1,73m2 o la necesidad de diálisis crónica o trasplante renal durante más de 28 días. La lesión renal aguda se define como la duplicación de la creatinina sérica.
CV: cardiovascular; IC: insuficiencia cardiaca; TFGe: tasa de filtración glomerular estimada
A partir de los eventos observados, se calculó el número necesario de pacientes a tratar (NNT), es decir, el número promedio de pacientes necesarios a tratar con dapagliflozina + terapia estándar con iSRAA en lugar de tratar sólo con terapia estándar con iSRAA para evitar un evento.
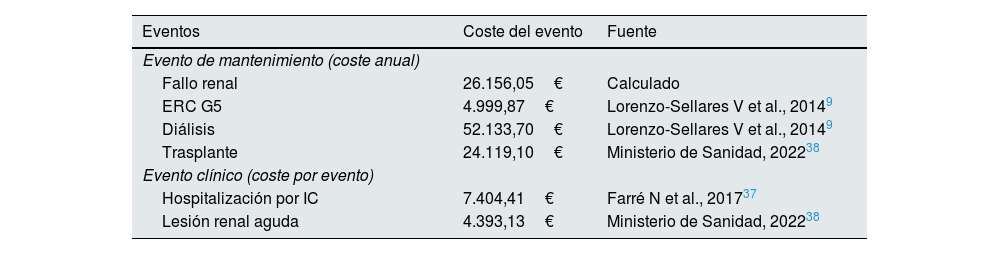
Costes incluidos en el modeloLos costes asociados con los eventos clínicos se obtuvieron como parte del programa de investigación global Inside CKD a partir de la literatura publicada16 (tabla 1). Los costes de los eventos clínicos se aplicaron una única vez en el año de incidencia del evento y los costes de mantenimiento se aplicaron desde la incidencia del evento hasta la muerte o el final del horizonte temporal. Se asumió que el coste asociado con la mortalidad era nulo.
Costes de eventos clínicos y de mantenimiento
| Eventos | Coste del evento | Fuente |
|---|---|---|
| Evento de mantenimiento (coste anual) | ||
| Fallo renal | 26.156,05€ | Calculado |
| ERC G5 | 4.999,87€ | Lorenzo-Sellares V et al., 20149 |
| Diálisis | 52.133,70€ | Lorenzo-Sellares V et al., 20149 |
| Trasplante | 24.119,10€ | Ministerio de Sanidad, 202238 |
| Evento clínico (coste por evento) | ||
| Hospitalización por IC | 7.404,41€ | Farré N et al., 201737 |
| Lesión renal aguda | 4.393,13€ | Ministerio de Sanidad, 202238 |
Nota: Los eventos de mantenimiento se presentan como coste anual y se aplican en el modelo como un coste por ciclo (diario). El evento de fallo renal se calcula como un promedio ponderado del coste de un paciente en ERC G5, diálisis y trasplante, y se consideran las distribuciones de la población incluida en el estudio DAPA-CKD. Se asume un coste único para todas las modalidades de diálisis, correspondiente al coste de hemodiálisis. Los eventos clínicos se presentan como un coste por evento y se aplican únicamente en el ciclo en el que suceden. La lesión renal aguda se define como la duplicación de la creatinina sérica. Todos los costes se expresan en €/2022, actualizados en base al IPC del INE de España.
ERC: enfermedad renal crónica; IC: insuficiencia cardiaca; INE: Instituto Nacional de Estadística; IPC: índice de precios consumo.
El coste del evento de mantenimiento del fallo renal se ajustó según la proporción de pacientes en ERC G5 sin TRS y con TRS, incluyendo en este último el coste de la diálisis y del trasplante. Se consideró que el 53,4% de los pacientes en ERC G5 no reciben TRS, el 43,7% reciben diálisis y el 2,8% han recibido un trasplante, en línea con la distribución de pacientes en TRS en el estudio DAPA-CKD14. El coste de la diálisis peritoneal se asumió equivalente al coste de la hemodiálisis9.
En cuanto a los costes farmacológicos, se incluyó el coste de la terapia estándar con iSRAA para los 2 brazos de tratamiento, estimado en 0,10€/día, considerando los principios activos del estudio DAPA-CKD, IECA y ARA II, y las distribuciones de uso para cada uno de los principios activos en base a literatura local14,17. El coste del tratamiento con dapagliflozina solo se incluyó en el brazo dapagliflozina + terapia estándar con iSRAA, estimado en 1,07€/día. Los costes se estimaron según la posología recomendada en la ficha técnica para todos los principios activos en el tratamiento de la ERC (10mg/una vez al día para dapagliflozina)12. Se consideró el precio de venta del laboratorio obtenido de la base de datos del Consejo General de Colegios Oficiales de Farmacéuticos18, aplicando la deducción de acuerdo con el Real Decreto Ley 8/201019.
Todos los costes se expresaron en € actualizados en base al índice de precios de consumo de España del año 202220. Se utilizó una tasa de descuento del 3% para los costes de acuerdo con las recomendaciones para la realización de evaluaciones económicas en España21–23.
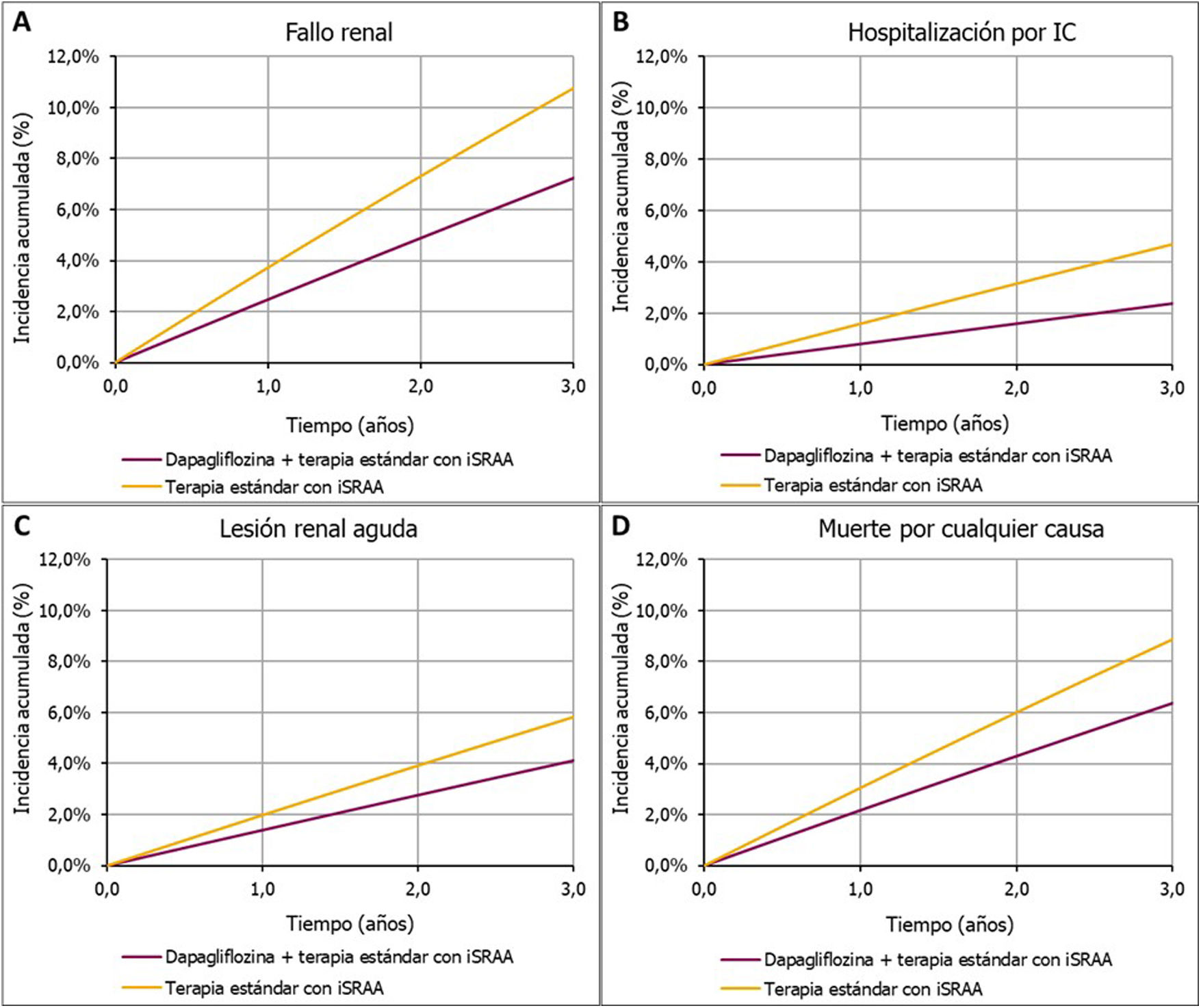
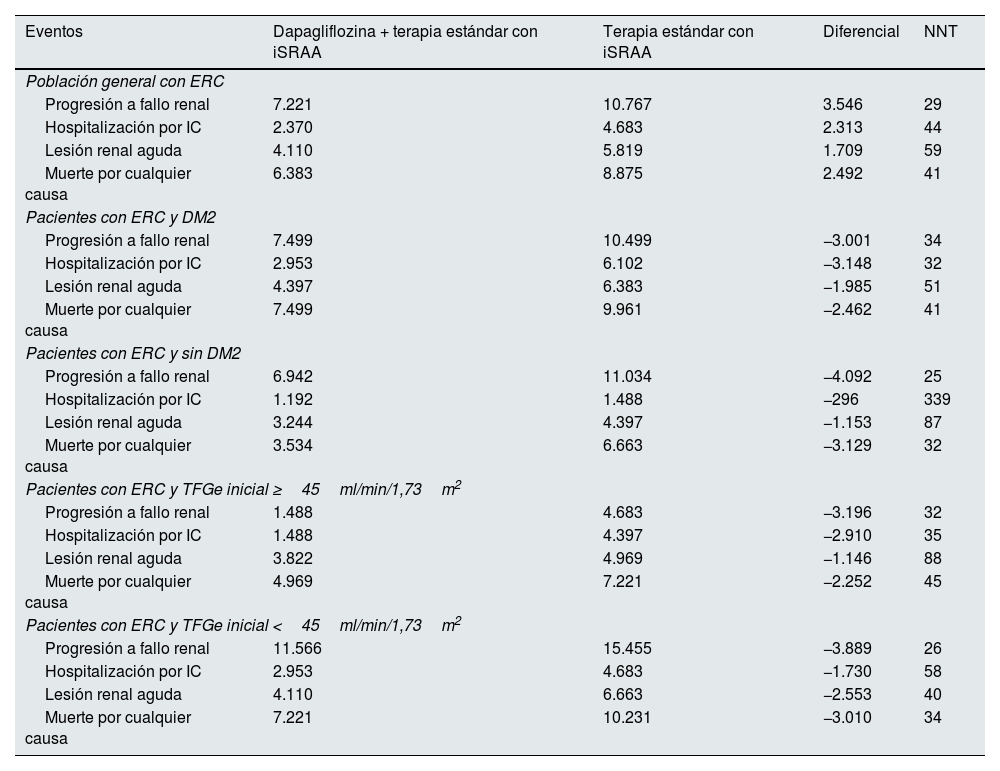
ResultadosResultados clínicosEn una cohorte virtual de 100.000 pacientes con ERC y características iniciales que reflejaban los criterios de inclusión del estudio DAPA-CKD (TFGe≥25 y ≤75ml/min/1,73m2 y CAC en orina 200 a 5.000mg/g), el tratamiento con dapagliflozina evitaría 3.546 eventos de progresión a fallo renal (1.550 de diálisis, 102 de trasplante y 1.894 sin inicio de TRS), lo que supondría una reducción de un 33% de estos eventos, de 10.767 a 7.221 en un horizonte temporal de 3 años. Dapagliflozina evitaría también 2.313 eventos de hospitalización por IC (−49%; 2.370 vs. 4.683), 1.709 eventos de lesión renal aguda (−29%; 4.110 vs. 5.819) y 2.492 eventos de muerte por cualquier causa (−28%; 6.383 vs. 8.875). En la tabla 2, se presentan los eventos por brazo de tratamiento para la población analizada y las subpoblaciones. En la figura 3, se presenta la incidencia acumulada de eventos por cada 100.000 pacientes en el brazo dapagliflozina + terapia estándar con iSRAA y en el brazo terapia estándar con iSRAA en 3 años.
Eventos clínicos totales por cada 100.000 pacientes/año observados en un horizonte temporal de 3 años
| Eventos | Dapagliflozina + terapia estándar con iSRAA | Terapia estándar con iSRAA | Diferencial | NNT |
|---|---|---|---|---|
| Población general con ERC | ||||
| Progresión a fallo renal | 7.221 | 10.767 | 3.546 | 29 |
| Hospitalización por IC | 2.370 | 4.683 | 2.313 | 44 |
| Lesión renal aguda | 4.110 | 5.819 | 1.709 | 59 |
| Muerte por cualquier causa | 6.383 | 8.875 | 2.492 | 41 |
| Pacientes con ERC y DM2 | ||||
| Progresión a fallo renal | 7.499 | 10.499 | −3.001 | 34 |
| Hospitalización por IC | 2.953 | 6.102 | −3.148 | 32 |
| Lesión renal aguda | 4.397 | 6.383 | −1.985 | 51 |
| Muerte por cualquier causa | 7.499 | 9.961 | −2.462 | 41 |
| Pacientes con ERC y sin DM2 | ||||
| Progresión a fallo renal | 6.942 | 11.034 | −4.092 | 25 |
| Hospitalización por IC | 1.192 | 1.488 | −296 | 339 |
| Lesión renal aguda | 3.244 | 4.397 | −1.153 | 87 |
| Muerte por cualquier causa | 3.534 | 6.663 | −3.129 | 32 |
| Pacientes con ERC y TFGe inicial ≥45ml/min/1,73m2 | ||||
| Progresión a fallo renal | 1.488 | 4.683 | −3.196 | 32 |
| Hospitalización por IC | 1.488 | 4.397 | −2.910 | 35 |
| Lesión renal aguda | 3.822 | 4.969 | −1.146 | 88 |
| Muerte por cualquier causa | 4.969 | 7.221 | −2.252 | 45 |
| Pacientes con ERC y TFGe inicial <45ml/min/1,73m2 | ||||
| Progresión a fallo renal | 11.566 | 15.455 | −3.889 | 26 |
| Hospitalización por IC | 2.953 | 4.683 | −1.730 | 58 |
| Lesión renal aguda | 4.110 | 6.663 | −2.553 | 40 |
| Muerte por cualquier causa | 7.221 | 10.231 | −3.010 | 34 |
Nota: La población general con ERC se refiere a pacientes con características iniciales que reflejaban los criterios de inclusión del estudio DAPA-CKD (TFGe≥25 y ≤75ml/min/1,73m2 y CAC en orina 200 a 5.000mg/g).
CAC: cociente albúmina/creatinina; DM2: diabetes mellitus tipo 2; ERC: enfermedad renal crónica; IC: insuficiencia cardiaca; iSRAA: inhibidores del sistema renina angiotensina aldosterona; NNT: número necesario de pacientes a tratar para evitar un evento; TFGe: tasa de filtración glomerular estimada.
El NNT con dapagliflozina en comparación con placebo fue de 29 (IC 95%: 27-31) para prevenir un evento de fallo renal, 44 (IC 95%: 41-47) para prevenir un evento de hospitalización por IC, 59 (IC 95%: 53-66) para prevenir un evento de lesión renal aguda y 41 (IC 95%: 37-45) para prevenir un evento de muerte por cualquier causa.
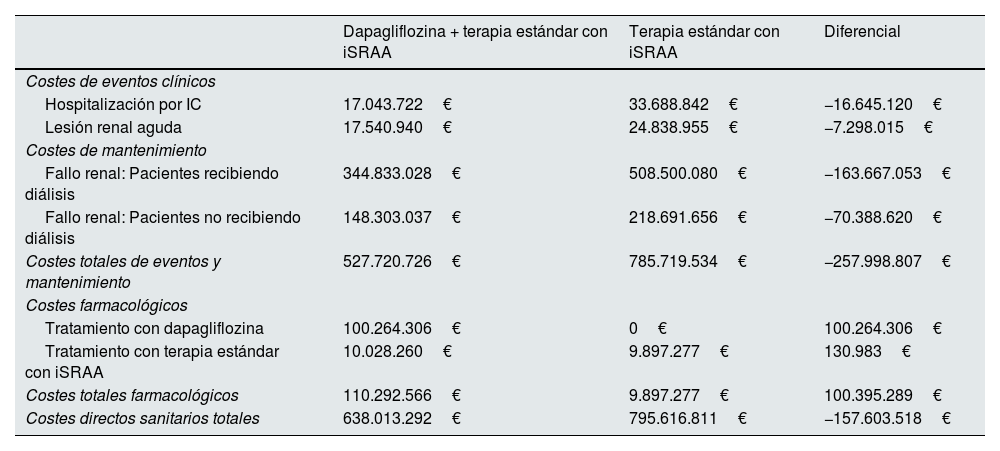
Resultados económicosEn línea con los resultados clínicos, la diferencia del coste asociado con la reducción de los eventos clínicos mostró ahorros para el tratamiento con dapagliflozina + terapia estándar con iSRAA en comparación con terapia estándar con iSRAA, siendo el más importante el generado por la reducción de la progresión a fallo renal en pacientes tratados con dapagliflozina. En total, con el tratamiento con dapagliflozina, se estimó que la reducción de eventos incidentes y evitar la progresión a fallo renal, con los consecuentes cuidados crónicos de mantenimiento, redujo el gasto sanitario en 258 millones de € por cada 100.000 pacientes tratados en 3 años, de los cuales el 63,4% (164 millones de €) se corresponde a los ahorros por la reducción de progresión a fallo renal en pacientes con necesidad de diálisis. Los resultados económicos por cada evento se muestran en la tabla 3.
Costes totales acumulados en 3 años por 100.000 pacientes en la población general con ERC
| Dapagliflozina + terapia estándar con iSRAA | Terapia estándar con iSRAA | Diferencial | |
|---|---|---|---|
| Costes de eventos clínicos | |||
| Hospitalización por IC | 17.043.722€ | 33.688.842€ | −16.645.120€ |
| Lesión renal aguda | 17.540.940€ | 24.838.955€ | −7.298.015€ |
| Costes de mantenimiento | |||
| Fallo renal: Pacientes recibiendo diálisis | 344.833.028€ | 508.500.080€ | −163.667.053€ |
| Fallo renal: Pacientes no recibiendo diálisis | 148.303.037€ | 218.691.656€ | −70.388.620€ |
| Costes totales de eventos y mantenimiento | 527.720.726€ | 785.719.534€ | −257.998.807€ |
| Costes farmacológicos | |||
| Tratamiento con dapagliflozina | 100.264.306€ | 0€ | 100.264.306€ |
| Tratamiento con terapia estándar con iSRAA | 10.028.260€ | 9.897.277€ | 130.983€ |
| Costes totales farmacológicos | 110.292.566€ | 9.897.277€ | 100.395.289€ |
| Costes directos sanitarios totales | 638.013.292€ | 795.616.811€ | −157.603.518€ |
Nota: La población general con ERC se refiere a pacientes con características iniciales que reflejaban los criterios de inclusión del estudio DAPA-CKD (TFGe≥25 y ≤75ml/min/1,73m2 y CAC en orina 200 a 5.000mg/g). Los costes diferenciales del tratamiento con terapia estándar con iSRAA se deben a diferencias de mortalidad de los pacientes en cada brazo de tratamiento.
CAC: cociente albúmina/creatinina; ERC: enfermedad renal crónica; IC: insuficiencia cardiaca; iSRAA: inhibidores del sistema renina angiotensina aldosterona; TFGe: tasa de filtración glomerular estimada.
El coste farmacológico de dapagliflozina + terapia estándar con iSRAA se estimó en 110 millones de € y el coste de la terapia estándar con iSRAA se estimó en 10 millones de € por cada 100.000 pacientes tratados en 3 años en los 2 brazos de tratamiento, resultando en un incremental de 100 millones de € por cada 100.000 pacientes tratados.
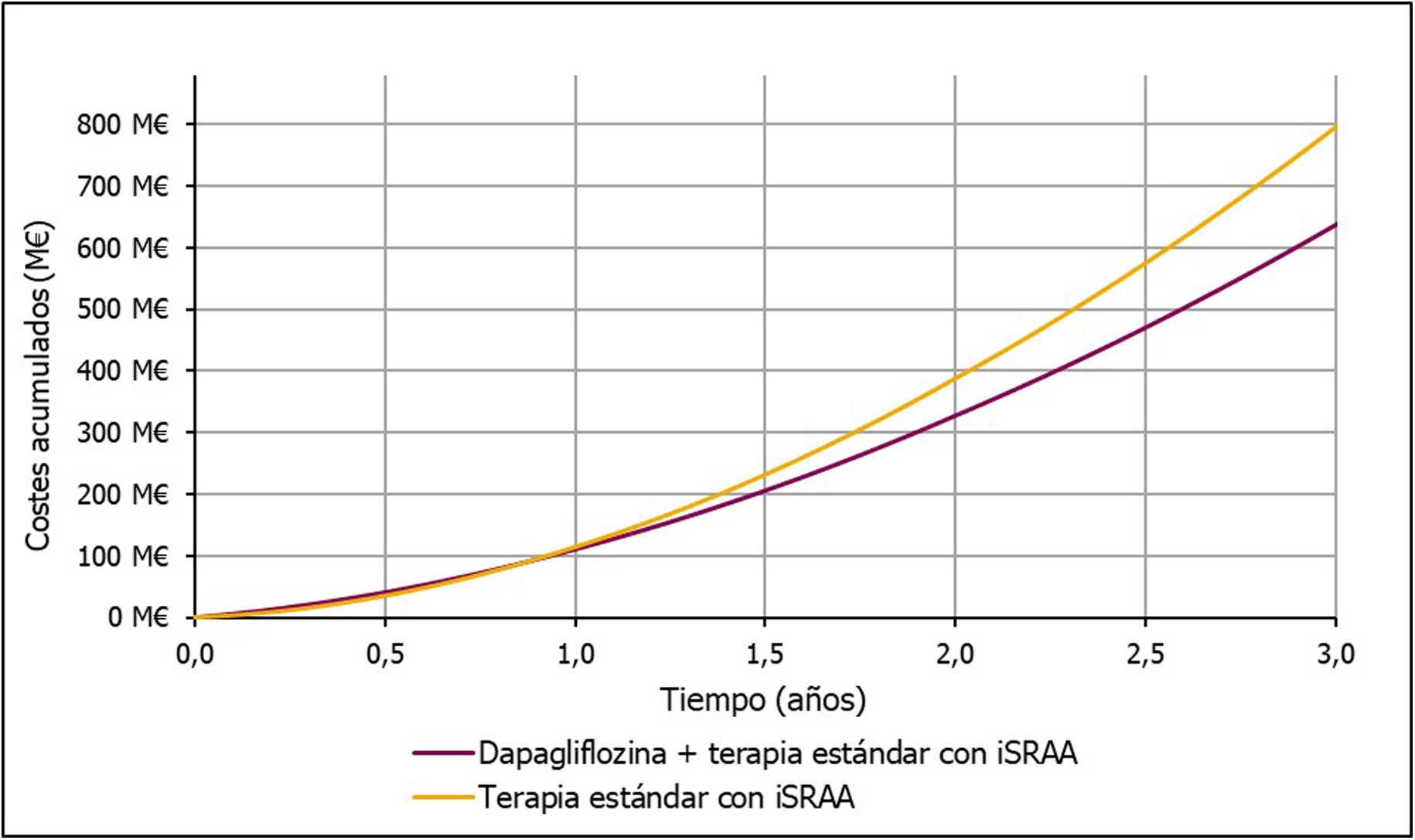
Restando el coste del tratamiento con dapagliflozina al de la reducción del gasto sanitario en eventos, el ahorro neto del tratamiento con dapagliflozina + terapia estándar con iSRAA frente a la terapia estándar con iSRAA sería de 158 millones de € por cada 100.000 pacientes tratados en 3 años (fig. 4). Por lo tanto, para cada paciente tratado con dapagliflozina se produciría un ahorro de 525,35€ al año, en comparación con la terapia estándar con iSRAA.
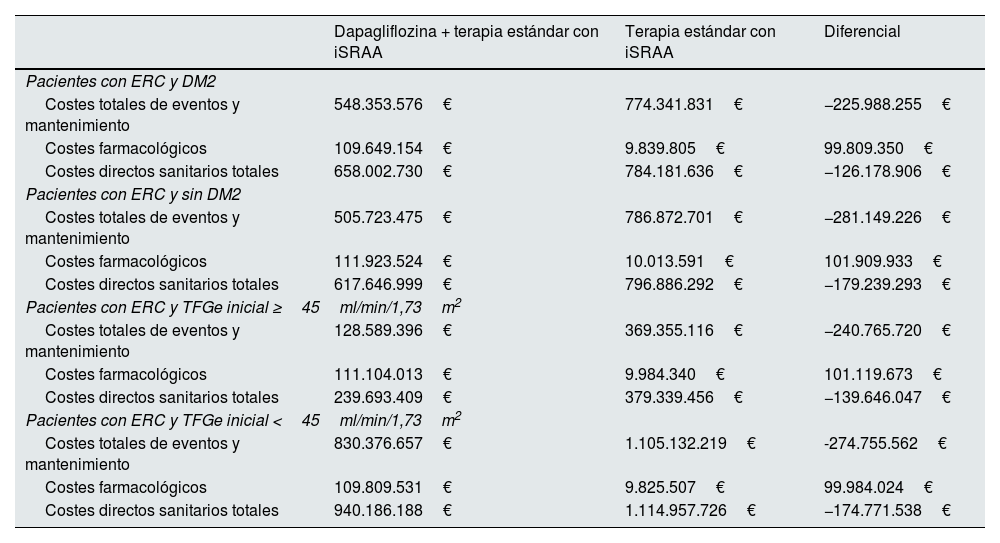
En el análisis de subgrupos, se obtuvieron ahorros derivados de la reducción de eventos clínicos en todos los subgrupos de pacientes analizados. En concreto, los ahorros netos variaron entre los 126 y los 179 millones de € por cada 100.000 pacientes tratados en 3 años, siendo los subgrupos en los que se observó un mayor ahorro los pacientes con ERC sin DM2 y los pacientes con ERC y una TFGe inicial <45ml/min/1,73m2, principalmente por una mayor reducción de eventos de progresión a fallo renal (tabla 4).
Costes totales acumulados en 3 años por 100.000 pacientes en los subgrupos analizados
| Dapagliflozina + terapia estándar con iSRAA | Terapia estándar con iSRAA | Diferencial | |
|---|---|---|---|
| Pacientes con ERC y DM2 | |||
| Costes totales de eventos y mantenimiento | 548.353.576€ | 774.341.831€ | −225.988.255€ |
| Costes farmacológicos | 109.649.154€ | 9.839.805€ | 99.809.350€ |
| Costes directos sanitarios totales | 658.002.730€ | 784.181.636€ | −126.178.906€ |
| Pacientes con ERC y sin DM2 | |||
| Costes totales de eventos y mantenimiento | 505.723.475€ | 786.872.701€ | −281.149.226€ |
| Costes farmacológicos | 111.923.524€ | 10.013.591€ | 101.909.933€ |
| Costes directos sanitarios totales | 617.646.999€ | 796.886.292€ | −179.239.293€ |
| Pacientes con ERC y TFGe inicial ≥45ml/min/1,73m2 | |||
| Costes totales de eventos y mantenimiento | 128.589.396€ | 369.355.116€ | −240.765.720€ |
| Costes farmacológicos | 111.104.013€ | 9.984.340€ | 101.119.673€ |
| Costes directos sanitarios totales | 239.693.409€ | 379.339.456€ | −139.646.047€ |
| Pacientes con ERC y TFGe inicial <45ml/min/1,73m2 | |||
| Costes totales de eventos y mantenimiento | 830.376.657€ | 1.105.132.219€ | -274.755.562€ |
| Costes farmacológicos | 109.809.531€ | 9.825.507€ | 99.984.024€ |
| Costes directos sanitarios totales | 940.186.188€ | 1.114.957.726€ | −174.771.538€ |
Nota: Los costes diferenciales del tratamiento con terapia estándar con iSRAA se deben a diferencias de mortalidad de los pacientes en cada brazo de tratamiento.
DM2: diabetes mellitus tipo 2; ERC: enfermedad renal crónica; iSRAA: inhibidores del sistema renina angiotensina aldosterona; TFGe: tasa de filtración glomerular estimada.
El uso de iSGLT2 en pacientes con ERC se recomienda en pacientes con una TFGe≥20ml/min/1,73m2 como un primer escalón terapéutico, junto al uso de IECA o ARA II, según la actualización más reciente de la guía internacional de referencia KDIGO24, por sus beneficios demostrados en la reducción de progresión de la enfermedad y eventos clínicos asociados14. En esta línea, en este estudio se analizó el impacto clínico y económico de la ERC a corto plazo asociado al tratamiento con dapagliflozina añadida a la terapia estándar con iSRAA (IECA y ARA II) frente a únicamente la terapia estándar con iSRAA en España.
Se cuantificó que el tratamiento con dapagliflozina en pacientes diagnosticados con ERC se traduciría en un ahorro neto total de 158 millones de € por cada 100.000 pacientes tratados en España en 3 años, incluyendo los costes farmacológicos incrementales de dapagliflozina. Este ahorro se debe mayoritariamente a la reducción del número de pacientes que progresan a fallo renal y precisan diálisis, estimado en 164 millones de €. Estos ahorros netos se observaron también en todas las subpoblaciones de pacientes analizadas, incluyendo pacientes con una TFGe inicial ≥45ml/min/1,73m2, donde el ahorro neto se estimó en 140 millones de € por cada 100.000 pacientes tratados en 3 años. Esto sugeriría que la introducción de dapagliflozina en estadios tempranos, cuando aún se puede interferir con la trayectoria de esta enfermedad y reducir la progresión a fallo renal no solo es necesario desde un punto de vista clínico, sino también económico.
En este estudio, el principal impulsor del ahorro por el tratamiento con dapagliflozina es la prevención de eventos de progresión a fallo renal, estimado en 234 millones de € por cada 100.000 pacientes tratados en España en 3 años, con una reducción del 33% de eventos frente a la terapia estándar con iSRAA. Por cada 100.000 pacientes tratados con las características de la población del estudio DAPA-CKD y asumiendo una progresión lineal en el tiempo, 1.119 pacientes iniciarían TRS (1.052 diálisis y 67 trasplante) anualmente en el brazo de dapagliflozina más terapia estándar con iSRAA frente a los 1.669 pacientes anuales que iniciarían TRS (1.569 diálisis y 100 trasplante) en el brazo con terapia estándar con iSRAA. En España, los datos más recientes del Registro Nacional de Enfermos Renales indican que 7.119 pacientes iniciaron un TRS en 2022 (6.751 diálisis y 368 trasplante)25. Como resultado, considerando que entre 300.000 y 400.000 pacientes con ERC se podrían beneficiar del tratamiento con dapagliflozina en España26, se estima que se podrían prevenir entre el 23 y el 31% de los pacientes incidentes en TRS en España.
En 2023 se publicaron los primeros resultados de Inside CKD, el primer programa diseñado para analizar la prevalencia y la carga previstas de la ERC en países de todo el mundo y simular estrategias de intervención para determinar su posible impacto en los resultados sanitarios y económicos a escala nacional y mundial16. En España, la proyección de la carga clínica y económica de la ERC entre 2022 y 2027 estimó un incremento de la prevalencia de la ERC en la población general, hasta los 5,68 millones de pacientes, y un incremento de la prevalencia del TRS hasta el 14,7% en 2027, lo que supondría un aumento del gasto sanitario público español hasta los 4.890 millones de € en ese año4. Este estudio pone de manifiesto la necesidad de intervenir en las etapas tempranas de la enfermedad para retrasar la progresión a fallo renal y demuestra que es una oportunidad única para actuar y poder ralentizar la progresión de la enfermedad mediante el tratamiento con dapagliflozina.
Sin embargo, si el manejo de la ERC continúa sin ningún cambio, se espera que hasta dos tercios de los pacientes con ERC tendrá una progresión silenciosa o no serán diagnosticados, por lo que no se les podría administrar tratamiento en etapa temprana4. Por este motivo, es de especial interés seguir las recomendaciones de las sociedades científicas27 y del Ministerio de Sanidad28 que establecen la necesidad de determinar la TFGe y el CAC en orina en las pruebas rutinarias de pacientes en riesgo de ERC para identificar y diagnosticar precozmente, tratar de forma temprana y reducir la progresión de la ERC, así como la asignación adecuada (en tiempo y forma) de los códigos de diagnóstico de ERC en las historias clínicas27,29,30.
Otras evaluaciones fármaco/económicas recientes de la terapia con dapagliflozina en pacientes con ERC en España y otros países europeos también concluyeron que el tratamiento con dapagliflozina tiene el potencial de reducir costes. En 2023, McEwan et al. estimaron el impacto económico medio del tratamiento con dapagliflozina + terapia estándar con iSRAA frente a la terapia estándar con iSRAA en 31 regiones de todo el mundo, incluyendo España, a partir del mismo modelo económico desarrollado con los resultados del estudio DAPA-CKD. Sin embargo, a diferencia del presente trabajo, no se incluyeron los costes farmacológicos. En concreto, se estimó que el tratamiento con dapagliflozina + terapia estándar con iSRAA frente a solo la terapia estándar con iSRAA generaría un ahorro promedio de 264 millones de $ por cada 100.000 pacientes en 3 años, en línea con los 258 millones de € estimados en este trabajo para España31. En 2022, McEwan et al. publicaron un análisis de coste/efectividad de la adición de dapagliflozina a la terapia estándar con iSRAA desde la perspectiva del pagador en 3 países: Reino Unido, Alemania y España. Este estudio concluyó que la terapia con dapagliflozina es coste/efectiva frente a la terapia estándar con iSRAA (IECA/ARA II) para el tratamiento de la ERC en los tres países, con una relación de coste/efectividad incremental de 9.875€ por año de vida ajustado por calidad en España, considerando un umbral de eficiencia de 30.000€ por año de vida ajustado por calidad32.
Existen también estudios basados en modelos de impacto presupuestario que incluyeron los costes de eventos clínicos en la evaluación de la introducción de dapagliflozina para el tratamiento de la ERC. En 2021, Darlington et al. publicaron un análisis del impacto presupuestario desde la perspectiva del pagador en Reino Unido, incluyendo como eventos clínicos la progresión de la ERC, progresión a fallo renal, hospitalización por IC y muerte. El análisis se realizó sobre una población de 929.000 pacientes potenciales para el tratamiento con dapagliflozina, y concluyó que el impacto presupuestario total de la introducción de este fármaco en un horizonte temporal de 3 años, incluyendo costes farmacológicos, resultaría en un ahorro de 291,3 millones de £ en comparación con la terapia estándar con iSRAA33. En el mismo sentido, de Pouvourville et al. publicaron en 2023 un estudio del impacto presupuestario de la introducción de dapagliflozina desde la perspectiva del pagador en Francia, incluyendo costes farmacológicos, eventos clínicos (progresión de la ERC, progresión a fallo renal, hospitalización por IC y muerte) y acontecimientos adversos. Se estimó un ahorro total de 650 millones de € en un horizonte temporal de 5 años en comparación con la terapia estándar con iSRAA (IECA/ARA II), derivado de la ralentización de la progresión de la enfermedad en los pacientes tratados con dapagliflozina34.
La perspectiva global del proyecto Inside CKD presenta ciertas limitaciones en su aplicación a cada entorno nacional. La estimación del coste de mantenimiento del evento de fallo renal se calculó utilizando la proporción de pacientes incidentes sin TRS, que inician diálisis y con trasplante renal de inicio, a partir de los resultados del estudio DAPA-CKD14. Cabe destacar que el coste del tratamiento de la diálisis en nuestro país es muy variable entre las distintas regiones y los datos que se utilizaron en este estudio provienen de una región específica (Islas Canarias) y podrían variar en otros entornos. No se tuvo en cuenta que el uso de recursos y el coste de los pacientes en el primer año del trasplante es significativamente superior a los años subsiguientes debido al procedimiento del trasplante en sí35. Sin embargo, esta potencial sobreestimación del coste del trasplante puede estar compensada por haber asumido, de acuerdo a lo descrito en métodos, que el 56,3% de los pacientes en ERC G5 aún no reciben ni diálisis ni trasplante. En consecuencia, el coste ponderado resultante del mantenimiento del fallo renal es probablemente inferior al esperable debido a que los pacientes requerirán iniciar TRS en un horizonte temporal corto.
Otra posible limitación es que la población incluida en el modelo es una cohorte definida y cerrada. La cohorte virtual de 100.000 pacientes de este análisis refleja las características iniciales de los pacientes del estudio DAPA-CKD, y podría no representar exactamente a la población potencial en España. Aun así, la población elegible a recibir tratamiento con dapagliflozina en España se encuentra en línea con los criterios de inclusión del estudio DAPA-CKD36, por lo que no se espera que esta suposición pueda influir significativamente en los resultados presentados. Al comparar la población del estudio DAPA-CKD con los datos del estudio nacional epidemiológico IBERICAN26, y con criterios conservadores, se estima que aproximadamente entre 300.000 y 400.000 pacientes se beneficiarían del tratamiento con dapagliflozina en España.
En este estudio se incluyeron únicamente los eventos de progresión a fallo renal, hospitalización por IC, lesión renal aguda y muerte por cualquier causa. Sin embargo, existen otros eventos clínicos que podrían verse beneficiados del tratamiento con dapagliflozina y su mejora podría resultar en ahorros mayores a los estimados. Por otro lado, el coste unitario de la hospitalización por IC es muy variable en la literatura y depende de la población de estudio (región, comorbilidades asociadas a los pacientes, número de hospitalizaciones), por lo que los ahorros derivados de la reducción de hospitalizaciones reportados podrían ser mayores al tratarse de una población con ERC previa37,38. Finalmente, no se tuvo en cuenta que el tratamiento con dapagliflozina en pacientes con ERC permitiría tratar también otras posibles comorbilidades (p, ej., DM2 e IC)39–41. En consecuencia, los costes farmacológicos de la terapia estándar con iSRAA podrían ser menores en pacientes tratados con dapagliflozina, y los ahorros mayores a los estimados.
ConclusionesEl tratamiento con dapagliflozina ha demostrado tener beneficios claves para el manejo de la ERC, tales como retrasar la progresión de la enfermedad y reducir la aparición de eventos clínicos asociados a la ERC. Este estudio demuestra que el tratamiento con dapagliflozina genera ahorros para el SNS español, incluso teniendo en cuenta el coste incremental del tratamiento farmacológico. El ahorro neto total en 3 años se estimó en 158 millones de € por cada 100.000 pacientes tratados con dapagliflozina + terapia estándar con iSRAA, en comparación con la terapia estándar con iSRAA.
FinanciaciónInside CKD está financiado por AstraZeneca. Inside CKD es un proyecto basado en datos de microsimulación, por lo que no se suministraron ni financiaron fármacos. Los análisis estadísticos fueron financiados por AstraZeneca. PharmaLex recibió financiación de AstraZeneca para la realización de este estudio.
La investigación de AO y JFNG está financiada por la Comunidad de Madrid en Biomedicina P2022/BMD-7223, CIFRA_COR-CM. Instituto de Salud Carlos III (ISCIII) RICORS program to RICORS2040 (RD21/0005/0001 y RD21/0005/0013) financiado por la Unión Europea - NextGenerationEU, Mecanismo para la Recuperación y la Resiliencia (MRR), Fondos FEDER. La investigación de AO también está financiada por PREVENTCKD Consortium Project ID: 101101220 Programme: EU4H DG/Agency: HADEA.
Conflicto de interesesBL, UA, BLC, MC y JJGS son empleados de AstraZeneca. LS, EPM y CC son empleados de PharmaLex. AO ha recibido subvenciones de Sanofi y honorarios por consultoría o conferencias o apoyo para viajes de Adviccene, Alexion, Astellas, AstrazZeneca, Amicus, Amgen, Boehringer Ingelheim, Fresenius Medical Care, GSK, Bayer, Sanofi-Genzyme, Menarini, Mundipharma, Kyowa Kirin, Lilly, Freeline, Idorsia, Chiesi, Otsuka, Novo-Nordisk, Sysmex y Vifor Fresenius Medical Care Renal Pharma, es director de la Catedra UAM-AstraZeneca de enfermedad renal crónica y electrolitos, y tiene acciones en Telara Farma. JFNG ha sido consultor y/o ha recibido honorarios por conferencias de AbbVie, Amgen, AstraZeneca, Bayer, Boehringer Ingelheim, Chiesi, Esteve, Sanofi-Genzyme, Lilly, MSD, Menarini, Mundipharma, Novartis, NovoNordisk, Servier, Shire y Vifor Pharma. RAA ha recibido honorarios por actividades de formación continuada de AstraZeneca, Boehringer-Ingelheim, Lilly, Bayer, Vifor-CSL y Novo-Nordisk, además de participar en «advisory boards» de Boehringer-Ingelheim, AstraZeneca y Bayer.
Los autores expresan su agradecimiento al equipo Global Inside CKD compuesto por Salvatore Barone y Claudia Cabrera de AstraZeneca.