Se presenta un caso de linfoma de células B de bajo grado del tejido linfoide asociado a mucosas (MALT), afectando al riñón izquierdo, y comienzo simultáneo de una gammapatía monoclonal IgM kappa. En este paciente no pudo identificarse ningún proceso inflamatorio predisponente local. Tras la nefrectomía izquierda, el espécimen renal mostró células centrocito-like y células linfoides en las lesiones linfoepiteliales que fueron positivas para CD20 y CD79 alfa. Las células neoplásicas expresaron IgM kappa monotípica citoplásmica. La demostración de células de estirpe B de la médula ósea expresando la misma proteína monoclonal que el tumor sugirió la afectación de la médula ósea incluso en ausencia de idéntica morfología. A pesar del tratamiento con quimioterapia y rituximab, el seguimiento clínico demostró extensión al riñón derecho, con transformación a linfoma de alto grado y, finalmente, diseminación sistémica. Este caso ilustra que el riñón se encuentra entre las localizaciones que pueden verse afectadas por los linfomas de células B de tipo MALT, de forma primaria o secundaria, y explica la necesidad de extender la investigación para detectar su posible diseminación. Se revisó la literatura sobre este infrecuente linfoma extranodal.
We report a case of low-grade B-cell lymphoma of mucosa-associated lymphoid tissue (MALT) involving the left kidney and simultaneous onset of a monoclonal gammopathy IgM kappa. No predisposing local inflammatory condition was identified. Following left nephrectomy, the renal specimen showed the centrocyte like cells and lymphoid cells in the lymphoepithelial lesions were positive for CD20 and CD79α. The neoplastic cells expressed monotypic cytoplasmic IgM kappa. The demonstration of bone marrow cells of B-lineage expressing the same monoclonal protein as the tumor suggested bone marrow involvement, even in the absence of identical morphology. Despite chemotherapy and rituximab treatment, clinical follow-up showed right kidney extension with high-grade transformation, and finally systemic dissemination. This case illustrates that the kidney is among the sites that may be involved by MALT B-cell lymphomas in a primary or secondary fashion, and the need for expanded investigation of the possible dissemination. We review the literature on this unusual extranodal lymphoma.
INTRODUCCIÓN
Isaacson y Wright1 definieron, inicialmente, el linfoma maligno del tejido linfoide asociado a mucosas (MALT) en el tracto gastrointestinal y, posteriormente, en el tiroides, pulmón y glándulas salivales, como una proliferación neoplásica de células centrocito-like con o sin células linfoplasmocíticas que suelen acompañarse de lesiones linfoepiteliales y centros germinales de aspecto benigno2. Más recientemente, se han descrito linfomas de células B de tipo MALT procedentes de una variedad de localizaciones que incluyen la glándula mamaria, el ojo, la conjuntiva, la piel, la vesícula biliar, el cuello uterino, la laringe y la tráquea2-4. El tracto urogenital es uno de los diversos lugares afectados en el linfoma tipo MALT3,4. Sin embargo, los linfomas de células B de tipo MALT afectando a los riñones son relativamente raros4-20. Este artículo describe la presentación clínica, características clínico-patológicas y evolución de la enfermedad en un paciente con linfoma de células B tipo MALT con afectación renal y un componente monoclonal IgM kappa en el suero.
CASO CLÍNICO
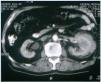
Hombre de 77 años de edad con antecedentes de hipertensión arterial de 30 años de evolución, que fue remitido a nuestro hospital para seguimiento por insuficiencia renal crónica. Cuatro años antes había sido diagnosticado, por endoscopia digestiva alta, de esófago de Barrett y úlcera duodenal con estenosis pilórica. En la biopsia del esófago se observó esofagitis con koilocitosis. El test de la ureasa en la biopsia fue negativo, pero recibió tratamiento específico para erradicación de H. pylori. En ese momento, los datos de laboratorio revelaron: hematocrito 40%, hemoglobina 12,5 g/dl, leucocitos 5.380/ml, con recuento diferencial normal y una velocidad de sedimentación globular (VSG) de 20 mm/h (normal, 15-30 mm/h). Las proteínas plasmáticas totales fueron de 5 g/dl y la albúmina de 3,1 g/dl. El análisis de orina fue normal y la creatinina sérica varió desde 1,2 hasta 1,4 mg/dl. Continuó recibiendo tratamiento con omeprazol y 16 meses después un estudio con bario del tracto gastrointestinal superior fue normal. En el momento del ingreso la exploración física fue normal. Los datos de laboratorio mostraron: hematocrito 34,5%, hemoglobina 11 g/dl, leucocitos 5.950/ml con fórmula normal, plaquetas 161.000/ml y VSG 100 mm/h. La coagulación sanguínea fue normal. Un análisis de orina reveló un sedimento normal y proteinuria de 1,2 g/24 h. La urea sérica fue de 70 mg/dl, la creatinina de 2,2 mg/dl y el aclaramiento de creatinina 45 ml/min. Las proteínas plasmáticas totales fueron de 9,6 g/dl, albúmina 4,1 g/dl y gammaglobulina 3,5 g/dl (con un pico monoclonal). Los valores de inmunoglobulinas medidas por nefelometría fueron IgM 4.640 mg/dl (normal, 38-231 mg/dl), IgG 858 mg/dl (normal, 650-1.700 mg/dl) e IgA 168 mg/dl (normal, 103-568 mg/dl), kappa 641 mg/dl (normal, 170-370 mg/dl), lambda 106 mg/dl (normal, 90-210 mg/dl). Por inmunofijación se detectó en el suero un pico monoclonal IgM kappa. Las crioglobulinas en suero fueron negativas y la proteinuria de Bence-Jones fue positiva. Otros datos de laboratorio mostraron: PCR 4,9 mg/dl, beta-2-microglobulina 4,9 mg/l, LDH 286 U/l, calcio 9,9 mg/dl y fosfato 3,2 mg/dl. Las serologías para el virus de Epstein-Barr y el virus de la hepatitis C fueron negativas. En la ecografía abdominal se detectó una masa sólida en el riñón izquierdo. Las radiografías y gammagrafía óseas no revelaron ninguna anormalidad. Una tomografía computarizada (TAC) toracoabdominal reveló una masa de unos 7 cm situada en la parte media del riñón izquierdo (figura 1). No hubo evidencia de adenopatías. En el aspirado de médula ósea se detectó un patrón normocelular y reveló un 12,5% de células plasmáticas atípicas. La citometría de flujo de la médula ósea mostró un 3% de linfocitos T policlonales y un 1% de linfocitos B policlonales. Las células plasmáticas fueron CD38++, CD138—, CD19+, CD45+, CD56—, CD117— y kappa monoclonal.
En septiembre del año 2000 se realizó una nefrectomía izquierda. El riñón pesó 240 g (incluyendo la glándula suprarrenal), midió 20 x 12 x 8 cm, y contenía una masa de 8 x 8 x 2 cm bien delimitada, que afectaba a la porción media subcortical del riñón. Histológicamente se encontró un infiltrado linfoide que se extendía de forma difusa en toda la región pericapsular y que afectaba a la corteza renal. Además, se demostró pérdida de la arquitectura renal por el infiltrado, con algunos túbulos y glomérulos residuales (figura 2). En algunas zonas el infiltrado fue difuso entre los folículos linfoides reactivos. Muchos centros germinales reactivos estaban colonizados por células neoplásicas con una zona residual del manto conservada (figura 2). En otras áreas, la neoplasia fue nodular, compuesta por folículos linfoides reactivos rodeados de zonas pálidas de pequeñas células linfoides con citoplasma pálido o claro y contornos nucleares ligeramente irregulares (células monocitoides y centrocito-like) (figura 2). En algunas áreas se observó un componente prominente de células plasmáticas y linfocitos plasmocitoides con ocasionales inclusiones intranucleares (cuerpos de Dutcher) y cuerpos de Russell (figura 2). Las células neoplásicas expresaron IgM kappa monotípica citoplásmica por inmunoperoxidasa. Las células tumorales también reaccionaron con el anticuerpo pan-L26 (CD 20, CD 79a), coexpresión de CD43 y tinción de linfocitos atípicos con bcl-2, fueron compatibles con un linfoma de células B tipo MALT de bajo grado. Se observaron de forma ocasional lesiones linfoepiteliales en la inmunotinción con citoqueratina. En las zonas del riñón que no estaban afectadas por el linfoma se observaron signos histológicos de nefrosclerosis.
Dos meses después de la nefrectomía, la creatinina sérica fue de 3 mg/dl y la VSG persistentemente elevada a 141 mm/h, las proteínas séricas 8,4 g/dl, la albúmina 4,1 g/dl y la gammaglobulina 2,4 g/dl, con persistencia de un pico monoclonal. Los valores de inmunoglobulinas séricas fueron: IgM 2.970 mg/dl, IgG 865 mg/dl e IgA 161 mg/dl. El paciente permaneció bien y asintomático, por lo que rechazó cualquier exploración invasiva. Recibió tratamiento con clorambucilo (5 mg/semana), pese a lo cual persistió el pico monoclonal (IgM kappa) y se mantuvo elevado el valor de IgM en el suero. Se realizó seguimiento mensual con analíticas sistemáticas. En abril de 2003, una TAC abdominal reveló una masa en su riñón derecho único. Se realizó biopsia por aspiración con aguja fina, en la cual se observó una infiltración por células B kappa, CD19+, CD10+ y CD20+. Se consideró que se había producido una transformación a linfoma MALT de alto grado y fue tratado simultáneamente con CHOP (ciclofosfamida, doxorubicina, vincristina y prednisona) y rituximab. El 26 de mayo de 2003 se administró un segundo ciclo de CHOP, desarrollando neutropenia grave y múltiples complicaciones, entre ellas sepsis e insuficiencia renal aguda que requirió hemodiálisis convencional. En octubre de 2003 tuvo lugar diseminación del linfoma produciéndose un fallo multiorgánico y el fallecimiento.
DISCUSIÓN
Los linfomas extranodales de células B tipo MALT surgen en localizaciones extraganglionares, suelen estar asociados con inflamación crónica como resultado de una infección o una enfermedad autoinmune y comparten características histológicas e inmunofenotípicas. En estas localizaciones anatómicas, los linfomas MALT se asocian habitualmente con procesos inflamatorios que predisponen a la linfomagénesis. Este hecho está mejor establecido en el estómago, donde los linfomas MALT están generalmente asociados con la infección por H. pylori1. La ausencia de tejido linfoide en el parénquima renal normal y la imposibilidad de descartar totalmente la presencia de focos microscópicos de tumor ha dado lugar a la controversia sobre la existencia del linfoma renal primario como una enfermedad distinta. Sin embargo, se ha sugerido que el linfoma puede surgir del hilio renal o de focos inflamatorios que atraen a los linfocitos a la zona, tales como la pielonefritis crónica8,20. Otros factores relacionados que pueden contribuir a la génesis del linfoma MALT renal han sido el síndrome de Sjögren4, la nefropatía IgA7, la glomerulonefritis membranoproliferativa12, el virus de Epstein-Barr10, la actinomicosis18, la sarcoidosis15, el lupus eritematoso17 y la infección por H. pylori9,18. La presencia concomitante de carcinoma de células renales18, de carcinoma de células de transición18 o de adenocarcinoma de colon18 no parece ser un factor predisponente.
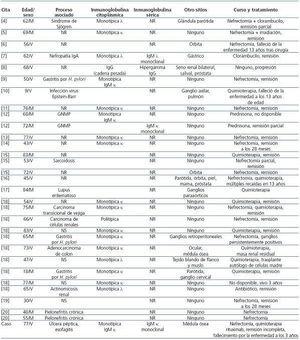
Según nuestros conocimientos, sólo 30 casos inequívocos (no incluyendo el descrito aquí) de linfoma de células B tipo MALT con afectación renal han sido comunicados en la bibliografía científica4-20 (tabla 1). Salvo un reciente informe de García, et al.18 de una serie de 10 casos, la mayoría fueron casos aislados. En muchos de estos pacientes es difícil dilucidar en qué órgano se inició el linfoma. Así, mientras que en 5 casos el tumor primario se localizó en las glándulas salivales, la órbita y el tracto gastrointestinal, la lesión renal representó una diseminación6-8,18. En 2 casos el tumor fue diagnosticado de forma simultánea en el riñón y en la glándula parótida4,16, y en otros 3 casos el linfoma MALT con afectación renal se asoció con la presencia de adenopatías10,17,18. En todos estos casos no pudo excluirse la afectación secundaria del riñón. Sólo en 18 casos el tumor podría haberse originado en el riñón5,9,11-15,18-20.
Los linfomas MALT suelen quedar confinados a los lugares de origen en el momento del diagnóstico y son de diseminación lenta, y cuando lo hacen tienen la tendencia a afectar a otros órganos mucosos. Esto explicaría, en algunos pacientes, el curso clínico prolongado y la eficacia de la resección quirúrgica sin terapia adicional9,11,13-15,18-20. En 8 casos con afectación renal, la neoplasia no recurrió ni se diseminó tras la nefrectomía9,11,13-15,18-20. En otro caso se produjo la remisión después de la nefrectomía e irradiación5. En un caso que presentó resolución definitiva de la neoplasia tras el tratamiento con clorambucilo, se produjo la desaparición del componente sérico monoclonal con mejoría de la sintomatología7. En un caso de actinomicosis renal, tuvo lugar la remisión tras la administración de antibióticos18. En otro caso se produjo una remisión parcial, a los 15 meses, tras la nefrectomía y la administración de clorambucilo4. En algunos pacientes el tumor presentó un comportamiento indolente y un curso clínico muy lento. En un caso el linfoma progresó muy lentamente y el paciente tuvo una supervivencia de 5 años sin ningún tratamiento8. Nueve pacientes permanecieron vivos sin evidencia de enfermedad de 9 a 53 meses18,19. Tres pacientes, incluyendo nuestro caso, fallecieron como consecuencia de la enfermedad entre 3 a 13 años después del diagnóstico6,10, dos de los cuales presentaron transformación en alto grado y diseminación del linfoma.
Las células del linfoma expresan inmunoglobulinas monotípicas de superficie o, en menor grado, inmunoglobulinas citoplásmicas, generalmente IgM15. Por otra parte, la gammapatía monoclonal es un fenómeno común en los pacientes con linfoma MALT, muy probablemente debido a la producción de paraproteínas por las células clonales linfoplasmocíticas21-23. En un estudio la gammapatía monoclonal se correspondió con las cadenas ligeras detectadas por inmunohistoquímica en la biopsia, en la mayoría de los casos22. En 18 de 31 casos de linfoma de células B tipo MALT del riñón (incluido el presentado en este artículo) se encontraron inmunoglobulinas citoplásmicas kappa o lambda. Sin embargo, hasta la fecha, sólo se han comunicado 3 casos de gammapatía monoclonal IgM, uno con cadenas ligeras tipo lambda y dos con tipo kappa7,12.
En nuestro caso, la patogenia del linfoma de células B resultó desconocida, ya que no pudo identificarse inflamación crónica en el riñón. Además, el caso que presentamos es singular, pues tiene características morfológicas, inmunológicas y fenotípicas de un linfoma de células B tipo MALT con afectación renal que coincidió con una gammapatía monoclonal IgM kappa. Así, en este caso, la gammapatía monoclonal se correspondió con las cadenas ligeras detectadas por inmunohistoquímica en el riñón. Por otro lado, la demostración de células de la médula ósea de estirpe B expresando la misma proteína monoclonal que el tumor sugirió afectación de la médula ósea incluso en ausencia de idéntica morfología. En la bibliografía médica, sólo hemos identificado otro caso de linfoma tipo MALT afectando al riñón y a la médula ósea18. Además, a los 2 meses de la nefrectomía, la persistencia del componente monoclonal en el suero sugirió una remisión incompleta. Asimismo, a pesar del tratamiento quimioterápico y con rituximab, la gammapatía monolonal IgM kappa persistió. El seguimiento clínico puso de manifiesto la extensión al riñón derecho con transformación en linfoma de alto grado y, por último, la diseminación sistémica. Por lo tanto, la presencia de gammapatía monoclonal se asoció con enfermedad más avanzada, con afectación de la médula ósea y con la transformación en alto grado23. Aunque, en la mayoría de los pacientes, el linfoma tipo MALT parece ser una enfermedad relativamente benigna, el curso clínico de nuestro paciente demostró claramente el potencial de malignidad y la importancia de un tratamiento precoz y agresivo. Tal como ocurrió en nuestro caso, los factores de pronóstico adverso pueden incluir: la presencia de gammapatía monoclonal, la afectación de la médula ósea, la elevada masa tumoral, la transformación en alto grado y la diseminación de la enfermedad24.
En resumen, este caso ilustra que el riñón es uno de los órganos que pueden verse afectados en los linfomas de células B tipo MALT, de forma primaria o secundaria, y en la necesidad de ampliar la investigación de una posible relación con afectación sistémica. Estos linfomas, al igual que otros linfomas tipo MALT, tienen un comportamiento indolente y un curso clínico lento, como lo demuestra la bibliografía científica disponible. Sin embargo, en algunos casos tiene lugar la transformación en un linfoma de alto grado y/o la diseminación de la enfermedad. La elección del tratamiento debe ser a la medida del paciente, teniendo en cuenta la localización, el estadio y las características clínicas de cada uno de los pacientes.
Figura 1. TAC mostrando el crecimiento tumoral a través de la corteza del riñón izquierdo.
Figura 2.
Tabla 1. Resumen de los datos clínicos y patológicos del linfoma de células B de tipo MALT afectando al riñón