Justificación: Se conoce como nefroesclerosis la enfermedad renal crónica (ERC) que complica la hipertensión arterial (HTA) esencial. La ausencia de correlación entre el control de la HTA y la progresión a ERC terminal sugiere la existencia de una enfermedad intrínseca y primitiva. Recientemente se ha asociado con polimorfismos del gen MYH9 en individuos afroamericanos. El objetivo del trabajo que presentamos es determinar si algún polimorfismo de dicho gen se relaciona en raza caucásica con la asociación de HTA esencial y nefroesclerosis y, además, conocer los marcadores de progresión a ERC terminal. Será un estudio retrospectivo que comparará a pacientes con nefroesclerosisfrente a pacientes con HTa esencial sin enfermedad renal y, además, se incluirán pacientes con nefroesclerosis y progresión de la enfermedad renal frente a los que se mantienen estables. Métodos: Entre octubre de 2009 y octubre de 2010 se incluirán 500 pacientes con ERC (estadios 3-5) atribuida a nefroesclerosis según criterios clínicos habituales, y 300 pacientes afectados de HTA esencial (FGe >60 ml/min/1,73 m2; microalbuminuria <300 mg/g). Para el estudio genético también se incluirán 200 controles sanos de población general. Habrá dos cortes del estudio, la primera visita en el hospital y la visita final (en estadio 5 el inicio del tratamiento sustitutivo constituirá el final del seguimiento). Se registrarán datos clínicos y analíticos, y se recogerán muestras de sangre para el estudio genético. Discusión: Nuestro estudio, con la doble vertiente genética y clínica, tratará de determinar si en la raza caucásica existe relación entre el diagnóstico de nefroesclerosis y el gen MYH9, y estudiará, además, los posibles marcadores de progresión.
Background: Hypertensive nephrosclerosis is a chronic kidney disease (CKD) associated with essential hypertension. The lack of correlation between hypertension control and progression to end-stage CKD suggests an intrinsic and primitive disease. New evidence suggests that MYH9 gene alterations are associated with polymorphisms in African Americans. The aim of this study is to investigate whether a polymorphism of MYH9 in Caucasians is linked to essential hypertension and nephrosclerosis. The secondary objective is to identify the clinical risk factors of progression to end-stage CKD. This is a retrospective study that will compare patients with nephrosclerosis and essential hypertensives without renal disease, and also patients with nephrosclerosis and impaired renal function with those that are stable. Method: Between October 2009 and October 2010, 500 patients with stages 3-5 CKD attributed to nephrosclerosis according to usual clinical criteria, and 300 essential hypertensives (eGFR>60mL/min/1.73m2; microalbuminuria <300mg/g) are to be recruited. A total of 200 healthy controls from the general population are also to be included for the genetic study. There are two study sections, being the first and final visits to the clinic (for stage 5 cases, the start of replacement therapy will be the end of follow-up). Clinical and laboratory data will be recorded, and blood samples will be collected. Discussion: Our study will aim to determine if there is a relationship between the diagnosis of nephrosclerosis and the MYH9 gene in Caucasians, and to study possible risk factors for progression to end-stage CKD, on both clinical and genetic bases.
INTRODUCCIÓN
El término nefroesclerosis suele aplicarse a la enfermedad renal que complica la hipertensión arterial (HTA) esencial y que afecta fundamentalmente a la microvasculatura preglomerular1,2. En la práctica, es una entidad con perfiles clínicos poco concretos, que agrupa a los pacientes hipertensos con enfermedad renal crónica (ERC) sin causas reconocibles de otra patología3,4.
En la nefroesclerosis, también conocida como nefroangiosclerosis benigna o nefropatía hipertensiva, la lesión microscópica más característica es la hialinosis de las arteriolas aferentes. Las alteraciones vasculares producirían vasoconstricción, isquemia glomerular (retracción del ovillo, esclerosis focal o global) y, en algunas zonas, fibrosis intersticial y atrofia tubular. Otros autores señalan que la hialinización de las arteriolas aferentes provocaría inicialmente vasodilatación, hipertrofia glomerular y, a largo plazo, lesiones de glomeruloesclerosis segmentaria y global que favorecerían la aparición de proteinuria y la progresión de la enfermedad. Estas alteraciones son mucho más frecuentes y graves en pacientes de raza negra, sin relación con el control de la presión arterial o el grado de proteinuria. En realidad, la nefroesclerosis constituye una forma de enfermedad renovascular intrarrenal, y en algunos casos es posible que represente, tanto desde el punto de vista histológico como clínico, una magnificación de las alteraciones propias del envejecimiento renal5-7.
Su relación causal con la HTA esencial es todavía objeto de debate. No parece evidente que la HTA tratada pueda conducir a la ERC terminal8-11. Por esta razón, algunos autores han postulado que las alteraciones estructurales renales podrían preceder a la HTA, y que sería un proceso intrínseco de la microvasculatura renal con pérdida de su autorregulación que se traduciría primariamente o bien en una excesiva vasoconstricción preglomerular4 o en una vasodilatación persistente de la arteriola aferente6,7. Un flujo plasmático renal crónicamente alterado conduciría a largo plazo a la HTA y a la ERC. La nefroangiosclerosis podría tener el mismo significado clínico que la aterosclerosis en vasos coronarios o cerebrales2,3.
La nefropatía vascular constituye tanto en EE.UU., como en Europa y en España, la segunda causa más frecuente de ERC terminal. Sin embargo, el diagnóstico de nefroesclerosis suele hacerse por exclusión, ante la ausencia de datos de otro tipo de nefropatía, y en muy pocos casos fundamentado por un soporte histológico. No existen signos o síntomas específicos, pero sí algunos hallazgos clínicos indicativos (hombres mayores de 55-60 años, HTA de larga evolución, hipertrofia de ventrículo izquierdo [HVI], ERC ligera y proteinuria inferior a 0,5-1 g/24 horas). Al igual que ocurre con la nefropatía diabética, casi nunca se recurre a la biopsia renal. Esta actitud puede ser razonable en muchos casos, pero es fuente de falsos diagnósticos12.
Algunos estudios con una muestra de pequeño tamaño sugieren que el grado de proteinuria puede ser variable, e incluso alcanzar el rango nefrótico. Sin embargo, existe el consenso general de que valores subnefróticos de proteinuria son típicos de la nefroesclerosis hipertensiva. Los criterios clínicos de inclusión en el estudio African American Study of Kidney Disease and Hypertension (AASK) exigían un nivel de proteinuria inferior a 2,5 (UP/Cr)4,13,14. En cuanto a la edad de llegada a ERC terminal en afroamericanos oscila entre los 45 y los 64 años, mientras que en norteamericanos de origen caucásico es superior a los 65 años4.
Comparada con las nefropatías glomerulares primitivas o con la nefropatía diabética, la progresión de la insuficiencia renal es lenta en la mayoría de casos, sobre todo en la raza blanca. La función renal puede permanecer estable durante años si se controla de forma adecuada la HTA. Sin embargo, en una proporción no elevada de casos la enfermedad progresa hasta alcanzar la ERC terminal5,12,15. La nefropatía vascular es la causa más frecuente de consultas hospitalarias por ERC en los servicios de nefrología de España. Hasta un 39% de casos presentan dicha etiología, por encima de la nefropatía diabética (20%) o de la glomerular (14%)16. Pese al exiguo porcentaje de pacientes con progresión, su elevada prevalencia justifica que sea la segunda causa de ERC terminal.
No están bien reconocidos los factores de progresión de la nefroesclerosis, lo que dificulta la aplicación de medidas preventivas. Habitualmente se cita, en primer lugar, la raza negra y, después, la edad, el grado de insuficiencia renal en el momento del diagnóstico, el nivel de presión arterial sistólica (PAS) y el grado de proteinuria1,13-20. En el estudio AASK, los pacientes con proteinuria inferior a 0,3 g/24 horas y que habían recibido un inhibidor de la enzima de conversión de la angiotensina (ECA), ramipril, desde el inicio, tenían, tras un seguimiento medio de 11 años, una progresión más lenta. En este mismo estudio la edad mayor de 70 años fue un factor que se relacionó de forma inversa con la progresión de la insuficiencia renal20,21.
En la raza blanca sólo algunos casos, quizá genéticamente predispuestos, presentan una evolución clínica desfavorable. La progresión de la enfermedad se ha asociado con la presencia concomitante de lesiones ateroscleróticas en aorta y arterias renales principales, y de procesos como la diabetes mellitus tipo 2, la hiperuricemia y la dislipemia3,5,10,19. En el estudio poblacional noruego HUNT 2, tras 10 años de seguimiento, la progresión a ERC terminal se relacionó en el análisis multivariante con el filtrado glomerular estimado (FGe) y con la microalbuminuria basales22.
En la última década, la enfermedad está siendo diagnosticada, fundamentalmente, en pacientes con edad superior a 65-70 años y patología vascular en otras localizaciones. En estos casos, la nefroesclerosis sería la manifestación en las arteriolas renales de una ateroesclerosis difusa19,23,24. Recientemente se ha señalado un hecho menos reconocido: la presencia de patología cardiovascular concomitante es un factor de progresión de la insuficiencia renal25-29. Levin et al., en un grupo de 313 pacientes con insuficiencia renal (FGe de 10-75 ml/min) y tiempo medio de seguimiento de 23 meses, comprobaron que la presencia de enfermedad cardiovascular (cardiopatía isquémica, enfermedad cerebrovascular, arteriopatía periférica o insuficiencia cardíaca) incrementaba el riesgo de progresión a ERC terminal (riesgo relativo [RR] 1,58; p = 0,047)25. Hillege et al. demostraron en 298 pacientes que habían tenido un infarto agudo de miocardio (IAM), que el FGe había disminuido 5,4 ml/min tras el primer año, cifra muy superior a la habitual de 1 ml/min/año descrita en población general28. Elsayed et al., en 13.826 sujetos incluidos en los ensayos Atherosclerosis Risk in Communities Study y Cardiovascular Health Study, de los cuales un 18,5% eran afroamericanos, comprobaron, tras 9 años de seguimiento, que en los casos con enfermedad cardiovascular basal aumentaba significativamente la probabilidad de desarrollar ERC (odds ratio [OR] 1,75; p <0,001)29.
En España está en marcha un estudio de diseño prospectivo avalado por la Sociedad Española de Nefrología (S.E.N.), el ESTUDIO PRONEFROS, para conocer la proporción de pacientes con nefroesclerosis que muestran progresión de la insuficiencia renal. Se han excluido basalmente los casos de nefroesclerosis «histórica» y se han incluido sólo casos incidentes (n = 430) a lo largo de un año. Tras 2 años de seguimiento, los datos preliminares muestran que sólo en el 3,9% de los casos existe deterioro de la función renal. Entre los marcadores de progresión destacan la presencia de valores basales más altos de PAS y un mayor porcentaje de eventos cardiovasculares asociados30.
La explicación de este hecho es compleja y probablemente multifactorial: el empeoramiento de la función miocárdica supone una reducción del flujo arterial renal que se añadiría a la presencia de las lesiones microvasculares y macrovasculares renales. Además, la presencia de disfunción renal ha comportado hasta hace muy pocos años que en muchas ocasiones se hayan infrautilizado los fármacos cardioprotectores o se haya sido más conservador con la aplicación de la revascularización coronaria o las prótesis valvulares31.
Desde hace años, la relación entre hiperuricemia y ERC en pacientes con HTA esencial ha sido controvertida. Si bien es cierto que hasta el 40% los individuos con gota desarrollan ERC, no lo es menos que casi todos tienen HTA y lesiones de arterioloesclerosis y glomeruloesclerosis similares a las observadas en pacientes con nefroesclerosis. No está demostrado que la hiperuricemia sea un factor de riesgo para ERC. Sin embargo, dos estudios recientes han abierto nuevas perspectivas: Iseki et al. han demostrado que la hiperuricemia es un marcador independiente de disfunción renal en sujetos que basalmente tenían función renal normal, sobre todo en mujeres32. Asimismo, Siu et al. han comprobado en 54 pacientes que el descenso del ácido úrico con alopurinol difería la progresión de la ERC33. Parece necesario promover estudios de diseño específico para aclarar si la hiperuricemia puede ser un factor independiente de riesgo vascular y renal34.
La ausencia de correlación entre el grado de control de la HTA y la prevención de la progresión de la enfermedad, tanto desde el punto de vista clínico como histológico, ha sugerido que este proceso puede ser una enfermedad renal intrínseca y primitiva. En algunos casos el contexto clínico guardaría cierta similitud con la glomerulonefritis segmentaria y focal (GNSF). Desde hace muchos años se buscan marcadores genéticos que puedan explicar el inicio y la evolución de la enfermedad. La HTA, la hiperuricemia, la dislipemia y el síndrome metabólico serían factores fenotípicos frecuentemente asociados, pero no los causantes del proceso2,3.
Algunos trabajos desarrollados hace una década verificaron una relación directa entre la nefroesclerosis y el genotipo DD del gen de la ECA. El alelo D parece ser predominante en pacientes hipertensos con nefroangioesclerosis y podría ser un marcador de progresión. Aunque la proporción de pacientes incluidos fue pequeña, los estudios se realizaron en raza caucásica, incluyeron soporte histológico y grupos control de hipertensos sin afectación renal y sujetos de población general35,36.
En EE.UU. los estudios genéticos sobre nefroesclerosis se han realizado fundamentalmente en raza afroamericana porque la enfermedad es más frecuente y agresiva37-42. Dos estudios independientes publicados recientemente han supuesto una nueva aproximación a la etiopatogenia de la enfermedad. El estudio de Kao et al., que incluyó a 1.372 pacientes, reveló una intensa relación entre la presencia de ERC terminal secundaria a nefroesclerosis hipertensiva en individuos no diabéticos, y algunos polimorfismos del gen MYH9, situado en el cromosoma 22, que codifica la cadena pesada de una proteína no muscular de la miosina IIA37. El estudio de Kopp et al. refirió, en 190 individuos de raza negra frente a 222 controles sanos, idéntica asociación con la presencia de GNSF de origen idiopático o secundaria a infección por el virus de la inmunodeficiencia humana (VIH), aunque no se encontró relación con la progresión38.
Además, un trabajo de Freedman et al. ha corroborado la presencia de los polimorfismos del gen MYH9 en 696 sujetos afroamericanos con nefropatía hipertensiva y ERC terminal, comparados con 948 individuos controles sin enfermedad renal, de los cuales un 34% eran hipertensos; sin embargo, no todos los individuos homocigotos para los alelos de riesgo del MYH9 desarrollaron la enfermedad, lo cual indica la presencia de otros factores, ambientales o de interacción con otros genes, añadidos a la susceptibilidad genética individual39. Por otra parte, el mismo grupo ha descrito recientemente la asociación entre el haplotipo E1 del MYH9, consistente en los polimorfismos rs4821480, rs2032487, rs4821481, y rs3752462, en el que se ha observado mayor riesgo, y la presencia de microalbuminuria en 1.458 pacientes con HTA esencial afroamericanos sin nefropatía, aunque la fuerza de la asociación es más débil que en los sujetos con GNSF y ERC terminal de origen hipertensivo40.
Complicando más el tema, se ha encontrado asociación del citado gen en 751 pacientes de raza negra diabéticos con ERC terminal frente a 227 controles diabéticos sin enfermedad renal y 925 controles sanos, pero no está clara la relación con el desarrollo de nefropatía diabética porque no existe confirmación histológica, e incluso se ha sugerido que podría coincidir con la nefropatía relacionada con polimorfismos del MYH9 de base41.
Parece que en fases iniciales la miosina IIA se sitúa fundamentalmente a nivel podocitario e induce alteraciones estructurales. Recientemente se ha descrito el papel de la pérdida y disfunción podocitaria en la patogenia de la enfermedad; un trabajo de Wang et al. demuestra en 41 pacientes con biopsia diagnóstica de nefroesclerosis hipertensiva, una disminución del número total de podocitos y de la expresión intrarrenal de genes de proteínas como la nefrina, la podocina y la sinaptopodina, lo cual además se relaciona con la disminución del FGe, y de forma inversamente proporcional con el grado de fibrosis renal43.
Una nueva y atrevida hipótesis sobre esta cuestión afirma que los polimorfismos de este gen serían marcadores de enfermedades renales diversas que tal vez se agrupen en un mismo grupo histológico, el de la GNSF y cualquiera de sus variantes, como la nefroesclerosis, que sería una enfermedad primitiva renal emparentada con la GNSF idiopática y con la colapsante observada en el VIH44. Incluso se han descrito en una enfermedad renal asociada con macrotrombocitopatía. Por último, existen una serie de entidades poco frecuentes relacionadas con mutaciones del citado gen, que se transmiten mediante herencia autosómica dominante, conocidas como MYH9-related disorders, que incluyen la anomalía de May-Hegglin, y los síndromes de Sebastian, Epstein y Fechtner, que en muchos casos cursan con nefropatía, aunque su mecanismo y el de la nefroesclerosis hipertensiva asociada con polimorfismos del MYH9 en raza negra actualmente se desconocen45. Sin embargo, no todos los casos de nefroesclerosis se asocian con haplotipos del MYH946.
Por todas estas razones, se necesitan nuevos estudios que proporcionen una mejor comprensión de su patogenia, y del papel potencial de la detección de polimorfismos del MYH9 en el diagnóstico y evolución de la ERC secundaria a nefroesclerosis (tabla 1).
HIPÓTESIS
La nefroesclerosis hipertensiva es una ERC que progresa infrecuentemente.
1. Los marcadores de progresión clínicos tendrían relación con:
a) La presencia de enfermedad cardiovascular asociada, sobre todo si los eventos cardiovasculares aparecen de forma recurrente.
b) El grado de proteinuria.
c) La función renal inicial.
d) La edad menor de 70 años.
2. Los marcadores de progresión histológicos tendrían relación con:
a) El grado de glomeruloesclerosis segmentaria y global.
b) El grado de fibrosis intersticial.
3. Los marcadores genéticos tendrían relación con:
a) Los polimorfismos del gen MYH9.
b) Los polimorfismos I/D del gen de la ECA.
OBJETIVOS
Objetivo principal
Determinar si algún polimorfismo del gen MYH9 se relaciona en raza caucásica:
a) Con la asociación de HTA esencial y nefroesclerosis.
b) Con la progresión de la enfermedad.
Objetivos secundarios
1. Comparar las características clínicas de los pacientes con HTA esencial con nefroesclerosis con los que tienen HTA sin enfermedad renal, y conocer los marcadores clínicos de progresión.
2. Reconocer el valor de la proteinuria, la patología cardiovascular asociada, el género, la edad (mayor y menor de 70 años), la presencia de hiperuricemia o gota úrica, y los tratamientos concomitantes (antihipertensivos, estatinas y antiagregantes).
MÉTODOS
Diseño del estudio
Estudio retrospectivo y multicéntrico, en el que participarán cuatro hospitales del Principado de Asturias (Hospital Universitario Central de Asturias, Hospital Valle del Nalón, Hospital de Cabueñes y Hospital San Agustín), y el Hospital Universitario Marqués de Valdecilla de Cantabria.
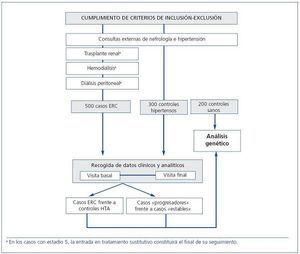
Habrá un estudio básico comparativo de pacientes con HTA esencial con nefroesclerosis frente a pacientes hipertensos sin enfermedad renal (grupo control). Además, se compararán los pacientes con nefroesclerosis y deterioro de la función renal frente a los que se mantienen estables. Para el estudio genético también se incluirán controles sanos de población general, con edades y sexo similares a los de los casos.
PACIENTES
Casos
Los casos se seleccionarán entre octubre de 2009 y octubre de 2010 de las consultas de nefrología, trasplante renal, unidades de hemodiálisis y diálisis peritoneal de los hospitales participantes.
Se reclutarán pacientes con FGe <60 ml/min/1,73 m2 (medido por la fórmula MDRD) en estadios 3-5, atribuido a nefroesclerosis según los criterios clínicos habituales (tabla 2), con o sin documentación histológica. No será válido el diagnóstico de ERC de origen indeterminado y se excluirán los pacientes con HTA secundaria, vasculorrenal o acelerada.
Se podrán admitir pacientes en estadio 5 en diálisis o trasplante renal, siempre que se disponga de datos evolutivos desde su primer contacto con el hospital; en ellos, el inicio del tratamiento sustitutivo constituirá el final del seguimiento.
Serán válidos para el estudio los casos menores de 80 años. Sin embargo, la selección se hará preferentemente en pacientes con edad inferior a 60 años, para minimizar el efecto de desnaturalización de los genes con la edad.
Controles
El grupo control procederá solamente de los Hospitales Universitario Central de Asturias y Valle del Nalón, para simplificar la recogida de datos, dado que se trata de individuos de la misma zona geográfica, con escasas diferencias entre ellos. Se incluirán pacientes con HTA esencial con FGe >60 ml/min/1,73 m2 y microalbuminuria <300 mg/g.
Datos en cada paciente
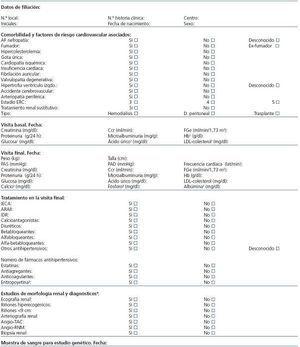
Se harán dos cortes del estudio, el de la primera visita en el hospital y el de la última visita («visita actual»). En todos los participantes se recogerán datos clínicos que incluirán variables sociodemográficas, de comorbilidad y riesgo cardiovascular, tratamientos médicos y exploración física, con peso en kilogramos, talla en centímetros, medida de la PAS y presión arterial diastólica (PAD) en consulta en milímetros de mercurio, y frecuencia cardíaca. Los datos analíticos que se registrarán serán la función renal mediante creatinina sérica, FGe, aclaramiento de creatinina, microalbuminuria en muestra de orina aislada (mg/g creatinina) y proteinuria en orina de 24 horas y, además, glucosa, ácido úrico, colesterol y metabolismo calcio-fósforo. Asimismo, también se incluirá la realización de técnicas de imagen (ecografía, angio-TAC, angio-RNM o arteriografía), y biopsia renal diagnóstica (tabla 3).
Análisis de laboratorio
Las determinaciones analíticas sistemáticas se realizarán, con métodos comunes, en el laboratorio de cada hospital. Las muestras de sangre para el estudio genético serán remitidas al Laboratorio de Genética Molecular del Hospital Universitario Central de Asturias. Se obtendrá el ADN a partir de los leucocitos de 10 ml de sangre periférica anticoagulada con EDTA. Dichas muestras se almacenarán durante 5 años.
Se determinarán los principales polimorfismos genéticos del gen MYH9 que mostraron asociación con la nefroesclerosis hipertensiva en individuos no diabéticos (rs4821480 y rs3752462, pertenecientes al haplotipo E-1), y del gen de la enzima de conversión de la ECA, mediante el test de reacción en cadena de polimerasa (PCR).
DEFINICIONES
Progresión de la enfermedad renal
Duplicación de la creatinina basal, descenso del FGe >50% sobre el valor basal o reducción de 25 ml/min/1,73/ m2, o llegada a ERC terminal (definida por la necesidad de tratamiento renal sustitutivo).
Hipertensión arterial
PAS >140 mmHg y/o de PAD >90 mmHg, o tratamiento con dieta o agentes antihipertensivos. También se analizará el porcentaje de pacientes con PAS >130 mmHg y/o de PAD >80 mmHg.
Diabetes mellitus
Glucemia basal >126 mg/dl o >200 mg/dl 2 horas después de sobrecarga oral de glucosa, o tratamiento antidiabético (dieta, antidiabéticos orales o insulina).
Hipercolesterolemia
LDL colesterol >100 mg/dl, o tratamiento con agentes hipolipemiantes.
Fumador
Consumo de tabaco (cigarrillos, puros, pipa) durante el último mes. Ex-fumador: ausencia de tabaco durante un año consecutivo.
Obesidad
Índice de masa corporal >30 kg/m2.
Comorbilidad cardiovascular
Deberá estar debidamente documentada. Presencia de uno o más de los siguientes: cardiopatía isquémica tipo infarto agudo de miocardio (IAM), angina inestable o angina estable, insuficiencia cardíaca, fibrilación auricular, valvulopatía mitral o aórtica degenerativa, ictus isquémico, hemorrágico o transitorio, arteriopatía periférica.
Hipertrofia ventricular izquierda
Diagnóstico realizado mediante ecocardiograma, método con mayor especificidad que el electrocardiograma.
ASPECTOS ÉTICOS
El investigador deberá informar al paciente sobre su participación en el estudio, que será voluntaria y no supondrá ningún cambio en su tratamiento ni en su atención médica. Posteriormente, el investigador deberá obtener el consentimiento informado y voluntario del paciente. Siempre se mantendrán los niveles más altos de confidencialidad, y se cumplirá la legislación nacional vigente sobre protección de datos.
El protocolo del estudio ha sido aprobado por el Comité Ético de Investigación Clínica Regional del Principado de Asturias.
TAMAÑO DE LA MUESTRA
Se ha estimado que el tamaño de la muestranecesario para observar los efectos de los polimorfismos del gen MYH9 según sus frecuencias alélicas, para un error alfa de 0,05 y un error beta de 0,2, será de 500 casos con ERC y 500 controles. Se distribuirán de la siguiente manera: 500 casos, 300 controles hipertensos sin insuficiencia renal y 200 sujetos de la población general (controles sanos).
Se intentará controlar la muestra en cuanto a sexo y edad (figura 1).
ANÁLISIS ESTADÍSTICO
Se realizará un análisis descriptivo de las variables continuas, proporcionándose media, mediana, desviación típica y rango, y en caso de variables discretas se presentara la distribución de frecuencias absolutas y porcentajes. En los casos en que fuera preciso, se calcularán los intervalos de confianza al 95%. La descripción de las variables principales se hará basándose en edad, sexo, grados de insuficiencia renal y proteinuria basales, grado de control de la HTA y de la dislipemia, y factores de riesgo cardiovascular asociados. Se evaluará la asociación entre variables cualitativas con el test de la chi cuadrado o prueba exacta de Fisher, y entre variables cuantitativas mediante tests paramétricos (t de Student, coeficiente de correlación de Pearson y ANOVA). En el caso de que no pueda asumirse la normalidad de la distribución, se aplicarán las pruebas no paramétricas de U de Mann-Whitney o Kruskal-Wallis. En las comparaciones las pruebas serán bilaterales y se considerarán significativas cuando p <0,05. Se ajustará un modelo de regresión logística, con objeto de evaluar la asociación de aquellas variables que en análisis «bruto» el resultado de la p del contraste sea inferior a 0,15. El análisis estadístico del estudio será realizado con SPSS para Windows, versión 15.0 (SPSS, Chicago, IL).
SOPORTE FINANCIERO
El Estudio NEFROSEN es un trabajo de práctica clínica habitual que no comporta gastos suplementarios. Se realizará con la promoción y el patrocinio de la Sociedad Española de Nefrología (S.E.N.) a través de su Grupo de Trabajo «Riñón e Hipertensión Arterial».
El coste por cada caso analizado en el subestudio genético de los polimorfismos del gen MYH9 es aproximadamente 10 euros. Para su financiación se cuenta con fondos de la Fundación Renal Iñigo Álvarez de Toledo (Grupo de Genética Molecular).
DISCUSIÓN
A raíz de la publicación de estudios genéticos sobre nefroesclerosis, algunos docuemntos han señalado que debería dejar de ser considerada como una enfermedad secundaria a la HTA esencial. Al menos en la raza negra, parece una enfermedad con base genética estrechamente relacionada con la GNSF, y se estima que puede existir asociación con los polimorfismos del gen MYH9 en un 43% de los individuos afroamericanos que progresan a ERC terminal47. En ellos, el control de la HTA no logra frenar la progresión, mientras que en la raza blanca parece más eficaz, por lo que se especula que la terapéutica de la nefroesclerosis hipertensiva debe abordarse con otra perspectiva que no sólo incluya el bloqueo del SRA y el control estricto de la presión arterial48.
Sin embargo, hay todavía muchas incógnitas alrededor de estos hallazgos. Los estudios referidos se han realizado en pacientes con diagnóstico de nefroesclerosis no apoyado en biopsias renales. Se señala la oportunidad de revaluar los casos del estudio AASK (n = 1.094 pacientes), que es el único realizado con confirmación histológica13,14.
En la raza blanca no hay estudios sobre si éstos u otros polimorfismos del MYH9 pudiesen estar implicados en la enfermedad. Solamente el grupo de Pattaro et al. encontró una asociación de dicho gen con los valores de creatinina sérica en 2.859 individuos europeos sin enfermedad renal, procedentes de tres poblaciones diferentes, si bien los genes relacionados con la función renal mostraron una gran heterogeneidad49.
El estudio propuesto tendrá la doble vertiente clínica y genética. Su relación parece lógica y complementaria. Las limitaciones son las propias de un diseño retrospectivo, junto con la carencia de un laboratorio centralizado para la analítica de rutina, porque los datos son históricos. Serán casos de nefroesclerosis que mantienen visitas periódicas desde un tiempo variable, y pacientes que han progresado a ERC terminal; por ello, contamos con un importante sesgo de selección al calcular el porcentaje de pacientes cuya enfermedad progresa, pues muchos se obtendrán de las unidades de diálisis y trasplante. Probablemente no se podrán obtener conclusiones claras sobre la progresión de la enfermedad pero, pese a las referidas limitaciones, creemos que puede ser interesante un trabajo como el expuesto porque las publicaciones sobre el tema son realmente escasas.
Parece necesario diseñar estudios genéticos prospectivos que determinen la relación de este gen, tanto con el diagnóstico como con la posibilidad de que sea un marcador de progresión.
Tabla 1. Principales estudios sobre los polimorfismos del gen MYH9 y la presencia de nefropatía
Tabla 2. Criterios de inclusión-exclusión
Tabla 3. Hoja de recogida de datos clínicos y analíticos
Figura 1. Reclutamiento de casos y controles