Presentamos dos casos de infección por Strongyloides stercoralis (S. stercoralis) en pacientes trasplantados renales en nuestro centro. Se describen las características de su presentación clínica, el tratamiento y la resolución del mismo.
INTRODUCCIÓN
Las infecciones parasitarias en pacientes trasplantados son poco frecuentes1. De las 342 especies de parásitos que pueden infectar a los humanos, sólo un 5% han sido descritas en trasplantados2. En una serie de 675 pacientes trasplantados, la prevalencia de infecciones parasitarias sintomáticas fue del 2,4%; S. stercoralis, seguido de Giardia lamblia y Toxoplasma gondii fueron los parásitos más frecuentemente implicados3. Hasta el momento, en la literatura española se han descrito múltiples casos de infección por S. stercoralis en la población general, pero ningún caso en pacientes trasplantados.
El Strongyloides stercoralis es un parásito intestinal que se encuentra distribuido de forma endémica en algunas zonas de España. Su infección puede provocar desde una eosinofilia aislada hasta un cuadro de diarrea asociada a hemoptisis y broncoespasmo con alta mortalidad. En los pacientes trasplantados, el cuadro clínico puede agravarse con un aumento del número de larvas adultas, provocando un fracaso multiorgánico; en estos pacientes, el diagnóstico de la infección puede ser complejo y, en ocasiones, la clínica puede atribuirse a efectos secundarios de fármacos ampliamente utilizados en el trasplante, por lo que se precisa un alto índice de sospecha para su correcto diagnóstico. Presentamos dos casos de infección activa por S. stercoralis en pacientes trasplantados renales en nuestro centro, su diagnóstico y evolución tras el tratamiento.
CASO 1
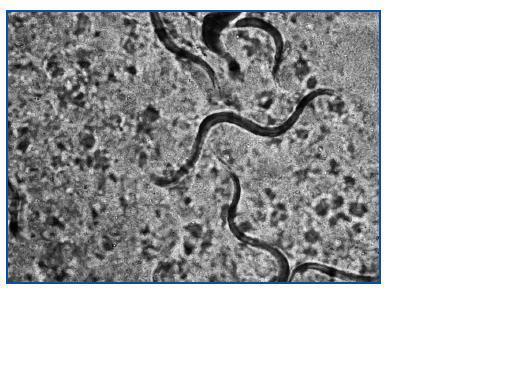
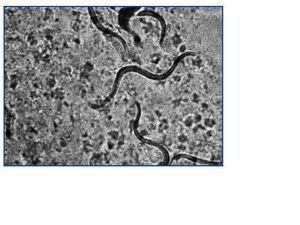
Varón de 55 años, en programa de DPCA crónica por insuficiencia renal secundaria a glomerulonefritis crónica. Recibió trasplante renal de donante cadáver en julio de 2005 e inmunosupresión con tacrolimus, micofenolato mofetil y prednisona; quedó con una función renal estable con creatinina en torno a 2,5 mg/dl. A los dos años del trasplante, presentó cuadro de diarrea persistente de 4-5 deposiciones al día, con pérdida de 2 kg de peso. El estudio microbiológico de heces detectó abundantes larvas de S. stercoralis (figura 1). La cifra de eosinófilos en sangre era normal (0,3 x 103/μl). El paciente residía en una localidad valenciana considerada como zona endémica de S. stercoralis. Se revisaron los antecedentes previos al trasplante, donde aparecieron episodios de urticaria y un asma leve que el paciente había tratado de forma esporádica con broncodilatadores. En las analíticas pretrasplante presentó de forma intermitente eosinofilia leve (1,0 x 103/ μl). Se inició tratamiento con tiabendazol a dosis de 1,5 g/12 horas (25 mg/kg/día) vía oral durante cinco días, repitiéndose el ciclo a los siete días por persistencia de la clínica. A los 14 días del inicio del tratamiento persistía la diarrea, con pérdida de 4 kg de peso y deterioro de la función renal, por lo que se ingresó para hidratación intravenosa. La muestra de heces obtenida durante el ingreso, así como la obtenida tras el segundo tratamiento con tiabendazol, fueron negativas para parásitos. El cuadro diarreico mejoró, con recuperación progresiva de la función renal hasta cifras de creatinina habituales. Una nueva muestra de estudio de parásitos en heces un mes más tarde fue negativa. En la actualidad, el paciente permanece asintomático, habiendo mejorado el cuadro urticariforme y el asma, con función renal estable. Se estudiaron los familiares convivientes, detectando en el hijo del paciente la presencia de S. stercoralis que se trató forma ambulatoria con tiabendazol.
CASO 2
Varón de 51 años con insuficiencia renal secundaria a síndrome de Alport, en hemodiálisis desde el año 2003. Recibió injerto renal de donante cadáver en agosto de 2006, inmunosupresión con tacrolimus, micofenolato mofetil y prednisona. Permanece con función renal estable con cifras de creatinina en torno a 2 mg/dl. El paciente presentó desde el postrasplante inmediato un cuadro de diarrea leve de 4-5 deposiciones blandas al día, que se atribuyó al tratamiento con micofenolato mofetil. Asimismo, presentó anemia normocítica normocrómica desproporcionada para el grado de insuficiencia renal, que no respondía al tratamiento con agentes eritropoyéticos. A los siete meses postrasplante, se objetivó en analítica de control una eosinofilia absoluta de 3,7 x 103/μl que se confirmó con una segunda muestra hematológica; el paciente seguía presentando la misma clínica de 4-5 deposiciones blandas desde el postrasplante. No presentó urticaria ni asma. El estudio de las heces mostró abundantes larvas de S. stercoralis. Se inició tratamiento con albendazol a dosis de 400 mg cada 12 horas por vía oral durante tres semanas. Tras finalizar el primer ciclo de tratamiento, el paciente presentó una normalización del número de deposiciones al día, con una mejoría de la eosinofilia a 0,8 x 103/μl y una normalización de las cifras de hemoglobina. Tras este primer ciclo de albendazol, la muestra de heces se negativizó para S. stercoralis. Posteriormente, se realizaron dos nuevos ciclos de una semana de tratamiento al mes y a los dos meses del diagnóstico, consiguiendo una total normalización de la cifra de eosinófilos en sangre periférica. En el estudio de parásitos en los familiares convivientes se detectaron formas compatibles con Blastocystis hominis y con Endolimax nana en la esposa del paciente, que se trató con metronidazol oral. Ambos residían en una zona endémica para S. stercoralis.
DISCUSIÓN
El S. stercoralis es un parásito intestinal particularmente endémico en algunas zonas de España, sobre todo a lo largo de la costa mediterránea y en poblaciones cercanas a la capital valenciana4. La infección por S. stercoralis se produce a partir del contacto de la piel del paciente con materiales contaminados por heces humanas; la larva desarrolla su ciclo vital en el organismo, hasta convertirse en gusano maduro a nivel del tracto digestivo y eliminando de nuevo las larvas en las heces del paciente. El aspecto que hace especialmente virulento a este parásito es que, además, en el intestino la larva puede madurar y atravesar la mucosa colónica, lo cual conlleva a la infección crónica o reinfección5.
En pacientes inmunocompetentes, este proceso de autoinfección puede perpetuarse sin causar síntomas, salvo eosinofilia fluctuante, cuadros de diarrea o asma leve, pero en pacientes inmunocomprometidos puede producirse la diseminación masiva de la larva a nivel del tubo digestivo, pulmones, hígado, corazón y sistema nervioso central, provocando un fallo multiorgánico con una elevada mortalidad, conocido como síndrome de hiperinfección2. En los pacientes trasplantados, la infección por el parásito puede ponerse de manifiesto con motivo de la terapia inmunosupresora, normalmente a partir de infecciones latentes presentes antes del trasplante, o bien pueden sufrir una primoinfección tras el trasplante, sobre todo si el paciente vive en una zona endémica.
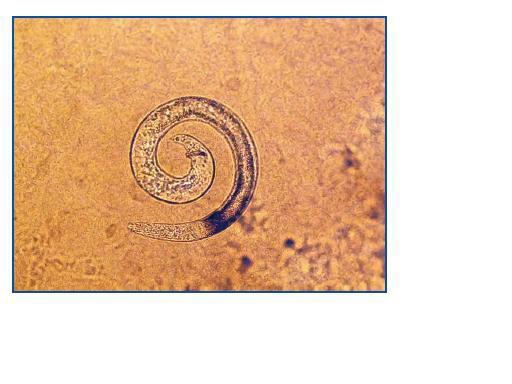
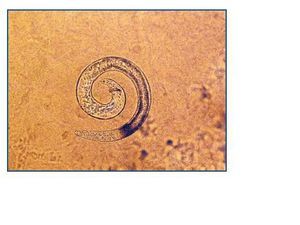
El diagnóstico de S. stercoralis puede ser complejo. La única anomalía puede ser la eosinofilia, y en los pacientes trasplantados puede no estar presente. Por este motivo, ante un cuadro diarreico no autolimitado en un paciente trasplantado, debemos descartar complicaciones de posibles fármacos, como el micofenolato mofetil, especialmente si se asocia al efecto procinético del tacrolimus. Si además el estudio convencional en heces resulta negativo, debe contemplarse la posibilidad de que el cuadro diarreico sea secundario a una infección parasitaria. Para diagnosticar una parasitosis por S. stercoralis, puede ser necesario remitir varias muestras de heces frescas para la detección de posibles larvas6 (figura 1), ya que una muestra única no detecta la infección hasta en un 70% de los casos. La sensibilidad de la visión directa de heces frescas aumenta a un 50% si se remiten tres muestras y a un 100% si envían siete muestras7. Si se procede al cultivo de estas heces en agar-plata, como fue en nuestros dos casos, pueden objetivarse larvas infectivas (figura 2). También se dispone de un test de ELISA específico con alta sensibilidad y especificidad6, y un test de ELISA indirecto para detectar la presencia de anticuerpos IgG e IgM frente a S. stercoralis8. En pacientes inmunocomprometidos, este test de ELISA específico podría estar indicado cuando la sospecha de parasitación es alta y las muestras de heces son repetidamente negativas, pudiendo ayudar al establecimiento de un diagnóstico y tratamiento precoces. Los anticuerpos específicos IgG pueden permanecer positivos años después de finalizar el tratamiento antihelmíntico9.
El tratamiento indicado para la Strongyloidiasis es el tiabendazol, a dosis de 25 mg/kg/día, repartidos en dos dosis. Se aconsejan dos días de tratamiento para infecciones no complicadas y cinco días para infecciones complicadas; en pacientes inmunodreprimidos además se aconseja repetir el ciclo de tiabendazol10, como en el caso 1. El efecto secundario más frecuente es la intolerancia digestiva. El albendazol a dosis de 400 mg/12 horas durante tres semanas, como utilizamos en el caso 2, es una terapia alternativa al tiabendazol que también ha demostrado eficacia frente al S. stercoralis, aunque la experiencia clínica es más limitada11. La ivermectina a dosis de 200 mg/kg/día, repartidas en dos dosis, también es un tratamiento aprobado y con menos efectos adversos que el tiabendazol, pero en España debe solicitarse como medicación extranjera. La eficacia del tratamiento debe documentarse con una muestra de heces negativa al final del mismo y solicitar una nueva muestra si reaparece la clínica, ya que la recidiva es frecuente. Se ha señalado que la ciclosporina podría tener efecto antiparasitario contra el S. stercoralis tanto en ratones12 como en humanos13, siendo reseñable que ninguno de nuestros pacientes recibía dicho fármaco inmunosupresor.
En conclusión, aunque la infección por S. stercoralis no es muy frecuente, puede ocasionar graves problemas para el paciente trasplantado si no se diagnostica y trata a tiempo. En la valoración de los candidatos a recibir un trasplante renal, se debe prestar especial atención a la presencia de eosinofilia inexplicada, historias de prurito o asma corticorresistente, con el fin de diagnosticar una posible infección parasitaria y erradicarla antes de iniciar el tratamiento inmunosupresor. Asimismo, en el diagnóstico diferencial de los síndromes diarreicos en el trasplantado renal, deberá incluirse muestra de heces frescas para la detección de posibles parásitos, especialmente ante la sospecha clínica o analítica de infección por S. stercoralis. En el caso de diagnóstico de dicha infección, deberán estudiarse también a los familiares convivientes. El riesgo de recidiva de esta enfermedad es frecuente, por lo que se recomienda obtener siempre una muestra negativa de heces tras finalizar el tratamiento y repetir la exploración ante la sospecha de nueva infección por S. stercolaris.
Figura 1.
Figura 2.