La enfermedad celíaca se produce por la interacción entre el gluten contenido en los cereales y varios factores genéticos y autoinmunes. Aunque las manifestaciones clínicas predominantes son digestivas, se han descrito varias manifestaciones sistémicas. También se ha asociado con varias enfermedades renales, entre las que predominan las glomerulonefritis. Describimos el caso de una paciente con una enfermedad celíaca aparecida tras su primera gestación que de forma simultánea presenta proteinuria nefrótica y microhematuria, con sustrato morfológico de nefropatía membranosa. Tras recibir tratamiento con medidas conservadoras (IECA, estatina) y dieta sin gluten, se aprecia mejoría de la clínica digestiva, y desaparición de los anticuerpos antitransglutaminasa tisular tipo IgA y de la proteinuria. Revisamos la relación entre enfermedad celíaca y nefropatía membranosa y el papel de la dieta libre de gluten en el control de las mismas.
INTRODUCCIÓN
La enfermedad celíaca (EC) es una entidad relativamente frecuente con una prevalencia en nuestro medio entre 1:250 y 1:500, dependiendo de los criterios diagnósticos1. En su patogenia intervienen factores genéticos (antígenos HLADQ2 y/o DQ8) y ambientales con alteraciones de la inmunidad humoral y celular frente a determinados antígenos contenidos en los cereales (trigo, cebada, centeno y avena) que contienen una proteína denominada gluten. Los péptidos derivados de la gliadina (fracción soluble en alcohol del gluten) poseen muchos componentes tóxicos que contienen varios antígenos implicados en su patogenia2. La EC aparece a cualquier edad, con cuadros de malabsorción más o menos evidentes y se puede asociar con otras enfermedades autoinmunes. También se ha descrito un aumento de enfermedades renales3, entre las que destacan las glomerulonefritis, especialmente las nefropatías con depósitos mesangiales de IgA4.
Describimos el caso de una paciente con EC clásica aparecida tras su primera gestación asociada con proteinuria nefrótica secundaria a nefropatía membranosa (NM). Tras recibir tratamiento con medidas conservadoras (IECA, estatina) y dieta sin gluten, se aprecia mejoría de la clínica digestiva, desaparición de los anticuerpos circulantes antitransglutaminasa tisular tipo IgA y disminución paralela de la proteinuria. Revisamos la relación entre EC y NM, así como el papel de la dieta libre de gluten en su control.
CASO CLÍNICO
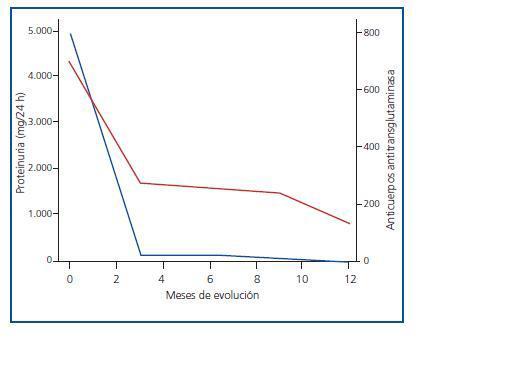
Mujer de 35 años, sin antecedentes de interés, que presenta un cuadro de dolor abdominal, diarreas y síndrome constitucional, aparecido unas semanas después de su primer parto; la gestación previa había transcurrido sin complicaciones. Es estudiada en la Sección de Aparato Digestivo, siendo diagnosticada de EC al reunir criterios diagnósticos: 1) título elevado de anticuerpos antitransglutaminasa; y 2) biopsia intestinal con atrofia de vellosidades en duodeno e hiperplasia de criptas. Poco después de la clínica comentada, presenta poliartralgias de medianas articulaciones, de predominio en carpos y tarsos, junto con parestesias y lesiones cutáneas con micropápulas pruriginosas. La envían a Nefrología por detectar proteinuria de +++. En la exploración física: tensión arterial 104/76 mmHg, IMC 27, mínimos edemas en miembros inferiores y pápulas en codos y brazos. En la analítica: hemograma y coagulación normales, creatinina 0,9 mg/dl, colesterol total 238 mg/dl, triglicéridos 104 mg/dl, proteínas totales 6,5 g/dl y albúmina 3,6 g/dl. En el estudio inmunológico: ANA, anti-DNA, ANCAS, C3, C4, anticuerpos anticardiolipina, anticoagulante lúpico y crioglobulinas negativos o normales. La serología frente a VHB, VHC y VIH negativa. Los anticuerpos antitransglutaminasa tisular IgA positivos a título 800 U/ml (normal <7 U/ml). En orina: proteínas 4,4 g/día y sedimento con 5 hematíes por campo. La ecografía renal es normal. Ante la persistencia de la proteinuria nefrótica durante varias semanas, se hace biopsia renal percutánea, cuyo resultado es una NM estadio 2, sin lesiones vasculares ni intersticiales. Recibe tratamiento con dieta sin gluten y otras medidas conservadoras con estatina, aspirina a dosis antiagregantes, enalapril y losartán, sin respuesta inicial. No obstante, a los 12 meses de seguimiento, se aprecia de forma simultánea la negativización de los anticuerpos antitransglutaminasa y la remisión completa de la proteinuria, como se indica en la figura 1. Durante este tiempo no ha presentado otros datos de enfermedad sistémica, salvo aumento de los niveles de TSH 6,6 μU/ml, con T4l de 1,1 ng/dl y anticuerpos antitiroglobulina y antimicrosomales negativos.
DISCUSIÓN
En este caso describimos una paciente que presenta de forma simultánea EC y NM, asociación muy poco descrita en la literatura. Muy posiblemente, ambas entidades tienen una patogenia común y un tratamiento similar.
La EC es una enfermedad autoinmune que aparece tras la exposición a antígenos ambientales (la gliadina contenida en el gluten) en pacientes con predisposición genética. Por motivos desconocidos, ciertos componentes de la gliadina provocan una respuesta inmune alterada en la pared intestinal, con inflamación local y liberación de
transglutaminasa tisular, enzima procedente de células inflamatorias y endoteliales y de fibroblastos. La transaminasa tisular aumenta la antigenicidad de los péptidos del gluten, con estímulo de células T, lo que conlleva la atrofia de vellosidades y el consiguiente síndrome de malabsorción1,2. La EC puede aparecer a cualquier edad y, a veces, de forma poco sintomática, si bien debuta con diarrea, dolor y distensión abdominal, vómitos, flatulencia y anorexia. Entre las manifestaciones extradigestivas, se encuentran: anemia ferropénica, poliartritis, retraso en el crecimiento, osteoporosis y síntomas neurológicos. Para el diagnóstico de EC es imprescindible realizar biopsia de la unión duodeno-yeyunal. La presencia de atrofia, acortamiento de las vellosidades e hipertrofia de las criptas en intestino delgado no son específicas, pero sí muy características de esta enfermedad. Por otro lado, la presencia de títulos elevados de anticuerpos antitransglutaminasa tisular de tipo IgA tiene un valor diagnóstico y evolutivo, ya que desaparecen de forma paralela a la mejoría clínica; se estima que su sensibilidad y especificidad son del 93,1 y 93,6%, respectivamente1,5. Por tanto, nuestra paciente tiene los tres criterios exigidos para el diagnóstico de EC clásica: atrofia de vellosidades, síntomas de malabsorción y desaparición de los síntomas tras dieta sin gluten.
La EC se asocia con otras enfermedades con patogenia autoinmune como dermatitis herpetiforme, déficit de IgA, síndrome de Sjögren, enfermedad de Addison, diabetes tipo 1, enfermedades tiroideas, lupus sistémico y hepatitis1,6. La paciente descrita en este caso presenta unas lesiones cutáneas no bien filiadas, posiblemente dermatitis atópica, que también se asocia con EC. Además, debuta con poliartralgias, sin criterios de lupus sistémico, posiblemente por el cuadro de osteoartritis que también se ha descrito en la EC. Además, los pacientes con EC tienen una mayor prevalencia de enfermedades renales. Ludvigson et al.3, en un estudio epidemiológico realizado en Suecia, describieron un aumento del número de casos de glomerulonefritis crónica e insuficiencia renal avanzada en los pacientes con EC, y este riesgo es mayor cuando el diagnóstico se hace en la edad adulta.
Aunque la aparición de enfermedad renal en la población de pacientes celíacos es baja y, viceversa, la presencia de EC en pacientes diagnosticados de glomerulonefritis es reducida, esta asociación tiene aspectos patogénicos comunes que pueden influir en el tratamiento. Se han descrito casos aislados de asociación de la celiaquía con síndrome nefrótico. Giménez et al.7 comunicaron una serie de cinco niños con síndrome nefrótico que en algún momento de la evolución desarrollaron EC; en la biopsia renal, realizada en dos de ellos, se puso de manifiesto lesiones de cambios mínimos o glomerulonefritis mesangial con depósitos de IgM. En nuestra opinión, es conveniente descartar EC más o menos encubierta en los pacientes con nefropatías glomerulares, dada la facilidad para conocer los niveles de anticuerpos antitransglutaminasa tisular y las implicaciones terapéuticas que conlleva. La principal asociación entre EC y enfermedad glomerular es, con mucho, la nefropatía IgA, que aparece en un 3% de los celíacos. Por otro lado, se ha descrito que un 22-77% de los pacientes con nefropatía IgA presenta anticuerpos antigliadina de tipo IgA, de los cuales el 3-4% presenta EC8,9. Curiosamente, nuestra paciente tiene una NM sin depósitos de IgA cuya asociación con EC es excepcional. Sólo hemos encontrado un caso similar al nuestro10, con mala respuesta al tratamiento con bloqueo del sistema renina-angiotensina combinado con dieta sin gluten, contrariamente a lo observado en nuestra paciente. En otra publicación se describe la asociación entre EC y NM, pero el paciente fue diagnosticado inicialmente de NM y, posteriormente, 10 años después, se diagnosticó de EC, al contrario de lo que ocurrió en el caso que presentamos11. En nuestra opinión, la asociación entre EC y NM no es fortuita y pensamos que tienen una patogenia autoinmune común. En primer lugar, ambas entidades debutan de forma simultánea y es posible que la alteración autoinmune facilite tanto la clínica digestiva como la renal. En segundo lugar, la remisión de la proteinuria coincide con la desaparición de los anticuerpos antitransglutaminasa tisular tipo IgA; aunque la remisión puede haber sido espontánea, la coincidencia temporal hace que podamos establecer una cierta relación, dado que la mayoría de las NM remite al corregir la causa original. Queremos destacar que nuestra paciente no ha recibido tratamiento inmunosupresor, dado que consideramos que tenía una NM secundaria y que, por otro lado, nunca tuvo un síndrome nefrótico completo.
Concluimos que la aparición de proteinuria en pacientes con EC puede deberse a NM y que la dieta sin gluten mejora ambas entidades, lo que apoya mecanismos patogénicos comunes.
Figura 1.