Sr. Director:
El diagnóstico y tratamiento de la hiponatremia hospitalaria conforma un reto para el profesional médico asistencial. Existen errores frecuentes de clasificación y diagnóstico reconocidos en el manejo habitual de esta patología. Entre ellos, el diagnóstico de insuficiencia adrenal (IA) central es a menudo obviado en el diagnóstico de la hiponatremia euvolémica, siendo claramente infradiagnosticado en este contexto.
Asimismo, dado el uso extendido de glucocorticoides (GC) en la práctica médica diaria, es importante resaltar que los pacientes en tratamiento crónico se encuentran en riesgo de desarrollar IA en caso de no ajustar la dosis ante una circunstancia intercurrente o una disminución-suspensión inadecuada del tratamiento. Se presenta un caso de tratamiento crónico nebulizador con corticoides acompañado de dosis de estrés de dexametasona ante un cuadro de meningitis, con el desarrollo de IA central posterior ante un manejo inadecuado del tratamiento.
CASO CLÍNICO
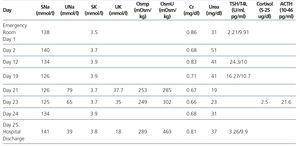
Mujer de 78 años ingresada por cuadro de meningitis bacteriana por neumococo y cuadro confusional. Antecedentes personales: hipertensión arterial, asma, cardiopatía isquémica e hipotiroidismo posquirúrgico. Tratamiento ambulatorio con levotiroxina 100 μg/24 h, valsartán 80 mg/24 h, diltiazem 60 mg/8 h, clopidogrel 75 mg/24 h, budesonida 0,50 mg 1 inhalación/8 h. En la exploración física presentaba fiebre de 38 ºC y desorientación temporo-espacial. Presentaba leucocitosis 20 600 ul (> 11 000 ul), INR: 1,3 (0,8-1,2), Cr: 0,86 mg/dl (0,6-1,35 mg/dl), urea: 31 mg/dl (10-50 mg/dl), Nap: 138 mmol/l (135-145 mmol/l), Kp: 3,5 mmol/l (3,5-5,5 mmol/l). Una tomografía axial computarizada (TAC) cerebral urgente descartó patología aguda. La punción lumbar confirmó meningitis por neumococo. Se inició tratamiento con suero glucosado 5 % 1500 cc/día, suero salino fisiológico 0,9 % 1000 cc/día (40 mEq cloruro potásico/24 h), meropenem 2 g/8 h, dexametasona 8 mg/6 h y vancomicina 1 g/8 h.
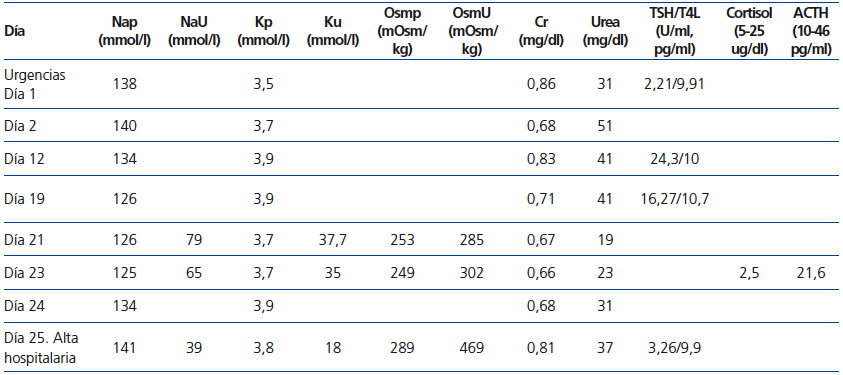
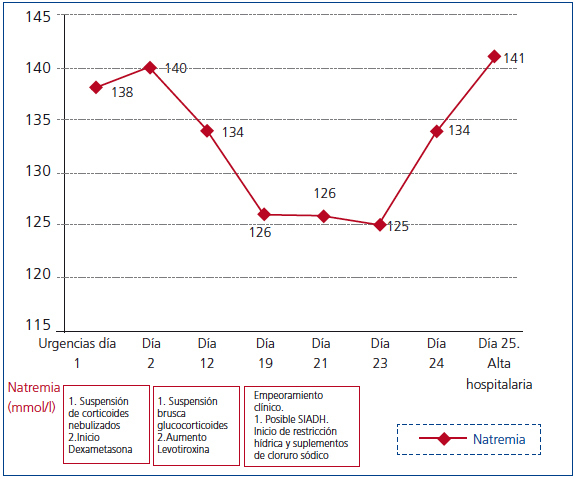
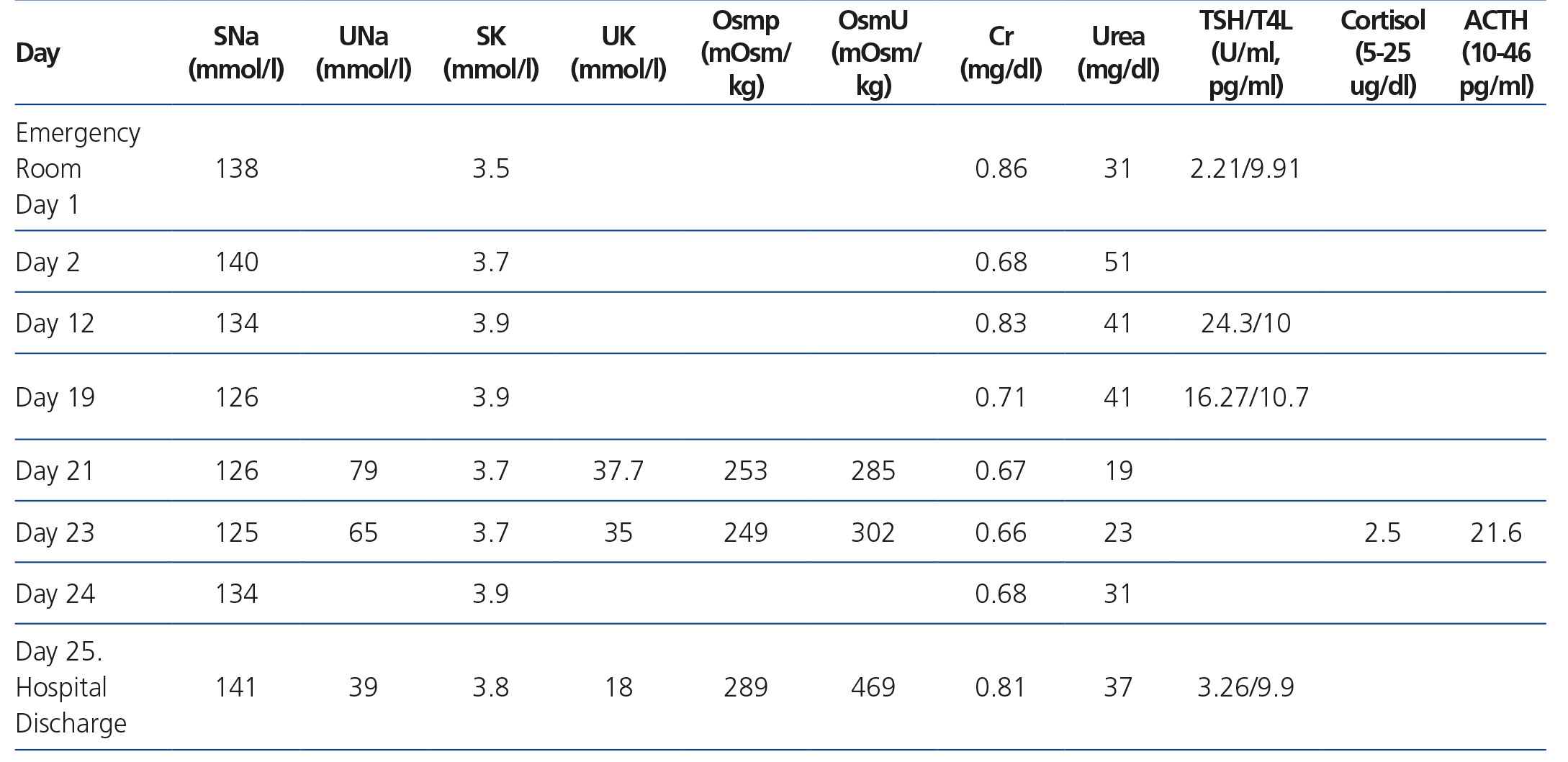
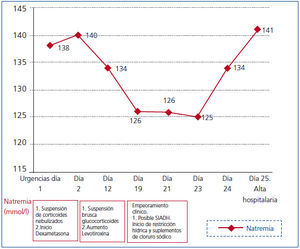
Mantuvo tratamiento con dexametasona 4 mg/6 h hasta el décimo día de ingreso, cuando se suspendió sin disminución previa de la dosis, al igual que la fluidoterapia. El día decimonoveno se repitió una TAC cerebral por somnolencia marcada y tendencia a la hipotensión arterial, sin hallazgos patológicos. La analítica mostraba Nap: 126 mmol/l, Cr: 0,71 mg/dl, urea: 40 mg/dl, gasometría venosa con pH: 7,39 y Kp: 4,1 mmol/l. Fue diagnosticada de síndrome de secreción inadecuada de hormona antidiurética (SIADH), iniciándose restricción hídrica a 1000 cc/día y cloruro sódico 2 g/8 h. No mejoró con dicho tratamiento, permaneciendo con Nap: 126 mmol/l, Nau: 79 mmol/, Osmp: 253 mOsm/kg (275-290 mOsm/kg), Osmu: 285 mOsm/kg (> 100 mOsm/kg). Clínicamente presentaba euvolemia clínica, bradipsiquia y desorientación. Acompañaba tendencia a hipotensión arterial e hipoglucemia (ayuno: 60 mg/dl). Se solicitó cortisol plasmático basal como parte del estudio de la hiponatremia euvolémica a las 8.00 horas, con resultado de 2,5 ug/dl (5-25 ug/dl), hormona corticotropina (ACTH): 21,6 pg/ml (10-46 pg/ml), siendo diagnóstico de IA central1. Con el diagnóstico de IA central debido a suspensión brusca de GC, se inició tratamiento con hidroaltesona oral 20 mg/8 h, Nap inicial: 125 mmol/l y respuesta en 24 horas: 134 mmol/l. Fue dada de alta tras 48 horas con hidroaltesona tras normalización de la hiponatremia e hipocortisolismo (figura 1 y tabla 1).
La hiponatremia mediada por hormona antidiurética (ADH) es frecuente en el hospital. Contribuyen estímulos fisiológicos como la náusea, el dolor, la secreción inadecuada de ADH o el hipocortisolismo. El SIADH es un diagnóstico de descarte y precisa de euvolemia clínica, con una función tiroidea y adrenal conservada2.
El tratamiento con GC crónico en dosis suprafisiológicas inhibe el eje hipotálamo-hipofisario-adrenal (HHA), con riesgo de IA en caso de interrupción inadecuada del tratamiento, siendo esta una de las causas más frecuentes de IA en la actualidad. Dosis elevadas de GC de manera crónica disminuyen la síntesis de factor hipotálámico liberador de corticotropina (CRH) hipotalámica, perdiendo su efecto trófico y secretagogo sobre las células corticotropas hipofisarias3. En ausencia de secreción de ACTH, la zona fasciculorreticular adrenal se atrofia. Sin embargo, el eje renina-angiotensina-aldosterona permanece intacto y, por tanto, el equilibrio ácido-base y el manejo renal del potasio.
Dentro de las posibles vías de administración de GC se encuentran la oral, la intravenosa, la oftálmica, la inhalada, la rectal, la transdérmica, la intramuscular o la intrarticular, todas debiendo ser consideradas en la valoración de un paciente con IA4,5.
En respuesta al hipocortisolismo, se produce un incremento en la síntesis y liberación de CRH y ADH en la zona dorsomedial parvocelular del núcleo paraventricular hipotalámico con el objetivo de estimular la secreción de ACTH, y secundariamente de cortisol. El proceso de recuperación del eje HHA es variable, pudiendo durar semanas-meses.
En esta situación, el exceso de ADH se traducirá en un incremento de aquoporinas en el túbulo colector renal, no inhibiendo su secreción ante hiposmolaridad plasmática y con riesgo de hiponatremia euvolémica.
Dentro del diagnóstico diferencial en paciente con hiponatremia tras meningitis aguda, debería ser considerado el síndrome pierde-sal cerebral, SIADH, hipotiroidismo e IA central. La hemodilución plasmática y la euvolemia clínica descartan el síndrome pierde-sal cerebral. El hipotiroidismo precisa ser muy severo para producir hiponatremia y es causa excepcional6. El SIADH es un diagnóstico de descarte, criterio fundamental y frecuentemente obviado.
La paciente utilizaba de manera crónica budesonida inhalada, que fue suspendida en el momento del ingreso, siendo capaz de suprimir el eje HHA en dosis altas cuando es utilizada de manera crónica. La suspensión de GC inhalados se ha descrito como causa de IA aguda central7. Ambos aspectos, tratamiento crónico previo con budesonida y tratamiento con dexametasona en dosis elevadas, marcaron el desarrollo de IA central.
La IA central presenta sintomatología poco específica: astenia, náuseas, dolor abdominal, hipotensión arterial o riesgo de hipoglucemia, entre otros8. Una elevada sospecha clínica es fundamental para su diagnóstico.
La respuesta clínica y analítica al tratamiento con GC en el paciente con IA central es espectacular. Dada la inhibición de secreción de vasopresina y la consecuente marcada acuaresis, existe el riesgo de sobrecorrección marcada de Nap durante las primeras 24-48 horas de tratramiento9. Ello puede asociar un incremento del riesgo de desarrollar mielinólisis osmótica, por lo que es obligación del médico asistencial prevenir dicho cuadro controlando la corrección de la natremia. El mensaje principal del presente caso clínico es remarcar la posibilidad de IA central en pacientes tras tratamiento con GC prolongado, así como que el SIADH es un diagnóstico de descarte en pacientes con hiponatremia euvolémica.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Evolución y estudio de la paciente con hiponatremia euvolémica
Figura 1. Evolución de la natremia durante el ingreso en una paciente con hiponatremia debida a hipocortisolismo
Tabla 1. Evolution of Laboratory Tests in the Euvolemic Patient