Sr. Director:
La ciclofosfamida es un agente alquilante sintético usado en la quimioterapia del cáncer y también como inmunosupresor. Entre sus efectos adversos se han descrito infecciones, mielosupresión, cistitis hemorrágica, reacciones de hipersensibilidad, toxicidad digestiva/hepática, pulmonar, cardíaca y neurológica, esterilidad y síndrome de secreción inadecuada de hormona antidiurética (SIADH)1-3.
Describimos a un paciente con dolor abdominal y elevación de enzimas hepáticas y pancreáticas tras la administración de ciclofosfamida.
Paciente de 57 años remitido por insuficiencia renal. Antecedentes personales: artralgias y artritis en los últimos 10 años, sordera, epistaxis frecuentes; pancreatitis por colelitiasis un mes antes. Exploración física: afebril, presión arterial 130/70 mmHg, crepitantes pulmonares bibasales y resto normal. En la analítica destacaban hemoglogina 8,1 g/dl (13-17), creatinina 6,44 mg/dl (0,84-1,25), urea 163 mg/dl (17-43), albúmina 2,63 g/dl (3,50-5,20), GOT 5 U/l (10-39), GPT 15 U/l (10-45), GGT 71 U/l (10-55), fosfatasa alcalina 102 U/l (30-120), bilirrubina total 0,69 mg/dl (0,3-1,2), amilasa 100 U/l (22-80), sedimento: 60-100 hematíes por campo, proteinuria 1,5 g/24 h, cultivo de orina negativo. c-ANCA negativo, p-ANCA positivo, PR3 negativo, MPO 50,5 (N <7 U/ml), anticuerpos anti-MBG negativos, serología para hepatitis B, C y virus de la inmunodeficiencia humana (VIH) negativa. Ecografía abdominal: colelitiasis, riñones de tamaño normal; la tomografía computarizada (TC) pulmonar reveló nódulos bilaterales. La biopsia renal mostró una glomerulonefritis necrosante focal y segmentaria con escasos depósitos en la inmunofluorescencia y fue diagnosticado de vasculitis ANCA positiva (poliangeítis microscópica/Wegener).
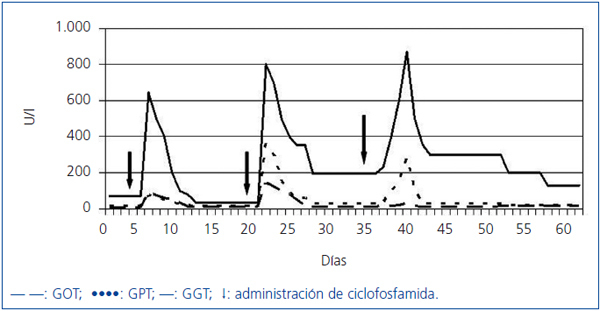
Fue tratado con tres bolos de metilprednisolona de 500 mg, continuando con 60 mg de prednisona al día por vía oral, hemodiálisis y plasmaféresis. Otros fármacos que recibía eran omeprazol, carbonato cálcico, sevelamer, furosemida y eritropoyetina. Se administró un primer bolo de ciclofosfamida (500 mg) y 12 horas después aparecieron sudoración y dolor abdominal difuso, sin signos de irritación peritoneal. Presentaba GOT 90 U/l, GPT 76 U/l, GGT 645 U/l, fosfatasa alcalina 109 U/l, bilirrubina total 0,66 mg/dl y amilasa 173 U/l; estos parámetros se normalizaron en los días siguientes; 15 días después se prescribió un segundo bolo de ciclofosfamida (750 mg), y a las 24 horas reapareció el dolor en el hipocondrio derecho. Presentaba GOT 144 U/l, GPT 358 U/l, GGT 802 U/l, fosfatasa alcalina 103 U/l, bilirrubina total 6,44 mg/dl, amilasa 208 U/l, lipasa 378 U/l (21-67), con evolución descendente en los días posteriores. La colangiorresonancia magnética mostró colelitiasis sin signos de complicación, vía biliar no dilatada, sin coledocolitiasis. Tras 15 días se pasó a ciclofosfamida oral a dosis de 50 mg/día. A los 4 días presentó dolor autolimitado en el hipocondrio derecho. Tenía GOT 27 U/l, GPT 281 U/l, GGT 871 U/l, fosfatasa alcalina 129 U/l, bilirrubina total 0,74 mg/dl, amilasa 97 U/l y lipasa 154 U/l (Figura 1). Se suspendió la ciclofosfamida, y se inició tratamiento con micofenolato de mofetilo a dosis de 500 mg/8 horas. Transcurrido un mes el paciente estaba asintomático, con diuresis espontánea de 2 l/día, normotenso, Cr 2,59 mg/dl, GOT 9 U/l, GPT 28 U/l, GGT 155 U/l, fosfatasa alcalina 105 U/l, bilirrubina total de 0,68 mg/dl, amilasa y lipasa normales, ANCA-MPO positivo débil. En la tomografía computarizada (TC) pulmonar se observó la práctica desaparición de las imágenes.
Existe una gran variabilidad interindividual en eficacia y toxicidad de la ciclofosfamida que se han relacionado principalmente con mecanismos farmacocinéticos y farmacogénicos1,2,4,5. Así, Navin Pinto et al. proponen que determinados polimorfismos de enzimas implicadas en el metabolismo de la ciclofosfamida (citocromo P450, glutatión S-transferasas y aldehído-deshidrogenasas) podrían estar relacionados con esta variación3. Se ha encontrado asociación entre altas dosis de ciclofosfamida y sus metabolitos tóxicos (acroleína y mostaza de fosforamida) y hepatotoxicidad2,4. También se ha relacionado la hepatotoxicidad con niveles elevados de otros metabolitos como la 4-hidroxiciclofosfamida2 y el O-carboxietil-fosforamida mostaza4. Asimismo, se ha señalado que las reacciones adversas por ciclofosfamida, pueden deberse a inhibición de la colinestarasa6. La hepatotoxicidad por ciclofosfamida se caracteriza por citolisis y colostasis, como sucedió en este caso, aparece tanto por vía oral como intravenosa y parece ser dependiente de la dosis. Se han descrito tres patrones histológicos: necrosis hepática masiva, necrosis de hepatocitos perivenosos y daño hepatocelular difuso con esteatosis leve1.
Los pacientes con insuficiencia renal avanzada pueden tener elevadas la amilasa (hasta tres veces el límite superior de la normalidad) y la lipasa (hasta dos veces). En este paciente, después del segundo bolo de ciclofosfamida, se observó una elevación de lipasa más de cinco veces superior al nivel normal, que puede indicar afectación pancreática. La ciclofosfamida, hasta donde conocemos, no se ha asociado con pancreatitis, pero la ifosfamida, otra mostaza nitrogenada similar a la ciclofosfamida sí se ha descrito como productora de pancreatitis7.
Las vasculitis ANCA pueden afectar al aparato digestivo. Nuestro paciente tenía una colelitiasis no complicada; los cólicos biliares podrían causar alteraciones analíticas similares a las aparecidas, pero en la colangiorresonancia magnética no había evidencia de coledocolitiasis. En este caso hubo una clara asociación temporal con la ciclofosfamida, que apoya el papel del fármaco. Según la escala de Naranjo et al.8, la relación entre hepatotoxicidad y ciclofosfamida, en este enfermo, es probable.
Este caso demuestra que es necesario controlar la función hepática y pancreática durante el tratamiento con ciclofosfamida.
Figura 1. Evolución de GOT, GPT y GGT durante el tratamiento con ciclofosfamida.