Sr. Director:
La glomerulosclerosis segmentaria y focal (GSF) se caracteriza por la presencia de síndrome nefrótico, hipertensión arterial y deterioro progresivo de la función renal. Aunque en muchos casos su etiología se desconoce, se ha asociado con trastornos hereditarios, con infecciones virales, inducida por tóxicos y con situaciones de hiperfiltración1.
La policitemia vera (PV) es un trastorno mieloproliferativo de etiología desconocida que se caracteriza por una excesiva producción de eritrocitos normales, de leucocitos y de plaquetas2.
La afectación glomerular en la PV es rara. Presentamos a una paciente diagnosticada de PV con síndrome nefrótico secundario a GSF e insuficiencia renal progresiva.
Mujer de 83 años de edad diagnosticada de PV 4 años antes, que ingresa para estudio de síndrome nefrótico e insuficiencia renal de 2 años de evolución.
No presenta antecedentes familiares de poliglobulia. Entre sus antecedentes personales cabe destacar: nefrectomía izquierda por hipernefroma a los 63 años, bronquiectasias con sobreinfecciones bacterianas de repetición, hipertensión arterial controlada con fármacos y enfermedad celíaca bien controlada con dieta. Cuatro años antes había sido diagnosticada de PV por biopsia de médula ósea, con datos de poliglobulia y trombocitosis, bien controlada en tratamiento con hidroxiurea (500 mg/día).
En marzo de 2007 comenzó con proteinuria de rango nefrótico (4,2 g/día) con Crs 1,1 mg/dl; se inició tratamiento antiproteinúrico con telmisartán 80 mg/día y espironolactona 50 mg/día y un mes más tarde la proteinuria desciende a 1,2 g/día sin cambio en la creatinina. Ingresa en junio de 2007 en el hospital por hiponatremia grave (107 mEq/l), sintomática, con hiperpotasemia (5,7 mEq/l) y acidosis metabólica (pH 7,34) secundaria al tratamiento con espironolactona; por la persistencia de proteinuria nefrótica y los antecedentes de bronquiectasias, se realizó biopsia de grasa abdominal y rectal que descartó la existencia de amiloidosis. A lo largo de su evolución la proteinuria varía entre 4-10 g/día y comienza con edemas en miembros inferiores, disminución de proteínas totales y albúmina (5,4/2,7 g/dl), y descenso progresivo del filtrado glomerular (Crs 1,6-1,7 mg/dl).
En mayo de 2009 ingresa por deterioro del estado general, edemas, Crs 3,6 mg/dl y proteinuria 8,4 g/día a pesar de tratamiento con ARA II. Al ingreso su presión arterial era 137/82 mmHg; en el examen físico se auscultaba soplo sistólico eyectivo II/VI en borde esternal izquierdo y presentaba edemas con fóvea bilaterales hasta raíz de muslo. Hemograma: hemoglobina 16,8 g/dl, hematocrito 56%, hematíes 6.750.000/µl, leucocitos 11.690/µl con fórmula normal y plaquetas 460.000/µl. Crs 4,3, urea 102 (mg/dl). Proteínas totales 5,9, albúmina 2,5 g/dl, colesterol 188, triglicéridos 260, ácido úrico 9,8 mg/dl. Proteinuria 6,9 g/d; sedimento 1-4 hematíes/campo y 5-10 leucocitos/campo. Inmunología: ANA, anti-ADN, ENA, ANCA y anti-MBG negativos. Complemento: C3 79; C4 30 mg/dl. PCR 0,37 mg/dl. Factor reumatoide negativo. IgG 820, IgA 185, IgM 188 mg/dl. Kappa 635, lambda 515 mg/dl. Se realizó biopsia renal con 8 glomérulos de los cuales dos estaban completamente esclerosados, y de los seis restantes, en uno se apreciaba ampliación mesangial global a partir de células y los otros cinco tenían lesiones proliferativas segmentarias sin necrosis acompañadas de moderada proliferación epitelial. El intersticio presentaba moderada fibrosis con atrofia tubular y ocasionales infiltrados inflamatorios crónicos. Los vasos arteriales y arteriolares son hiperplásicos con ocasionales lesiones hialinas. Estos hallazgos eran indicativos de glomerulonefritis proliferativa segmentaria variante celular.
Se inició tratamiento con tres choques de 6-metilprednisolona de 125 mg y posteriormente prednisona (1 mg/kg/día) y micofenolato mofetilo (360 mg/12 horas); no se objetivó descenso de la proteinuria y la función renal se deterioró progresivamente con clínica urémica, por lo que se decidió canalización de catéter permanente yugular derecho e iniciar tratamiento con hemodiálisis periódicas con mejoría progresiva de los síntomas. Se suspendió el tratamiento con micofenolato mofetilo y la prednisona se retiró de forma progresiva.
Nuestra paciente desarrolló un síndrome nefrótico secundario a GSF 4 años después de la detección de la policitemia. Cumplía los criterios de la OMS para el diagnóstico de PV2 (Hb superior a 16,5 g/dl en mujeres, ausencia de causas de poliglobulia secundaria, disminución de niveles de EPO, esplenomegalia, trombocitosis >400.000/µl y leucocitosis >12.000/µl). A pesar de un buen control de la PV con hidroxiurea y del tratamiento con esteroides a dosis altas y agentes inmunosupresores, el síndrome nefrótico no mejoró, y se acompañó de un deterioro progresivo de la función renal con sintomatología urémica e inicio de tratamiento sustitutivo.
La biopsia renal demostró la existencia de una glomerulosclerosis segmentaria y focal variante celular que tiene un pronóstico peor que otras GSF (hialinosis perihiliar, variante «tip» y variante clásica) y mejor que la colapsante3.
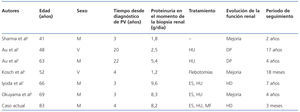
La presencia conjunta de GSF y PV es una asociación rara. En la literatura sólo se han publicado 6 casos confirmados histológicamente4-8. En la tabla 1 se resumen los datos clínicos de los 6 casos publicados y del actual.
A partir de ella podemos obtener algunos datos interesantes. La edad media en el momento de la biopsia renal fue de 60,3 años (rango, 41-83). En 5 de los 7 casos (71,4%) se diagnosticó la GSF hasta 4 años después de la detección de la policitemia. Cuatro pacientes (57,1%) desarrollaron proteinuria de rango nefrótico; 3 pacientes fueron tratados con esteroides y agentes inmunosupresores, de los cuales sólo uno presentó mejoría de la función renal, precisando los otros dos hemodiálisis por deterioro progresivo de las cifras de creatinina plasmática con aparición o empeoramiento de síntomas urémicos.
La presencia de GSF en estos pacientes podría estar directamente relacionada con la PV. Como indican Sharma et al4, las alteraciones hemodinámicas en la PV, así como la vasodilatación renal y el aumento del flujo sanguíneo renal efectivo, podrían desencadenar una glomerulosclerosis renal. Ferrario et al9 sugieren que el daño glomerular hemodinámico induce la activación de las células mesangiales, lo que conduce a una hiperproducción de matriz extracelular. Además, las células endoteliales dañadas facilitan la activación plaquetaria, liberando factor activador de plaquetas, lo que induce la proliferación de células endoteliales y mesangiales. Estas alteraciones podrían contribuir al desarrollo de cambios glomerulares escleróticos.
En resumen, recomendamos realizar pruebas de detección regulares de la presencia de daño renal en pacientes con PV. Si estos pacientes desarrollan proteinuria, la asociación con GSF podría ser considerada como una posible, aunque rara, complicación. En pacientes con proteinuria de rango nefrótico, la combinación de esteroides e inmunosupresores administrada precozmente podría frenar la progresión del daño renal.
Tabla 1. Casos de GSF asociados a PV