Introducción y objetivos: A pesar de disponer de una información limitada, el conocimiento de los niveles relativos del factor de crecimiento fibrobástico 23 (FGF 23), fosfato (P), calcio (Ca), paratohormona intacta (PTHi) y 25/1,25 vitamina D3 en cada momento evolutivo de la insuficiencia renal crónica ha aportado datos para sustituir o al menos modificar antiguos paradigmas. Se definen estadios más precoces, se señalan amplias implicaciones pronósticas y se sugieren nuevas intervenciones terapéuticas. Planteamos un estudio transversal-descriptivo y analítico de estos parámetros en una amplia muestra de enfermos distribuidos en todo el espectro de la enfermedad renal crónica. Material y métodos: Evaluamos los niveles de FGF 23 con un ELISA de segunda generación que mide molécula intacta (Kainos Laboratories, Japón) en un diseño transversal de una población adulta con todos los estadios de la enfermedad renal crónica basados en CKD-EPI junto a niveles de Ca, P, paratohormona y metabolitos de la vitamina D. Resultados: Estudiamos a 251 enfermos (146 hombres y 77 mujeres) con una edad promedio de 62,5 (desviación estándar [DE]: 11,5) años, siendo el 43% de ellos diabéticos. Los niveles de FGF 23 aumentan progresivamente; este cambio es significativo en el estadio 4 en relación con el 1 (110,61 vs. 31,32 ng/l). La PTHi muestra un comportamiento similar. La 1,25 vitamina D baja progresivamente hasta llegar en el estadio 4 a un cambio significativo. Los niveles de Ca no se modifican. Los niveles de 25 vitamina D3 son bajos en todo momento sin tender a un descenso progresivo. Los niveles de P no se modificaron hasta su aumento en el estadio 4. En el análisis multivariante, los niveles de FGF 23 se correlacionan negativamente con el filtrado glomerular (FG) y positivamente con la PTHi y el P. Conclusiones: A lo largo de la enfermedad renal crónica, los incrementos de FGF 23 y PTHi podrían ser los más precoces, seguidos del descenso de 1,25 dihidroxivitamina D3 (1,25 OHD3) y del incremento del P. El Ca y la 25 hidroxivitamina D3 no se modifican. Los niveles de FGF 23 muestran una sólida relación con el FG estimado, PTHi, 1,25 OHD3 y P.
Background and Objectives: The ample information available in relation to FGF 23, calcium, phosphorus, PTH, and 25/1,25 vitamin D has allowed us to define consistent values for each variable in each stage of chronic kidney disease (CKD). These values can define early stages, prognostic issues, and new treatment targets. We describe a cross-sectional study of these parameters in patients with different stages of CKD. Method: We measured FGF 23 by ELISA (intact molecule, Kainos Laboratory, Japan), calcium, phosphorus, PTH and vit D by standard methods. Results: We examined 251 patients, 146 of which were men, with a mean age of 62.5 (11.5) years and 43% prevalence of type II DM. Levels of FGF 23 rose progressively, in a very significant manner, in correlation with the evolution of CKD, especially in stage 4 as compared to stage 1 (110.61ng/L vs 31.32ng/L). The same happened with iPTH values. Additionally, levels of 1,25 vitamin D decreased in a similar manner. Calcium values did not change. 25 vit D3 levels were low at all times and showed no tendency for a steady decline. Phosphorus rose in stage 4 CKD. Levels of FGF 23 were negatively correlated with renal function indicators and positively correlated with PTH and P. Conclusions: During the evolution of CKD, changes of FGF 23 and PTH would be the earliest markers. Calcium and 25 vit D3 do not vary with changes in the progression of CKD. Values of FGF 23 show an important correlation with PTH, 1,25 vit D3, P and estimated glomerular filtration rate.
INTRODUCCIÓN/OBJETIVOS
La idea que tenemos sobre el metabolismo fosfocálcico en la insuficiencia renal crónica ha cambiado sustancialmente en los últimos años. Los nuevos conocimientos fisiológicos y fisiopatológicos señalan nuevos actores, definen escenarios más precoces, muestran amplias implicaciones pronósticas, sugieren nuevas intervenciones terapéuticas y sustituyen, o al menos modifican, antiguos paradigmas1.
A pesar de la disminución de la masa nefronal, el riñón disfuncionante es capaz de eliminar eficazmente la carga de fosfato (P), incrementándose la fosfatemia sólo en estadios muy avanzados. El factor de crecimiento fibrobástico 23 (FGF 23) es una proteína sintetizada en el osteocito que inhibe la reabsorción proximal de P, promueve la disminución de los niveles de 1,25 (OH)2 vit D3 (calcitriol) al inhibir la α-1 hidroxilasa renal y bloquea la síntesis/liberación de paratohormona (PTH) intacta (PTHi)2. El FGF 23 necesita klotho, una proteína involucrada en los procesos de envejecimiento, como obligado cofactor al convertir su potencial receptor en altamente específico.
En los últimos años se ha consolidado la certeza de que las alteraciones del metabolismo fosfocálcico explican una buena parte del elevado riesgo cardiovascular presente en la insuficiencia renal, al alterar morfológica y funcionalmente los grandes vasos en forma de calcificaciones vasculares, disfunción endotelial y rigidez arterial3. Si bien el FGF 23 podría representar sólo un marcador de carga de fosfato, hay claros indicios que sugieren una acción tóxica directa sobre el vaso4.
Aunque disponemos de una información limitada, los niveles relativos de FGF 23, calcio (Ca), P, PTHi y diversos metabolitos de la vitamina D3: 25 hidroxivitamina D (25 OHD3) y 1,25 dihidroxivitamina D (1,25 OHD3) son diferentes en cada momento evolutivo de la enfermedad renal crónica (ERC). En el tiempo se refleja la categorización de las influencias mutuas que gobiernan estos parámetros.
Planteamos un estudio transversal-descriptivo y analítico de estos parámetros en una amplia muestra de pacientes distribuidos en todo el espectro de la ERC.
MATERIAL Y MÉTODOS
Estudiamos pacientes afectos de ERC, visitados en nuestras consultas externas de Nefrología durante los últimos dos años. Excluimos aquellos pacientes con una nefropatía de rápida evolución o un síndrome nefrótico y los sometidos a tratamiento inmunosupresor.
El estudio de la función renal se realiza a través del cálculo del filtrado glomerular estimado (FGe) de acuerdo con la fórmula de CDK-EPI5. El estadiaje de la insuficiencia renal se ajusta a los cinco estadios definidos por las guías K/DOQI6. En el estadio 5 se desglosan las situaciones de prediálisis (5a) y de tratamiento sustitutivo en curso (5b).
Las muestras de sangre fueron extraídas y guardadas a –80 ºC hasta su análisis. La determinación de Ca y P se realiza por los procedimientos estándares en nuestro laboratorio: la PTHi por ECLIA (electrochemiluminiscence immunoassay, PTH Cobas®, de Roche), con un rango de normalidad de entre 15 y 65 pg/ml; la 25 OHD3 por ECLIA (vitamin D3 [25-OH] Cobas®, de Roche), con un rango de normalidad de entre 19,1 y 57,6 ng/ml, y la 1,25 OHD3 por método radioisotópico (DIAsource 1,25 [OH]2-VIT.D-RIA-CT®), con un rango de normalidad de entre 18 y 78 pg/ml. La molécula intacta de FGF 23 se midió con un ELISA de segunda generación (Kainos Laboratories, Japón). Los valores de FGF 23 son referidos a una muestra control de población sana formada por 136 individuos sanos, sin tratamiento alguno, de similar edad y distribución por sexo, con una media de 29,23 (desviación estándar: 8,3 ng/l).
Se obtuvo consentimiento informado de todos los pacientes y el estudio fue aprobado por el comité de ética del hospital.
Se utilizó estadística descriptiva y estadística analítica con test paramétricos y no paramétricos en función de la distribución de las diversas variables. Para evaluar la relación entre variables continuas, se utilizó el test de Spearman. Para la comparación de variables según los diferentes estadios de ERC, se utilizó ANOVA para un factor con test de Sheffe posterior. La relación bivariada entre las variables 1,25 OHD3, FGe y FGF 23 se modelizó basándose en modelos de regresión curvilínea. La relación asumida fue de tipo potencia: ln(y) = ln(b0) + (b1 ln(x)). Posteriormente, para el análisis de la relación entre la variable principal de interés (FGF 23) y el resto de las variables explicativas, se construyó un modelo lineal generalizado; las variables continuas que no tenían relación lineal con la variable principal (fósforo, 1,25 OHD3 y FGe) se recodificaron con el objetivo de linealizar esta relación. Para todos los análisis se consideró estadísticamente significativo un valor de p inferior a 0,05. Aplicamos el paquete estadístico SPSS versión 17 (SPSS, Chicago, IL, EE. UU.).
RESULTADOS
Estudiamos a 251 pacientes distribuidos entre los estadios 1 al 5 de ERC. Sus características demográficas, clínico-analíticas, su adscripción a una patología renal concreta y el tratamiento de las alteraciones del metabolismo fosfocálcico en curso se describen en la tabla 1. En una muestra de 26 individuos sanos obtenemos valores de referencia de FGF 23.
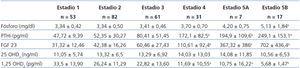
En la tabla 2 se reflejan los resultados de los diversos parámetros del metabolismo fosfocálcico en los distintos estadios de ERC.
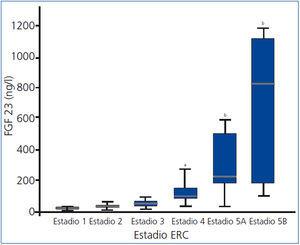
Los niveles de FGF 23 aumentan progresivamente (figura 1), alcanzando una diferencia significativa en el estadio 4 en relación con el estadio 1. Los niveles de FGF 23 en nuestra población de referencia son consistentemente más bajos.
La PTHi muestra un comportamiento similar al FGF 23, aumentando progresivamente hasta alcanzar una diferencia significativa en el estadio 4.
Los niveles de 1,25 OHD3 descienden en todo momento, pero, lastrados por una amplia variabilidad, no alcanzan significación estadística hasta el estadio 4.
No encontramos variaciones en los niveles de Ca ni de 25 OHD3 a lo largo de todo el espectro de disfunción renal. Los primeros son normales y los segundos consistentemente bajos en todo momento.
Los niveles de P no se modifican hasta el estadio 4, donde han aumentado en relación con el estadio 1.
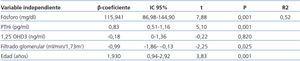
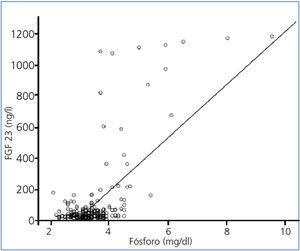
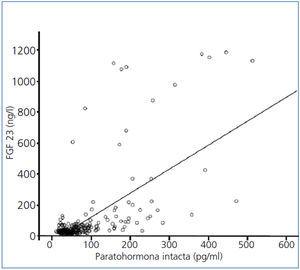
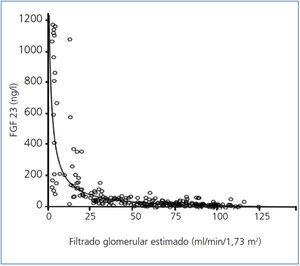
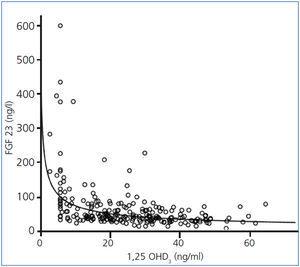
Los niveles de FGF 23 se correlacionan positivamente con los de P (figura 2) y PTHi (figura 3), y negativamente con los niveles de filtrado glomerular (FG) (figura 4) y de 1,25 vit D3 (figura 5).
En el análisis multivariado el P, la PTHi y el FG explican de una manera independiente hasta el 55% de la variabilidad de los niveles de FGF 23 (tabla 3).
Pocos son los pacientes con medicación activa (quelantes del P y derivados de la vitamina D); se concentran en el estadio 5 (tabla 1) y su exclusión no cambia los resultados.
DISCUSIÓN
El FGF 23 se ha descrito como un marcador independiente de progresión de insuficiencia renal crónica, también en los pacientes diabéticos7. Se relaciona de forma sólida con definidos elementos de riesgo cardiovascular, como la hipertrofia ventricular izquierda, la carga aterosclerótica y la disfunción vascular8. Presenta valores elevados según el grado de lesión coronaria y disfunción miocárdica9. En población incidente y prevalente en hemodiálisis10 expresa riesgo de morbimortalidad general, independiente de cualquier otra valoración del metabolismo fosfocálcico. En un amplio y reciente estudio, el FGF 23 se ha mostrado como un potente predictor de mortalidad en la ERC11.
De acuerdo con la literatura, los niveles de FGF 23 se incrementan progresivamente a lo largo de todo el espectro de la ERC, hasta multiplicar por 20 sus cifras en los pacientes sometidos a tratamiento sustitutivo. En el estudio más extenso publicado hasta el momento, 3879 pacientes en estadios de ERC entre el 2 y el 4, el FGF 23 alcanza un incremento significativo a partir de descensos del FG de 57,8 ml/min/1,73 m2 comparando con cifras de su población control12. Cuando el comparador es el estadio 1 de ERC, las diferencias se hacen significativas a partir del estadio 413, como en nuestro caso, o del estadio 314. En otros estudios se han encontrado incrementos valorables en estadios más precoces de ERC15. En estas fases ya existe una masa nefronal disminuida y las cifras elevadas de FGF 23 posibilitan una necesaria excreción urinaria incrementada de P16. En todo caso, la precocidad de estos incrementos hay que integrarla no sólo con la carga de P, sino también con las complejas relaciones entre el FGF 23 y la proteína klotho. Si la insuficiencia renal crónica es un estado de deficiente expresión de klotho, definirá una resistencia relativa a la acción del FGF 23, que incrementará necesariamente sus valores17, aunque, en sentido opuesto, se ha descrito que elevados niveles de FGF 23 modulan a la baja la expresión de klotho18.
Tal y como se cita en la literatura, encontramos unos aumentos de PTHi en apariencia paralelos a los de FGF 2319. Se han publicado evidencias experimentales que sitúan los incrementos de PTHi posteriores en el tiempo a los de FGF 23, refrendadas con datos clínicos más recientes20. En todo caso, en la patogenia del hiperparatiroidismo secundario el FGF 23 juega un importante papel junto con las alteraciones del sensor de Ca y del receptor de la vitamina D. El FGF 23 habilitado por klotho inhibe la síntesis de PTH. De forma similar a lo que ocurre en el riñón, las paratiroides del paciente con insuficiencia renal expresan menos klotho, de forma que el hiperparatiroidismo secundario puede considerarse un estado de resistencia relativa al FGF 2321. Sabemos que son necesarios ciertos niveles de PTH para la acción del FGF 23 en el hueso y en el riñón22. También conocemos que valores elevados de FGF 23 pueden favorecer la refractariedad al tratamiento del hiperparatiroidismo secundario23.
Los descensos progresivos de 1,25 OHD3, como los que hemos observado, han sido descritos ampliamente24. El efecto inhibitorio del FGF 23 sobre la α-1 hidroxilasa parece predominar sobre el estimulatorio ejercido por el incremento de PTH. Según nuestros datos, no parece probable que los descensos del 1,25 OHD3 se expliquen por los descensos de su sustrato, el 25 OHD3, al ser estos últimos muy anteriores y generalizados en todo el espectro de la ERC. Si bien la literatura recoge series sin correlación de niveles de las dos formas de vitamina D25, también encontraremos lo contrario26. Se ha sugerido que la toxicidad del FGF 23 podría estar mediada parcialmente por los déficits27 de 25 y/o 1,25 vit D3. En nuestra serie, los niveles de 25 vit D3 son bajos en todo momento, sin presentar, como en la amplia serie de Craver28, un descenso progresivo. Hemos realizado simultáneamente las determinaciones de 25 vit D3 con un único kit en muestras de seroteca. Si bien no podemos descartar que nuestros valores sean inapropiadamente bajos, sí podemos afirmar con rotundidad que no descienden con el avance de la insuficiencia renal. Una razón que apuntamos es el hecho de tener un porcentaje más alto de diabéticos en los primeros estadios de insuficiencia renal (en los grupos con un FG > 60 ml/min/1,73 m2 el porcentaje de diabéticos es del 57,4%; entre 30-60 ml/min/1,73 m2 es del 29,6%, y con FG < 30 ml/min/1,73 m2 es del 13%), pacientes estos en los que se ha reconocido una particular propensión29 al déficit de 25 vit D3.
El incremento tardío de la fosfatemia ha sido reconocido de forma universal30, y así lo han corroborado nuestros datos.
Si bien en el análisis univariado los aumentos de FGF 23 van paralelos a los descensos de 1,25 vit D3 (r = –0,40, p < 0,001), en el análisis multivariado los niveles del primero no tienen un condicionante independiente en los niveles del segundo. La literatura recoge múltiples conexiones fisiológicas y fisiopatológicas entre las dos sustancias, algunas de ellas directas y otras integradas con otros determinantes. Recordemos que la 1,25 OHD3 estimula la síntesis de FGF 23 por el osteocito31, imagen especular y cierre del círculo de retrocontrol del FGF 23 que inhibe la síntesis de 1,25 OHD3 por el riñón. En todo caso, el tratamiento del hiperparatiroidismo con calcitriol y posiblemente con sus análogos, a pesar de incrementar los niveles de FGF 2332, no deja, aunque pueda parecer paradójico, de mejorar el perfil de morbimortalidad de los pacientes tratados. Quizá sea importante el aumento en la expresión de klotho causado por la administración33 de 1,25 vit D3. Esta expresión podría incrementarse también con el bloqueo en la acción o en la síntesis de angiotensina II34. En todo caso, el uso simultáneo de quelantes, al dificultar la absorción intestinal de P, podría disminuir los incrementos de FGF 2335. Se han publicado datos muy favorables con sevelamer36 y recientemente con lantano37. También la combinación de cinacalcet con dosis bajas de vitamina D se ha mostrado especialmente favorable en modular los incrementos de FGF 2338. Todavía por llegar, los análogos de larga duración de la PTH podrían, al disminuir la expresión de los trasportadores de P renales (NPT2a/NPT2c), prevenir los incrementos de FGF 2339.
En nuestro trabajo, no creemos que altere en absoluto la validez de nuestros datos el peso de los pocos pacientes tratados con quelantes y/o vitamina D, especialmente concentrados en diálisis.
A los datos previos sobre el metabolismo fosfocálcico en la progresión de la ERC se han de añadir los propios del FGF 23. En conjunto, la tradicional hipótesis trade off que señala a la hipocalcemia y a la carga de P como los primeros motores de la disminución del 1,25 vit D3 y del aumento de la PTHi ha sido modificada con la llegada del FGF 23, que pugna por ser el primer actor que sale a escena40.
En los próximos años las guías, con mucha probabilidad, definirán un momento de inicio de tratamiento con quelantes del P muy anterior a la aparición de hiperfosfatemia, según los valores de FGF 23 o del incremento en la excreción urinaria de P41. El tratamiento de las alteraciones del metabolismo fosfocálcico en la insuficiencia renal va mucho más allá de la salud ósea y condiciona directamente la mejoría del perfil de morbimortalidad cardiovascular42.
Reconocemos como limitación más importante de nuestro estudio la falta de datos referida a la excreción urinaria de P.
En conclusión, los cambios de paradigma aportados por el conocimiento del papel fisiológico y fisiopatológico del FGF 23, incrementado y activo desde estadios muy tempranos de ERC, posiblemente nos obligarán a adoptar nuevas actitudes y tratamientos más precoces, todo ello en un intento de frenar el ritmo de progresión de la insuficiencia renal y minimizar su impacto como factor de riesgo cardiovascular.
Agradecimientos
Agradecemos a nuestras becarias Àngels López y Mirta Solà su colaboración.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Características de los pacientes
Tabla 2. Resultados según filtrado glomerular por CKD-EPI
Tabla 3. Factores asociados con el factor de crecimiento fibroblástico 23. Análisis multivariante
Figura 1. Niveles de factor de crecimiento fibroblástico 23 según estadio de enfermedad renal crónica
Figura 2. Correlación entre los niveles séricos de factor de crecimiento fibroblástico 23 y los niveles séricos de fósforo
Figura 3. Correlación entre los niveles séricos de factor de crecimiento fibroblástico 23 y los niveles séricos de paratohormona intacta
Figura 4. Correlación entre los niveles séricos de factor de crecimiento fibroblástico 23 y los niveles de filtrado glomerular estimado
Figura 5. Correlación entre los niveles séricos de factor de crecimiento fibroblástico 23 y los niveles séricos de 1,25 OHD3