Antecedentes: El embarazo en las pacientes con injerto renal se considera de alto riesgo. Objetivos: Identificar las complicaciones perinatales en las mujeres con trasplante renal atendidas en nuestra institución y compararlas con los reportes de la literatura nacional e internacional. Material y métodos: Se estudiaron las complicaciones perinatales de 18 pacientes con trasplante renal de las que se obtuvieron 19 recién nacidos, atendidas entre el 1 de enero de 2009 y el 31 de diciembre de 2010. Los resultados se compararon con reportes previos. Resultados: Edad materna: 28,27 ± 4,70 años, paridad: 2, intervalo del trasplante a la concepción: 7,52 ± 6,20 años, primera consulta prenatal a las 14,35 ± 6,74 semanas, seguimiento prenatal: 18,88 ± 9,18 semanas, 6 consultas prenatales, edad gestacional al nacimiento: 33,11 ± 8,72 semanas. Complicaciones maternas: operación cesárea: 88,88%, transfusión: 38,88%, anemia: 33,33%, ruptura prematura de membranas: 22,22%, parto pretérmino: 22,22%, infección del tracto urinario: 16,66%, preeclampsia: 11,11%, hipertensión arterial descontrolada: 11,11%, aborto: 11,11%, atonía uterina: 5,55%, diabetes gestacional: 0% y mortalidad: 0%. Complicaciones fetales: prematuridad: 52,63%, mortalidad: 21,05%, cuidados intensivos: 21,05% y bajo peso neonatal por restricción del crecimiento: 10,52%. Complicaciones del trasplante: deterioro de la filtración sin necesidad de diálisis: 5,55%, rechazo: 0% y pérdida del injerto: 0%. Conclusiones: Comparativamente, la frecuencia de las complicaciones perinatales fue elevada. El embarazo no tuvo efecto adverso sobre la función renal ni la supervivencia de las pacientes. El injerto renal estable en mujeres con edad fértil no es necesariamente una contraindicación para el embarazo.
Background: Pregnancy in patients with kidney grafts is considered high-risk. Objectives: Determine perinatal complications in women with kidney transplants treated by our hospital and compare them with complications reported in national and international literature. Material and Method: We studied perinatal complications in 18 patients with renal transplantation who delivered 19 newborns and were treated between 1 January 2009 and 31 December 2010. Results were compared with previous reports. Results: Maternal age: 28.27±4.70 years old, parity: 2, interval from transplant to conception: 7.52±6.20 years, first prenatal visit 14.35±6.74 weeks, prenatal care: 18.88±9.18 weeks, 6 prenatal visits, gestational age at birth: 33.11±8.72 weeks. Maternal complications: cesarean section: 88.88%, blood transfusion: 38.88%, anaemia: 33.33%, premature rupture of membranes: 22.22%, preterm delivery: 22.22%, urinary tract infection: 16.66%, preeclampsia: 11.11%, uncontrolled hypertension: 11.11%, miscarriage: 11.11%, uterine antony: 5.55%, gestational diabetes: 0%, and mortality: 0%. Foetal complications: premature birth: 52.63%, mortality: 21.05%, intensive care: 21.05%, and low birth weight due to growth restriction: 10.52%. Transplantation complications: filtration impairment without need for dialysis: 5.55%, graft rejection: 0%, and graft loss: 0%. Conclusions: The frequency of perinatal complications was high. Pregnancy had no adverse effect on renal function and patient survival. Stable renal grafts in women of childbearing age is not necessarily a contraindication for pregnancy.
INTRODUCCIÓN
Las mujeres con insuficiencia renal crónica terminal (IRCT) en edad reproductiva tienen mayor frecuencia de infertilidad y trastornos endocrinos adversos para la concepción1-4. El injerto renal exitoso puede corregir estos factores e incrementar las posibilidades de un embarazo5. El primer caso con trasplante (Tx) renal y embarazo se publicó en 1963 por Murray et al.6. Posteriormente, en 1976, Davison et al.7 propusieron la primera guía de consejería para el embarazo programado en este tipo de enfermas, la cual se ha modificado8-10.
Las recomendaciones actuales incluyen un tiempo de espera de al menos un año para las receptoras de un riñón de donante vivo relacionado (DVR) y de dos años en el caso de un donante vivo no relacionado (DV no R), creatinina sérica (Cr) < 177 mmol/l (< 2 mg/dl), preferentemente < 133 mmol/l (< 1,5 mg/dl), ningún episodio reciente de rechazo agudo ni evidencia de un rechazo en evolución, presión sanguínea normal o con un régimen antihipertensivo mínimo (una sola droga), proteinuria ausente o mínima (< 0,5 g/día), ultrasonido renal normal sin dilatación pielocalicial, consumo de dosis bajas de inmunosupresores (prednisona < 15 mg/día, azatioprina < 2 mg/kg/día, ciclosporina < 4 mg/kg/día, tacrolimus a dosis terapéuticas), el retiro de mofetil-micofenolato y sirolimus antes de la concepción, un estricto control prenatal y determinaciones periódicas de la concentración sanguínea de las drogas inmunosupresoras para ajustar las dosis basándose en los cambios fisiológicos de la gestación y de la función del injerto9-12.
Con el seguimiento de las recomendaciones de instituciones internacionales como la Food and Drug Admnistration (FDA) de Estados Unidos, además del uso de drogas a dosis bajas y la introducción de nuevos medicamentos, se ha logrado reducir la frecuencia de las complicaciones fetales en el nacimiento10-14 y de malformaciones congénitas, no así las complicaciones maternas15-18. Datos procedentes del National Transplantation Pregnancy Registry (NTPR) de Estados Unidos19, del registro de Tx y embarazo del Reino Unido20 y de los reportes de diversos países, como el de Cruz et al. de México21, Sgro et al. de Canadá22, Oliveira el al. de Brasil23, Kurata et al. de Japón24 y Fernández et al. de España25, han contribuido notablemente con sus resultados para el análisis del problema. El tratamiento de las complicaciones maternas, fetales y del Tx se debe individualizar actuando siempre con prontitud y con la participación de un equipo multidisciplinario19-26 incluyendo, después de la atención al parto, la práctica de algún método anticonceptivo por la posibilidad de un embarazo subsecuente27.
El objetivo del presente estudio fue identificar las complicaciones perinatales en las mujeres con Tx renal que son atendidas en nuestra institución y compararlas con los reportes de la literatura nacional e internacional.
MATERIAL Y MÉTODOS
Se estudiaron 18 mujeres embarazadas con Tx renal de las que se obtuvieron 19 recién nacidos, atendidas del 1 de enero de 2009 al 31 de diciembre de 2010 en el Hospital de Ginecología y Obstetricia N.º 3 del Instituto Mexicano del Seguro Social de la ciudad de México, un centro de atención terciaria para pacientes con embarazo de alto riesgo. A partir de la revisión de los expedientes se registraron los principales datos maternos, fetales, del injerto renal y las complicaciones perinatales.
Los datos maternos incluyeron edad, paridad, edad gestacional en la primera consulta prenatal, duración del seguimiento prenatal, edad gestacional en el momento del parto, número de consultas prenatales y de ingresos en el hospital, medicamentos del embarazo, causas de la atención al parto, tipo del parto (vaginal, histerotomía, operación cesárea) y el método anticonceptivo posparto.
Los datos fetales incluyeron el número de productos, peso, calificación de Apgar al primero y a los cinco minutos del nacimiento, edad neonatal evaluada con el método de Capurro y la supervivencia.
Los datos del Tx renal incluyeron la causa de la IRCT, tipo de donación (DVR, DV no R o donante cadáver [DC]), el tiempo del Tx a la concepción y del Tx al nacimiento, las dosis y las modificaciones de los medicamentos inmunosupresores, la frecuencia de la hipertensión arterial sistémica (HTAS) y de la proteinuria anormal (> 300 mg/día) y la uresis prenatal en 24 h. Para estimar la filtración del Tx se calculó la depuración de la Cr endógena (DCrE) a partir de la edad, el peso y el valor de la Cr utilizando la fórmula de Cockroft-Gault ([140 – edad (años) x peso (kg) / Cr x 72] 0,85). Se comparó la DCrE previa a la atención del parto con la de la primera consulta prenatal.
Las complicaciones perinatales se estudiaron como complicaciones maternas, fetales y del Tx renal. Las complicaciones maternas incluyeron aborto espontáneo, operación cesárea, ruptura prematura de las membranas (RPM), parto pretérmino (PP), anemia, transfusión, preeclampsia-eclampsia (P-E), descontrol de la HTAS, diabetes gestacional, infección del tracto urinario, complicaciones del parto y muerte materna. Las complicaciones fetales incluyeron la restricción del crecimiento fetal (RCF), sufrimiento fetal agudo (SFA), sufrimiento fetal crónico, insuficiencia respiratoria, necesidad de ingreso en la Unidad de Cuidados Intensivos Neonatales (UCIN), prematuridad (< 37 semanas), malformaciones congénitas y mortalidad. Se incluyeron como complicaciones del Tx renal el deterioro de la filtración (reducción de la DCrE), incremento de la proteinuria, episodios de rechazo, necesidad de practicar una biopsia, tratamiento antirrechazo en su caso, pérdida del injerto y requerimiento de diálisis.
Análisis estadístico
Se utilizaron medidas de tendencia central (media y mediana), de dispersión (rango, desviación estándar) y la prueba t de Student. Se consideró como significativo el valor p < 0,05.
RESULTADOS
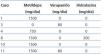
Datos maternos: La edad fue 28,27 ± 4,70 años (rango 20 a 36), paridad (mediana): 2 (rango 1 a 3), edad gestacional en la primera consulta prenatal: 14,35 ± 6,74 semanas (rango 5 a 25), duración del seguimiento prenatal: 18,88 ± 9,18 semanas (rango 0 a 33), edad gestacional en el momento del parto: 33,11 ± 8,72 semanas (rango 8 a 39), consultas prenatales (mediana): 6 (rango 1 a 11), ingresos en el hospital (mediana): 2 (rango 1 a 3), parto vaginal por aborto: 11,12% (2 casos), operación cesárea: 88,88% (16 casos) y complicaciones del parto: 5,55% (un caso por atonía uterina transitoria resuelta con tratamiento médico). Todas las pacientes recibieron ácido fólico y fumarato ferroso y el 33,33% (6 casos) recibieron medicamentos antihipertensivos (metildopa, hidralazina, verapamilo) durante el embarazo (tabla 1). En orden de frecuencia, las indicaciones de atención del parto fueron RPM: 22,23% (4 casos), PP: 22,23% (4 casos), aborto espontáneo incompleto: 11,11% (2 casos), P-E: 11,11% (2 casos), cesárea iterativa: 5,55% (1 caso), HTAS descontrolada: 5,55% (1 caso), SFA: 5,55% (1 caso), deterioro de la función del injerto: 5,55% (1 caso), baja reserva fetal: 5,55% (1 caso) y labor con embarazo de término: 5,55% (1 caso). Como método anticonceptivo se practicó la oclusión tubárica bilateral en 66,67% (12 casos) y la colocación de un dispositivo intrauterino en 27,78% (5 casos). En 5,55% (1 caso) hubo rechazo para cualquier método. No se prescribieron los métodos de barrera o la píldora.
Datos fetales: Se atendieron 19 recién nacidos (1 embarazo gemelar). La media del peso fue 2091,82 ± 786,65 g, calificación de Apgar (mediana) al primero y a los cinco minutos del nacimiento: 8-9, edad neonatal: 32,83 ± 9,02 semanas y supervivencia: 78,95% (15 casos).
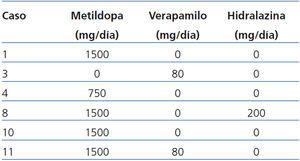
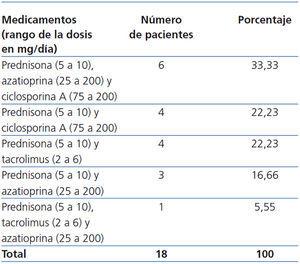
Datos del Tx renal: Las causas de la IRCT fueron: hipoplasia renal congénita: 44,45% (8 casos), glomerulopatía primaria: 33,33% (6 casos), glomerulonefritis posestreptocócica: 11,11% (2 casos) y nefropatía no determinada: 11,11% (2 casos). La mayoría de los riñones trasplantados procedieron de un DVR (44,45% [8 casos]), seguido de un DV no R (50% [9 casos]) y DC (5,55% [1 caso]). El tiempo del Tx a la concepción fue de 7,52 ± 6,20 años (rango 3 a 21). La mayoría fueron mujeres primigrávidas (61,11% [11 casos]), cuyo período de tiempo del Tx a la concepción fue de 7,59 ± 6,57 años (rango 3,94 a 21); las 7 enfermas restantes fueron multíparas (rango 2 a 3), con un período del Tx a la concepción de 7,40 ± 6,09 años (rango 3 a 20,95), similar al de las primigrávidas (p = 0,95). El tipo y la dosis de los fármacos inmunosupresores del Tx renal se muestran en la tabla 2. Como se puede observar, en el momento de la concepción 5 mujeres recibieron combinaciones de drogas que incluyeron tacrolimus, el cual se sustituyó por ciclosporina al conocer su estado de gravidez. La dosis del resto de los fármacos no se modificó, no se realizó la determinación de su concentración sanguínea en ningún caso. La frecuencia de HTAS fue del 33,33% (6 casos), y de la proteinuria anormal, 27,77% (5 casos). La media de la uresis prenatal fue 1994,59 ± 966,31 ml/24 h. La Cr de la primera consulta prenatal fue 1,10 ± 0,40, y la previa a la atención del parto, 1,23 ± 0,41 mg/dl (p = 0,36). La DCrE de la primera consulta prenatal fue 77,85 ± 29,60, y la previa a la atención del parto, 70,64 ± 20,85 ml/min/1,73 m2 SC (p = 0,40).
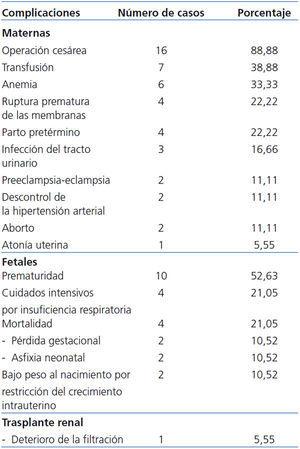
Complicaciones maternas: En orden de frecuencia, las complicaciones encontradas fueron: operación cesárea: 88,88% (16 casos), transfusión: 38,88% (7 casos), anemia: 33,33% (6 casos), RPM: 22,22% (4 casos), PP: 22,22% (4 casos), infección del tracto urinario: 16,66% (3 casos), P-E: 11,11% (2 casos), descontrol de la HTAS: 11,11% (2 casos), aborto: 11,11% (2 casos) y atonía uterina: 5,55% (1 caso). No se presentaron casos de diabetes gestacional ni de muerte materna (tabla 3).
Complicaciones fetales: La más frecuente fue la prematuridad (52,63% [10 casos]), seguida de la necesidad de UCIN por insuficiencia respiratoria (21,05% [4 casos]) y bajo peso al nacimiento por RCF (10,52% [2 casos]) (tabla 3). La mortalidad fue del 21,05% (4 casos; 2 casos por aborto [10,52%] y 2 casos por asfixia neonatal [10,52%]).
Complicaciones del Tx renal: Sólo se encontró reducción de la DCrE en 5,55% (1 caso). No se registraron casos de incremento de la proteinuria, episodios de rechazo, biopsias renales, pérdida del injerto o la necesidad de diálisis (tabla 3).
DISCUSIÓN
Con mucho, las complicaciones maternas superaron en frecuencia a las complicaciones fetales y del Tx renal. El impacto de las complicaciones maternas resultó mayor sobre el bienestar fetal, no así sobre la filtración del injerto, la cual prácticamente no se modificó. Aun cuando nuestras pacientes cursaban con edad madura similar a las de otras series20,21,25 y a pesar de que se logró un seguimiento prenatal acorde a las recomendaciones actuales9-12,19-26, sus características generales fueron los embarazos cortos (33,11 ± 8,72 semanas), la práctica de la operación cesárea en la gran mayoría de ellos (88,88%), la obtención de recién nacidos prematuros (52,63%) con bajo peso (2091,82 ± 786,65 g) y mortalidad fetal elevada (21,05%). El retraso de la referencia de las pacientes para su atención especializada (14,35 ± 6,74 semanas) y la comorbilidad elevada detectada al momento de la primera consulta prenatal a partir de HTAS (38,88%) y de proteinuria anormal (27,77%) posiblemente contribuyeron a la presentación de las complicaciones maternas, como se ha reportado en otras investigaciones19-21,23-25. La complicación materna más frecuente fue la operación cesárea: 88,88%, una cifra comparativamente mayor que la reportada por Cruz et al. (71,23%)21, NTPR (46 al 55%)19, Reino Unido (72%)20, Oliveira et al. (61,5%)23 y Kurata et al. (73,9%)24. A diferencia de otras series, no presentaron complicaciones urológicas del injerto por el crecimiento uterino28, ni de la técnica quirúrgica de la cesárea29 o del legrado uterino, practicado en 2 pacientes. Las complicaciones que le siguieron en frecuencia fueron la transfusión (38,88%) y la anemia (33,33% de los casos); aun cuando el 100% de las enfermas recibieron medicamentos hematínicos, el porcentaje de esta última fue elevado. Es importante señalar que para el tratamiento de la anemia se prefirió directamente la transfusión, y no la administración de eritropoyetina, a pesar de que el uso racional de este fármaco durante la gestación es considerado como un recurso útil y seguro4.
Complicaciones inherentes al embarazo tales como la RPM (22,22%), el PP (22,22%) y la infección del tracto urinario (16,66%) tuvieron porcentajes elevados y no podemos descartar que también hayan tenido un efecto adverso sobre la condición fetal. Lo mismo ocurre con la P-E y la HTAS descontrolada, encontradas ambas en el 11,11%, dos enfermedades cuyo efecto adverso sobre la gestación ha sido documentado ampliamente19-21,23-25, aun cuando su frecuencia resultó acorde a las investigaciones previas. La atonía uterina (5,55%), la única complicación del parto que encontramos, se interpreta más bien como circunstancial. En relación con las complicaciones fetales, la mortalidad elevada (21,05%), la necesidad de ingresar a los recién nacidos a la UCIN (21,05%) y el bajo peso al nacimiento por RCF (10,52%) se pueden explicar como secundarias al alto porcentaje de prematuridad (52,63%). A pesar de que la mayoría de los recién nacidos fueron prematuros y presentaron bajo peso al nacimiento, la supervivencia (78,94%) resultó acorde con los resultados de reportes previos19-21,23-25.
Respecto a las complicaciones del Tx renal, encontramos una reducción de la DCrE sólo en el 5,55% (1 caso). No se registró un incremento de la proteinuria aun en los casos con P-E ni hubo episodios de rechazo, necesidad de biopsia renal, pérdida del injerto o requerimientos de diálisis (tabla 3), y la media de la uresis diaria prenatal permaneció normal (1994,59 ± 966,31 ml/24 h), un valor que no pudimos comparar, ya que la literatura consultada no la describe19-21,23-25. Así, en nuestras pacientes, el embarazo no mostró un efecto adverso sobre la función del Tx, lo cual está acorde con lo reportado desde hace al menos una década30-34. Pudo haber influido en la conservación de la filtración del injerto renal la concurrencia de varios factores, tales como el tipo de donación, el Tx único, la ausencia de episodios de rechazo previos o en evolución al momento de la concepción, el tiempo prolongado del Tx a la concepción, las dosis estables de las drogas inmunosupresoras, el retiro de medicamentos potencialmente agresivos por otros de mayor seguridad, la Cr de la primera consulta en niveles bajos (1,10 ± 0,40 mg/dl), la DCrE basal normal o elevada (77,85 ± 29,60 ml/min/1,73 m2 SC) y un control médico prenatal satisfactorio30-34.
En nuestra serie, el 94,44% de las pacientes tenían un injerto renal a partir de un DVR o DV no R, y sólo el 5,56% de DC, a diferencia del registro del Reino Unido20 en el que el 80% (141 de 176 receptoras) habían recibido un riñón de DC, y de la serie de Fernández et al.25 en la que el 65,19% (25 de 39 casos) tenían un injerto de DC. Todas nuestras enfermas tuvieron Tx renal único, no así en la serie de Fernández et al.25, que incluyó 3 casos con dos injertos y 1 paciente embarazada trasplantada por tercera ocasión. En nuestra investigación encontramos que el tiempo del Tx a la concepción resultó más prolongado (7,52 ± 6,20 años) que el del registro de Gran Bretaña (6 años)20 y el de Fernández et al. (3,11 ± 1,05 años)25. No tuvimos casos con embarazo y Tx renal ≤ 1 año de evolución como se ha reportado en la literatura9,25. La evolución del Tx renal fue satisfactoria tanto en nuestras pacientes primíparas como en las multíparas (p = 0,95) de manera similar al reporte de Ehrich et al.35, quienes en 1996 encontraron que 99 de 102 mujeres receptoras de un injerto renal con embarazo exitoso habían tenido dos y hasta tres embarazos previos.
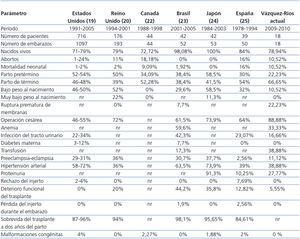
Comparamos nuestros resultados perinatales con los de dos reportes nacionales previos; el primero de Cruz et al.21, quienes estudiaron a 60 pacientes atendidas entre 1990 y 2005 en el Instituto Nacional de Perinatología (INPER), y el segundo de Romero et al.36, quienes estudiaron a 30 mujeres embarazadas con Tx renal atendidas entre diciembre de 1999 y abril de 2008 en el Hospital de Ginecología y Obstetricia N.º 4 (Dr. Luis Castelazo Ayala) perteneciente al Instituto Mexicano del Seguro Social; ambos, centros de atención terciaria de la ciudad de México similares al nuestro (tabla 4). Encontramos que nuestras pacientes tuvieron cifras parecidas respecto a la frecuencia del aborto, PP, labor con parto de término, HTAS, malformaciones congénitas y deterioro funcional del Tx. Nuestros porcentajes resultaron más altos respecto a la operación cesárea, RPM y la mortalidad neonatal, y fueron más bajos en relación con la frecuencia de recién nacidos vivos, bajo peso al nacimiento, infección del tracto urinario, P-E, proteinuria, episodios de rechazo y pérdida de la función del Tx. No pudimos comparar nuestros hallazgos de anemia, transfusión y diabetes gestacional, ya que los estudios citados no los reportaron.
En comparación con los reportes de la literatura internacional19,20,22-25, encontramos que nuestros resultados fueron similares en relación con la supervivencia fetal, aborto, bajo y muy bajo peso al nacimiento, mortalidad neonatal, HTAS, P-E, proteinuria, rechazo del Tx, pérdida del injerto durante el embarazo y malformaciones congénitas. Nuestras frecuencias fueron elevadas respecto al parto de término, RPM, operación cesárea y transfusión, y fueron más bajas respecto al PP, anemia, infección del tracto urinario, diabetes gestacional y deterioro de la función del Tx (tabla 5).
Más recientemente, Díaz et al.37 reportaron la evolución gestacional, del injerto y del neonato de 10 pacientes embarazadas trasplantadas de riñón cuya media de la edad fue 28,9 años, y del tiempo postrasplante, 44 meses. Todas recibían tratamiento inmunosupresor consistente en prednisona 5 mg/día y tacrolimus a dosis variables para conseguir niveles plasmáticos de 6 a 8 ng/ml. Las complicaciones maternas incluyeron: operación cesárea: 30% (3 casos), aborto del primer trimestre: 10% (1 caso), descontrol de la HTAS: 10% (1 caso), que requirió la administración de un segundo medicamento antihipertensivo, y preeclampsia: 10% (1 caso), que requirió de una operación cesárea urgente. La media del peso de los recién nacidos fue 2809 g y sólo dos de ellos presentaron prematuridad, ninguno desarrolló complicaciones de interés ni se encontraron malformaciones. La función del injerto renal no resultó afectada, la proteinuria se incrementó en el tercer trimestre aunque no representó un motivo de alarma y no se detectó ningún episodio de rechazo agudo.
Los resultados satisfactorios de este reporte han sido comentados ampliamente por Pallardó et al.38 en una revisión que incluyó el análisis y la comparación con los datos disponibles a partir de otras investigaciones, concluyendo que la diferencia de la frecuencia y la distribución de las complicaciones maternas, fetales y del Tx renal entre las series consultadas se puede explicar basándose en la diversidad de las características de las pacientes estudiadas y del Tx, la experiencia de los equipos multidisciplinarios, el avance de la moderna terapéutica inmunosupresora y de los cuidados obstétricos en las últimas décadas.
En este contexto, coincidimos en que todos estos factores, además del antecedente de que las principales series iniciaron el registro de sus pacientes hace 10 años o más, nos obligan a considerar la conveniencia de revisar periódicamente los resultados de los centros de atención especializada para las mujeres con Tx renal y embarazo.
CONCLUSIÓN
En la presente serie la frecuencia de las complicaciones perinatales en conjunto resultó elevada. El embarazo no tuvo efecto adverso sobre la función del Tx renal. El injerto renal estable en mujeres con edad fértil no es necesariamente una contraindicación para el embarazo.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Medicamentos antihipertensivos administrados durante el embarazo
Tabla 3. Complicaciones perinatales
Tabla 5. Comparación de la frecuencia de las complicaciones perinatales con los reportes de la literatura mundial
Tabla 4. Comparación de las complicaciones perinatales con reportes previos de dos centros de atención terciaria de la ciudad de México
Tabla 2. Tratamiento inmunosupresor durante el embarazo