La hipertensión arterial resistente (HTAR) supone un importante impacto a nivel multiorgánico e incrementa la morbimortalidad. Este trabajo evalúa la evolución de la lesión orgánica mediada por hipertensión en pacientes con HTAR tras añadir espironolactona.
Material y métodosEstudio retrospectivo de 58 pacientes con HTAR a quienes se añadió espironolactona (12,5-25mg/día). Se obtuvieron parámetros de presión arterial clínica y MAPA-24h, cociente albúmina/creatinina y datos ecocardiográficos previos a iniciar espironolactona y tras 12 meses de tratamiento.
ResultadosEl 36,2% de los pacientes eran mujeres y la edad media de 67,3±10,1 años. Se objetivó un descenso en albuminuria (mediana [RIC25-75]) de 27,0 (7,5-255,4) a 11,3 (3,1-37,8) mg/g (p = 0,009), siendo más marcado en pacientes con albuminuria grado A2 y A3: de 371,2 (139,5-797,4) a 68,4 (26,5-186,5) mg/g, p =0,02.. A nivel ecocardiográfico se evidenció: pared posterior: −1,0±0,4mm (p<0,001), tabique interventricular: −0,6±0,5mm (p=0,01), índice de masa del ventrículo izquierdo (VI): −14,7±10,2g/m2 (p=0,006), índice de remodelado del VI: −0,04±0,036 (p=0,03), sin cambios estadísticamente significativos en fracción de eyección VI, diámetro diastólico VI, diámetro sistólico VI, diámetro de aurícula izquierda, relación entre onda de llenado ventricular temprano y contracción auricular ni en índice de presión llenado VI.
La presión arterial clínica sistólica/diastólica presentó un descenso de −12,5±4,9/−4,9±3,0mmHg, p<0,001. En los MAPA-24h se observó un descenso significativo de presión arterial sistólica y diastólica en los períodos diurno y nocturno, y un cambio favorable en el patrón circadiano en el 38,1% de los pacientes, p<0,001.
ConclusionesAñadir espironolactona en HTAR contribuye a la reducción de la lesión orgánica mediada por hipertensión a nivel de albuminuria y de parámetros ecocardiográficos de cardiopatía hipertensiva.
Resistant hypertension (RH) represents an important multi-organic impact and increases the morbi-mortality. We aimed to evaluate the evolution of hypertensive mediated organ damage in patients with RH after adding spironolactone.
Material and methodsRetrospective study of 58 patients with RH who started spironolactone (12.5–25mg daily). Office blood pressure, 24-h ambulatory blood pressure monitoring (24h-ABPM), urine albumin-to-creatinine ratio and echocardiographic parameters were analyzed prior to initiation of spironolactone and after 12 months of treatment.
ResultsThirty-six percent of patients were women and mean age was 67.3±10.1 years. We observed a decrease in urine albumin-to-creatinine ratio (median [RIQ25–75]) of 27.0 (7.5-255.4) to 11.3 (3.1–37.8) mg/g, P = .009. This was more relevant in patients with albuminuria grade A2 and A3: 371.2 (139.5–797.4) to 68.4 (26.5–186.5) mg/g, P = .02. The echocardiographic changes were: posterior wall thickness: −1.0±0.4mm (P<.001), interventricular septal thickness: −0.6±0.5mm (P=.01), left ventricular (LV) mass index: −14.7±10.2g/m2 (P=.006), LV remodeling index: −0.04±0.036 (P=.03), without statistically significant changes in LV ejection fraction, LV end-diastolic diameter, LV end-systolic diameter, left atrial diameter, relationship between early ventricular filling wave and atrial contraction and LV filling pressure index.
Systolic/diastolic office blood pressure decreased −12.5±4.9/−4.9±3.0mmHg, P<.001. In 24h-ABPM, systolic and diastolic BP had a significant decrease in diurnal and nocturnal periods and 38.1% of patients presented a favorable change in the circadian pattern, P<.001.
ConclusionsAdding spironolactone to patients with RH contributes to improve hypertensive mediated organ damage by reducing albuminuria levels and echocardiographic parameters of hypertensive heart disease.
La hipertensión arterial resistente (HTAR) supone un importante problema de salud pública en la actualidad, tanto para médicos de atención primaria como para especialistas. Su prevalencia se estima entre un 10-20% de la población hipertensa tratada1–3 y estos pacientes presentan un riesgo más elevado de sufrir eventos cardiovasculares mayores causantes de morbimortalidad3,4.
Las guías de Práctica Clínica de la Sociedad Europea de Hipertensión y de la Sociedad Europea de Cardiología recomiendan el uso de espironolactona, antagonista del receptor de la aldosterona, como cuarto fármaco en pacientes con HTAR2. La eficacia antihipertensiva de espironolactona en pacientes con HTAR ha sido ampliamente confirmada en el control tanto de la presión arterial (PA) clínica como de la PA automedida en domicilio y de la monitorización ambulatoria de PA de 24h (MAPA-24h)5–7, aunque en pocos estudios se detalla la variación del patrón circadiano de la PA tras la introducción de espironolactona. Además, espironolactona tiene una acción beneficiosa en la reducción de la fibrosis miocárdica y del remodelado ventricular en pacientes con insuficiencia cardíaca (IC)8–10, y en la reducción de la proteinuria en pacientes con hipertensión y albuminuria patológica o nefropatía diabética11–13. La evidencia científica en cuanto a los beneficios cardíacos tras añadir espironolactona se centra sobre todo en pacientes con IC8–10. En concreto, los estudios en pacientes hipertensos se limitan a reportar la reducción de la masa ventricular izquierda14,15 siendo escasos o con muestras más reducidas los estudios centrados en pacientes con HTAR y que aporten más datos ecocardiográficos16. El objetivo de este estudio fue evaluar la evolución de la lesión orgánica mediada por la hipertensión (LOMH) a nivel cardíaco y renal en pacientes con HTAR tras añadir espironolactona al tratamiento antihipertensivo.
MétodosPoblaciónEstudio observacional retrospectivo de pacientes diagnosticados de HTAR a los que se añadió espironolactona al tratamiento antihipertensivo (dosis inicial de 12,5-25mg/día), atendidos en la Unidad de Hipertensión Arterial y Riesgo Vascular del Servicio de Nefrología del Hospital del Mar de Barcelona, desde abril 2016 a septiembre 2018 y con seguimiento posterior hasta enero 2020. El estudio fue aprobado por el Comité de Ética institucional local de acuerdo con la Declaración de Helsinki.
Los objetivos específicos fueron: (i) evaluar el efecto de espironolactona en la LOMH, de acuerdo con los parámetros ecocardiográficos y la albuminuria, a los 12 meses de su adición al tratamiento antihipertensivo; (ii) evaluar la eficacia de espironolactona en el control de la PA clínica y MAPA-24h, así como los cambios en el patrón circadiano de la PA; (iii) analizar si existen asociaciones entre los cambios de PA y los cambios en la LOMH tras añadir espironolactona.
Se incluyeron pacientes de edad igual o superior a los 18 años, diagnosticados de HTAR, definida de acuerdo con las guías de la Sociedad Europea de Hipertensión3 como PA>140/90mmHg a pesar de recibir tratamiento con al menos 3 fármacos antihipertensivos de diferentes clases terapéuticas incluido un diurético. Se confirmó el diagnóstico de HTAR mediante MAPA-24h (PA 24h>130/80mmHg).
Variables estudiadasSe evaluaron datos clínicos y de laboratorio en el momento inicial y a los 12 meses del comienzo de espironolactona. Se recogieron datos demográficos y de la historia clínica de los pacientes, incluyendo edad, sexo, índice de masa corporal y perímetro abdominal, presencia o ausencia de patologías concomitantes (enfermedad cardiovascular [cardiopatía isquémica, enfermedad cerebrovascular y enfermedad vascular periférica], diabetes mellitus tipo 2 [DM2], dislipidemia, enfermedad renal crónica [ERC] y síndrome de apnea obstructiva del sueño) y parámetros de laboratorio (filtrado glomerular estimado17, potasio y hemoglobina glucosilada [HbA1c] en plasma y excreción urinaria de albúmina [EUA] medida mediante cociente albúmina/creatinina en orina), antes de iniciar espironolactona y tras 12 meses de tratamiento. Se definieron los grados de albuminuria como A1 a la EUA inferior a 30mg/g, A2 la EUA entre 30-300mg/g y A3 la EUA superior a 300mg/g18.
Parámetros ecocardiográficosMediante ecocardiograma transtorácico validado utilizando transductores 2,0–4,0MHz mediante un sistema Vivid E9 (GE Healthcare) en modo bidimensional y Doppler color, con el paciente en decúbito supino y sin inclinación, se analizaron los siguientes parámetros: grosor de la pared posterior (PP), grosor del tabique interventricular (TIV), fracción de eyección del ventrículo izquierdo, índice de masa ventricular izquierda (IMVI), diámetro diastólico del ventrículo izquierdo (DDVI), diámetro sistólico del ventrículo izquierdo, índice de remodelado ventricular izquierdo (IRVI=2xPP/DDVI), diámetro de la aurícula izquierda, relación entre la onda de llenado ventricular temprano y la contracción auricular (E/A) e índice de presión de llenado ventricular izquierdo (Ee’). Estas determinaciones se llevaron a cabo en el momento basal y tras 12 meses de tratamiento con espironolactona, aproximadamente. Además, también se valoraron los patrones geométricos del ventrículo izquierdo (VI).
AlbuminuriaSe evaluó por método inmunonefelométrico, siendo expresada mediante el cociente albúmina/creatinina determinado en orina reciente de primera hora de la mañana. Los parámetros bioquímicos se obtuvieron con autoanalizadores utilizando métodos estándares. De nuevo, estas determinaciones se realizaron antes de empezar tratamiento con espironolactona y tras 12 meses.
Presión arterialSe determinó la PA clínica mediante un dispositivo semiautomático validado (Omron® 705IT) con manguito de tamaño adecuado al perímetro braquial de cada sujeto. En cada visita se realizaron 3 medidas de PA, espaciadas 1-2min, iniciadas tras 5min de reposo con el paciente sentado y se consideró como valor definitivo el promedio de las 3 medidas.
La PA mediante MAPA-24h se determinó por medio de un dispositivo semiautomático validado (Spacelabs 90207-5Q) con manguito de tamaño adecuado a cada paciente. La monitorización de PA se inició entre las 8-10h de un día laborable, con valores de PA sistólica (PAS) y PA diastólica (PAD) obtenidos cada 20min a lo largo de los períodos de vigilia y sueño. Estos períodos fueron definidos según las horas de sueño y despertar informadas por los pacientes durante el día de la prueba. Se requirió un mínimo del 80% de lecturas válidas para considerar el registro de buena calidad y aceptarse como válido.
Se recogieron datos referentes a los fármacos antihipertensivos prescritos en el momento basal y tras 12 meses del inicio de espironolactona. La adherencia al tratamiento fue evaluada por los datos autorreportados por el paciente, con revisión sistemática del mismo en cada visita.
Análisis estadísticoSe utilizaron medidas estadísticas de tendencia central, media aritmética (intervalo de confianza del 95% [IC 95%]) para las variables continuas y distribución de frecuencias para las variables discretas. Se utilizó la mediana (percentiles 25 y 75) para las variables continuas que no seguían una distribución normal. La variación de los parámetros de interés a los 12 meses del seguimiento se estudió mediante modelos lineales mixtos. Para evaluar el cambio experimentado por la albuminuria, parámetro de distribución no normal, se utilizó el test de Wilcoxon. Las correlaciones entre la diferencia en el tiempo de las PAS y PAD y los cambios en la LOMH se evaluaron mediante el coeficiente de correlación de Pearson.
Todos los análisis se ajustaron por las variables edad, sexo, índice de masa corporal, DM2 y filtrado glomerular estimado. Se consideraron resultados estadísticamente significativos los valores de p<0,05. Para el análisis estadístico se utilizó el programa STATA 15.1 (StataCorp, CollegeStation, TX, EE. UU.).
ResultadosSe incluyeron un total de 58 pacientes, con edad media de 67 años, la mayoría varones de raza caucásica, con alta prevalencia de dislipidemia y obesidad (tabla 1).
Características basales de los pacientes con hipertensión arterial resistente
| HTAR (n=58) | |
|---|---|
| Edad, años (media±DE) | 67,3±10,1 |
| Sexo varón, N (%) | 37 (63,8%) |
| Raza caucásica, N (%) | 54 (93,1%) |
| IMC, kg/m2 (media±DE) | 31,6 (4,8) |
| Perímetro abdominal, cm (media±DE) | 111,3±12,6 |
| Diabetes mellitus tipo 2, N (%) | 28 (48,3%) |
| Dislipidemia, N (%) | 41 (70,7%) |
| ERC grado 1, N (%) | 18 (31,0%) |
| ERC grado 2, N (%) | 24 (41,4%) |
| ERC grado 3A, N (%) | 8 (13,8%) |
| ERC grado 3B, N (%) | 8 (13,8%) |
| Albuminuria total, mg/g, mediana (RIC25-75) | 27,0 (7,5 - 255,4) |
| Albuminuria A2, N (%) | 10 (17,2%) |
| Albuminuria A3, N (%) | 10 (17,2%) |
| SAOS, N (%) | 23 (39,7%) |
| Cardiopatía isquémica, N (%) | 9 (15,5%) |
| Enfermedad cerebrovascular, N (%) | 7 (12,1%) |
| Vasculopatía periférica, N (%) | 4 (6,9%) |
Albuminuria A2: excreción urinaria de albúmina entre 30-300mg/g; Albuminuria A3: excreción urinaria de albúmina>300mg/g; DE: desviación estándar; ERC: enfermedad renal crónica; IMC: índice de masa corporal; SAOS: síndrome apnea obstructiva del sueño.
Antes de iniciar espironolactona, los pacientes recibían un promedio de 3,8±1,2 fármacos antihipertensivos: 100% un diurético (71,3% tiazídico y 28,7% de asa); 94,2% un bloqueante del sistema renina-angiotensina-aldosterona (84,5% ARA-II y 15,5% IECA); 87,9% un calcioantagonista; 60,7% un betabloqueante; 35,4% un alfabloqueante; 10,2% un simpaticolítico (clonidina o moxonidina); 3,4% un inhibidor directo de renina (aliskiren) y 2,4% un vasodilatador arterial (hidralazina).
La dosis diaria de espironolactona inicial (mediana [RIC25-75]) fue de 25mg (12,5-25) y de 25mg (12,5-37,5) a los 12 meses.
A nivel de seguridad renal se detectó una elevación significativa de potasio en 0,36±0,02mmol/l y un descenso del filtrado glomerular estimado en −6,0±1,0ml/min/1,73m2 a los 12 meses de tratamiento, p<0,05 en ambos casos.
Cambios en la lesión orgánica mediada por hipertensiónLa albuminuria presentó un descenso desde una mediana (RIC25-75) inicial de 27,0mg/g (7,5 a 255,4) hasta 11,3mg/g (3,1-37,8) a los 12 meses, p=0,009. En pacientes que basalmente presentaban albuminuria A2 o A3, esta reducción fue especialmente marcada: de 371,2mg/g (139,5-797,4) inicial a 68,4mg/g (26,5-186,5) final, p=0,02. El descenso de albuminuria no se correlacionó con un cambio de peso en los pacientes (variación de índice de masa corporal de+0,3kg/m2 tras 12 meses de seguimiento, correlación r=−0,20; p=0,2), ni con la variación de la HbA1c en pacientes con DM2 (variación de HbA1c de −0,05% tras 12 meses, correlación r=0,14, p=0,5). Ningún paciente se diagnosticó de nueva aparición de DM2 durante el estudio.
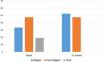
En cuanto a los parámetros ecocardiográficos (tabla 2), se objetivó una reducción en el grosor de la PP (media [IC 95%]) de −1,0mm (−1,4 a −0,6), p<0,001, del TIV en −0,6mm (−1,1 a −0,1), p=0,01, del IMVI de −14,7g/m2 (−24,9 a −4,4), p=0,006, y del IRVI en −0,04 (−0,08 a −0,004), p=0,03; sin hallarse cambios estadísticamente significativos en la variación de la fracción de eyección del ventrículo izquierdo, el DDVI, el diámetro sistólico del ventrículo izquierdo, el DAE, la E/A y el E/e’. Además, la proporción de pacientes con IMVI patológico (>95g/m2 en mujeres o>115g/m2 en hombres) se redujo del 72,4% en el momento inicial al 56.9% tras 12 meses de tratamiento con espironolactona (p<0,001). Respecto a los patrones geométricos del VI (fig. 1), inicialmente predominaba el patrón de hipertrofia concéntrica, presente en el 60,7% de los pacientes, prevalencia que disminuyó al 32,1% tras 12 meses de tratamiento (p<0,001). El patrón ecocardiográfico de VI normal fue el mayoritario a los 12 meses de tratamiento con espironolactona (37,5% de los pacientes), mientras que previamente al mismo era del 21,4%. Globalmente, el 21,4% de los pacientes presentó una mejoría en su patrón geométrico del VI inicial, p=0,001.
Variación de los parámetros ecocardiográficos tras 12 meses de tratamiento con espironolactona
| Parámetro | Basal | 12 Meses | p |
|---|---|---|---|
| PP (mm) | 12,4±2,0 | 11,4±1,7 | <0,001 |
| TIV (mm) | 13,0±2,1 | 12,4±1,8 | 0,01 |
| FEVI (%) | 63,6±9,0 | 62,8±7,5 | 0,4 |
| DDVI (mm) | 48,9±6,3 | 47,3±6,1 | 0,07 |
| DSVI (mm) | 29,3±6,1 | 28,2±4,5 | 0,2 |
| IMVI (g/m2) | 133,1±37,9 | 118,4±39,3 | 0,006 |
| IRVI | 0,53±0,10 | 0,49±0,10 | 0,03 |
| DAI (mm) | 39,8±5,8 | 41,3±5,8 | 0,05 |
| E/A | 0,88±0,22 | 0,91±0,36 | 0,5 |
| E/e’ | 9,5±4,5 | 9,9±5,4 | 0,6 |
DAI: diámetro de la aurícula izquierda; DDVI: diámetro diastólico del ventrículo izquierdo; DSVI: diámetro sistólico del ventrículo izquierdo; E/A: relación entre la onda de llenado ventricular temprano y la contracción auricular; E/e’: índice de presión de llenado ventricular izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; IMVI: índice de masa ventricular izquierda; IRVI: índice de remodelado ventricular izquierdo; PP: grosor de la pared posterior; TIV: grosor del tabique interventricular.
Respecto a la PA clínica, a los 12 meses de añadir espironolactona se observó una reducción significativa de la PAS de 152,0±16,0mmHg a 139,5±14,4mmHg y de la PAD de 83,1±13,4mmHg a 78,2±10,7mmHg, p<0,001 en ambos casos. Un 60,4% de los pacientes con control insuficiente de la PA clínica previo al inicio de espironolactona alcanzaron un control correcto (PAS≤140mmHg y PAD≤90mmHg) tras 12 meses de tratamiento. Este porcentaje resultó superior al analizar los cambios de PA de acuerdo con la MAPA-24h (se disponía de MAPA-24h inicial y final en 36 de los 58 pacientes). Así, en la tabla 3 se muestran los resultados obtenidos en los registros de MAPA-24h, observándose un descenso de PAS y de PAD tanto en el período diurno como en el nocturno. El 66,7% de los pacientes normalizaron la presión arterial (PAS 24h≤130mmHg y PAD 24h≤80mmHg) tras 12 meses de tratamiento. Referente a los patrones circadianos de la MAPA-24h (fig. 2), inicialmente predominaba el patrón non-dipper, en el 47,6% de los pacientes. Tras 12 meses de tratamiento, el patrón predominante fue el dipper (52,4%) y desapareció el patrón riser, p<0,001. El 38,1% de los pacientes presentó un cambio favorable en el patrón circadiano de PA (entendido como el cambio de riser a non-dipper, de riser a dipper o de non-dipper a dipper), p=0,002.
Variación de presión arterial por MAPA-24h tras 12 meses de tratamiento con espironolactona
| Pa | Basal | 12 Meses | p |
|---|---|---|---|
| PAS-24h (mmHg) | 147,1±14,3 | 135,0±17,4 | <0,001 |
| PAD-24h (mmHg) | 77,7±11,1 | 71,2±8,7 | 0,001 |
| PAS diurna (mmHg) | 150,3±13,7 | 138,2±18,2 | 0,001 |
| PAD diurna (mmHg) | 80,5±11,2 | 74,2±9,5 | 0,001 |
| PAS nocturna (mmHg) | 140,7±17,6 | 128,7±16,8 | 0,002 |
| pad nocturna (mmHg) | 71,5±11,2 | 65,1±8,2 | 0,002 |
MAPA-24h: monitorización ambulatoria de PA de 24h; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Cuatro pacientes (6,9%) presentaron inicialmente albuminuria A2 o A3, hipertrofia concéntrica del VI y patrón riser en el MAPA-24h. Tres de ellos mejoraron en los 3 parámetros de LOMH tras 12 meses con espironolactona, el cuarto presentó mejoría exclusivamente en el nivel de albuminuria.
Asociación entre los cambios de PA y los cambios en la LOMHLa reducción de albuminuria se correlacionó con el descenso de la PAD clínica obtenido tras la introducción de espironolactona: r=0,46; p=0,02. Al analizar por separado a los pacientes con albuminuria A1 y los que presentaban albuminuria A2 o A3 (fig. 3), se evidenció una correlación con la PAD con mayor poder estadístico: r=0,50 en el grupo con albuminuria A1 inicial (p=0,04) y r=0,88 en el grupo con albuminuria A2 o A3 inicial (p=0,01). No hallamos correlaciones entre la reducción de la albuminuria y el descenso de PAS clínica. Tampoco objetivamos correlaciones entre los cambios ecocardiográficos (PP, TIV, IMVI e IRVI) y el descenso de PAS o PAD clínicas. En los pacientes con albuminuria A2 o A3 en el momento inicial, la reducción de albuminuria se correlacionó con la reducción del grosor de la PP tras la introducción de espironolactona (r=0,40; p=0,04), pero no se halló correlación entre la reducción de albuminuria y los cambios del TIV, IMVI o IRVI.
Correlación entre la reducción de albuminuria y la reducción de PAD tras 12 meses de tratamiento con espironolactona en pacientes con albuminuria A2 o A3 inicial (A) y albuminuria A1 inicial (B).
Dif_Alb: diferencia entre albuminuria final e inicial; Dif_PADc: diferencia entre PAD clínica final e inicial; PAD: presión arterial diastólica.
El hallazgo principal de este estudio es la confirmación de que el uso de espironolactona en pacientes con HTAR reduce la LOMH a nivel cardíaco y renal. Los beneficios ecocardiográficos se han reproducido en la literatura sobre todo en pacientes con IC8–10, aunque los datos son más limitados en pacientes sin IC. Edwards et al.14 objetivaron una reducción de la masa ventricular izquierda en pacientes con ERC, y Pitt et al.15 demostraron también una reducción de la hipertrofia ventricular izquierda en pacientes hipertensos con eplerenona 200mg/día, pero los estudios centrados en pacientes con HTAR tratados con espironolactona son escasos. Gaddam et al.16 observaron una reducción de la masa ventricular izquierda, el TIV y el DDVI en pacientes con HTAR tras 6 meses de tratamiento con espironolactona 25-50mg/día, aunque la cohorte analizada era de tamaño muestral reducido (n=11) y siendo el seguimiento de 6 meses. Todos los estudios anteriores se centraron en la reducción en el porcentaje de pacientes con hipertrofia ventricular izquierda, sin aportar otros datos respecto a cambios en los parámetros ecocardiográficos. Por el contrario, en nuestro estudio se analizan los cambios en cada uno de los parámetros ecocardiográficos, y, de forma novedosa, se muestran los distintos patrones geométricos del VI y los cambios que experimentan tras el tratamiento con espironolactona (así, un 21,4% de los pacientes presentó una mejoría respecto al patrón geométrico del VI inicial).
En cuanto a la acción antiproteinúrica, el efecto beneficioso de espironolactona es similar al objetivado sobre todo en pacientes diabéticos o con ERC e hipertensión arterial11–13. En nuestro estudio se objetiva una mejoría de la albuminuria tras 12 meses de tratamiento con espironolactona en pacientes con HTAR en los que la prevalencia de DM2 y de ERC eran del 48% y del 27%, respectivamente, menores que en los estudios referenciados. Descartamos que la mejoría de la albuminuria estuviera relacionada con una pérdida de peso de los pacientes durante el estudio o con una mejoría significativa de la HbA1c en pacientes diabéticos. Además, objetivamos una correlación entre el descenso de la PAD conseguido tras introducir espironolactona y la reducción de la albuminuria, sugiriendo que el efecto antiproteinúrico de espironolactona debe estar relacionado con la eficacia antihipertensiva. Por el contrario, la mejora de los parámetros ecocardiográficos no se correlacionó con el descenso de la PA, por lo que podría tratarse de un efecto intrínseco del propio fármaco o a través de otros mecanismos no analizados aquí, como las modificaciones en el eje renina-angiotensina-aldosterona. Estos datos serían consistentes con la información previamente publicada respecto a los beneficios a nivel cardiológico y renal obtenidos al utilizar inhibidores de la enzima convertidora de angiotensina o antagonistas de los receptores de la angiotensina II19,20, fármacos que también interfieren con el sistema renina-angiotensina-aldosterona.
En todos los estudios citados anteriormente, la reducción de la LOMH se consiguió con una dosis inicial de espironolactona de 25-50mg/día y una posterior escalada de dosis hasta 50-100mg/día. En nuestro estudio, la dosis inicial de espironolactona fue de 12,5-25mg/día y la mediana final de 25mg/día, con lo que los beneficios de protección cardiovascular y renal de espironolactona se consiguieron con dosis aparentemente inferiores a las de estudios previos.
La eficacia antihipertensiva de espironolactona observada en este estudio es superponible a la de estudios previos5–7. Con relación al registro MAPA-24h, la reducción de la PAS y PAD en ambos períodos, diurno y nocturno, ya ha sido reportada6,7 con anterioridad, pero son escasos los estudios que detallan cómo varía el patrón circadiano de la PA tras añadir espironolactona. Nuestro estudio aporta datos sobre dichos cambios, observándose la conversión del 100% de pacientes con patrón riser a perfiles circadianos de menor riesgo cardiovascular tras 12 meses de tratamiento, así como una mejoría significativa del patrón circadiano según la MAPA-24h inicial en el 38,1% de los pacientes. Estos hallazgos contribuyen a una mejoría del perfil de riesgo cardiovascular de estos pacientes.
Las limitaciones principales del estudio incluyen el hecho de que se trata de un estudio observacional retrospectivo y unicéntrico. Además, la muestra queda limitada por el requerimiento de un ecocardiograma inicial y otro tras 12 meses de tratamiento con espironolactona, no siempre realizados en todos los pacientes de nuestra consulta a los que se añade este fármaco, por lo que solo se ha podido analizar un número de pacientes inferior al que realmente recibe espironolactona en nuestra práctica clínica real.
En conclusión, espironolactona es un fármaco eficaz en la reducción de la LOMH, esto es, cardiopatía hipertensiva y albuminuria, así como en la mejoría del patrón circadiano de PA en pacientes con HTAR, lo que contribuye a la mejora del perfil de riesgo cardiovascular de estos pacientes.
FinanciaciónEste estudio ha contado con financiación parcial del proyecto ISCIII - Subprograma RETICS, fondos FEDER y REDinREN RD16/0009/0013.
Conflicto de interesesLos autores declaran no tener conflicto de intereses relacionado con el contenido de este artículo.