Los pacientes con enfermedad renal crónica en hemodiálisis presentan gran comorbilidad cardiovascular. La enfermedad arterial periférica (EAP) se asocia a mayor mortalidad y ha incrementado el interés en su detección precoz y tratamiento. El objetivo del presente trabajo es determinar la frecuencia y gravedad de EAP sintomática, establecer su relación con la mortalidad en pacientes en hemodiálisis que han sido tratados precozmente y compararlos con una cohorte de nuestro centro ya reportada.
Material y métodosEstudio retrospectivo sobre una cohorte de todos los pacientes incidentes desde 2014 y seguidos hasta diciembre de 2019. Se recogieron datos demográficos, riesgo cardiovascular, la presencia de EAP sintomática basal y durante el seguimiento. Con la escala Rutherford se graduaron los síntomas o lesiones tróficas.
ResultadosInicialmente eran 91 pacientes y se perdió seguimiento de 7 casos que no incluyeron en el estudio. Edad 64±16 años, hombres 51,6% (47/91)). El porcentaje de EAP basal fue del 10,7% (9/84). Durante una mediana de seguimiento de 35 meses (20-57), el diagnóstico de EAP aumentó al 25% (21/84). La mitad de los enfermos con EAP (52,38% [11/21]) obtuvo una puntuación mayor de 3 de la clasificación clínica de Rutherford que corresponde con estadios severos. Requirieron reintervención por reaparición de los síntomas 13/21 pacientes (61,9% de los casos con EAP).
El desarrollo de EAP se asoció de forma significativa con la presencia de un índice de Charlson elevado (3,9±2,1 vs. 7,7±3,5; p:0,001), con ser varón (19 vs. 2; p=0,001), diabético (no: 7; sí: 15; p=0,001) y con el antecedente de cardiopatía isquémica crónica (no: 13; sí:8; p=0,001), de forma que un 38,1% (8/21) presentó cardiopatía isquémica en los pacientes que desarrollaron EAP mientras que en ausencia de EAP la presencia de cardiopatía isquémica fue de un 9,5% (6/63). Además, más de la mitad (66,7% [14/21]) de los que desarrollaron EAP eran diabéticos.
El análisis univariante mostró que la edad, la proteína C reactiva, la albúmina y el número de intervenciones quirúrgicas, pero no la EAP, se asociaban con la mortalidad. En el análisis multivariante ajustado por otros factores solo la proteína C reactiva, se relacionó con la supervivencia global Exp (β): 2,17; p=0,011; IC (1,19-3,97). Con respecto a la mortalidad cardiovascular, en el análisis multivariante de Cox, solo la EAP se relacionó con la mortalidad de origen cardiovascular Exp (β): 1,73; p=0,006; IC (1,17-2,56).
ConclusionesUn número significativo de paciente en hemodiálisis desarrollan EAP, requiriendo cirugía vascular periférica. La EAP no se asoció a mortalidad global en nuestra cohorte, pero mostró asociación con la mortalidad cardiovascular. Aunque son necesarios estudios prospectivos con mayor tamaño muestral, los nuevos tratamientos quirúrgicos y el seguimiento por los cirujanos vasculares podrían mejorar la gravedad de la EAP y el pronóstico a largo plazo.
Patients with chronic kidney disease on hemodialysis present high cardiovascular comorbidity. Peripheral arterial disease (PAD) is associated with higher mortality and the interest in its early detection and treatment is increasing. The objective of this study is to determine the frequency and severity of symptomatic PAD, and to establish its relationship with mortality in hemodialysis patients that have received treated early and compare them with a cohort of our center already reported.
Material and methodsRetrospective study on a cohort of incident patients since 2014 and followed up until December 2019. Demographic data, cardiovascular risk, the presence of symptomatic PAD at baseline and during follow-up were collected. Trophic lesions were graded using the Rutherford scale.
ResultsInitially, there were 91 patients and 7 cases that were not included in the study were lost to follow-up. Age 64±16 years, men 51.6% (47/91). The percentage of baseline PAD was 10.7% (9/84). During a median follow-up of 35 months (20–57), the diagnosis of PAD increased to 25% (21/84). Half of the patients with PAD (52.38% [11/21]) obtained a score greater than 3 in the Rutherford Clinical Classification, which corresponds to severe disease. 13/21 patients required reoperation due to recurrence of symptoms (61.9% of cases with PAD).
The development of PAD was significantly associated with the presence of an elevated index of Charlson (3.9±2.1 vs 7.7±3.5; P=.001) with being male (19 vs 2; P=.001), diabetic (no: 7; yes: 15; P=.001) and with a history of chronic ischemic heart disease (no: 13; yes: 8; P=.001), so that 38.1% (8/21) had ischemic heart disease in patients who developed PAD, while in the absence of PAD the presence of ischemic heart disease was 9.5% (6/63). Furthermore, more than half (66.7% [14/21]) of those who developed PAD were diabetic.
Univariate analysis showed that age, C reactive protein, albumin, and number of surgical interventions, but not PAD, were associated with mortality. In the multivariate analysis adjusted for other factors, only C reactive protein was related to overall survival Exp β: 2.17; P=.011; CI (1.19–3.97). Regarding cardiovascular mortality, in the multivariate Cox analysis, only PAD was related to mortality of cardiovascular origin Exp β: 1.73; P=.006; CI (1.17–2.56).
ConclusionsA significant number of patients on hemodialysis develop PAD requiring peripheral vascular surgery. PAD was not associated with overall mortality in our cohort, but it did show an association with cardiovascular mortality. Prospective studies with a larger sample size are necessary. New surgical treatments and follow-up by vascular surgeons could improve the severity of PAD and the long-term prognosis.
- •
La afectación cardiovascular y con ella la enfermedad arterial periférica (EAP) son importantes causas de mortalidad en población con enfermedad renal crónica en hemodiálisis.
- •
El ser varón, diabético, tener parámetros de inflamación y la presencia de cardiopatía isquémica se relacionan con la aparición de EAP.
- •
El seguimiento multidisciplinar y abordaje quirúrgico por los cirujanos vasculares se ha modificado en los últimos años, con disminución del número de amputaciones mayores.
- •
El seguimiento y abordaje precoz podría tener implicaciones en la reducción de la mortalidad.
- •
La persistencia de parámetros inflamatorios como la PCR conlleva mayor riesgo de mortalidad cardiovascular en pacientes en hemodiálisis y EAP.
La enfermedad renal crónica (ERC) es un factor de riesgo independiente para el desarrollo de enfermedad arterial periférica (EAP)1,2. La prevalencia de EAP en algunas series es de hasta el 25%3,4 y se ha asociado con la mortalidad cardiovascular, morbilidad, hospitalización y peor calidad de vida referida5–7.
Un factor que favorece la EAP en los pacientes en hemodiálisis (HD) es la calcificación vascular, debida no solo a la calcificación de la íntima secundaria a aterosclerosis, sino también por calcificación de la capa media. Esta es favorecida por una alteración del balance entre factores que favorecen la calcificación (como la trasformación osteoblástica de la célula muscular lisa, inducida principalmente por el incremento de fósforo e inflamación) y el descenso de factores inhibidores de la calcificación como la disminución de la fetuína A (proteína de unión a chaperonas que en condiciones normales inhibe la cristalización de partículas de fosfato cálcico llamadas calciproteínas)8,9.
El diagnóstico precoz de EAP supone un reto; se trata de conseguir el diagnóstico en aquellos que son asintomáticos para poder recibir un tratamiento adecuado. Desde 2017 las guías europeas para el diagnóstico y tratamiento de EAP han implementado la recomendación de cribado mediante la determinación del índice tobillo brazo (ITB) en población con ERC10–12.
En cuanto al tratamiento, la revascularización tras una isquemia crítica de miembros inferiores produce peores resultados en los pacientes con ERC que en aquellos que no la padecen13–15. En el programa Medicare de 1991 y 1994 2 tercios de los pacientes amputados que tenían ERC avanzada antes de necesitar terapia sustitutiva renal y una vez iniciada, fallecían en el transcurso de 2 años siguientes a la intervención. La tasa de amputación fue de un 4,8-6,2% en dicha población frente a un 4,3% de amputaciones en población sin ERC avanzada16,17.
En un metaanálisis de 2017, los hazard ratio para la aparición de EAP fueron de 1,22 y 2,06 para un TFGe de 45 y 15mL/min/1,73m2 respectivamente comparándolo con un TFGe de 95ml/min/1,73m2. Los factores de riesgo asociados a mortalidad fueron la enfermedad coronaria, cerebrovascular, demencia, ASA superior a 4, deterioro cognitivo y la presencia de enfermedad renal18.
Es importante conocer el beneficio de tratar precozmente a paciente con EAP en HD, por ello, el objetivo específico del presente estudio fue determinar la mortalidad global y cardiovascular de pacientes en HD con EAP sintomática tratados precozmente tras el desarrollo de nuevas técnicas quirúrgicas en los últimos años. Además, se comparan con los datos recogidos, previamente, en nuestro centro. Como objetivo secundario, se propuso evaluar otras variables: demográficas, inflamación y riesgo cardiovascular.
Material y métodosDiseño del estudioEstudio observacional retrospectivo de una cohorte compuesta por todos los pacientes mayores de 18 años que iniciaron tratamiento renal sustitutivo en HD en nuestro centro durante el año 2014, y fueron seguidos hasta diciembre de 2019.
Variables basales recogidasCausa de la enfermedad renal, el tipo de acceso vascular, la presencia de eventos cardiovasculares previos a la entrada en HD y factores de riesgo cardiovascular. Además, se recogieron parámetros analíticos de inflamación y nutrición incluyendo: colesterol, triglicéridos, albúmina, prealbúmina, proteína C reactiva y otros parámetros relacionados con la ERC como metabolismo fosfocálcico: (calcio, fosforo, parathormona, magnesio) y anemia (hemoglobina, índice de saturación de transferrina y prescripción de análogos de eritropoyetina). Además, se recogió la presencia de tratamiento anticoagulante o antiagregante. La comorbilidad quedó reflejada por el índice de Charlson, considerando comorbilidad leve: 0-1 puntos; baja: 2, y alta:>3.
Estudio de la enfermedad arterial periférica, definiciónBasalmente se recogió la presencia de EAP sintomática antes de iniciar HD y el grado de afectación. Al finalizar el estudio se recogió el desarrollo de EAP sintomática y el grado de afectación presentada a lo largo del seguimiento.
Se definió EAP sintomática como la presencia de síntomas (entendidos por claudicación de la marcha referida por el paciente) o la presencia de isquemia crítica de miembros inferiores (por la presencia de dolor en reposo, lesiones tróficas, pérdida tisular o gangrena). Se utilizó la clasificación de Rutherford para evaluar el grado de afectación. Así, las categorías 1-3 se corresponden con clínica de claudicación de leve a severa, y a partir de grado 4 a 6, se agrupan las categorías donde se plantean inicio de intervención por presencia de dolor en reposo o pérdida tisular. De esta forma: la categoría 1 corresponde a claudicación leve; la categoría 2 es claudicación moderada y la categoría 3 es claudicación severa. La presencia de dolor en reposo corresponde a la categoría 4, la categoría 5 con pérdida tisular menor y la categoría 6 es gran pérdida tisular definida por úlceras isquémicas severas o gangrena.
Variables recogidas al finalizar el seguimientoDurante el seguimiento se recogieron variables de mortalidad y evolución de los pacientes que incluyeron: el desarrollo de EAP sintomática en los pacientes de la cohorte, el tratamiento y número de intervenciones recibidas, en aquellos que requirieron reintervención y cuántos continuaron seguimiento por cirugía vascular periférica (CVP). Además de la situación actual (si continuaron en diálisis, si recibieron trasplante, pérdida de seguimiento o si se produjo el fallecimiento) y en qué casos la mortalidad fue de causa vascular. También, se documentó la puntuación Rutherford tras finalizar el seguimiento.
Análisis estadísticoEn el análisis descriptivo, las variables cuantitativas se presentan como media±desviación estándar, y las categóricas mediante frecuencias y porcentaje.
Para el contraste de hipótesis en las tablas cruzadas, según la variable cualitativa se ha empleado Chi cuadrado, y para las tablas cruzadas cualitativa-cuantitativa el test t de Student. Para la comparación múltiple, se utilizó el análisis de supervivencia medida por Kaplan-Meier y análisis de regresión de Cox.
Se consideró hallazgo significativamente estadístico una p<0,05, e IC 95%. Para el análisis y procesamiento de los datos utilizamos el programa estadístico SPSS V17.0 (Chicago, Illinois®, EE. UU.)
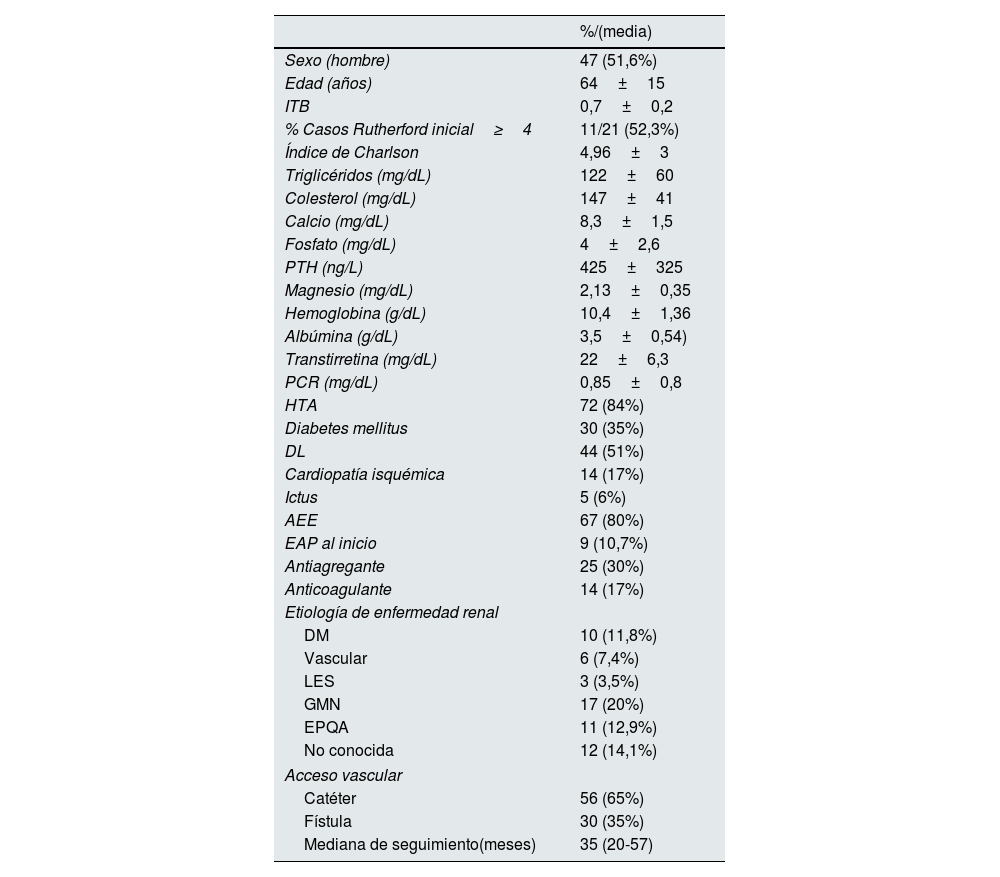
ResultadosCaracterísticas basalesLa población estaba compuesta por un total de 91 pacientes, se perdió seguimiento en 7 pacientes y quedaron un total de 84. Un 51,6% eran varones con una edad media de 64±15 años. La mediana de seguimiento fue de 35 (20-57) meses.
Las características basales y datos bioquímicos de la población de estudio se muestran en la tabla 1. Al inicio de seguimiento un 10,7% (9/84) presentaban EAP. Hasta un tercio de los pacientes de la cohorte (29,7% [25/84]) recibía tratamiento antiagregante y 14/84 (17%) se encontraban anticoagulados. La puntuación media del índice de Charlson era de 4,98±3, y en el 77% de los pacientes la puntuación era≥3.
Características basales de la población estudiada
| %/(media) | |
|---|---|
| Sexo (hombre) | 47 (51,6%) |
| Edad (años) | 64±15 |
| ITB | 0,7±0,2 |
| % Casos Rutherford inicial≥4 | 11/21 (52,3%) |
| Índice de Charlson | 4,96±3 |
| Triglicéridos (mg/dL) | 122±60 |
| Colesterol (mg/dL) | 147±41 |
| Calcio (mg/dL) | 8,3±1,5 |
| Fosfato (mg/dL) | 4±2,6 |
| PTH (ng/L) | 425±325 |
| Magnesio (mg/dL) | 2,13±0,35 |
| Hemoglobina (g/dL) | 10,4±1,36 |
| Albúmina (g/dL) | 3,5±0,54) |
| Transtirretina (mg/dL) | 22±6,3 |
| PCR (mg/dL) | 0,85±0,8 |
| HTA | 72 (84%) |
| Diabetes mellitus | 30 (35%) |
| DL | 44 (51%) |
| Cardiopatía isquémica | 14 (17%) |
| Ictus | 5 (6%) |
| AEE | 67 (80%) |
| EAP al inicio | 9 (10,7%) |
| Antiagregante | 25 (30%) |
| Anticoagulante | 14 (17%) |
| Etiología de enfermedad renal | |
| DM | 10 (11,8%) |
| Vascular | 6 (7,4%) |
| LES | 3 (3,5%) |
| GMN | 17 (20%) |
| EPQA | 11 (12,9%) |
| No conocida | 12 (14,1%) |
| Acceso vascular | |
| Catéter | 56 (65%) |
| Fístula | 30 (35%) |
| Mediana de seguimiento(meses) | 35 (20-57) |
AEE: agentes estimulantes de la eritropoyesis; DL: dislipidemia; DM: diabetes mellitus; EAP: enfermedad arterial periférica; EPQA: enfermedad poliquística del adulto; GMN: glomerulonefritis; HTA: hipertensión arterial; ITB: índice tobillo brazo; LES: lupus eritematoso sistémico; PCR: proteína C reactiva; PTH: parathormona.
Basalmente el 10,7% (9 pacientes) presentaba EAP. Este porcentaje aumentó a 25% (21/84 pacientes) al finalizar el estudio. La mayoría de ellos (18 pacientes) permaneció en seguimiento en consulta de CVP. La progresión de la afectación vascular se manifestó mediante la clasificación de Rutherford, recogida al diagnóstico y tras el seguimiento (tabla 2). En el momento de la aparición de la EAP sintomática, 11/21 (52,3%) tenían una puntuación>3 que se corresponde con estadios más severos y suelen implicar intervención. En el seguimiento, el porcentaje de pacientes clasificados con Rutherford>3 no se modificó, y solo 3/21 pacientes con EAP mostraron una progresión en su puntuación de Rutherford al final del seguimiento respecto al inicio de EAP sintomática (tabla 2).
Escala de Rutherford
| Clasificación | Rutherford al inicio de EAP (n=21) | Rutherford final (n=21) | |
|---|---|---|---|
| 0 | Asintomático | 2 (9,5%) | 3 (14,28%) |
| 1 | Claudicación leve | 4 (19%) | 3 (14,28%) |
| 2 | Claudicación moderada | 1 (4,76%) | 2 (9,5%) |
| 3 | Claudicación severa | 3 (14,28%) | 2 (9,5%) |
| 4 | Dolor en reposo | 1 (4,76%) | 1 (4,76%) |
| 5 | Pérdida tisular menor | 8 (38,09%) | 8 (38,09%) |
| 6 | Pérdida tisular mayor | 2 (9,5%) | 2 (9,5%) |
EAP: enfermedad arterial periférica.
Tan solo se dispuso de ITB en 7 pacientes, con un valor medio al diagnóstico de EAP de 0,86±0,18 y la puntuación media de ITB tras seguimiento fue 0,74±0,32, por lo que no fue posible el análisis de la EAP asintomática.
El desarrollo de EAP se asoció de forma significativa con la presencia de un índice de Charlson elevado (no: 2; sí: 19; p=0,001), con ser varón (no: 2, sí: 19, p=0,001), diabético (no: 7; sí: 14; p=0,001) y con el antecedente de cardiopatía isquémica crónica (no: 13; sí: 8 p=0,001), de forma que un 38,1%(8/21) presentó cardiopatía isquémica en el grupo que desarrollo EAP; sin embargo, en ausencia de EAP la presencia de cardiopatía isquémica se observó en un 9,5% (6/63). Más de la mitad (66,7% [14/21]) de los que desarrollaron EAP eran diabéticos.
Tratamiento intervencionistaTras el diagnóstico de EAP, inicialmente se realizaron 9 intervenciones quirúrgicas: 5 amputaciones menores, una angioplastia femorofemoral, un bypass femoropoplíteo, un bypass femorofemoral y una amputación mayor. En el seguimiento, 13 pacientes (62%) presentaron de nuevo síntomas de EAP y se requirió reintervención en 3 pacientes en varias ocasiones, ascendiendo el total a 18 intervenciones. La amputación menor continuó siendo la intervención más frecuente. Solamente se contabilizó un caso de amputación mayor, el resto recibió tratamiento médico.
EvoluciónLa mediana de seguimiento de todos los pacientes desde el inicio de HD en 2014 fue de 35 meses (20-57 meses). Durante este tiempo la mortalidad en la unidad de diálisis fue 30/84 pacientes (35,7%), el 40,5% (34/84) recibió trasplante, el 20,2% (17/84) permaneció en diálisis, y en el 3,6% (3/84) se perdió el seguimiento.
La mortalidad de origen cardiovascular ocurrió en 13 pacientes, lo cual supuso un 43% de la mortalidad total. Ninguno de los 3 pacientes que requirieron reintervenciones falleció durante el seguimiento.
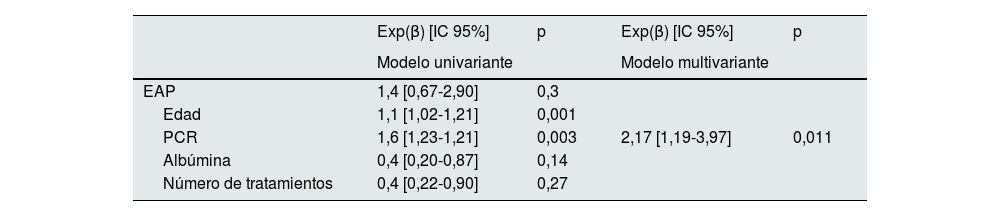
En el análisis univariante la edad, la proteína C reactiva (PCR), la albúmina y el número de tratamientos recibidos, pero no la EAP, se asociaron con la mortalidad total. En el análisis multivariante tras ajuste por otros factores, solo la PCR se relacionó con la mortalidad. Exp (β): 2,17; p=0,011; IC: 1,19-3,97 (tabla 3).
Modelo de Cox para análisis de supervivencia global. (Ajustado por factores EAP, edad, PCR, albúmina, número de tratamientos)
| Exp(β) [IC 95%] | p | Exp(β) [IC 95%] | p | |
|---|---|---|---|---|
| Modelo univariante | Modelo multivariante | |||
| EAP | 1,4 [0,67-2,90] | 0,3 | ||
| Edad | 1,1 [1,02-1,21] | 0,001 | ||
| PCR | 1,6 [1,23-1,21] | 0,003 | 2,17 [1,19-3,97] | 0,011 |
| Albúmina | 0,4 [0,20-0,87] | 0,14 | ||
| Número de tratamientos | 0,4 [0,22-0,90] | 0,27 |
EAP: enfermedad arterial periférica; IC: intervalo de confianza; PCR: proteína C reactiva.
PCR con asociación con mortalidad cardiovascular 2,17; IC: 1,19-3,97; p=0,011.
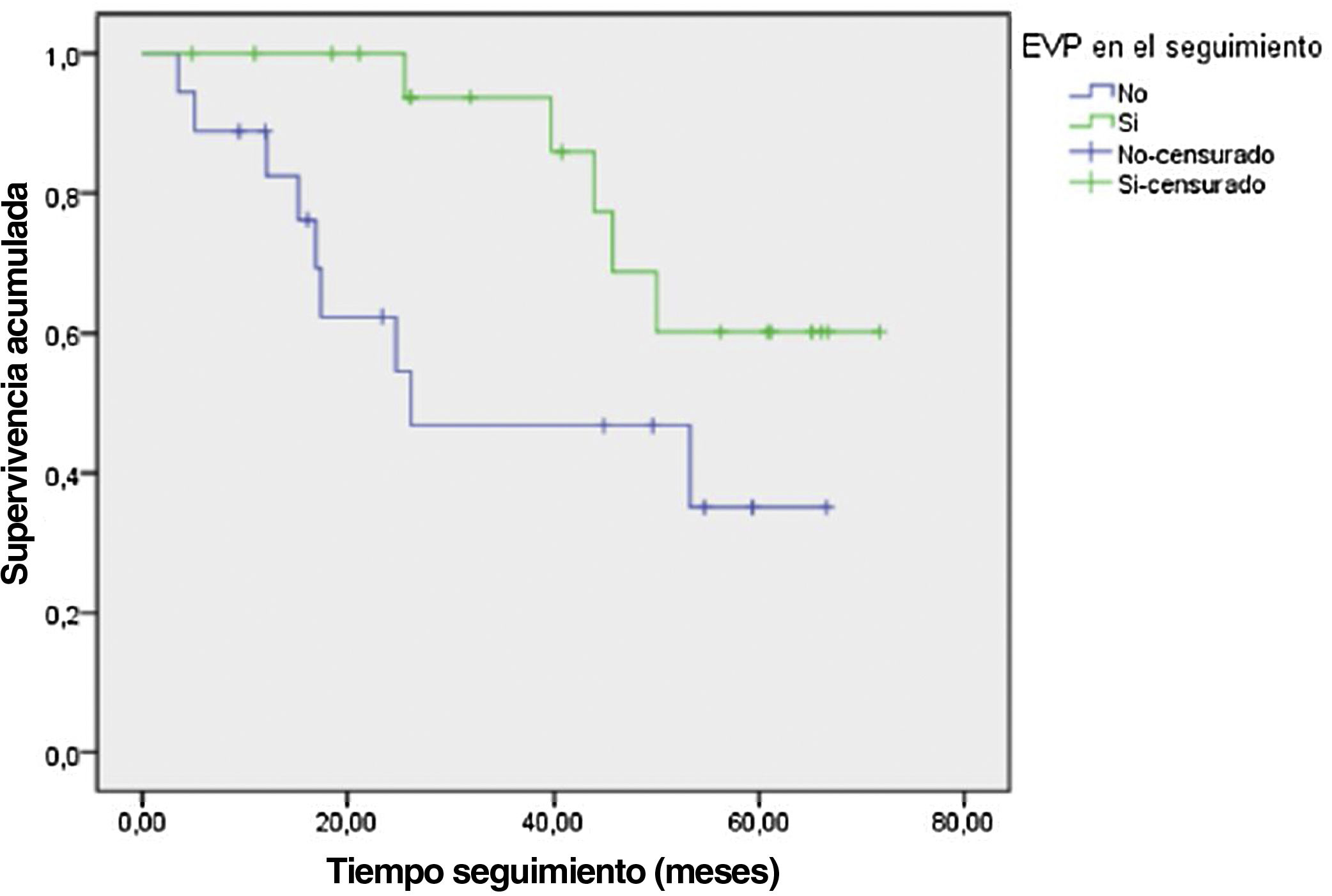
Con respecto a la mortalidad cardiovascular, en el análisis multivariante de Cox, solo la EAP se relacionó con la mortalidad de origen cardiovascular: Exp (β): 1,73; p=0,006; IC: 1,17-2,56 (fig. 1).
DiscusiónPresentamos los resultados de nuestro estudio sobre pacientes incidentes en HD en el que hemos detectado que un 10,7% inicia tratamiento renal sustitutivo con EAP, y a lo largo de 35 meses de seguimiento lo desarrolla un 14,3% adicional. De esta forma, un cuarto de nuestra población en HD (25%) desarrolla EAP. Por tanto, se trata de una patología que sigue siendo frecuente en diálisis.
La población en HD presenta mayor riesgo de calcificación vascular y de EAP. La frecuencia en pacientes prevalentes en diálisis muestra un rango variable en parte explicable por una tendencia al infradiagnóstico, que oscila entre el 25 y el 40% con implicaciones en la morbimortalidad y calidad de vida4,19.
En un trabajo previamente publicado por nuestro grupo en 220 pacientes prevalentes en HD seguidos retrospectivamente desde 2001 a 2005, el desarrollo de EAP se asoció con mayor edad, estado de diabetes mellitus, Charlson, prealbúmina y PCR. La prevalencia de EAP en este trabajo fue de 39,5% (87/220) y se asoció de forma independiente con la mortalidad al final de seguimiento, en el que el 55,2% (48/87) había fallecido. Se realizaron 5 amputaciones mayores, 4/5 de las cuales fallecieron20.
Entonces, pese a la elevada prevalencia, el porcentaje de pacientes que recibían algún tipo de tratamiento intervencionista era tan solo de un 5%, y estaba representado prácticamente en su totalidad por la amputación mayor. El 95% restante recibía únicamente tratamiento médico, y no siempre de manos de CVP, sino que con frecuencia se limitaba a manejo en el centro de diálisis o en el centro de salud20.
En comparación con nuestro trabajo previo de pacientes en HD prevalentes con EAP, el trabajo actual se centra en pacientes incidentes. Teniendo esto en cuenta observamos una prevalencia algo menor del 25%. En cambio, en la cohorte actual, 9/21(42,8%) requirieron intervención quirúrgica inicial frente a tan solo el 5% del trabajo previo y la mayoría continuaron seguimiento por CVP. En nuestro actual trabajo tan solo hubo una amputación mayor, respecto a las 5 del trabajo previo. Y ni las reamputaciones menores ni la mayor tuvieron un impacto negativo en la supervivencia en la cohorte actual.
Estudios previos han relacionado peores resultados de EAP en HD tras revascularización quirúrgica y/o amputación18,20. Probablemente la principal explicación de esta asociación se deba no al tipo de tratamiento, sino al retraso en el diagnóstico. En nuestra opinión el hecho de que en el actual estudio la EAP no se asocie con la mortalidad global y sí con la cardiovascular podría relacionarse con el seguimiento estrecho por parte de CVP de la práctica totalidad de los pacientes, lo cual permite detectar la enfermedad precozmente, aplicar diversos tratamientos y evaluar posteriormente su efectividad. Muchos de nuestros pacientes recibieron tratamiento intervencionista en lugar de tratamiento médico, y sin embargo solo en una ocasión fue necesaria la amputación mayor.
En la clasificación de Rutherford utilizada para graduar los síntomas o presencia de lesiones tróficas en el momento de aparición de la EAP sintomática, casi la mitad de los pacientes obtuvo una puntuación superior a 3, correspondiente con estadios más severos. Durante el tiempo de seguimiento, la EAP se mantuvo estable. No se apreció ningún caso de empeoramiento de la categoría de Rutherford; esto es debido a la detección precoz de infecciones o úlceras susceptibles de tratamiento en el seguimiento por CVP.
En cuanto a los tratamientos intervencionistas, inicialmente se llevaron a cabo en 9 casos, con reaparición de los síntomas en el 56%, con un total de 18 intervenciones. La intervención más frecuente tanto de novo como en reintervención fue la amputación menor, y tan solo en un caso se requirió amputación mayor.
El precisar una reintervención como una revascularización percutánea o angioplastia no se asoció con la mortalidad, por lo que no parece conllevar un resultado negativo en términos de supervivencia. Podría permitir un beneficio de tratamientos intermedios con mejora en su calidad de vida y funcionalidad. Sin embargo, creemos que el limitado tamaño muestral no permite correlacionar la reintervención con la mortalidad.
El perfil del paciente que desarrolla EAP no ha cambiado sustancialmente en los últimos años, ya que en nuestra serie se ha asociado significativamente con el hecho de ser varón, con antecedente de cardiopatía isquémica, la presencia de diabetes mellitus y un índice de Charlson elevado.
Tan solo la PCR elevada se asoció de forma significativa con la mortalidad global, sin hallar asociación con ningún tipo de evento cardiovascular, por lo que fundamentalmente el estado inflamatorio elevado es el que ha influido en la mortalidad. Tampoco se asocia a la edad, probablemente porque estudiamos una muestra incidente con una edad media no excesivamente alta. Sin embargo, aunque no observamos que la EAP influya de forma significativa con la mortalidad general, sí mostró una asociación clara e independiente con la mortalidad cardiovascular.
Como limitación a nuestro estudio se incluyeron los casos con EAP sintomática dada la dificultad de la detección de EAP asintomática, puesto que tan solo se dispuso de ITB en 7 casos, dato que hubiese dado información complementaria. Sin embargo, la principal fortaleza es haber incluido a todos los pacientes incidentes en HD durante un periodo de 12 meses, con un seguimiento de 5 años y con recogida de todos los eventos que han tenido en este periodo.
Por tanto, podemos concluir que en la actualidad ha aumentado el intervencionismo precoz de los pacientes con EAP sintomática con respecto a hace 10 años. En nuestra cohorte, un importante porcentaje de pacientes desarrolló EAP, requiriendo actuación por CVP. Así, los nuevos tratamientos y el seguimiento por los cirujanos vasculares podrían mejorar el pronóstico de estos pacientes.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesSin conflictos.