La enfermedad antimembrana basal glomerular (EMBG) es un trastorno autoinmune caracterizado por la presencia de anticuerpos antimembrana basal glomerular (AMBG), hemorragia pulmonar, glomerulonefritis necrotizante y depósito lineal de inmunoglobulinas en inmunofluorescencia directa. La predisposición genética, entre otros factores, posee un papel importante en el desarrollo de la enfermedad. Estudios previos han demostrado que el antígeno leucocitario humano (HLA), HLA-DR15 y HLA- DR4, se asocian con mayor riesgo de presentarla, mientras que el HLA-DR1 y HLA-DR7 han demostrado ser factor de protección frente a su desarrollo.
Describimos el primer caso de dos hermanos no gemelos con EMBG con tipaje HLA idéntico, con factor de riesgo HLA-DR4 y factor de protección HLA-DR7. Planteamos la importancia de analizar el tipaje de histocompatibilidad en hermanos de pacientes con EMBG, para determinar el grado de susceptibilidad genética y plantear en ellos un seguimiento estrecho, con el objetivo de lograr un diagnóstico y tratamiento precoces en caso de presentar la enfermedad.
Anti-glomerular basement membrane disease (AGBM) is an autoinmune disorder characterized by the presence of anti-glomerular basement membrane (anti-GBM) antibodies, alveolar hemorrhage, necrotizing glomerulonephritis, and linear deposition of immunoglobulins through direct inmunofluorescence. Genetic predisposition, among other factors, plays an important role in the development of the disease. Previous studies have shown that HLA-DR15 and HLA-DR4 increase the risk of presenting it, while HLA-DR1 and HLA-DR7 protect against its development.
We describe the first case of two non-twin siblings with AGBM and identical HLA, with HLA-DR4 as risk factor and HLA-DR7 as protection factor. We propose the importance of analyzing HLA in siblings of patients with AGBM, to determine the degree of genetic susceptibility and to carry out a close follow-up on them, with the aim of achieving an early diagnosis and treatment in case of presenting the disease.
La enfermedad antimembrana basal glomerular (EMBG) es un trastorno autoinmune poco frecuente, con una incidencia de 0,5-1 casos por millón de habitantes y ligero predominio de afectación en varones. Se caracteriza por la presencia de anticuerpos antimembrana basal glomerular (AMBG), hemorragia pulmonar, glomerulonefritis necrotizante y depósito lineal de inmunoglobulinas en inmunofluorescencia directa en biopsia renal1. Los AMBG se dirigen frente al dominio NC1 de la cadena alfa 3 del colágeno tipo IV que se expresa en la membrana basal glomerular (MBG) del riñón y la membrana basal de los alvéolos pulmonares, aunque se han descrito anticuerpos contra otros dominios antigénicos diferentes2. A pesar de que la etiopatogenia no es del todo conocida, la exposición ambiental, la predisposición genética y la presencia de células T autorreactivas, poseen un papel importante en el desarrollo de esta enfermedad3. Excepcionalmente se han descrito casos familiares sin presentar una alteración genética determinada. Sin embargo, sí se ha evidenciado que ciertos antígenos de histocompatibilidad como el HLA-DR15 y HLA-DR4 aumentan la susceptibilidad de presentar la enfermedad, y que otros como el HLA-DR7 y HLA-DR1, son factores de protección frente al desarrollo de la enfermedad4,5.
Describimos el primer caso de dos hermanos no gemelos con EMBG con tipaje HLA idéntico y un factor de protección frente al desarrollo de la enfermedad, el HLA-DR7. Además, ambos eran fumadores y compartían HLA-DR4. Esto sugiere que probablemente la coexistencia del factor ambiental como es el tabaco, junto el factor de riesgo HLA-DR4, no evita que la presencia del HLA-DR7 proteja frente al desarrollo la enfermedad. Por este motivo es importante realizar el tipaje de histocompatibilidad en hermanos de pacientes que presentan la EMBG, para determinar el grado de susceptibilidad y plantear si requieren seguimiento estrecho, con el objetivo de lograr un diagnóstico y tratamiento precoces en caso de desarrollar la enfermedad.
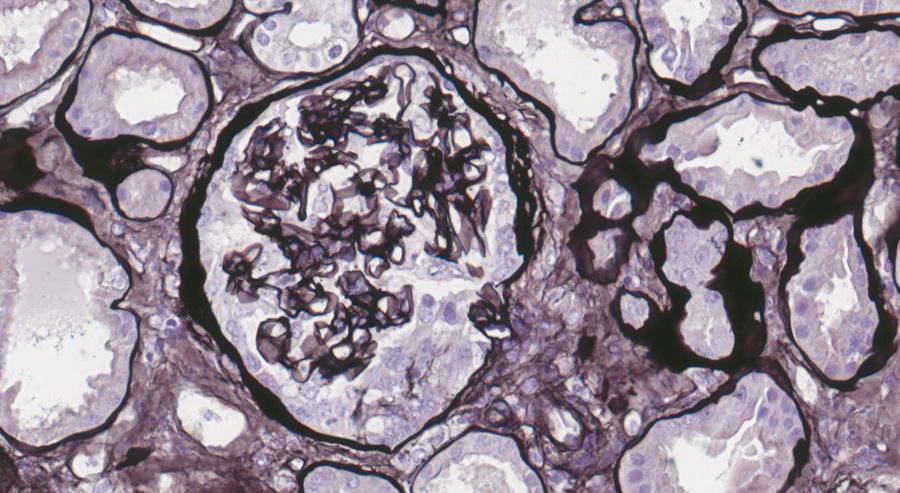
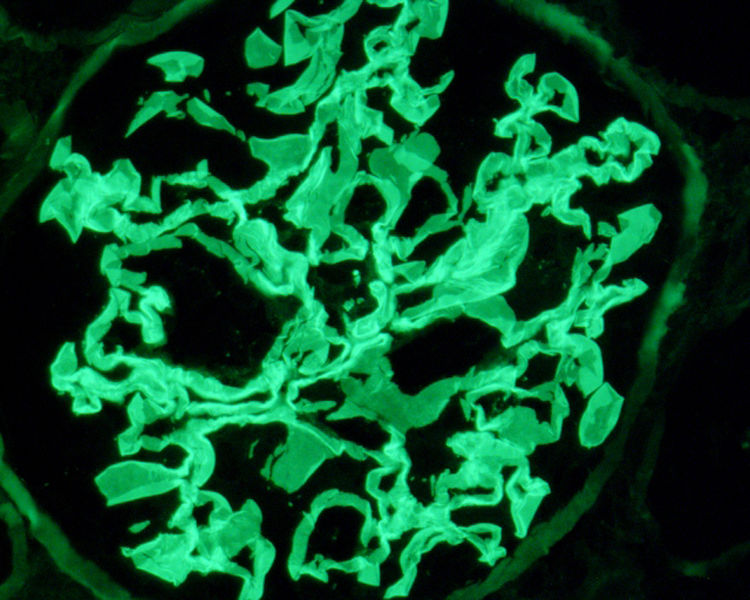
Exposición del casoPresentamos el caso de un varón de 19 años, fumador activo y antecedente de trastorno de déficit de atención e hiperreactividad. Consulta en Urgencias en agosto 2017 por tos y disnea de una semana de evolución. En el examen físico destacan crepitantes bilaterales en la auscultación pulmonar, y en la radiografía de tórax infiltrado intersticial bilateral. Ingresa con sospecha de neumonía bilateral. A las 48 horas muestra disminución progresiva de diuresis, hemoptisis e insuficiencia respiratoria en gasometría arterial, que requiere intubación orotraqueal con ventilación mecánica invasiva e ingreso en Unidad de Cuidados Intensivos (UCI). En análisis de sangre destaca hemoglobina 8,6 mg/dL, creatinina 4,35 mg/dL, urea 250 mg/dL. En análisis de orina macrohematuria y cociente proteínas/creatinina 3,5 g/g. Solicitamos estudio glomerular con AMBG negativos, siendo el resto (complemento, inmunoglobulinas, proteinograma, anticuerpos antinucleares [ANA], anticuerpos anticitoplasma de neutrófilos [ANCA], serología del virus de la inmunodeficiencia humana [VIH], del virus de la hepatitis B [VHB], del virus de la hepatitis C [VHC]) normal o negativo. Se hace fibrobroncoscopia con hallazgos compatibles con hemorragia alveolar diagnosticándose de síndrome pulmón riñón. Iniciamos tratamiento inmunosupresor con metilprednisolona bolos de 1 g diario intravenoso durante tres días consecutivos, y prednisona vía oral 1 mg/kg/día, ciclofosfamida intravenosa cada tres semanas, dosis ajustada a filtrado glomerular (FG), recambio plasmático (16 sesiones en total) y tratamiento renal sustitutivo con hemodiálisis a demanda. La biopsia renal se realiza tras salida de UCI una vez estabilizado el paciente. En la microscopía óptica se observan 28 glomérulos, ninguno de ellos esclerosado. En uno de ellos se percibe una semiluna epitelial circunscrita (fig. 1). Inmunofluorescencia directa con patrón lineal positivo intenso para IgG, Kappa y Lambda, patrón granular mesangial y parietal para C3 (fig. 2). En la microscopía electrónica se encuentran ocasionales reduplicaciones de la membrana basal de apariencia inespecífica. Con estos hallazgos se diagnostica de EMBG. Tras varias semanas de hospitalización el paciente presenta algunas complicaciones como infección digestiva secundaria por citomegalovirus y leucopenia severa, por lo que se cambia ciclofosfamida por rituximab. Recibe dos dosis de 375 mg/m2/semana, pero tras nuevo episodio de hemorragia alveolar se completa tratamiento de inducción con ciclofosfamida. Recibe en total seis ciclos de ciclofosfamida (dosis total 6.200 mg), con remisión del cuadro clínico y de las alteraciones analíticas, con función renal normal que mantiene actualmente.
Más de un año después, en octubre de 2018, la hermana del primer caso acude a urgencias. Se trata de una mujer de 23 años, fumadora activa sin otros antecedentes personales de interés. Consulta por dolor abdominal en flanco derecho, vómitos y astenia de una semana de evolución. En el examen físico presenta crepitantes bibasales y edemas en miembros inferiores. En análisis de sangre destaca Hb 8,4 g/dL, creatinina 6,27 mg/dL, urea 143 mg/dL. En análisis de orina: hematuria intensa, piuria moderada y cociente proteínas/creatinina de 0,90 g/g. La radiografía de tórax muestra un infiltrado intersticial bilateral. Completamos estudio con protocolo glomerular (complemento, inmunoglobulinas, proteinograma, ANA, ANCA, AMBG, serología VIH, VHB, VHC) con resultado normal o negativo. No pudo llevarse a cabo fibrobroncoscopia por negativa e intolerancia de la paciente, pero dado el antecedente familiar y cuadro sugestivo de síndrome pulmón riñón se inicia tratamiento precoz con plasmaféresis (recibe en total nueve sesiones), metilprednisolona bolos de 1 g intravenoso durante tres días consecutivos, seguido de prednisona vía oral 1 mg/kg/día y ciclofosfamida intravenosa cada tres semanas, dosis ajustada a FG. Se realiza biopsia renal una vez estabilizada la paciente. En la microscopía óptica se observan 35 glomérulos, ninguno de ellos esclerosado. En cinco glomérulos se ve ruptura de la membrana basal glomerular con semilunas epiteliales circunscritas. El intersticio no muestra fibrosis ni inflamación. Inmunofluorescencia directa con patrón lineal positivo intenso para IgG Kappa y Lambda, y morfología granular y lineal discontinua de C3. Microscopía electrónica sin hallazgos relevantes. Con estos hallazgos se diagnostica de EMBG. Recibe seis ciclos de ciclofosfamida (dosis total 6.700 mg) con adecuada respuesta al tratamiento inmunosupresor, remisión del cuadro clínico y de las alteraciones analíticas, normalizándose la función renal, que se ha mantenido estable hasta el día de hoy.
Los dos casos recuperaron completamente la función renal, debido probablemente a la rapidez de instauración del tratamiento y la presencia de escasas semilunas en la biopsia renal. Dado que ambos pacientes presentaron la misma enfermedad y al estar sometidos a factores de riesgo similares, se decide obtener la tipificación HLA, mostrando el mismo grado de histocompatibilidad entre ambos hermanos no gemelos (mismatch 0 de 6): A*02, A*23, B*35, B*44, DRB1*04, DRB1*07.
DiscusiónLa EMBG se produce tras un desencadenante ambiental en un individuo genéticamente predispuesto, por una falta de comunicación entre sistema inmune innato y adaptativo y una respuesta inmunológica aberrante5. Además, en la EMBG, los mecanismos para la formación de autoanticuerpos AMBG no están claros y se sugiere que las células T autorreactivas desempeñan un papel importante en su patogenia. Por lo tanto, la susceptibilidad genética junto a factores ambientales y la pérdida de la regulación inmune contribuyen a que se desarrolle la EMBG1,3.
En cuanto a los estímulos ambientales que favorecen el desarrollo de EMBG, destacan el tabaco y el humo de hidrocarburos, pudiendo ser los desencadenantes ambientales responsables de activar la patogenia en pacientes genéticamente predispuestos5. En nuestro caso ambos hermanos presentaban como factor ambiental común el hábito tabáquico. Se especula que las toxinas inhaladas promueven la producción de autoanticuerpos AMBG al exponer los epítopos de colágeno en los alvéolos lesionados5. Otra hipótesis sugiere que los fumadores tienen niveles elevados de tiocianato en sangre, que inhibe la actividad de la peroxidasina, que es una enzima que cataliza las reticulaciones en los hexámeros de colágeno tipo IV de la MBG, lo que promovería el acceso de inmunoglobulinas anti-MBG a los epítopos de la cadena α3 NC16.
Por otra parte, los genes del complejo principal de histocompatibilidad son los más relacionados con la susceptibilidad genética de esta enfermedad. Los alelos HLA de clase II desempeñan un papel central en la regulación de la respuesta inmune, sin embargo, el mecanismo subyacente aún se desconoce. Se cree que la asociación de HLA en la EMBG refleja la capacidad de ciertas moléculas de clase II para unirse y presentar antígenos a los receptores de células T, contribuyendo a la producción de anticuerpos específicos7. Estudios previos han demostrado que el HLA-DRB1*15:01 haplotipo (HLA-DR15 serotipo), HLA-DRB1*04 (HLA- DR4 serotipo) están asociados con un incremento del riesgo de desarrollar la EMBG. Contrariamente, HLA-DRB1*01 haplotipo (HLA DR1 serotipo) y HLA DRB1*07 (HLA-DR7 serotipo) han demostrado ser factores protectores para desarrollar la EMBG1,4,5. En nuestro caso ambos hermanos presentaron la enfermedad a pesar de tener un factor protector, el HLA DR7. Se sugiere que el HLA DR15 aumenta la susceptibilidad de tener la enfermedad debido a que estos pacientes presentan péptidos de la cadena alfa 3 del colágeno tipo IV en una conformación que activa las células T proinflamatorias8. Derivado de esta idea, Phelps et al. sugieren que el mecanismo por el que HLA DR1 y DR7 confieren un efecto protector es que capturan los péptidos de la cadena alfa 3 del colágeno tipo IV, previniendo su presentación unida a HLA DR159.
En la literatura se han descrito varios casos de síndromes familiares de EMBG con HLA similar. Debido a la baja incidencia de la EMBG, no ha sido posible determinar con exactitud la herencia genética que puede predisponer a la enfermedad en las familias afectadas10–14.
Entre ellos, destacan algunos que afectan a hermanos no gemelos, como ocurrió en nuestro caso. Durcan et al.12, describen el caso de una mujer de 71 años y su hermano 60 años con EMBG. Los dos eran exfumadores y en el tipaje HLA ambos tenían dos factores de riesgo (DRB1*15:01 y DRB1*04:03) y ningún factor protector. Li et al.13 describen el caso de una mujer de 49 años con EMBG, homocigota para DRB1*15:01, y su hermana que a los 29 años presenta la misma enfermedad y fallece durante el ingreso, no pudiendo obtener tipificación de HLA ni, por tanto, determinar si tenía HLA de riesgo o protector de padecer la EMBG. Angioi et al.14 describen el caso de una mujer de 65 años con EMBG, con dos hermanos que tuvieron la enfermedad en la adolescencia. Uno de ellos falleció, el otro desarrolló enfermedad renal crónica terminal y recibió un trasplante renal. Los tres eran fumadores y habían estado expuestos a queroseno. Se realizó tipificación HLA del caso índice y del hermano, presentando HLA idéntico (A1, A3, B7, DQ6, DR15, DR51), ambos homocigotos para el factor de riesgo HLA-DR15, sin tener ningún factor protector.
El resto de los casos descritos son, en su mayoría, previos a 1990. En ellos se incluyen dos miembros de cada familia en particular, inclusive gemelos, hermanos y primos hermanos. Algunos comparten factores de exposición ambiental10,14, pero dada su fecha de publicación, no cuentan con tipificación de HLA ni diagnóstico por inmunofluorecencia14.
Comparamos nuestro caso con los descritos en la literatura, en todos ellos se observó la presencia de HLA de riesgo para el desarrollo de la enfermedad, al igual que en el nuestro. Sin embargo, en ninguno se objetivó HLA protector. Nos encontramos, por tanto, ante el primer caso de hermanos no gemelos con EMBG con HLA idéntico y factor de riesgo HLA-DR4, a pesar de tener el factor protector HLA-DR7. Es decir, aunque el HLA DR7 se considera protector frente a la EMBG, en nuestro caso no fue suficiente para evitar su desarrollo, probablemente debido a la presencia de HLA de riesgo, la misma exposición ambiental, el tabaco y la coexistencia de HLA idéntico.
Planteamos la importancia de analizar el tipaje de histocompatibilidad en hermanos de pacientes con EMBG, con el objetivo de detectar coincidencias en el HLA o antígenos asociados a mayor riesgo de desarrollar la enfermedad, para poder realizar en ellos un seguimiento estrecho, un diagnóstico y tratamiento precoces, y mejorar así el pronóstico de la enfermedad.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.