En este estudio presentamos los resultados del subgrupo de pacientes españoles del estudio VERIFIE, primer estudio postautorización prospectivo que evalúa la seguridad y efectividad a largo plazo del oxihidróxido sucroférrico (OHS) en pacientes en diálisis con hiperfosfatemia durante la práctica clínica habitual.
Pacientes y métodosSe incluyeron pacientes en hemodiálisis y diálisis peritoneal con indicación de tratamiento con OHS. La duración del seguimiento fue de 12 a 36 meses desde el inicio del tratamiento con OHS. Las variables primarias de seguridad fueron la incidencia de reacciones adversas a medicamentos, eventos médicos de interés especial y variaciones en los parámetros del hierro. La efectividad del OHS se evaluó mediante el cambio en los niveles de fósforo sérico.
ResultadosSe reclutaron 286 pacientes y se analizaron los datos de 282. De estos 282 pacientes, 161 (57,1%) abandonaron el estudio de manera prematura y un 52,5% recibieron tratamiento concomitante con otros captores de fósforo. Un 35,1% reportaron reacciones adversas a medicamentos y la mayoría fueron de tipo gastrointestinal (77,1%) y de intensidad leve/moderada (83,7%). Un 14,2% de los pacientes presentaron eventos médicos de interés especial, de los que el 93,7% fueron leves/moderados. Se observó un incremento de la ferritina (386,66 vs. 447,55ng/mL; p=0,0013) y saturación de la transferrina (28,07 vs. 30,34%; p=0,043) desde el inicio hasta la última visita. Los niveles de fósforo sérico disminuyeron progresivamente desde 5,69mg/dL al inicio hasta 4,84mg/dL en la última visita (p<0,0001), aumentando la proporción de pacientes con niveles de fósforo≤5,5mg/dL un 32,2%, y con una dosis diaria media de 1,98 comprimidos/día.
ConclusionesEl OHS presentó un perfil de efectividad favorable, un perfil de seguridad similar al observado en el estudio internacional con una mayoría de efectos adversos de severidad leve/moderada, y un número reducido de comprimidos diarios en pacientes españoles en diálisis.
In this study, we show the results of the subset of Spanish patients of the VERIFIE study, the first post-marketing study assessing the long-term safety and effectiveness of sucroferric oxyhydroxide (SFOH) in patients with hyperphosphatemia undergoing dialysis during clinical practice.
Patients and methodsPatients undergoing hemodialysis and peritoneal dialysis with indication of SFOH treatment were included. Follow-up duration was 12–36 months after SFOH initiation. Primary safety variables were the incidence of adverse drug reactions, medical events of special interest, and variations in iron-related parameters. SFOH effectiveness was evaluated by the change in serum phosphorus levels.
ResultsA total of 286 patients were recruited and data from 282 were analyzed. Among those 282 patients, 161 (57.1%) withdrew the study prematurely and 52.5% received concomitant treatment with other phosphate binders. Adverse drug reactions were observed in 35.1% of patients, the most common of which were gastrointestinal disorders (77.1%) and mild/moderate in severity (83.7%). Medical events of special interest were reported in 14.2% of patients, and 93.7% were mild/moderate. An increase in ferritin (386.66ng/mL vs 447.55ng/mL; P=.0013) and transferrin saturation (28.07% vs 30.34%; P=.043) was observed from baseline to the last visit. Serum phosphorus levels progressively decreased from 5.69mg/dL at baseline to 4.84mg/dL at the last visit (P<.0001), increasing by 32.2% the proportion of patients who achieved serum phosphorus levels≤5.5mg/dL, with a mean daily SFOH dose of 1.98pills/day.
ConclusionsSFOH showed a favorable effectiveness profile, a similar safety profile to that observed in the international study with most adverse events of mild/moderate severity, and a low-daily pill burden in Spanish patients in dialysis.
- •
Este subanálisis del estudio VERIFIE evalúa la seguridad y efectividad a largo plazo del oxihidróxido sucroférrico (OHS) en pacientes españoles.
- •
Los principales eventos adversos asociados al OHS fueron de tipo gastrointestinal y de intensidad leve/moderada.
- •
No se observaron alteraciones clínicamente relevantes en variables relacionadas con el metabolismo del hierro.
- •
El OHS fue efectivo en la disminución progresiva de los niveles de fósforo sérico.
- •
La dosis diaria media durante el periodo de observación (988,1mg) resultó en un número reducido de comprimidos diarios (1,98 comprimidos/día).
La hiperfosfatemia es una complicación común que se manifiesta a partir de la enfermedad renal crónica (ERC) y se agrava conforme avanza la enfermedad debido a la pérdida progresiva de la capacidad de excreción urinaria del fósforo1. En pacientes con ERC, los niveles elevados de fósforo se asocian a complicaciones cardiovasculares, calcificación vascular, alteraciones óseas, agravamiento del hiperparatiroidismo secundario y mayor riesgo de mortalidad2,3. Desde 2006, a todas estas alteraciones, junto a una mayor fragilidad ósea, se las conoce por sus siglas en inglés como CKD-MBD (cronic kidney disease mineral and bone disorders)4,5.
Con el objetivo de prevenir estos desenlaces, las guías Kidney Disease: Improving Global Outcomes5 (KDIGO) y las de la Sociedad Española de Nefrología (SEN)6 recomiendan mantener los niveles de fósforo dentro del rango de normalidad. Los resultados del estudio COSMOS indican que los valores asociados con menor mortalidad están entre 2,5−4,5mg/dL7. Existen 3 abordajes terapéuticos principales encaminados a alcanzar estos objetivos: dieta con bajo contenido en fósforo, su eliminación mediante diálisis y uso de fármacos captores de fósforo. En más del 80% de pacientes en diálisis, las restricciones dietéticas y la diálisis no son suficientes, por lo que se requiere el uso de captores de fósforo8.
Actualmente existe una amplia variedad de captores de fósforo con diferentes principios activos: basados en calcio, en metales como magnesio, hierro o aluminio, o polímeros8,9. Entre sus características diferenciales se encuentran la capacidad de unión al fósforo en el rango de pH del tracto gastrointestinal, el número de comprimidos diarios y el perfil de tolerabilidad10. A pesar de la demostrada eficacia de los captores de fósforo necesaria para obtener beneficios significativos, un estudio europeo mostró que solo el 26,7% de los pacientes que recibió este tratamiento alcanzó los objetivos terapéuticos de KDIGO11.
El oxihidróxido sucroférrico (OHS, Velphoro®; Vifor Fresenius Medical Care Renal Pharmaa, Glattbrugg, Suiza) es un nuevo captor de fósforo basado en hierro con una potente capacidad de unión al fósforo en un amplio rango de pH, lo que permite el uso de un número reducido de comprimidos, ventaja que, se ha demostrado, mejora el cumplimiento12. El OHS se comercializó en Estados Unidos y Europa y está indicado en pacientes adultos con ERC que reciben tratamiento crónico en hemodiálisis o diálisis peritoneal13,14. La eficacia del OHS y su no inferioridad respecto al carbonato de sevelámero en el descenso del fósforo sérico se demostraron en un estudio fase iii y su posterior extensión en 1059 pacientes con ERC en diálisis15,16. La mayor parte de los acontecimientos adversos fueron de tipo gastrointestinal (diarrea) y por lo general tuvieron una intensidad leve/moderada15,16. Posteriormente, otros estudios observacionales también han demostrado la efectividad del OHS utilizando un número reducido de comprimidos17–19. En comparación con otros captores de fósforo (carbonato de calcio, acetato de calcio, lantano, carbonato de sevelámero y citrato férrico), un estudio situó al OHS como el captor más potente con la mayor capacidad de unión a fósforo20. Hasta la publicación del estudio VERIFIE (Velphoro Evaluation of Real-lIfe saFety, effectIveness and adherencE), un estudio prospectivo, multicéntrico y multinacional llevado a cabo en 7 países y 172 centros y que incluyó a 1406 pacientes, no existían datos postautorización de seguridad a largo plazo21. Con el objetivo de conocer el perfil de seguridad y efectividad de los pacientes españoles, en este subanálisis se muestran los resultados de los centros españoles que participaron en el estudio VERIFIE.
MétodosDiseño y población del estudioVERIFIE (NCT02687594) es un estudio no intervencionista prospectivo y multicéntrico llevado a cabo en 7 países europeos21. En este documento se muestran los resultados obtenidos en el grupo de pacientes reclutados en los 34 centros españoles participantes. El estudio se realizó de acuerdo con los principios de la Declaración de Helsinki. Todos los participantes dieron su consentimiento informado por escrito. El protocolo del estudio internacional fue aprobado por el Comité Ético de Investigación Clínica de cada centro participante.
El objetivo del estudio VERIFIE fue evaluar la seguridad y efectividad del OHS a largo plazo (hasta 36 meses)21. Para ello, se recogió información demográfica, clínica y de comorbilidades, así como datos relativos al tratamiento previo y concomitante con otros captores de fósforo o con suplementos de hierro intravenoso u oral. Los pacientes incluidos disponían de información clínica de los 6 meses precedentes al inicio del tratamiento con OHS. Los periodos de observación correspondientes a las fases prospectivas y retrospectivas del estudio aparecen detallados en la publicación del estudio VERIFIE21.
Se incluyeron pacientes adultos (≥18 años) en hemodiálisis y diálisis peritoneal durante al menos 6 meses, que otorgaron su consentimiento a participar en el estudio, con indicación de tratamiento con OHS de acuerdo con su ficha técnica, previamente tratados y aquellos que no habían recibido tratamiento previo (naïve) con captores de fósforo. Los pacientes que discontinuaron el tratamiento y los que habían participado en otro estudio intervencionista o que habían sido reclutados en otro estudio con OHS fueron excluidos21.
Variables de estudioLas variables primarias de seguridad fueron la incidencia y proporción de pacientes con reacciones adversas a medicamentos (RAM) y eventos médicos de interés especial (EMIE), como la diarrea, el riesgo potencial (evaluado por el facultativo) de enmascaramiento de hemorragias gastrointestinales causada por la decoloración de las heces asociada al OHS y parámetros relacionados con el metabolismo del hierro (ferritina, transferrina, índice de saturación de la transferrina y hemoglobina). Las RAM se definen como cualquier evento adverso que presente una relación causal razonable con el tratamiento en estudio. Los EMIE incluyen sangrados gastrointestinales, sobrecarga de hierro y diarrea independientemente de su relación con OHS. Para determinar la efectividad del OHS, se evaluó el cambio respecto al inicio en los niveles de fósforo sérico, así como el porcentaje de pacientes que controlaron los niveles de fósforo sérico (≤5,5 y ≤4,5mg/dL).
Como objetivos secundarios, se evaluaron otros parámetros de laboratorio relacionados con el metabolismo óseo y mineral como calcio, vitamina D y hormona paratiroidea intacta (PTHi). También se evaluó la dosis diaria media de OHS y los cambios en la dosis de OHS.
Las variables de estudio se recogieron antes del inicio del tratamiento y a lo largo del periodo de observación (meses 1, 3, 6, 12, 18 y 24). En aquellos pacientes que abandonaron el estudio de manera prematura, los datos de la última observación completada se recogieron en la variable «última visita». La información se recogió de manera agregada para pacientes en hemodiálisis (216; 76,6%) y diálisis peritoneal (66; 23,4%) para no reducir el tamaño de la muestra.
Análisis estadísticosPara el cálculo del tamaño muestral del estudio internacional se tuvo en cuenta la incidencia del 5% de hemorragias gastrointestinales reportadas previamente en el estudio DOPPS (Dialysis Outcomes and Patient Patterns Study)22. Los cálculos se realizaron mediante la prueba de Chi cuadrado para una muestra, con un nivel de significación bilateral de 0,05. Se estableció que 1000 pacientes serían suficientes para alcanzar el objetivo del estudio de una exposición de 900-1000 pacientes/año.
Los resultados se analizaron de manera exploratoria y descriptiva. Las RAM, EMIE, eventos fatales y otras variables de seguridad se clasificaron por órganos y sistemas y término preferente según la terminología MedDRA (Medical Dictionary for Regulatory Activities) en su versión 22.0.
Los resultados de las variables primarias se expresaron mediante número de pacientes y porcentaje e intervalo de confianza al 95% para la frecuencia de RAM, EMIE y eventos fatales. La tasa de incidencia ajustada por exposición por paciente/año se calculó como el número de pacientes con un evento específico dividido por el tiempo de seguimiento total para todos los pacientes. Todas las variables de seguridad se analizaron en el conjunto de análisis de seguridad, que comprende a aquellos pacientes que recibieron al menos una dosis de OHS y con al menos una evaluación de seguridad disponible.
Las variables de efectividad se expresaron mediante la media y desviación estándar, el cambio respecto al valor basal y la proporción de pacientes que alcanzaron niveles objetivo (≤5,5mg/dL) y óptimos (≤4,5mg/dL) de fósforo. Los valores de p se calcularon mediante un análisis post hoc exploratorio. El análisis de los niveles de fósforo se realizó en el conjunto de análisis completo, que incluye a aquellos pacientes que recibieron al menos una dosis de OHS, con al menos una evaluación de efectividad basal y al menos una posterior.
Los análisis estadísticos se llevaron a cabo con el paquete de análisis estadístico SAS (SAS Institute Inc., Cary, NC, Estados Unidos), en su versión 9.4 TS1M3. Se consideró una p<0,05 como estadísticamente significativa.
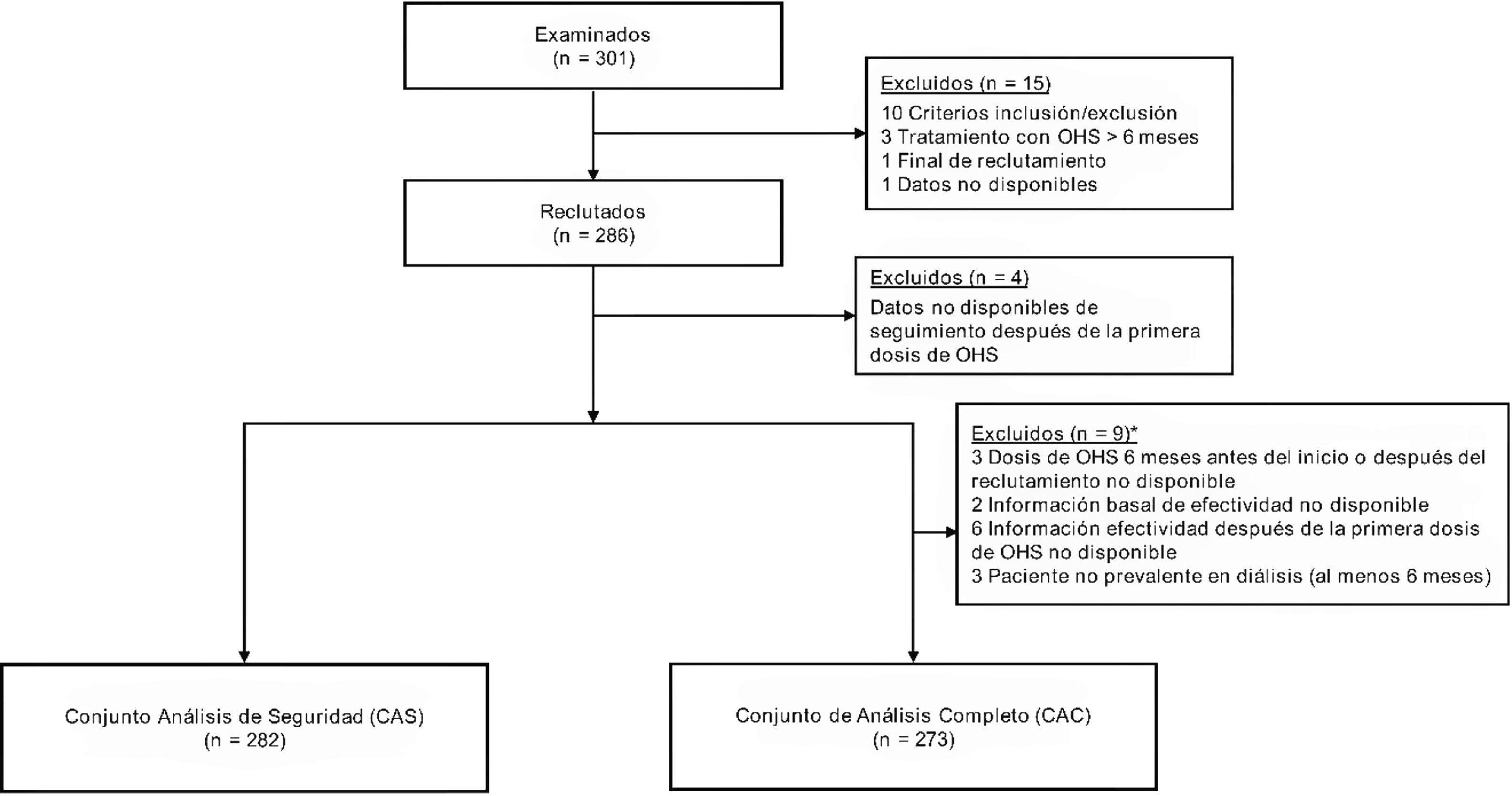
ResultadosPoblación de estudioEn este subanálisis del estudio internacional se reclutaron 286 pacientes de 34 centros españoles. Cuatro pacientes no dispusieron de datos de seguimiento después de la primera dosis de OHS y fueron excluidos del análisis (282 pacientes formaron parte del conjunto de análisis de seguridad y 273 del conjunto de análisis completo) (fig. 1).
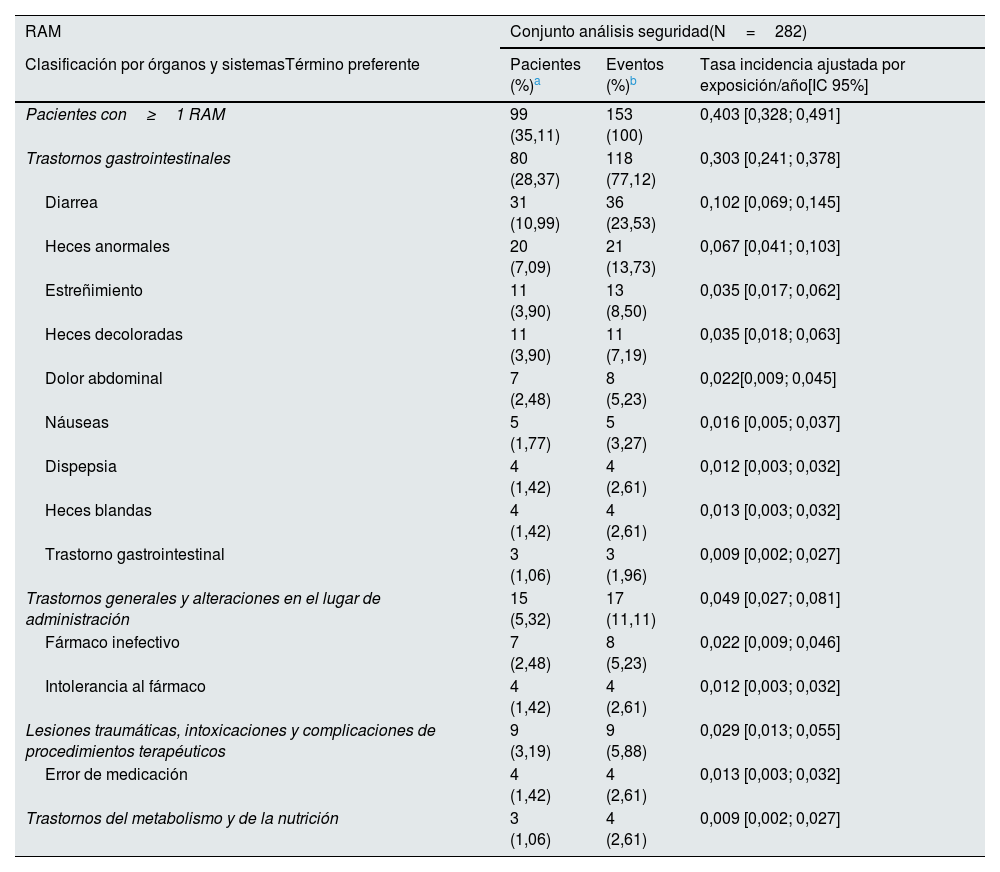
Las características basales de los sujetos incluidos en la población de seguridad se muestran en la tabla 1. Se observó una mayor proporción de hombres (174; 61,7%) y una predominancia (216; 76,6%) de pacientes en hemodiálisis en comparación con los pacientes en diálisis peritoneal (66; 23,4%). La mayor parte de los pacientes había recibido tratamiento previo con otros captores de fósforo (63,8%), sevelámero (24,4%), basados en calcio (21,7%), basados en calcio/sevelámero (21,7%) y lantano 13,33% (tabla 1). Durante el seguimiento del estudio, un total de 148 pacientes (52,5%) recibieron tratamiento concomitante con otros captores de fósforo (tabla suplementaria 1).
Características basales demográficas y clínicas de los pacientes
| Variables | Conjunto análisis seguridad (N=282) |
|---|---|
| Edad (años), media±DE | 62,3±14,72 |
| Sexo (varones), N (%) | 174 (61,70%) |
| Peso (kg), media±DE | 76±18,78 |
| IMC (kg/m2), media±DE | 27,9±6,14 |
| Causa de ERC, N (%) (n=279)a | |
| Diabetes | 60 (21,51%) |
| Hipertensión | 39 (13,98%) |
| Otra | 178 (63,80%) |
| Datos no disponibles | 2 |
| Tiempo en diálisis hasta inicio tratamiento (años), media±DE | 4,6±6,51 |
| Modalidad de diálisis | |
| Hemodiálisis | 216 (76,60%) |
| Diálisis peritoneal | 66 (23,40%) |
| Tratamiento previo con captores de fósforob | 180 (63,82%) |
| Sevelámero | 44 (24,44%) |
| Basados en calcio | 39 (21,67%) |
| Basados en calcio/sevelámero | 39 (21,67%) |
| Lantano | 24 (13,33%) |
| Basados en calcio/lantano | 21 (11,67%) |
| Basados en calcio/sevelámero/lantano | 6 (3,33%) |
| Sevelámero/lantano | 6 (3,33%) |
| Basados en aluminio | 1 (0,56%) |
| Otros tratamientos previos | |
| Agentes estimulantes de la eritropoyetina | 187 (66,31%) |
| Hierro intravenoso/oral | 136 (48,23%) |
| Vitamina D activa | 109 (38,65%) |
| Vitamina D nativa | 90 (31,91%) |
| Calcimiméticos | 82 (29,08%) |
| Laxantes | 16 (5,67%) |
DE: desviación estándar; ERC: enfermedad renal crónica; IMC: índice de masa corporal.
Un total de 161 (57,1%) pacientes abandonaron el estudio de manera prematura. Las causas principales de abandono prematuro fueron la interrupción permanente del tratamiento con OHS (33,5%), el trasplante (22,4%), la muerte (14,3%) o la ocurrencia de RAM/EMIE (11,8%) (tabla 2). Entre los pacientes que interrumpieron de manera permanente el tratamiento con OHS, las causas principales fueron la ocurrencia de RAM/EMIE/toxicidad/eventos fatales (48,9%) y la decisión del paciente (27,1%).
Razones de abandono prematuro del estudio
| Razones de abandono prematuro | Conjunto análisis seguridad(N=161)a |
|---|---|
| Interrupción permanente del tratamiento con OHS | 54 (33,54%) |
| Trasplante | 36 (22,36%) |
| Exitus | 23 (14,29%) |
| RAM/ EMIE | 19 (11,80%) |
| Pérdida de seguimiento | 16 (9,94%) |
| Retirada de consentimiento | 5 (3,11%) |
| Evento adverso (diferente de RAM/EMIE/evento fatal) | 3 (1,86%) |
| Decisión del paciente | 3 (1,86%) |
| Decisión del facultativo | 1 (0,62%) |
| Falta de adherencia al tratamiento | 1 (0,62%) |
EMIE: eventos médicos de interés especial; OHS: oxihidróxido sucroférrico; RAM: reacciones adversas a medicamentos.
La duración de la exposición a OHS tuvo una mediana de 54,1 semanas (rango: 1,4-123,3 semanas) y una media de 58,2±30,1 semanas.
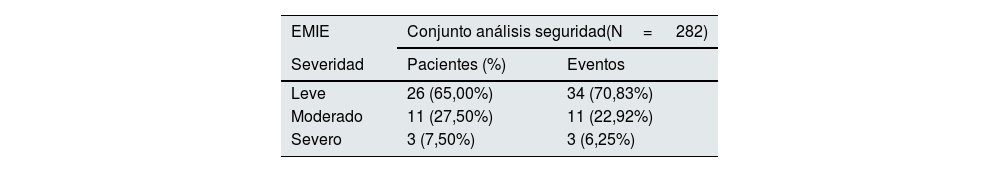
Variables de seguridadUn total de 99 pacientes (35,1%) reportaron 153 RAM durante el tratamiento con OHS, siendo las más comunes las gastrointestinales (118 eventos en 80 pacientes) (tabla 3). Las RAM se clasificaron mayoritariamente como leves o moderadas (83,7%) y en un 82,4% de los casos hubo sospecha de relación con el tratamiento. Un total de 3 pacientes (1,1%) reportaron 5 RAM serias: anemia, heces anormales, agravamiento de la condición, infección del tracto respiratorio y polineuropatía (tabla suplementaria 2).
Reacciones adversas a medicamentos clasificadas por órganos y sistemas y términos preferentes
| RAM | Conjunto análisis seguridad(N=282) | ||
|---|---|---|---|
| Clasificación por órganos y sistemasTérmino preferente | Pacientes (%)a | Eventos (%)b | Tasa incidencia ajustada por exposición/año[IC 95%] |
| Pacientes con≥1 RAM | 99 (35,11) | 153 (100) | 0,403 [0,328; 0,491] |
| Trastornos gastrointestinales | 80 (28,37) | 118 (77,12) | 0,303 [0,241; 0,378] |
| Diarrea | 31 (10,99) | 36 (23,53) | 0,102 [0,069; 0,145] |
| Heces anormales | 20 (7,09) | 21 (13,73) | 0,067 [0,041; 0,103] |
| Estreñimiento | 11 (3,90) | 13 (8,50) | 0,035 [0,017; 0,062] |
| Heces decoloradas | 11 (3,90) | 11 (7,19) | 0,035 [0,018; 0,063] |
| Dolor abdominal | 7 (2,48) | 8 (5,23) | 0,022[0,009; 0,045] |
| Náuseas | 5 (1,77) | 5 (3,27) | 0,016 [0,005; 0,037] |
| Dispepsia | 4 (1,42) | 4 (2,61) | 0,012 [0,003; 0,032] |
| Heces blandas | 4 (1,42) | 4 (2,61) | 0,013 [0,003; 0,032] |
| Trastorno gastrointestinal | 3 (1,06) | 3 (1,96) | 0,009 [0,002; 0,027] |
| Trastornos generales y alteraciones en el lugar de administración | 15 (5,32) | 17 (11,11) | 0,049 [0,027; 0,081] |
| Fármaco inefectivo | 7 (2,48) | 8 (5,23) | 0,022 [0,009; 0,046] |
| Intolerancia al fármaco | 4 (1,42) | 4 (2,61) | 0,012 [0,003; 0,032] |
| Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos | 9 (3,19) | 9 (5,88) | 0,029 [0,013; 0,055] |
| Error de medicación | 4 (1,42) | 4 (2,61) | 0,013 [0,003; 0,032] |
| Trastornos del metabolismo y de la nutrición | 3 (1,06) | 4 (2,61) | 0,009 [0,002; 0,027] |
IC 95%: intervalo de confianza al 95%; RAM: reacción adversa a medicamentos.
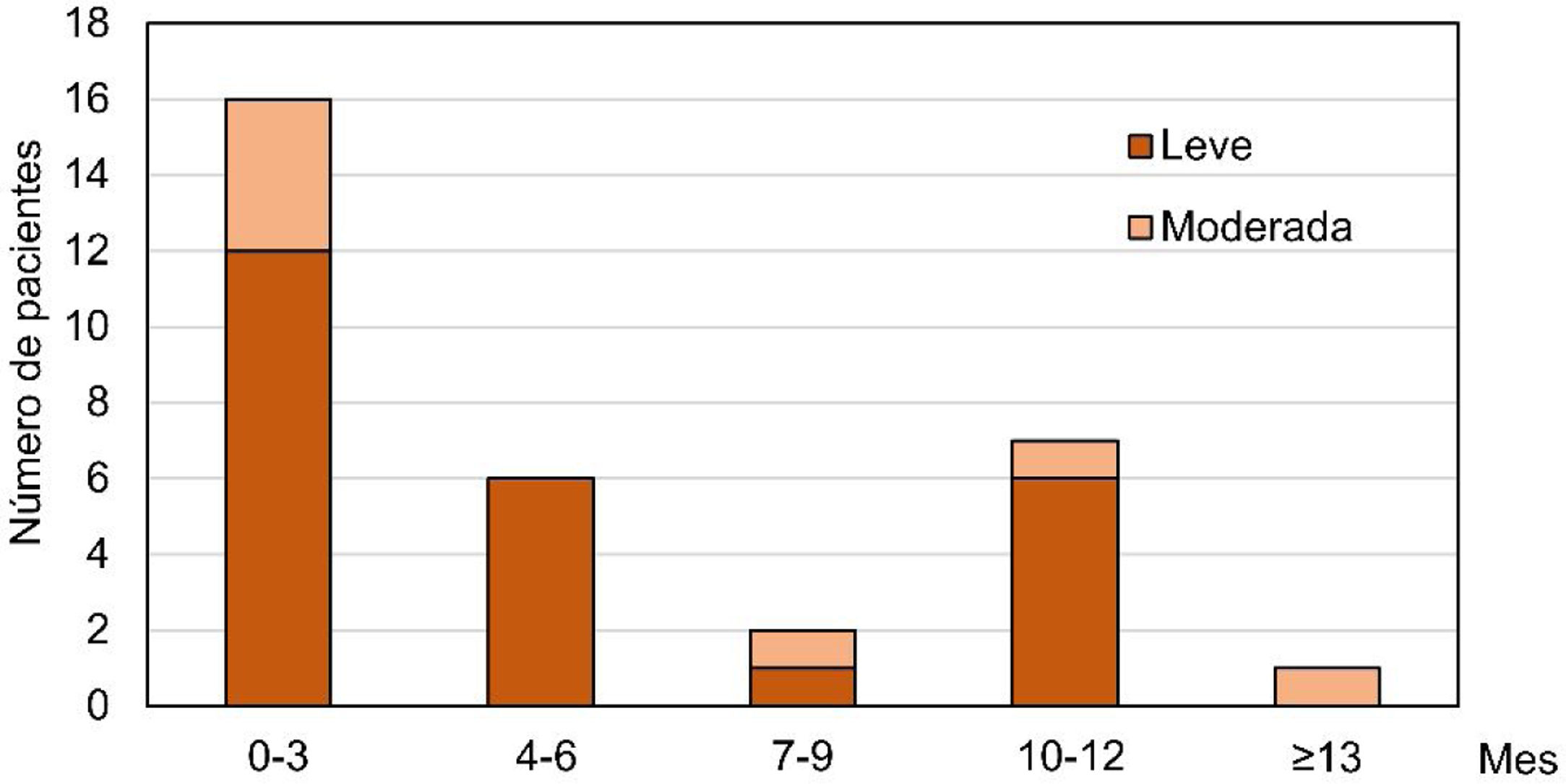
En total, 40 pacientes (14,2%) registraron 48 EMIE, de los cuales 34 (70,8%) fueron leves, 11 (22,9%) moderados y 3 (6,3%) severos. La mayoría se clasificaron como trastornos gastrointestinales (47 EMIE en 39 pacientes), siendo la diarrea el más común (81,25% de los eventos). Se reportó relación con el tratamiento con OHS en 37 EMIE (32 pacientes) de los cuales uno fue sobrecarga de hierro y el resto correspondió a episodios de diarrea (tabla 4). Los episodios de diarrea fueron leves/moderados, aparecieron en un 50% de los casos durante los 3 primeros meses (fig. 2) y se resolvieron durante los 2 primeros meses en un 46,2% de los pacientes. Los 8 pacientes con sangrados gastrointestinales presentaban factores de riesgo preexistentes como medicación (87,5%) o condiciones/enfermedades médicas previas (37,5%). No se detectó ningún retraso significativo en el diagnóstico de hemorragias gastrointestinales relacionado con la decoloración de las heces ni se encontró una relación causal de las mismas con el tratamiento con OHS.
Eventos médicos de interés especial registrados en la población de seguridad y clasificados por órganos y sistemas y términos preferentes
| EMIE | Conjunto análisis seguridad(N= 282) | |
|---|---|---|
| Severidad | Pacientes (%) | Eventos |
| Leve | 26 (65,00%) | 34 (70,83%) |
| Moderado | 11 (27,50%) | 11 (22,92%) |
| Severo | 3 (7,50%) | 3 (6,25%) |
| Clasificación por órganos y sistemasTérmino preferente | Pacientes (%) | Eventos (%)a | Tasa incidencia ajustada por exposición/año[IC 95%] |
|---|---|---|---|
| EMIE | |||
| Pacientes con≥1 EMIE | 40 (14,18) | 48 (100) | 0,133 [0,095; 0,182] |
| Trastornos gastrointestinales | 39 (13,83) | 47 (97,92) | 0,130 [0,092; 0,177] |
| Diarrea | 32 (11,35) | 39 (81,25) | 0,106 [0,072; 0,150] |
| Hemorragia gastrointestinal | 3 (1,06) | 3 (6,25) | 0,009 [0,002; 0,027] |
| Malformación vascular gastrointestinal hemorrágica | 1 (0,35) | 1 (2,08) | 0,003 [0,000; 0,017] |
| Hematoquecia | 1 (0,35) | 1 (2,08) | 0,003 [0,000; 0,017] |
| Melena | 1 (0,35) | 1 (2,08) | 0,003 [0,000; 0,017] |
| Hemorragia rectal | 1 (0,35) | 1 (2,08) | 0,003 [0,000; 0,017] |
| Hemorragia gastrointestinal alta | 1 (0,35) | 1 (2,08) | 0,003 [0,000; 0,017] |
| Trastornos del metabolismo y de la nutrición | 1 (0,35) | 1 (2,08) | 0,003 [0,000; 0,017] |
| Sobrecarga de hierro | 1 (0,35) | 1 (2,08) | 0,003 [0,000; 0,017] |
| EMIE serios | |||
| Pacientes con≥1 EMIE serio | 8 (2,84) | 9 (100,00) | 0,025 [0,011; 0,049] |
| Trastornos gastrointestinales | 8 (2,84) | 9 (100,00) | 0,025 [0,011; 0,049] |
| Diarrea | 1 (0,35) | 1 (11,11) | 0,003 [0,000; 0,017] |
| Hemorragia gastrointestinal | 3 (1,06) | 3 (33,33) | 0,009 [0,002; 0,027] |
| Malformación vascular gastrointestinal hemorrágica | 1 (0,35) | 1 (11,11) | 0,003 [0,000; 0,017] |
| Hematoquecia | 1 (0,35) | 1 (11,11) | 0,003 [0,000; 0,017] |
| Melena | 1 (0,35%) | 1 (11,11) | 0,003 [0,000; 0,017] |
| Hemorragia rectal | 1 (0,35%) | 1 (11,11) | 0,003 [0,000; 0,017] |
| Hemorragia gastrointestinal alta | 1 (0,35) | 1 (11,11) | 0,003 [0,000; 0,017] |
EMIE: eventos médicos de interés especial; IC 95%: intervalo de confianza al 95%.
Tiempo de aparición del primer episodio de diarrea desde el inicio del tratamiento.
El gráfico muestra el número de pacientes en los que el primer episodio de diarrea leve y moderada aparece durante el periodo (meses) transcurrido desde el inicio del tratamiento en el conjunto de análisis de seguridad (n=282). Ningún paciente mostró diarrea clasificada como severa. Debido al número limitado de pacientes con diarrea, los resultados se agruparon por trimestres.
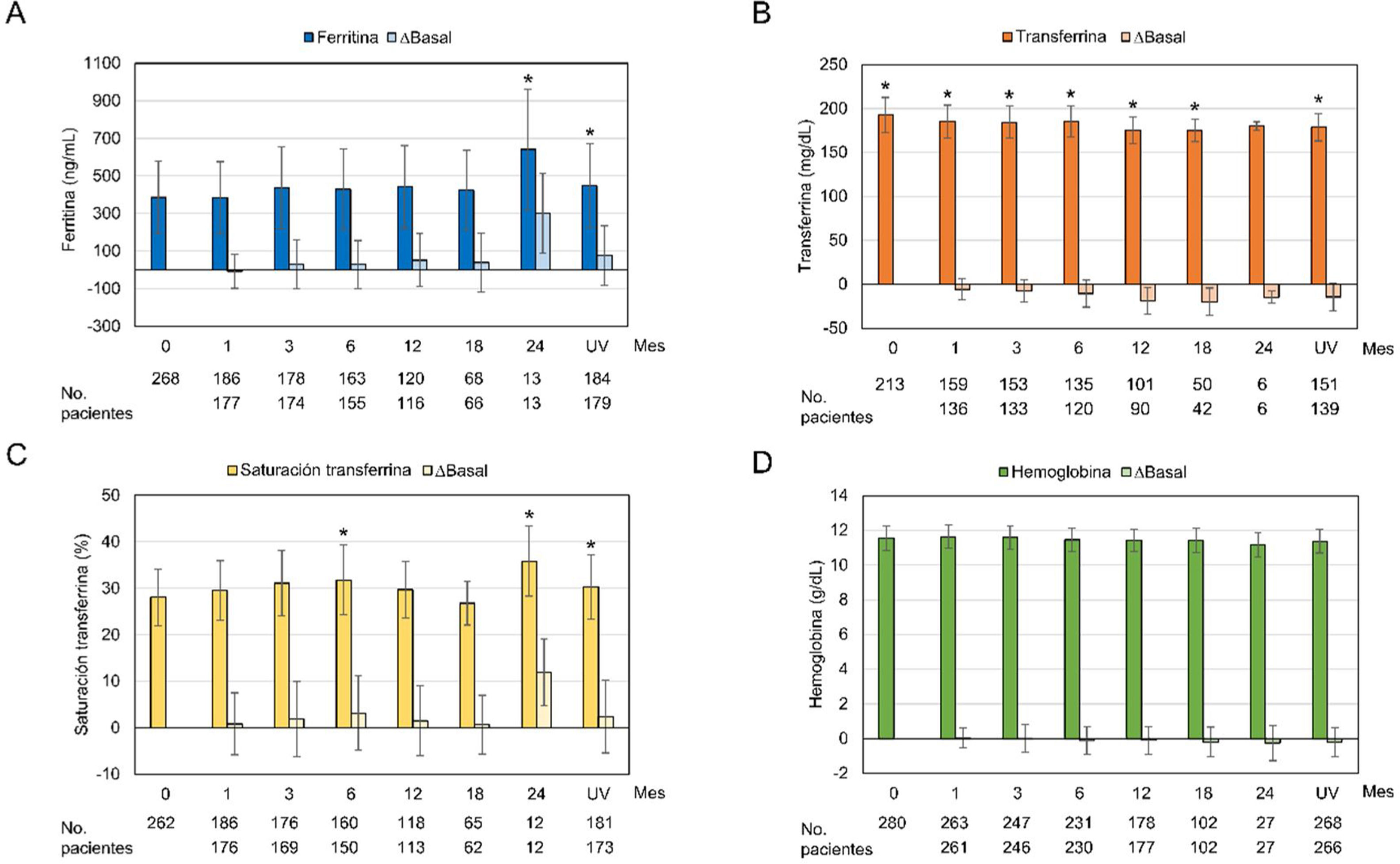
Cuando se analizaron los parámetros relacionados con el hierro, se observó un aumento de la ferritina a lo largo del tratamiento con OHS que alcanzó significación estadística en el mes 24 y en la última visita (386,66ng/mL al inicio frente a 447,55ng/mL en la última visita; p=0,0013). Los niveles de transferrina disminuyeron de manera significativa con el tratamiento con OHS en todas las visitas respecto a la visita basal, excepto en el mes 24 (p=0,053). El índice de saturación de la transferrina no mostró una tendencia definida, con incrementos significativos en los meses 6 y 24 y en la última visita. El perfil de la hemoglobina se mantuvo constante, sin cambios significativos en ninguna de las visitas respecto al inicio del tratamiento (fig. 3). Cuando se analizaron los niveles de ferritina en función del tratamiento concomitante con hierro intravenoso u oral, se observó que únicamente aquellos pacientes que habían recibido tratamiento concomitante presentaron un incremento significativo en los niveles de ferritina en los meses 3, 6, 24 y en la última visita (362,64ng/mL al inicio y 473,99ng/mL en la última visita; p=0,0003). Por el contrario, los pacientes que no habían sido tratados de manera concomitante con hierro intravenoso u oral presentaron una disminución en los niveles de ferritina respecto al inicio, a excepción del mes 12 y la última visita (419,61ng/mL al inicio y 413,18ng/mL en la última visita; p=0,56) (figura suplementaria 1).
Valores de los parámetros del hierro y cambios respecto a los valores basales durante el periodo de observación.
UV: última visita.
Los gráficos muestran la media±desviación estándar y los cambios respecto al valor basal durante el periodo de observación (meses) en el conjunto de análisis de seguridad (n=282) para: (A) ferritina, (B) transferrina, (C) índice de saturación de la transferrina y (D) hemoglobina. * p≤0,05 respecto a la visita basal.
Se reportaron 40 eventos fatales en 24 (8,5%) pacientes: 11 sufrieron eventos cardiacos (3,9%), 6 (2,1%) trastornos generales y alteraciones en el sitio de la administración, 4 (1,4%) infecciones e infestaciones y 3 (1,1%) enfermedades gastrointestinales (tabla suplementaria 3). Ningún evento fatal se consideró relacionado con el tratamiento.
La proporción de pacientes con RAM y EMIE fue comparable entre pacientes en hemodiálisis y diálisis peritoneal, si bien fueron ligeramente superiores en pacientes en hemodiálisis para los EMIE (15,3 vs. 10,6%) y, dentro de estos, para los EMIE clasificados como serios (21,2 vs. 14,3%). El 3,94% del total de RAM, EMIE y eventos fatales resultó en una reducción de la dosis de OHS.
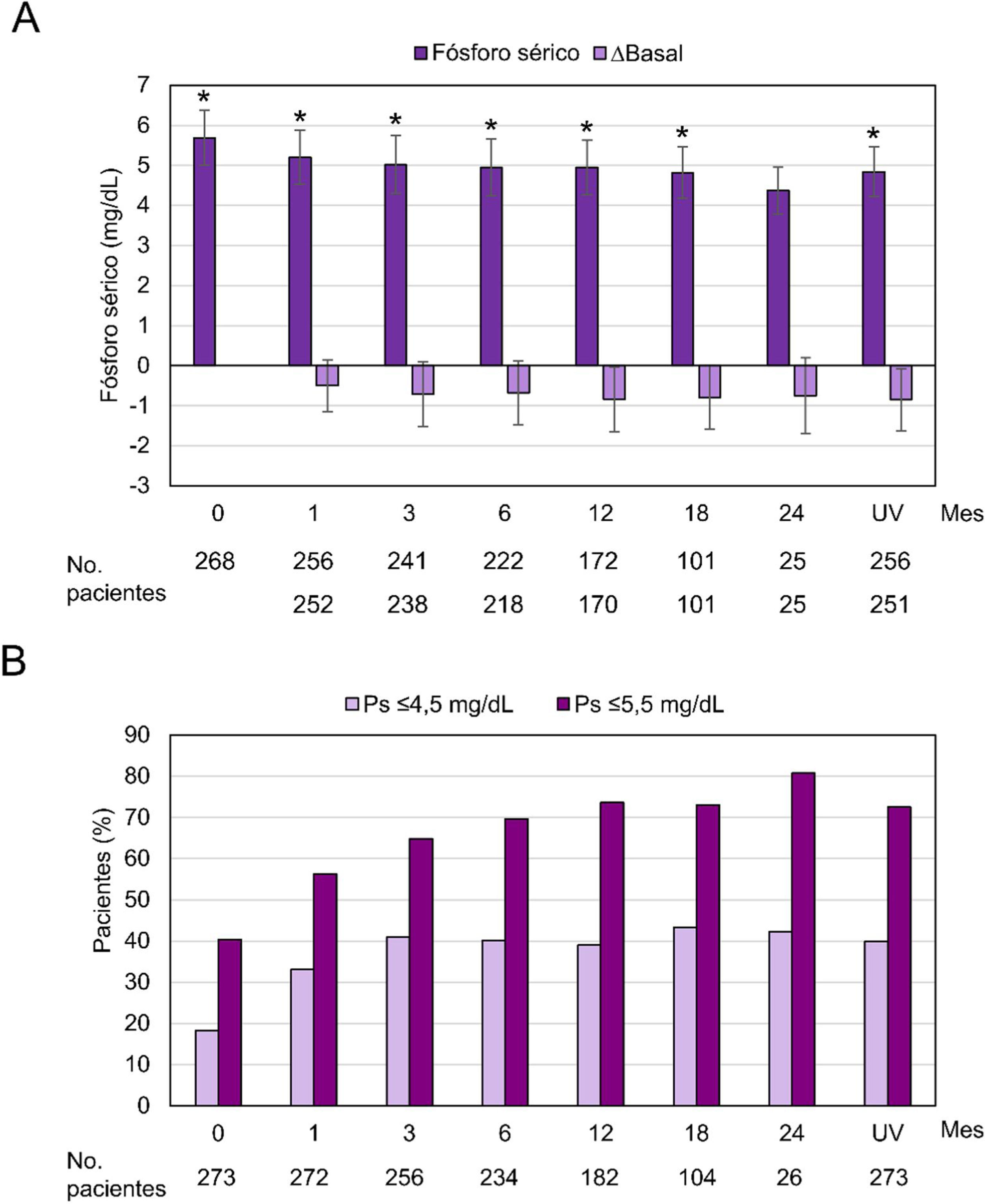
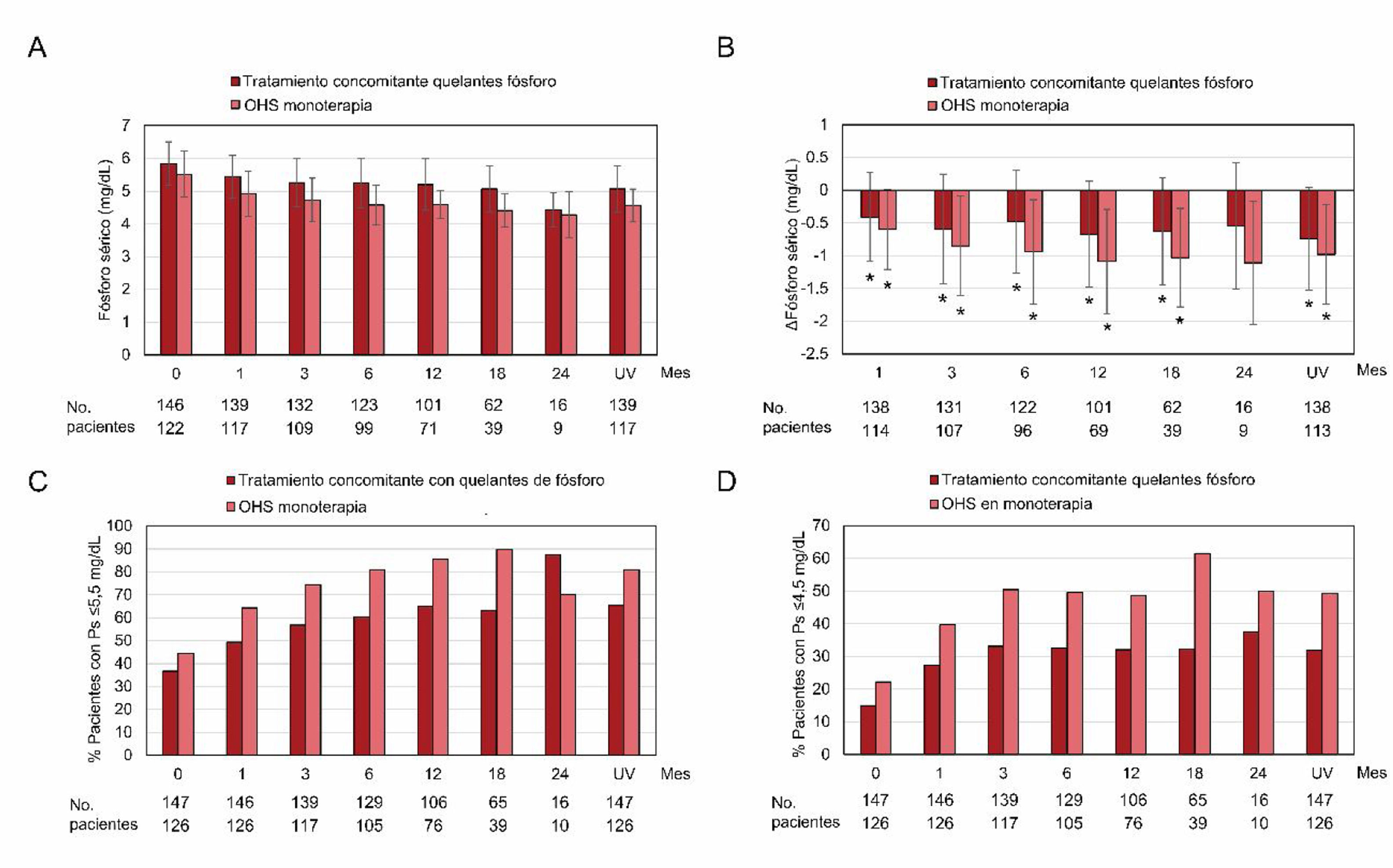
Variables de efectividadLos niveles de fósforo sérico disminuyeron progresivamente y de manera significativa a lo largo del seguimiento, a excepción del mes 24 cuya diferencia respecto a la visita basal no alcanzó significación estadística (p=0,058). En la visita basal, el nivel de fósforo sérico fue 5,69±1,37mg/dL y disminuyó hasta 4,84±1,25mg/dL en la última visita (p<0,0001). Un 40,3% de los pacientes tenían niveles de fósforo≤5,5mg/dL en la visita basal, mientras que en el mes 12 la proporción ascendió al 73,6% y al 72,5% en la última visita. La proporción de pacientes con niveles de fósforo≤4,5mg/dL aumentó desde un 18,3% en la visita basal hasta un 39% en el mes 12 y un 40,0% en la última visita (fig. 4).
Niveles de fósforo sérico durante el periodo de observación.
Ps: fósforo sérico; UV, última visita
(A) Media±desviación estándar y diferencia respecto al valor basal del fósforo sérico durante el periodo de observación (meses) en el conjunto de análisis completo (n=273). * p≤0,05 respecto a la visita basal, p=0,058 en el mes 24. (B) Proporción de pacientes con niveles de fósforo sérico≤4,5mg/dL y ≤5,5mg/dL.
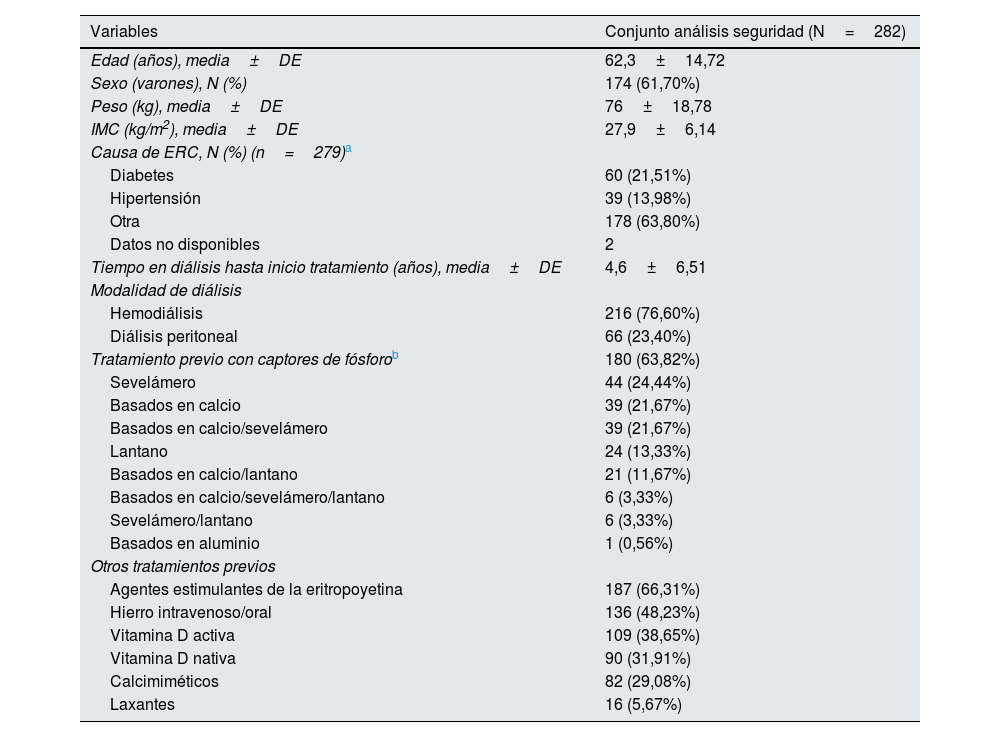
El análisis estratificado en base al tratamiento concomitante con captores de fósforo durante el estudio mostró una mayor reducción en los valores absolutos de fósforo en el grupo de pacientes que no recibió tratamiento concomitante (OHS en monoterapia). La proporción de pacientes que alcanzó niveles «objetivo» de fósforo (≤5,5mg/dL) aumentó en los 2 grupos, siendo más alta en el grupo tratado con OHS en monoterapia. La proporción de pacientes con niveles de fósforo≤4,5mg/dL en la última visita fue del 32% en el grupo que recibió tratamiento concomitante y del 49,2% en los tratados con OHS en monoterapia (fig. 5).
Niveles de fósforo sérico durante el periodo de observación en función del tratamiento concomitante con captores de fósforo.
OHS: oxihidróxido sucroférrico; Ps: fósforo sérico; UV: última visita.
(A) Media±desviación estándar de los niveles de fósforo sérico durante el periodo de observación (meses) en pacientes que recibieron tratamiento concomitante con captores de fósforo u OHS en monoterapia en el conjunto de análisis completo (n=273). (B) Diferencia respecto al valor basal en los niveles de fósforo sérico. * p≤0,05 respecto a la visita basal. (C) Proporción de pacientes con niveles de fósforo sérico≤5,5mg/dL y (D)≤4,5 mg/dL en pacientes que recibieron tratamiento concomitante con captores de fósforo u OHS en monoterapia en el conjunto de análisis completo.
La dosis diaria inicial de OHS fue 884,6±424,94mg (1,77 comprimidos/día) y aumentó hasta 1002,7±520,92mg (2,01 comprimidos/día) en la última dosis. Durante el periodo de observación del estudio, la dosis diaria media fue 988,1±448,87mg (1,98 comprimidos/día).
Los pacientes que recibieron tratamiento concomitante con otros captores de fósforo recibieron una dosis mayor de OHS durante el seguimiento (1084±450,21mg [2,17 comprimidos/día]) en comparación con los que recibieron OHS en monoterapia (876,3±422,22mg [1,75 comprimidos/día]).
Parámetros relacionados con el trastorno mineral y óseo asociado a la enfermedad renal crónicaNo se observaron cambios relevantes en los niveles de calcio, PTHi o 25-hidroxivitamina D en la población de seguridad durante el seguimiento (figura suplementaria 2).
DiscusiónLos resultados de la población española del estudio VERIFIE muestran la efectividad de OHS en la reducción del fósforo sérico, con un perfil de efectividad, seguridad y un número reducido de comprimidos diarios consistentes con el estudio internacional21 y con los estudios pivotales15,16.
En este análisis se incluyeron datos de los 282 pacientes españoles pertenecientes al estudio internacional VERIFIE21, uno de los estudios más extensos reportados hasta la fecha en esta población en España. En términos generales, los datos demográficos y clínicos basales fueron similares a los del estudio internacional21. Sin embargo, se han observado algunas diferencias como la incidencia de hipertensión que en el subgrupo de pacientes españoles (14%) fue ligeramente inferior a la del estudio internacional (21%)21 y a la del ensayo fase iii (24%)15. Además, la diálisis peritoneal tuvo una mayor incidencia en este análisis (23%) en comparación con el estudio internacional (12%)21 y el estudio fase iii (8%)15. También se apreciaron diferencias en el tratamiento previo con otros captores de fósforo; una menor proporción de pacientes de los centros españoles recibieron sevelámero en comparación con el estudio internacional (24,4 frente a 35%)21. Se reportó también un mayor porcentaje de interrupciones del tratamiento en este análisis (33,54%) frente al estudio global (17%)21.
El perfil de seguridad de OHS a largo plazo mostró una incidencia y severidad de las RAM similar a la observada previamente21. La proporción de pacientes con RAM y EMIE fue ligeramente inferior en el subgrupo español en comparación con el estudio internacional21. Tal y como se observó en estudios publicados anteriormente15,16,23, la mayoría de las RAM fueron de tipo gastrointestinal y, principalmente, diarrea. La diarrea fue transitoria en la mayoría de los casos. La reducción de la dosis de OHS debido a la existencia de RAM, EMIE y eventos fatales se produjo en un 3,94% de los casos. No se puede descartar, por tanto, que en algún caso la mejora en la diarrea se debiera a dicha reducción. Un estudio fase iii y su posterior extensión en pacientes con ERC en diálisis comparó la eficacia y seguridad de OHS con la del carbonato de sevelámero, mostrando que la diarrea leve y las heces decoloradas eran más frecuentes con OHS y las náuseas y el estreñimiento con sevelámero15. La extensión a largo plazo de este estudio reportó una incidencia similar de eventos gastrointestinales entre ambos tratamientos16.
La mayoría (98%) de los EMIE reportados fueron gastrointestinales y únicamente un 6,3% fueron severos. Se registraron 8 sangrados gastrointestinales, pero en todos los casos existían factores de riesgo previos y no se observó ningún retraso significativo en el diagnóstico de la hemorragia gastrointestinal relacionado con la decoloración de las heces en el subgrupo español. El 48,2% de los pacientes estaban tomando suplementos de hierro (oral/intravenoso) al inicio. Los 40 eventos fatales registrados se consideraron no relacionados con el tratamiento.
Pese a la naturaleza férrica de este compuesto, no se observaron alteraciones clínicamente relevantes en variables relacionadas con el metabolismo del hierro. El cambio en los niveles de ferritina fue ligeramente inferior que en el estudio internacional (29,6ng/mL frente a 43,22ng/mL a los 6 meses)21 y que en el análisis post hoc del estudio fase iii en la semana 24 (119ng/mL)24. Tanto en el estudio internacional como en el subgrupo español solo se observó un incremento significativo en los niveles de ferritina respecto a la visita basal en pacientes que recibieron hierro intravenoso u oral. Este hecho concuerda con lo observado tanto en el estudio fase iii15,16 y el análisis post hoc24 como en estudios observacionales retrospectivos18,19 e implica una absorción mínima del hierro asociada al tratamiento con OHS. Cabe destacar que uno de los 2 casos de sobrecarga de hierro del estudio internacional perteneció al subgrupo de pacientes españoles.
Los datos de efectividad estuvieron en línea con los del estudio internacional21, alcanzando una reducción significativa y progresiva de los niveles de fósforo que se mantuvo dentro de rango (≤5,5mg/dL) a partir del primer mes hasta el final del seguimiento. Cabe destacar que la proporción de pacientes con niveles de fósforo sérico≤4,5mg/dL aumentó desde el 18,3% en la visita basal hasta el 41% en el mes 3 y permaneció alrededor del 40% durante el seguimiento. Estos porcentajes apoyan el efecto rápido y duradero del OHS previamente reportado en el estudio internacional21 y resultan prometedores ya que, como se reportó en el estudio COSMOS, niveles de 4,4mg/dL se asocian con el menor riesgo de mortalidad7. En línea con esto, la SEN establece 4,5mg/dL como el límite superior de fósforo sérico recomendado6.
Una de las diferencias con el estudio internacional es que, en el subgrupo español, los valores de fósforo sérico fueron sistemáticamente inferiores y la proporción de sujetos con niveles objetivo fue superior21. Después de 3 meses de tratamiento con OHS, se observaron cambios en los niveles de fósforo sérico de −0,71 y −0,76mg/dL en el presente análisis y en el estudio internacional21, respectivamente, valores que contrastan con la mayor reducción (−0,71mmol/L, −2,17mg/dL) observada en la semana 12 en el estudio fase iii15. Estas diferencias llaman la atención pero se podrían explicar, además de por diferencias en el diseño de ambos estudios, por los niveles basales marcadamente inferiores en este subanálisis y en el estudio internacional en comparación con los observados en los estudios fase iii con OHS15,25 y en otros estudios observacionales17,19. También podría ser explicado por las características específicas de la práctica clínica española, así como por diferencias en la dieta. De manera similar al estudio internacional21, la proporción de pacientes con niveles «objetivo» (≤5,5mg/dL) y «óptimos» (≤4,5mg/dL) de fósforo fue mayor en el subgrupo tratado con OHS en monoterapia.
La dosis diaria inicial de OHS fue 884,6±424,94mg (1,77 comprimidos/día) y aumentó hasta 988,1±448,87mg (1,98 comprimidos/día) durante el periodo de observación. Este reducido número de comprimidos, ligeramente inferior que el reportado en el estudio internacional21, contrasta con las dosis diarias medias necesarias con otros captores de fósforo. En un subanálisis del estudio DOPPS se reportó una media de 6 comprimidos/día de captores de fósforo a nivel global y de 5,1 en España26. El presente estudio también refleja que la dosis diaria media fue mayor en sujetos que recibieron tratamiento concomitante con otros captores (2,17 comprimidos/día) comparado con los tratados con OHS en monoterapia (1,75 comprimidos/día) y que la proporción de pacientes con niveles objetivo fue mayor en estos últimos. El menor número de comprimidos con OHS en monoterapia podría explicarse considerando el hecho conocido de que la prescripción de un mayor número de comprimidos/día se asocia con un menor cumplimiento y adherencia26 y un menor control del fósforo27. En un estudio prospectivo, el cambio de tratamiento a OHS resultó en una disminución de los niveles de fósforo con un menor número de comprimidos, lo que resultó en un aumento en la adherencia al tratamiento 28.
El reducido número de comprimidos reportado con OHS tiene especial relevancia en la población en diálisis, habitualmente polimedicada, y ayudaría a explicar las tasas elevadas de pacientes con niveles «objetivo» de fósforo observadas en este estudio. Sin embargo, es importante resaltar el 33,5% de interrupciones permanentes del tratamiento con OHS, siendo una de las causas principales la decisión del paciente (27,1%)29. En este contexto, la efectividad de estos agentes no radica únicamente en su capacidad de unir fósforo, sino también en su posibilidad de ser aceptado por el paciente. A su vez, se ha observado que tener en cuenta las preferencias del paciente mejora la adherencia del mismo30. El análisis por países del estudio DOPPS mostró que solo el 61% de los sujetos españoles incluidos reportó haber tomado el tratamiento prescrito con captores de fósforo26. De manera similar, en un estudio conducido en España, solo el 40% de los 121 pacientes incluidos era cumplidor, mostrándose una relación entre el número de comprimidos y la baja adherencia a los captores de fósforo29.
Por último, no se observaron cambios sustanciales en variables como el calcio, PTHi o 25-hidroxivitamina D durante el tratamiento con OHS, en línea con lo reportado anteriormente16, reforzando la especificidad del OHS hacia el fósforo. Es importante resaltar que modificaciones en la dosis o el inicio del tratamiento con calcimiméticos pueden modular los niveles de PTHi o fósforo. En este estudio, un 29,1% de los pacientes estaba recibiendo tratamiento con calcimiméticos antes del inicio del estudio y un 41,8% durante el seguimiento.
El estudio VERIFIE fue el primero en mostrar los resultados de práctica clínica con OHS de manera prospectiva y a largo plazo. Este subanálisis refleja la experiencia con OHS en los centros españoles participantes en VERIFIE. La importancia de este subanálisis radica en la utilidad de conocer la evolución de los pacientes teniendo en cuenta los perfiles demográficos y clínicos y las actuaciones clínicas específicas de España, lo que podría ayudar a reforzar y optimizar algunos aspectos del manejo clínico de esta población. Una de las principales fortalezas del estudio es el considerable tamaño muestral y el amplio rango de variables clínicas analizadas. Los resultados obtenidos están en línea con los reportados en el estudio internacional21 y ensayos publicados anteriormente, pero muestran las particularidades específicas de este subgrupo.
Las principales limitaciones del estudio residen en su carácter observacional, la falta de grupo control y la ausencia de datos relativos a la adherencia de los pacientes. Debido a su carácter observacional y de seguimiento a largo plazo, el tamaño muestral disminuyó a lo largo del seguimiento, resultando en un grupo limitado de pacientes en el mes 24. Cabe destacar que algunas variables, como el periodo de aparición del primer episodio de diarrea, se tuvieron que agrupar por meses debido al número reducido de datos.
ConclusiónEste subanálisis del estudio VERIFIE muestra que OHS fue un tratamiento efectivo para el control de la hiperfosfatemia con un número muy reducido de comprimidos diarios según la práctica clínica habitual en pacientes españoles en diálisis. El perfil de seguridad fue similar al observado en la población internacional con una mayoría de eventos adversos de intensidad leve/moderada.
FinanciaciónEl presente trabajo ha sido financiado por Vifor Fresenius Medical Care Renal Pharma (Glattbrugg, Suiza).
Conflicto de interesesPablo Molina ha recibido honorarios por conferencias de Abbot, Amgen, Fresenius-Kabi, Nutricia, Sanofi y Vifor/Fresenius-Renal Pharma, así como por consultorías de Palex y Vifor/Fresenius-Renal Pharma. Nuria García Fernández ha recibido ayuda para formación de Vifor Pharma y ha participado en reuniones de asesoría científica de Mundipharma. Alejandro Martin Malo ha recibido honorarios por conferencias y consultorías de Medtronic, Vifor Pharma, AstraZeneca y Astellas. Roser Peiró Jordán es una empleada de Vifor Pharma. Jorge Cannata-Andia ha recibido becas de viaje de Vifor Pharma. El resto de los autores declara no tener conflictos de interés.
Carla Granados de Trialance SCCL ha asistido en la preparación del manuscrito.
Prof. Mariano Rodríguez, Dr. Jesús Grande Villoria, Dra. Ana Blanco Santos, Dr. Rafael García Maset, Dra. Pilar Sánchez Pérez, Dra. Fabiola Dapena Vielba, Dr. Juan Manuel Díaz Gómez, Dra. María Cruz Cid Parra, Dra. Laura Fuentes, Dra. M.a Paz Alcaide, Dr. Jesús Calviño Varela, Dra. M.a José Fernández Reyes, Dr. Emilio Gonzáles Parra, Dra. Rosa María Ruiz Calero, Dr. Pedro Abaigar, Dra. Josefa Galán González, Dr. Alejandro Pérez Alba, Dra. Adoración Martínez Losa, Dra. Mercedes Salgueira, Dra. Delfina Yetman Almiron, Dr. Juan Manuel Buades Fuster, Dra. Meritxel Ibernon Vilaron, Dr. José María Portolés Pérez, Dr. César Remón Rodríguez y Dr. José Luis Lerma.