Introducción: La obesidad aumenta el riesgo de proteinuria e insuficiencia renal crónica, y acelera la progresión de enfermedades renales. En los pacientes obesos existe un aumento de la actividad del sistema renina-angiotensina-aldosterona (SRAA) y de los niveles de aldosterona. Ningún estudio ha comparado la eficacia de las diferentes estrategias antiproteinúricas actualmente disponibles (inhibidores de la enzima convertidora de la angiotensina [IECA], antagonistas de los receptores de la angiotensina [ARA], antagonistas de la aldosterona) en pacientes obesos con nefropatías proteinúricas. Métodos: Es un estudio prospectivo y aleatorizado, realizado en un único centro. Fueron seleccionados doce pacientes obesos (índice de masa corporal >30 kg/m2), con proteinuria >0,5 g/24 h, de nuestras consultas de Nefrología. Los pacientes fueron tratados consecutivamente durante seis semanas y en orden aleatorio con un IECA (lisinopril 20 mg/día), una terapia combinada con IECA más ARA (lisinopril 10 mg/día más candesartán 16 mg/día) y eplerenona (25 mg/día). Se estableció un período de lavado de seis semanas entre los diferentes períodos de tratamiento. El objetivo principal del estudio fue el cambio en la proteinuria de 24 h al final de cada período de tratamiento y el número de pacientes que mostraban una reducción de la proteinuria superior al 25% con respecto al valor basal. Resultados: La reducción de la proteinuria obtenida por lisinopril (11,3 ± 34,8%) no fue estadísticamente significativa con respecto al valor basal, mientras que la reducción con lisinopril y candesartán (26,9 ± 30,6%) y eplerenona (28,4 ± 31,6%) mostró una diferencia estadísticamente significativa frente a sus valores basales (comparación intragrupo) y frente al grupo de lisinopril (comparación entre grupos). El número de pacientes que mostraron una reducción mayor al 25% de la proteinuria fue significativamente mayor con eplerenona (67%) y lisinopril + candesartán (67%) que con lisinopril (25%). Conclusiones: La monoterapia con antagonistas de la aldosterona (eplerenona) y la terapia de combinación con IECA + ARA fueron más efectivos que los IECA en monoterapia para reducir la proteinuria en pacientes obesos con diferentes tipos de nefropatías crónicas proteinúricas.
INTRODUCCIÓN
La obesidad es una causa reconocida de proteinuria y de daño renal progresivo1-3. Estudios recientes muestran que la glomerulopatía asociada a la obesidad es una entidad cada vez más diagnosticada y con una mayor incidencia3,4. Asimismo, la obesidad ha demostrado su participación en la progresión de diferentes patologías renales5-7. La cuantía de la proteinuria es un importante factor de riesgo en la progresión de la enfermedad renal en sujetos con nefropatías diabéticas y no diabéticas, y cualquier medida terapéutica que permita reducir la cantidad de proteinuria desarrollará una influencia favorable, renoprotectora, sobre la evolución a largo plazo de la función renal8,9. Entre estas medidas terapéuticas, el bloqueo del SRAA en sus diferentes modalidades, los IECA, los ARA, la combinación de IECA y ARA, y más recientemente los antagonistas de la aldosterona y de la renina, representan las medidas antiproteinúricas más eficaces10-13. Considerando lo anteriormente expuesto, el papel de la obesidad sobre la evolución de las enfermedades renales y las proporciones epidémicas que la obesidad ha alcanzado en las sociedades desarrolladas, la respuesta de los pacientes obesos con nefropatías proteinúricas a las diferentes estrategias que bloquean el SRAA es un tema de extraordinaria importancia clínica, teniendo en cuenta que la actividad del SRAA está incrementada en la obesidad14,15. Estudios recientes sugieren que los pacientes obesos presentan un incremento en la síntesis de aldosterona, lo que podría desempeñar un papel importante en las diferentes complicaciones asociadas a la obesidad, incluyendo el daño renal16,17. Estudios experimentales desarrollados en animales obesos han demostrado que el uso de los antagonistas de la aldosterona reduce drásticamente la progresión de las lesiones renales18. Estas investigaciones sugieren que los pacientes obesos con nefropatías proteinúricas podrían tener una respuesta antiproteinúrica más favorable a los antagonistas de la aldosterona que al tradicional bloqueo del SRAA con IECA o ARA. Sin embargo, no existe ningún estudio clínico que haya investigado específicamente esta cuestión. Para intentar demostrar esta hipótesis, diseñamos un estudio prospectivo, aleatorizado, para comparar la eficacia antiproteinúrica de un IECA (lisinopril), la combinación de un IECA y un ARA (candesartán más lisinopril), y un antagonista de la aldosterona (eplerenona) en pacientes obesos con proteinuria.
MATERIAL Y MÉTODOS
Pacientes
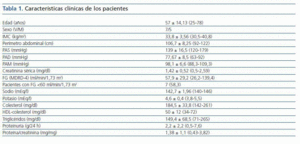
El estudio clínico fue aprobado por el comité de ensayos clínicos de nuestro hospital y se solicitó la firma del consentimiento informado a cada paciente antes de su inclusión en el estudio. Los pacientes fueron seleccionados en la consulta de Nefrología de nuestro hospital. Todos los pacientes cumplían los siguientes criterios: proteinuria superior a 0,5 g/24 h en al menos tres determinaciones consecutivas en un período de seis meses previo al estudio; obesidad, definida por un índice de masa corporal (IMC) superior a 30 kg/m2; y una función renal estable con un filtrado glomerular (FG) >15 ml/min/1,73 m2. Se excluyeron los pacientes con rápido deterioro de la función renal, con mal control de la presión arterial media (PAM >100 mmHg), pacientes que requerían más de tres fármacos antihipertensivos, con una situación clínica inestable, y pacientes que recibieran tratamiento con inmunosupresores o AINE. Los pacientes incluidos en el estudio fueron diabéticos y no diabéticos.
Diseño
Los pacientes seleccionados en este estudio pertenecen al mismo centro hospitalario, y se trata de un estudio prospectivo y aleatorizado. A aquellos pacientes que tomaban fármacos bloqueantes del SRAA se les indicó la necesidad de suspenderlos durante al menos seis semanas antes del inicio del estudio. Todos los demás fármacos antihipertensivos, incluyendo diuréticos, se mantuvieron en la misma dosis a lo largo del estudio. También se mantuvieron sin cambios otra serie de fármacos (estatinas, fármacos hipoglucemiantes e insulina en pacientes diabéticos). La doxazosina fue administrada en algunos pacientes durante el período de seis semanas previo a la aleatorización y durante los períodos de lavado para el control de la PA. Los pacientes mantuvieron su dieta habitual. Después de la aleatorización, los pacientes fueron incluidos de forma consecutiva durante seis semanas a un tratamiento con lisinopril (20 mg una vez al día), lisinopril (10 mg una vez al día) más candesartán (16 mg una vez al día) y eplerenona (25 mg una vez al día) en orden aleatorio. La aleatorización se realizó mediante unos sobres que contenían el orden del tratamiento que el paciente debía recibir. El orden resultante fue IECA, IECA más ARA, eplerenona en cuatro pacientes, IECA más ARA, eplerenona, IECA en otros cuatro, y eplerenona, IECA, IECA más ARA en los cuatro restantes. Se trata de un estudio de diseño abierto. Se establecieron seis semanas de período de lavado entre los tres diferentes períodos de tratamiento. La medicación del estudio fue administrada durante la mañana.
Parámetros clínicos y de laboratorio
Al inicio y al final de cada período de tratamiento se procedió a la recopilación de los diferentes datos clínicos y bioquímicos. Se realizó un examen físico general, incluyendo las mediciones del índice de masa corporal (peso en kilogramos dividido por el cuadrado de la altura en metros) y del perímetro abdominal. La PA fue medida tras cinco minutos de reposo con el paciente sentado, con un dispositivo automático. Se registró la media de tres lecturas. La PAM se calculó como la suma de la tercera parte de PA sistólica (PAS) y las dos terceras partes de la PA diastólica (PAD). Las analíticas realizadas incluían recuento sanguíneo completo, creatinina sérica, glucosa, sodio, potasio, ácido úrico, calcio, fósforo, colesterol total, colesterol HDL, colesterol LDL, triglicéridos, proteínas totales, albúmina, bilirrubina, transaminasas hepáticas, proteína C-reactiva y hemoglobina glucosilada en pacientes diabéticos. Las muestras de sangre para la actividad de la renina plasmática y aldosterona también se tomaron en cada visita, tras 30 minutos de reposo en decúbito supino. El día antes de cada visita los pacientes recogían muestras de orina durante 24 horas para las determinaciones urinarias de proteinuria, sodio, potasio y la excreción de creatinina. Además, se recogió una muestra de la primera orina de la mañana para realizar el cociente proteína-creatinina. Se utilizó un autoanalizador estándar para la medición de los parámetros bioquímicos. La actividad de la renina plasmática se midió con RIA, que detecta la cantidad de angiotensina I producida por hora, en presencia del exceso de angiotensinógeno (nanogramos de la angiotensina I producido por mililitro de plasma por hora). La aldosterona se midió utilizando un dispositivo RIA.
Objetivos del estudio
El objetivo principal del estudio fue el cambio en la proteinuria de 24 h al final de cada período de tratamiento. También fue analizado el número de pacientes que presentaron una reducción de la proteinuria superior al 25% con respecto al valor basal de cada período de tratamiento. Los objetivos secundarios fueron los cambios en la función renal (estimada por la creatinina sérica y el FG) y en el potasio sérico.
Tamaño de la muestra
Estudios previos6,19 mostraban que la adición de los fármacos antialdosterónicos (eplerenona o espironolactona) sobre otros agentes bloqueantes del SRAA incrementaban la reducción de la proteinuria basal entre un 25-50%. En un estudio piloto realizado por nuestro grupo (datos no publicados), se encontró que la reducción de la proteinuria en pacientes obesos era un 35% mayor con los antialdosterónicos que con los IECA o ARA. Estableciendo un nivel de confianza del 95%, se estimó que se necesitaban 11 pacientes para poder realizar el diseño del estudio. Finalmente, fueron seleccionados 12 pacientes para realizar el estudio.
Análisis estadístico
Los resultados se representan como media ± desviación estándar y con el rango entre los valores mínimo y máximo. Para establecer comparaciones entre los grupos con respecto a los valores basales, se utilizaron el test t de Student y el test de Mann-Whitney. Se utilizaron el test t de Student o el test de Wilcoxon para las comparaciones dentro de los grupos. Para las comparaciones entre grupos, se utilizaron el test de Kruskal-Wallis y el test de Mann-Whitney. Se realizaron correlaciones mediante el test de Pearson. Se consideraron significativos calores con una p <0,05. El análisis estadístico se realizó con el programa SPSS, versión 13.0 (SPSS Inc, Chicago, IL).
RESULTADOS
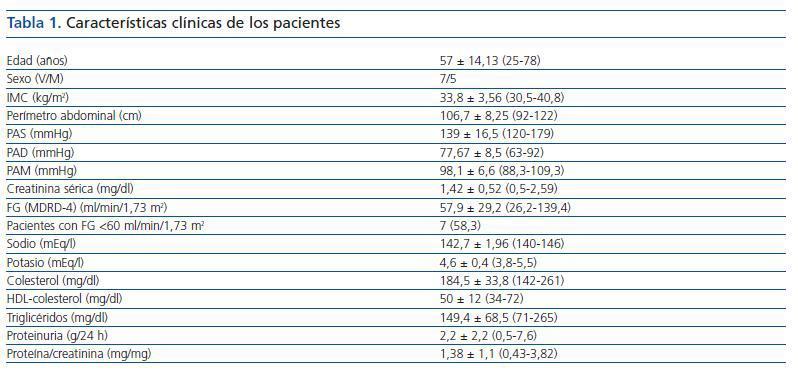
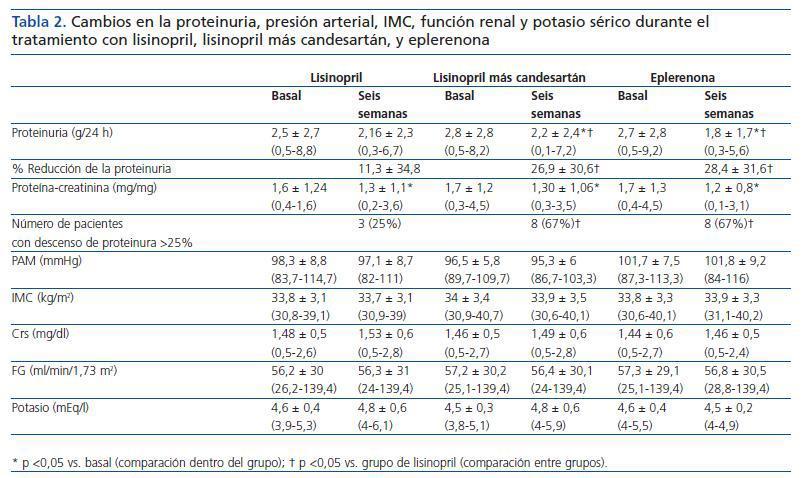
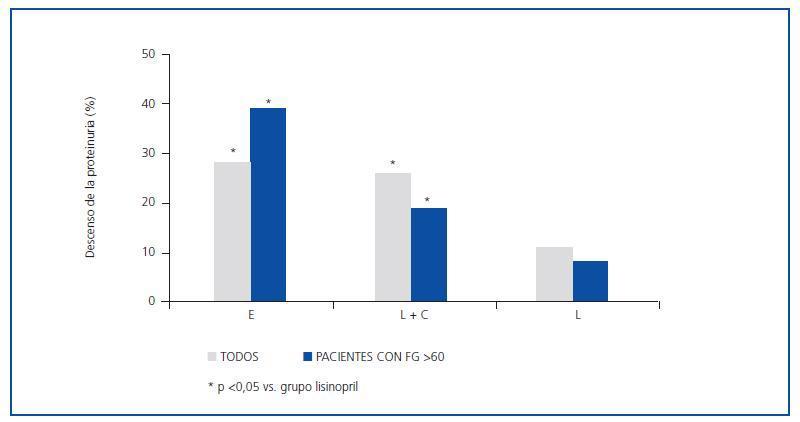
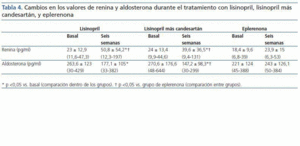
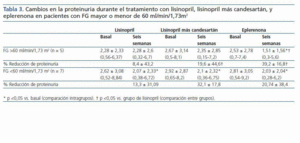
Se incluyeron 12 pacientes (siete varones, cinco mujeres), todos ellos caucásicos. En la tabla 1 se resumen las características clínicas de los pacientes estudiados. Siete pacientes (58%) tenían un FG inferior a 60 ml/min/1,73 m2. Los diagnósticos fueron nefropatía diabética (5), glomeruloesclerosis focal y segmentaria asociada a la obesidad (3), nefropatía IgA (2) y nefroangioesclerosis (2). Como se muestra en la tabla 2 y en la figura 1, tanto la eplerenona como la combinación de lisinopril y candesartán obtuvieron una reducción de la proteinuria significativamente mayor que lisinopril. La reducción de la proteinuria observada por lisinopril (11,3 ± 34,8%) no fue estadísticamente significativa con respecto al valor basal (p = 0,158), mientras que las de la combinación lisinopril y candesartán (26,9 ± 30,6%), y eplerenona (28,4 ± 31,6%) mostraron una diferencia estadísticamente significativa con respecto a los valores basales (comparación dentro del grupo p = 0,045 y p = 0,034, respectivamente) y al grupo de lisinopril (comparación entre grupos, p = 0,041 y p = 0,034, respectivamente).
La influencia de los tres tratamientos en el cociente proteínacreatinina mostró una tendencia similar a la obtenida con los valores de la proteinuria de 24 h, lo que indica que los resultados no fueron influenciados por los posibles errores de recogida de orina. La reducción en el cociente obtenida por lisinopril más candesartán y eplerenona (26,3 ± 21,6 y 27,2 ± 22,5%, respectivamente) fue superior a la obtenida por lisinopril (17,3 ± 19,6%), aunque estas diferencias no fueron estadísticamente significativas en la comparación entre grupos (tabla 2). El número de pacientes que mostraron una reducción de la proteinuria superior al 25% con respecto a los valores basales fue significativamente mayor con eplerenona (n = 8, 67%) y con lisinopril más candesartán (n = 8, 67%) que con lisinopril (n = 3, 25%, p = 0,026 con respecto a los otros grupos), tal y como se muestra en la tabla 2.
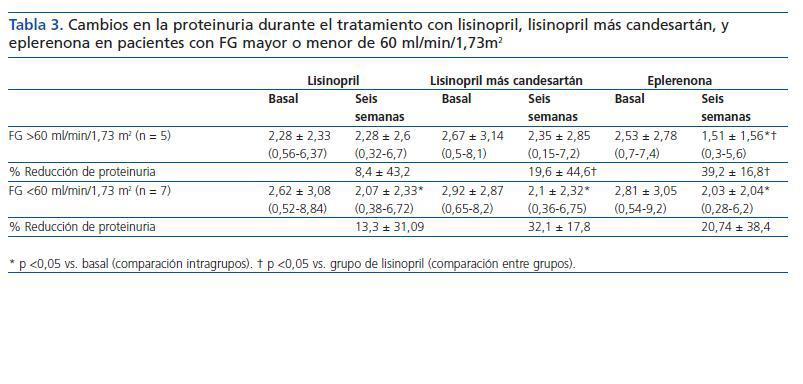
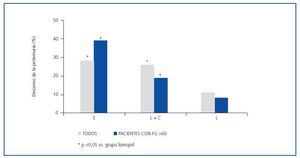
Como se indica en la tabla 3 y la figura 1, la eficacia antiproteinúrica de la eplerenona fue más evidente en pacientes con función renal conservada (FG >60 ml/min/1,73 m2). En este grupo de pacientes, la proteinuria disminuyó significativamente en un 39 ± 16% con respecto a los valores basales tras seis semanas en tratamiento con eplerenona (p = 0,043), mientras en los pacientes con un FG <60 ml/min/1,73 m2 fue de 20 ± 38% con respecto a los valores basales. Esta tendencia (respuesta antiproteinúrica superior en pacientes con función renal conservada) no se observó en los otros dos grupos de tratamiento (monoterapia con lisinopril y combinación lisinopril más candesartán).
La reducción de la proteinuria fue independiente de los cambios en la PA, el peso corporal o la función renal. No se encontraron correlaciones significativas entre la reducción de la proteinuria y la proteinuria basal, la actividad de la renina plasmática o la aldosterona.
Modificaciones en la presión arterial, índice de masa corporal, función renal y potasio sérico
Como se muestra en la tabla 2, no hubo cambios significativos en la PA, IMC, creatinina sérica o FG durante los tres diferentes períodos de tratamiento. Esta estabilidad también se observó entre los pacientes con FG <60 ml/min/1,73 m2 y los pacientes diabéticos cuando se analizaron por separado. El potasio sérico mostró un ligero incremento, aunque no significativo, en los tres grupos, sin encontrar diferencias entre los diferentes grupos de tratamiento. El número de pacientes en los que las cifras de potasio sérico se situaron por encima de 5,5 mEq/l tras el tratamiento fue de 2/12 (16%) con lisinopril y 2/12 (16%) con lisinopril más candesartán, mientras que ninguno de los pacientes tratados con eplerenona alcanzó este nivel de potasio. Todos los pacientes en los que el potasio sérico superó los 5,5 mEq/l tenían basalmente un FG <60 ml/min/1,73 m2. En el conjunto de pacientes con FG <60 ml/min/1,73 m2 (n = 7), el aumento de potasio sérico fue de 4,8 ± 0,4 a 5 ± 0,6 mEq/l con lisinopril (p = 0,398), 0,6 ± 0,3 a 5 ± 0,6 mEq/l con lisinopril más candesartán (p = 0,043 con respecto al valor basal) y 4,8 ± 0,4 a 4,7 ± 0,2 con eplerenona (p = 0,735). Los cambios en el potasio sérico de los pacientes diabéticos fueron similares a los de los no diabéticos.
Renina, aldosterona y otros valores de laboratorio
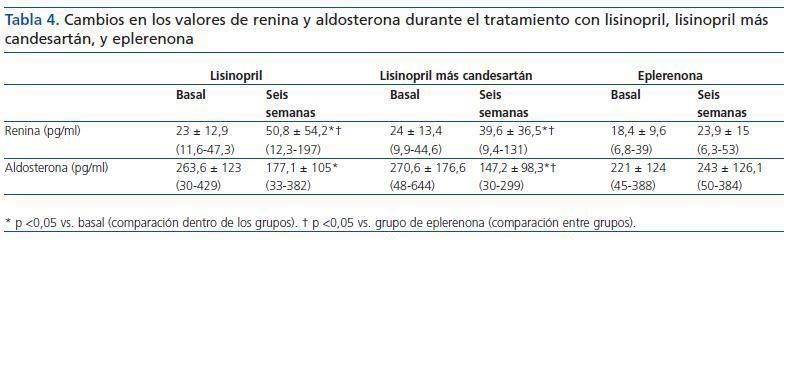
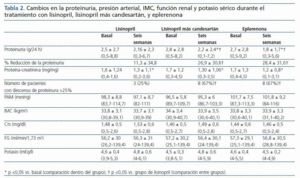
Se observó un incremento de la renina plasmática en los pacientes tratados con lisinopril y lisinopril más candesartán, mientras que la renina se mantuvo estable con eplerenona. Del mismo modo, la aldosterona sérica mostró una disminución significativa con lisinopril y con la combinación lisinopril más candesartán en comparación con eplerenona (tabla 4).
No hubo cambios significativos en los valores de glucosa, sodio, ácido úrico, calcio, fósforo, colesterol total, colesterol HDL, colesterol LDL, triglicéridos, proteínas totales, albúmina, bilirrubina, transaminasas hepáticas, proteína C-reactiva o hemoglobina glucosilada.
DISCUSIÓN
El bloqueo del SRAA, ya sea con el uso de IECA o ARA en monoterapia o en combinación, y más recientemente, con los antagonistas de la renina y aldosterona, representa la medida terapéutica más eficaz en la reducción de la proteinuria en ualquier nefropatía crónica proteinúrica10-13. La renoprotección obtenida por estos fármacos está estrechamente relacionada con su efecto antiproteinúrico. Sin embargo, estudios experimentales y clínicos han demostrado que la actividad del SRAA está incrementada en la obesidad y que el tejido adiposo, especialmente el visceral, sintetiza todos los componentes del SRAA14,15. Por otro lado, los pacientes obesos presentan niveles plasmáticos elevados de aldosterona18 y estudios recientes han demostrado que los adipocitos viscerales pueden secretar determinados factores que incrementan la producción de aldosterona por las glándulas suprarrenales, por vías diferentes a las rutas clásicas de la renina-angiotensina19. Los ácidos grasos oxidados, comúnmente elevados en obesos, también pueden aumentar la síntesis de aldosterona20. Este conjunto de datos podría sugerir un efecto antiproteinúrico más favorable de los antagonistas de aldosterona en los pacientes obesos, debido al iperaldosteronismo asociado a la obesidad. Los resultados de nuestro estudio apoyan esta hipótesis. Por una parte, encontramos que la reducción de la proteinuria lograda tras seis semanas de tratamiento con lisinopril fue más bien modesta (11,3 ± 34,8%). Las reducciones obtenidas por los antagonistas de aldosterona, eplerenona (28,4 ± 31,6%) y por la combinación de IECA más ARA (lisinopril más candesartán) (26,9 ± 30,6%) fueron significativamente más eficaces, y esta mejor respuesta no puede ser explicada sólo por las diferencias en los valores de la presión sanguínea en los grupos de tratamiento. El número de pacientes que lograron reducciones de la proteinuria superior al 25% respecto al basal fue significativamente mayor con eplerenona y con la terapia de combinación que con la monoterapia con lisinopril.
El hallazgo de que la eplerenona es más eficaz que la monoterapia con IECA para reducir la proteinuria en pacientes obesos es interesante, sobre todo teniendo en cuenta que utilizamos una dosis relativamente baja (25 mg/día). Epstein et al. demostraron que la coadministración de eplerenona (dosis de 50-100 mg) con un IECA, en comparación con un IECA en monoterapia, era más eficaz en la reducción de la albuminuria en pacientes diabéticos, sin presentar incrementos significativos en los valores de potasio21. La reducción de la proteinuria lograda con dosis de 50 mg de eplerenona (41%) no fue significativamente mayor cuando se duplicó la dosis a 100 mg/día (48%). Curiosamente, aunque este estudio no fue diseñado específicamente para los pacientes obesos, la media de IMC de los pacientes incluidos fue superior a 30 kg/m2.21 La dosis de 50 mg/día de eplerenona es la utilizada comúnmente en pacientes con insuficiencia cardiaca, situación clínica en la que los antagonistas de la aldosterona también han demostrado un efecto beneficioso22. Por lo tanto, es posible que dosis más elevadas de eplerenona (50 mg/día) puedan incrementar el efecto antiproteinúrico observado en nuestro estudio. El motivo para usar dosis bajas de eplerenona (25 mg/día) en nuestro estudio fue que más de la mitad de los pacientes presentaban insuficiencia renal (FG <60 ml/min/1,73 m2) y, por tanto, el riesgo de hiperpotasemia podría ser teóricamente superior en estos pacientes. Sin embargo, como se muestra en la tabla 2, el potasio sérico se mantuvo estable en los tres grupos de tratamiento. Sólo dos pacientes (16%) con lisinopril y lisinopril más candesartán presentaron un potasio sérico superior a 5,5 mEq/l, mientras que ninguno de los pacientes tratados con eplerenona presentó estas cifras de potasio. Estos resultados concuerdan con estudios previos que muestran una baja incidencia de hiperpotasemia en pacientes con enfermedad renal en tratamiento con inhibidores de la aldosterona12,21. Sin embargo, es importante resaltar que los resultados de nuestro estudio son a corto plazo (seis semanas de tratamiento), siendo necesario la realización de estudios a largo plazo que confirmen la seguridad de los antagonistas de la aldosterona en pacientes con diferentes nefropatías, y en especial en aquellos pacientes con insuficiencia renal crónica. En este sentido, es interesante señalar que en nuestro estudio la eplerenona fue particularmente eficaz en pacientes con función renal conservada (FG >60 ml/min/1,73 m2): el efecto antiproteinúrico en estos pacientes casi se duplicó respecto a los pacientes que presentaban un FG <60 (39 ± 16% vs. 20 ± 38%), como se muestra en la tabla 3. Varios estudios clínicos publicados en los últimos años han puesto de relieve la eficacia renoprotectora y antiproteinúrica de los inhibidores de la aldosterona, tanto espironolactona como eplerenona. La mayoría de estos estudios fueron diseñados para analizar el efecto antiproteinúrico del bloqueo de la aldosterona cuando se añade al tratamiento con un IECA o un ARA23-29, y todos ellos demostraron una importante reducción de la proteinuria con esta medida terapéutica. Sin embargo, existen pocos estudios que comparen la eficacia antiproteinúrica de los antagonistas de la aldosterona frente a los IECA o los ARA. Epstein et al., en un estudio prospectivo y aleatorizado en un gran número de pacientes diabéticos tipo 2, demostraron que la eplerenona (200 mg/día) tenía un mayor efecto antiproteinúrico que el enalapril 40 mg/día30. Rachmani et al. demostraron que la espironolactona (100 mg/día) fue superior a cilazapril (5 mg/día) para reducir la albuminuria en mujeres diabéticas tipo 231. En ambos estudios, la combinación de espironolactona o eplerenona con el IECA fue más eficaz que cualquiera de los dos fármacos por separado30,31. Nuestros resultados, obtenidos en pacientes obesos con nefropatía proteinúrica diabética y no diabética, coinciden con los resultados obtenidos en estos estudios previos. También encontramos que la combinación IECA-ARA tenía un efecto antiproteinúrico significativamente mayor que la monoterapia con IECA, y que su eficacia era similar a la del tratamiento con eplerenona. Varios estudios y metaanálisis han sugerido que la respuesta antiproteinúrica con la terapia de combinación IECA más ARA es superior a la encontrada con monoterapia IECA o ARA en dosis más altas, sin diferencias en el control de la presión arterial que podría interferir en los resultados11,32,33. Sin embargo, es necesario señalar que estudios recientes han mostrado una mayor incidencia de efectos adversos (duplicación de la creatinina sérica, diálisis) y de mortalidad con la combinación de un IECA más un ARA que con la monoterapia con estos fármacos, aunque se confirmó la mayor eficacia antiproteinúrica de la terapia combinada34.
Dentro de las limitaciones de nuestro estudio, debemos señalar que los períodos de tratamiento sólo fueron de seis semanas. Este hecho sólo nos permite sugerir un posible efecto renoprotector de los antagonistas de la aldosterona, ligados a una eficacia antiproteinúrica superior. Con respecto a la duración del estudio, es importante señalar que, aunque este tiempo es insuficiente para acreditar el perfil de seguridad de los diferentes grupos farmacológicos (eplerenona, IECA o IECA más ARA), no se observaron hiperpotasemias o cambios en el filtrado glomerular durante las seis semanas de tratamiento. Obviamente, es necesaria la realización de estudios prospectivos con un mayor tiempo de seguimiento, que permita demostrar el efecto renoprotector de estos fármacos. Es obligado recordar que tanto los IECA como los ARA en monoterapia han demostrado un claro efecto renoprotector en importantes estudios prospectivos en pacientes con nefropatía diabética y no diabética35-40.
En resumen, nuestro estudio indica que los antagonistas de la aldosterona pueden constituir una opción terapéutica muy interesante para los pacientes obesos con nefropatías proteinúricas, tanto diabéticas como no diabéticas. Estos resultados apoyarían el papel de la aldosterona en la patogenia del daño renal inducido por la obesidad, como diversos estudios experimentales recientes han mostrado. Sin embargo, son necesarios estudios con un mayor número de pacientes y un mayor seguimiento para valorar de forma concluyente la eficacia y la seguridad de estos fármacos.
¿Qué se sabe sobre esta cuestión?
- La cuantía de la proteinuria es un factor de riesgo en la progresión de las nefropatías crónicas proteinúricas diabéticas y no diabéticas. La suma de los antagonistas de la aldosterona al tratamiento habitual con IECA o ARA incrementa significativamente la reducción de la proteinuria en estos pacientes.
- Los pacientes obesos tienen un incremento de la síntesis de aldosterona, lo cual puede desempeñar un papel fundamental en las complicaciones de la obesidad. Los antagonistas de la aldosterona pueden reducir las lesiones renales observadas en modelos animales de obesidad.
¿Qué aporta este estudio?
- La monoterapia con un antagonista de la aldosterona (eplerenona) es más eficaz que un IECA en monoterapia (lisinopril) y de una eficacia similar a la combinación de un IECA más ARB (lisinopril más candesartán) en la reducción de la proteinuria en pacientes obesos con diferentes tipos de nefropatías proteinúricas.
- La eplerenona, así como los IECA y los IECA más ARB en combinación, fueron bien toleradas, y no se observaron hiperpotasemias significativas o deterioros de la función renal.
Tabla 1.
Tabla 4.
Tabla 2.
Tabla 3.
Figura 1.