Objetivo: Comparar in vitro la dinámica de la secreción de hormona paratiroidea (PTH) regulada por calcio y su relación con el ciclo celular en adenomas frente a hiperplasia de paratiroides. Material y métodos: Ocho adenomas de paratiroides y 23 glándulas hiperplásicas procedentes de 8 pacientes con hiperparatiroidismo primario y 7 pacientes con hiperparatiroidismo secundario, respectivamente. Para el estudio de la dinámica de secreción, pequeños fragmentos de tejido paratiroideo se transfirieron secuencialmente a intervalos de una hora a pocillos con concentraciones variables de calcio: 0,4, 0,6, 0,8, 1,0, 1,25, y 1,35 o 1,5 mM. Se determinaron las concentraciones de iPTH en el medio. Células paratiroides se aislaron sin el uso de enzimas y el ciclo celular paratiroideo se analizó por el método de Vindelov. El núcleo se adquirió por citometría de flujo y se analizó usando un software CELLFIT. Resultados: En los tejidos paratiroideos de las glándulas hiperplásicas, el aumento del calcio extracelular produjo una disminución de la secreción de PTH manifestada con valores de calcio de 0,8 mM y una inhibición máxima de secreción de PTH con un calcio de 1,25 mM. Por el contrario, en los tejidos de los adenomas de paratiroides se requirieron concentraciones de Ca de 1,2 mM para provocar una mínima disminución de la secreción de PTH. En los adenomas no hubo correlación entre las fases del ciclo celular y la calcemia o el set point, en las hiperplasias hubo una correlación significativa entre el porcentaje de células en fase G0/G1 con el set point (r = 0,914; p <0,005) y el calcio sérico basal (r = 0,862; p <0,02). Conclusiones: La regulación de la secreción de PTH por el calcio extracelular in vitro es menos sensible en adenomas que en glándulas hiperplásicas paratiroideas. En hiperplasia paratiroidea la proliferación celular parece estar regulada por la concentración de calcio extracelular (a mayor calcemia menor proliferación).
Aim: To compare the dynamics of calcium-regulated PTH secretion in vitro from adenomatous versus hyperplastic glands and to investigate the relationship between the parathyroid cell cycle and the calcium-regulated PTH secretion in these glands. Materials and methods: A total of 31 parathyroid glands (8 adenomatous and 23 hyperplastic) from 8 patients with primary hyperparathyroidism and 7 with secondary hyperparathyroidism respectively were studied. For the evaluation of calcium-regulated PTH secretion, small parathyroid pieces of 1 mm were sequentially transferred to wells with varying Ca concentrations: 0.4, 0.6, 0.8, 1, 1.25 and 1.35 or 1.5 mM. PTH concentrations were determined in the medium. For the parathyroid cell cycle studies, parathyroid cells were isolated without the use of enzymes and cell cycle was analyzed using the method described by Vindelov. The nuclei were acquired by flow cytometer and analyzed using the CELLFIT software. Results: In parathyroid tissues from hyperplastic glands, the increase in extracellular calcium produced a decrease in PTH secretion which was apparent with a calcium level as low as 0.8 mM and the maximal inhibition of PTH secretion was obtained with a calcium of 1.25 mM, by the contrary, adenomatous glands required a calcium of 1.2 mM to produce a minimal decrease in PTH secretion. In hyperplastic parathyroid glands but not in parathyroid adenomas there was a significant correlation between the percentage of cells in G0/G1 phase with the set point (r = 0.914; P <0.005) and the basal serum Ca (r = 0.862; P <0.02). Conclusions: The control of the extracellular calcium-PTH release in vitro is less sensitive in parathyroid adenomas than hyperplasic parathyroid glands. In parathyroid hyperplasia the cell proliferation may be regulated by the extracellular calcium concentration (higher calcemia less proliferation).
INTRODUCCIÓN
Desde hace años se sabe que el calcio sérico es el principal factor responsable del estímulo o frenación de la secreción de hormona paratiroidea (PTH) y que existe una relación sigmoidal inversa entre la concentración de calcio y la PTH1.
La glándula paratiroidea tiene una especial sensibilidad a las variaciones de la calcemia, y así, pequeños descensos en la concentración de calcio provocan rápidamente un aumento de la secreción de PTH, mientras que pequeños incrementos de calcemia la disminuyen.
Algunos estudios in vivo e in vitro ya han demostrado que esta respuesta de la PTH a cambios en la concentración de calcio es anormal en pacientes con hiperparatiroidismo primario2,3 y en pacientes urémicos con hiperparatiroidismo secundario4.
Hoy en día se sabe que el calcio ejerce su acción a través del receptor-sensor de calcio específico de la célula paratiroidea5,6, y se ha sugerido que una disminución de su densidad podría ser responsable de la menor respuesta a los cambios de concentración de calcio de las glándulas paratiroides hipertróficas o de los adenomas7.
Hasta ahora, la comparación in vitro de la respuesta de PTH regulada por calcio de adenomas procedentes de pacientes con hiperparatiroidismo primario frente a glándulas hiperplásicas de pacientes con hiperparartiroidismo secundario no ha sido plenamente evaluada8.
Por otro lado, se sabe que las diferentes concentraciones de calcio son capaces de estimular o frenar la proliferación de las células paratiroides9, pero la relación entre el ciclo celular y la concentración de calcio de adenomas paratiroideos e hiperplasia glandular también ha sido poco estudiada.
El objetivo de este estudio fue comparar la dinámica de la secreción de PTH regulada por calcio in vitro en adenomas frente a glándulas hiperplásicas y valorar la relación entre el ciclo celular paratiroideo y la secreción de PTH regulada por calcio en estas glándulas.
MATERIALES Y MÉTODOS
Pacientes
El estudio incluyó glándulas procedentes de 8 pacientes con hiperparatiroidismo primario y siete de pacientes afectados de enfermedad renal crónica con hiperparatiroidismo secundario, cuyas características se exponen en la tabla 1.
Tejido paratiroideo
Se incluyeron en el estudio un total de 31 glándulas paratiroideas, 8 adenomas y 23 glándulas con hiperplasia difusa que se procesaron de la siguiente manera: inmediatamente tras la resección, tanto los adenomas como las glándulas hiperplásicas se separaron en varias alícuotas e incubaron a 4 °C en RPMI con concentraciones de calcio de 1,5 mM durante 16-18 horas hasta que se realizaba el estudio in vitro.
De las varias alícuotas incubadas de cada glándula, una de ellas se empleó para la evaluación de la secreción de PTH in vitro y otra para el estudio del ciclo celular.
Evaluación de la secreción de hormona paratiroidea regulada por calcio in vitro
Medio de incubación
La alícuota de tejido paratiroideo se cortó en piezas de aproximadamente 1 mm3 que se separaron en pocillos individuales de nilón, cada uno de ellos con medio de incubación de 2 ml a 37 °C (AOS-0, SBS Instruments S.A., Badalona, España). El medio de incubación era una solución tamponada (pH = 7,4) que contenía, en mM, NaCl 125, KCL 5,9, MgCl2 0,5, NaH2PO4 y Na2HPO4 (1:2) 1, Na-piruvato 1, glutamina 4, glucosa 12, Hepes 25 con insulina rápida 0,1 U/ml, albúmina sérica bovina 0,1%, penicilina G 100 U/ml, estreptomicina 100 Pg/ml y CaCl2 en rangos desde 0,4 a 1,5.
Secreción de hormona paratiroidea regulada por calcio
Tras 5 horas de incubación, el tejido paratiroideo se transfirió secuencialmente a intervalos de una hora a otros pozos que contenían soluciones con concentraciones variables de calcio: 0,4, 0,6, 0,8, 1,0, 1,25 y 1,35 o 1,5 mM. La concentración de calcio se confirmó en cada experimento con la medición del calcio ionizado usando un electrodo selectivo (modelo 634, Ciba Corning, Essex, Reino Unido). El calcio ionizado en el medio se mantuvo constante durante la hora de incubación. La concentración de PTHi en el medio de incubación se midió usando el equipo humano PTHi IRMA (Nichols, Institute, San Juan Capistrano, CA, EE.UU.), con un coeficiente de variación intraensayo e interensayo de 4,3 y de 4,7%, respectivamente. El calcio iónico sérico fue medido con un electrodo selectivo de calcio (Ciba Corning c-634).
Terminología
Se utilizaron los siguientes términos: 1) PTH basal, el valor de PTH antes de la inducción de hipocalcemia o hipercalcemia; 2) PTH máxima, el valor más alto de PTH observado en respuesta a la hipocalcemia y que una reducción de la concentración de calcio sérico no lograba aumentar más el valor de PTH; 3) PTH mínima, el nivel de PTH mínimo durante la supresión por la hipercalcemia y que los aumentos posteriores de calcio sérico no lograban disminuir más su valor; 4) el set point de la secreción de PTH se calculó de dos maneras: una como la concentración de calcio sérico a la cual la secreción de PTH máxima se reducía a un 50% y, otra como la concentración de calcio que reducía la secreción de PTH a la mitad entre la secreción máxima y la mínima10.
Análisis del ciclo celular paratiroideo
Las células paratiroideas se aislaron sin el uso de enzimas. Pequeños fragmentos de tejido paratiroideo se aplastaron usando fórceps de Dupont en un microscopio invertido (×10), seguido de pipeteado suave. Para mantener una concentración celular alta, todas estas manipulaciones se realizaron con volúmenes bajos de PBS pL.
El ciclo celular paratiroideo se analizó usando el método descrito por Vindelov y Christensen11. Brevemente, los núcleos celulares limpios se aislaron por la acción combinada de un detergente no iónico Nonidet-P40 y tripsina, seguido por un tratamiento con inhibidor de la tripsina (type II-0) para parar la reacción de la tripsina y con RNAsa para prevenir que el colorante se una al ARN de doble cadena. En un paso final, los núcleos aislados se tiñeron con ioduro de propidio y se estabilizó con espermina.
El núcleo se adquirió por citometría de flujo (FACScan, Beckton-Dickinson, CA, EE.UU.) y se analizó usando un software CELLFIT (Beckton-Dickinson).
La viabilidad celular se evaluó por citometría de flujo. Las células se expusieron con fluordiacetato verde (15 min a 37 °C en la oscuridad), lo que tiñe las células vivas, y ioduro de propidio rojo (5 min a 37 ºC en la oscuridad) que marca las células muertas. Posteriormente, las células se introdujeron en el citómetro de flujo y se analizaron con el software LYSIS II (Beckton-Dickinson)12.
Reactantes
El RPMI se adquirió a Biowhittaker, Vervier, Bélgica; el PBS a Oxoid, Hampshire, Reino Unido; los demás reactivos provienen de Sigma, St. Louis, MO, EE.UU.
Análisis estadístico
Los valores se expresan en media ± DE. Se emplearon ANOVA y test de Duncan para comparar promedios múltiples. El test de la t no pareado se empleó para evaluar las diferencias entre promedios de grupos. La correlación entre dos variables se evaluó por análisis de regresión lineal.
RESULTADOS
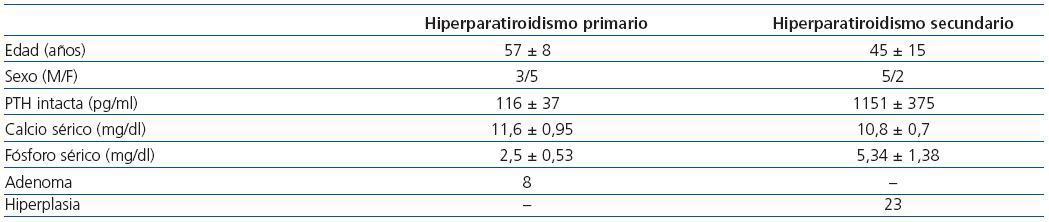
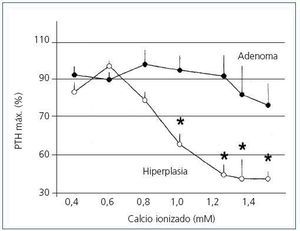
Los cambios en la secreción de PTH regulada por calcio in vitro en las 23 glándulas paratiroideas hiperplásicas y los 8 adenomas descritas anteriormente se exponen en la figura 1. En los tejidos paratiroideos de las glándulas hiperplásicas, el aumento del calcio extracellular produjo una disminución de la secreción de PTH manifestada con valores de calcio de 0,8 mM y una inhibición máxima de secreción de PTH con un calcio de 1,25 mM. Por el contrario, en los tejidos de los adenomas de paratiroides se requirieron concentraciones de Ca de 1,2 mM para provocar una mínima disminución de la secreción de PTH, lográndose inhibición de la secreción con el aumento de concentración de Ca.
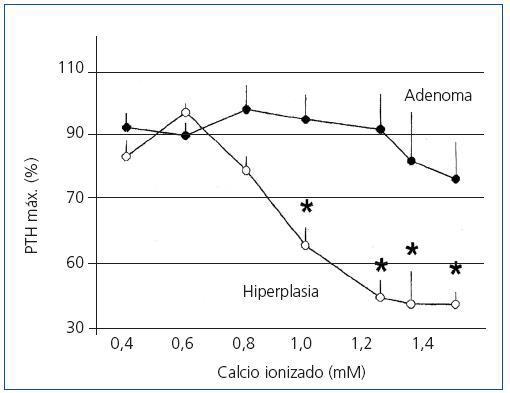
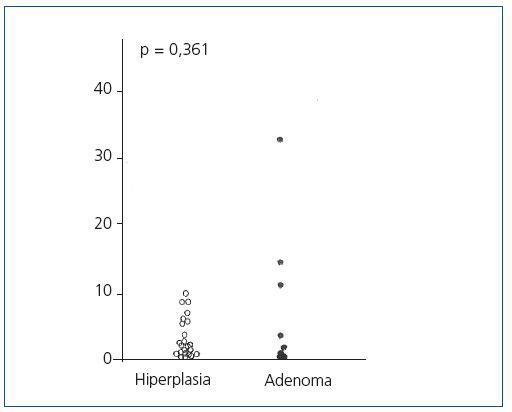
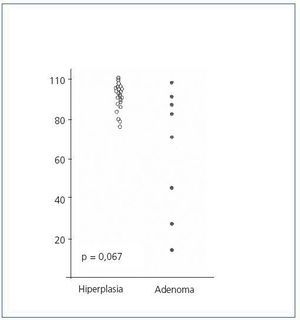
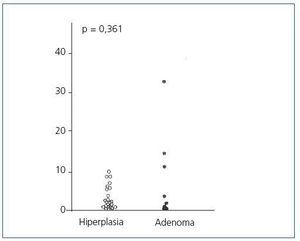
El análisis del ciclo celular mostró que el porcentaje de células paratiroideas en fase G0/G1 en adenomas paratiroideos fue variable, desde 13 a 97%, con media de 64 ± 12%; estos valores contrastan con los observados en glándulas de hiperplasia secundaria que fue siempre mayor a 74% con una media de 89 ± 3 % (figura 2). De manera similar, el porcentaje de células en fase S fue inferior al 10% en glándulas paratiroideas hiperplásicas mientras que 3 de los 8 adenomas paratiroideos tenían más del 11% de células en fase S (figura 3).
No hubo diferencias significativas entre los valores de las medias de los porcentajes de células en fase G0/G1 o fase S de los adenomas respecto a las glándulas hiperplásicas.
Para evaluar una posible asociación entre la severidad del hiperparatiroidismo y el porcentaje de células en reposo (fase G0/S1), los valores de PTH basales mínimos y máximos se correlacionaron con el porcentaje de células en fase G0/G1.
En los adenomas, no hubo ninguna correlación significativa.
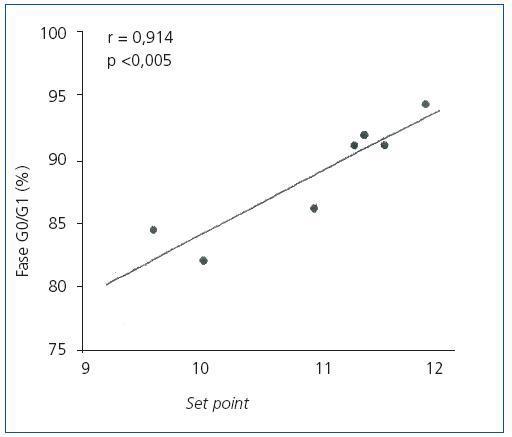
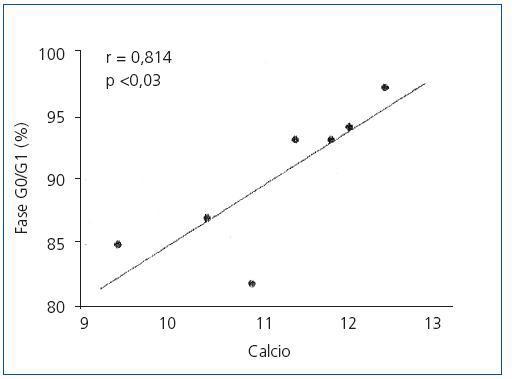
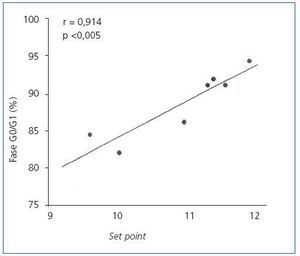
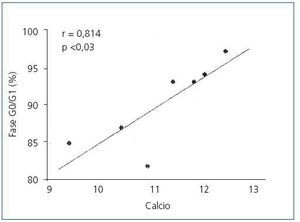
En las glándulas hiperplásicas, no hubo correlación significativa entre la concentración de PTH basal, mínima o máxima y el porcentaje de células en fase G0/G1 (valores de r = 0,525, 0,0821 y 0,709, respectivamente). No obstante, hubo una correlación significativa entre el porcentaje de células en fase G0/G1 con el set point de calcio (r = 0,914; p <0,005) (figura 4) y la concentración de calcio sérico basal (r = 0,862; p <0,02) (figura 5), es decir, a mayor concentración de calcio menor proliferación.
DISCUSIÓN
Estudios previos muestran que in vivo la regulación de la secreción de PTH en respuesta a los cambios en la concentración de calcio se encuentra alterada tanto en hiperpartiroidismo primario como en el secundario6-8,13. Otros estudios, tanto in vivo como in vitro, han mostrado que el set point de Ca y la secreción no supresible de PTH es mayor en pacientes con hiperparatiroidismo primario que en sujetos sanos14-16.
En un trabajo reciente10, utilizando tejido hiperplásico, observamos que si bien hay diferencias entre el set point de calcio in vivo e in vitro, el grado máximo de inhibición de PTH y la dinámica de la secreción de PTH regulada por el calcio es similar en las dos circunstancias, por lo que se puede extrapolar que los resultados obtenidos in vitro con tejido intacto son similares a los que se producen in vivo.
Estudios in vitro usando células paratiroideas aisladas de adenomas o glándulas hiperplásicas han demostrado que el set point de la secreción de PTH fue mayor que en el tejido paratiroideo normal, sugiriendo una regulación anormal de la secreción de PTH por calcio6-8,14.
En nuestro estudio, a diferencia de los anteriores, la secreción de PTH regulada por calcio in vitro se evaluó en adenoma paratiroideo y en hiperplasia paratiroidea secundario usando pequeñas cantidades de tejido paratiroideo intacto. El presente estudio demuestra que la secreción de PTH regulada por calcio es claramente diferente entre adenomas paratiroideos y glándulas hiperplásicas, siendo la secreción de PTH mínimamente inhibida por el calcio en adenomas y progresivamente disminuido en glándulas hiperplásicas a pesar de tratarse de pacientes con PTH basales significativamente más elevadas que las de los adenomas.
La concentración de calcio extracelular requerido para reducir la secreción de PTH fue significativamente mayor en adenomas que en glándulas hiperplásicas. Estos resultados indican que la supresibilidad de la secreción de PTH en adenomas está disminuida comparada con las glándulas hiperplásicas. Estos hallazgos son similares a otros comunicados en la bibliografía científica y en los que se empleaban células paratiroideas aislada7. En nuestro caso la diferencia entre adenomas y tejido hiperplásico parece magnificada, lo que se podria atribuir al hecho de que empleamos tejido intacto, que podría ser más equiparable a la situación in vivo. Una alteración en el receptor sensible a calcio en las células paratiroideas podría explicar esta diferencia. Algunos estudios demuestran que la proteína y el ARN mensajero del receptor sensible a calcio están disminuidos tanto en adenomas paratiroideos como en glándulas hiperplásicas, aunque más disminuidos en los adenomas17-19. No obstante, en un mismo estudio, la proteína del receptor-sensor de calcio determinada por inmunohistoquímica no fue diferente entre adenomas e hiperplasia20. Otros estudios han objetivado una considerable variación en el número de células con déficit de receptor de calcio en adenomas de paratiroides, aunque en cualquier caso, siempre se constata una significativa reducción en la expresión del receptor de Ca21.
En adenomas paratiroideos hubo un amplio rango en el porcentaje de células en fase G0/G1 (desde el 13 al 97%), en contraste a la hiperplasia secundaria con más de 74% de células en fase G0/G1. Estos hallazgos son similares a los comunicados por otros grupos de trabajo mostrando que en adenomas paratiroideo el porcentaje de células en G0/G1 estaba comprendido entre el 10 y el 90%, mientras que en la hiperplasia secundaria todas las glándulas tenían más del 70% de células en fase G0/G122-24. Estos datos sugieren una estimulación de crecimiento patológica diferente para adenomas paratiroideos respecto a las glándulas hiperplásicas. No se encontraron diferencias estadísticas entre la media del porcentaje de células en fase G0/G1 en adenomas frente a la hiperplasia secundaria, dado tal vez por la alta dispersión de los valores en el grupo de adenomas.
Es conocido que las células de las glándulas paratiroideas hiperplásicas muestran una moderada actividad proliferativa. Para proliferar, una célula debe entrar en la fase de ciclo celular donde ocurre la síntesis de ADN y posterior mitosis, y seguir una evolución organizada25,26. La progresión organizada a través del ciclo celular asegura que la replicación del ADN esté completa antes de que ocurra la mitosis. Durante la transición a través del ciclo celular, una célula puede permanecer en reposo en un número de checkpoints específicos que evitan completar el ciclo celular y por tanto la proliferación.
Una observación interesante de nuestro estudio fue la buena correlación entre el set point de secreción de PTH y el calcio basal con el porcentaje de células en fase G0/G1. De hecho, las concentraciones elevadas de calcio se asociaron con un bajo porcentaje de células proliferando. Estos resultados nos muestran que en las glándulas hiperplásicas, las células paratiroideas no siempre están en una fase de proliferación, como cabría esperar.
Por otra parte, la hipocalcemia se considera un factor relevante en la generación y desarrollo del hiperparatiroidismo secundario, por el efecto sobre el estímulo de la proliferación paratiroidea22. Nuestros hallazgos indican que el control de la proliferación de las células paratioideas por el calcio se mantienen también en estados avanzados de hiperpartiroidismo secundario.
En conclusión, la regulación de la secreción de PTH por el calcio extracelular in vitro es menos sensible en adenomas paratiroideos que en glándulas hiperplásicas paratiroideas. Además, en hiperplasia paratiroidea por hiperparatiroidismo secundario la proliferación celular parece estar regulada por la concentración de calcio extracelular, es decir, a mayor calcemia menor proliferación.
De todo ello se deduce que un cierto grado de hipercalcemia, o quizá más importante todavía, el tratamiento con calcimiméticos, podría frenar la proliferación celular en el hiperparatiroidismo secundario. Con ello, teóricamente también se podría prevenir el crecimiento monoclonal y la formación de adenomas, que son mucho más difíciles de controlar.
Tabla 1. Características clínicas y hallazgos patológicos
Figura 1. Cambios de secreción de PTH regulada por calcio in vitro: adenoma frente a hiperplasia de paratiroides
Figura 2. Porcentaje de células en fase G0-G1 (%)
Figura 4. Correlación entre el porcentaje de células en Fase G0/G1 con el set point de calcio
Figura 5. Correlación entre el porcentaje de células en fase G0/G1 con el [Ca]
Figura 3. Porcentaje de células en fase S (%)