Introducción: La poliquistosis renal autosómica dominante (PQRAD) es la enfermedad hereditaria más frecuente con mayor amenaza para la vida. El análisis molecular de microsatélites polimórficos, localizados en torno a los genes responsables de la enfermedad (PKD1 y PKD2) se utiliza para confirmar el diagnóstico y dar consejo genético. Métodos: Se desarrolló un método de genotipado para cinco marcadores de PKD1 y cuatro de PKD2, basado en dos reacciones de PCR múltiple y análisis por electroforesis capilar. Un total de 110 individuos, pertenecientes a 14 familias afectas, fueron genotipados para confirmar la concordancia con el método de PCR simple usado previamente. Resultados: El rango de tamaño de los fragmentos amplificados fue desde 95 a 154 pb, y los perfiles completos de marcadores microsatélites se obtuvieron a partir de 1-5 ng de ADN. La especificidad de la PCR múltiple fue del 88,5% (IC 95% 75,9-95,2), y la sensibilidad del 87,9 (IC 95% 76,1-94,6). Conclusiones: Esta estrategia, junto con la detección automática de alelos, permite realizar un análisis genético fiable, sencillo, más rápido y de menor coste que el basado en amplificaciones individuales de los microsatélites.
Background: Autosomal Dominant Polycystic Kidney Disease (ADPKD) is the most common life-threatening hereditary disease. Molecular analysis with highly polymorphic short tandem repeats, located in the vicinity of the two genes responsible for the disease (PKD1 and PKD2), is used to confirm diagnosis and give genetic counseling to members of affected families. Methods: We have developed a new assay to genotype five PKD1 and four PKD2 markers, based on two multiplex PCR reactions, and capillary electrophoresis analysis. A total of 110 subjects, belonging to 14 affected families, were genotyped to confirm the concordance with the singleplex method used previously. Results: The amplicons ranged from 95 to 154 bp in length, and complete STR profiles were obtained from 1-5 ng DNA. The specificity of the multiplex PCR system was 88,5% (95%CI= 75,9-95,2), and the sensitivity, 87,9 (95%CI= 76,1-94,6). Conclusions: This is a useful strategy that, together with automated computer-based allele detection, allows reliable, simple, faster, and cheaper genetic analysis than the previous singleplex method.
Introducción
La Poliquistosis Renal Autosómica Dominante (PQRAD) es la tercera causa más frecuente de enfermedad renal crónica1, y la enfermedad hereditaria que con mayor frecuencia amenaza la vida2. Su prevalencia varía entre 1/400 a 1/1000 individuos, dependiendo de la población3. Se caracteriza por la formación de múltiples quistes en los riñones y por trastornos cardiovasculares y gastrointestinales tales como aneurisma intracraneal o aórtico, prolapso de la válvula mitral, hernia de la pared abdominal, etc. El 50% de los pacientes presenta enfermedad renal crónica en la quinta década de vida.
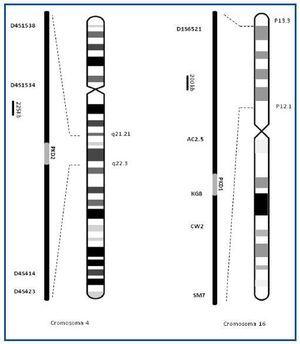
Hasta ahora, dos genes han sido identificados como causantes de la enfermedad: PKD1, en la región cromosómica 16p13.3 (85% de los casos), y PKD2, en la región cromosómica 4q21 (15% de los casos). La PQRAD se diagnostica con facilidad por ecografía cuando los quistes ya están presentes. Sin embargo, el análisis genético puede ser utilizado cuando los resultados ecográficos son confusos, o cuando se requiere un diagnóstico definitivo en un individuo menor de 30 años. Una aplicación importante del diagnóstico molecular es el consejo genético, consistente en proporcionar al paciente información sobre su enfermedad, el patrón de herencia y el riesgo de trasmisión a la descendencia (50%). Además, puede aplicarse en familias con PQRAD para confirmar posibles donantes de riñón. Por otro lado, actualmente se están llevando a cabo ensayos clínicos en los que se pone a prueba la capacidad de ciertos fármacos para frenar la progresión de la enfermedad2. Los pacientes con un diagnóstico temprano podrían ser candidatos al tratamiento con estos nuevos agentes terapéuticos en un futuro.
El análisis molecular se puede llevar a cabo mediante búsqueda directa de mutaciones o de forma indirecta, por análisis de ligamiento, usando marcadores informativos (microsatélites), localizados en las proximidades de los genes de interés. Estos marcadores permiten realizar el seguimiento del cromosoma responsable de la enfermedad a través de las generaciones de la familia estudiada. Dos series de microsatélites seleccionados en un estudio previo para PKD1 ((D16S521, KG8, AC2.5, CW2, SM7) y PKD2 (D4S1538, D4S1534, D4S423, D4S414) fueron usadas para el análisis de ligamiento en familias con PQRAD (Figura 1). La idoneidad de estos marcadores para nuestra población fue estudiada en 30 familias afectas4. Los marcadores fueron amplificados de forma individual y mezclados posteriormente para el análisis, permitiendo una identificación genética inequívoca del 97.7% de los pacientes y el 88.7% de los individuos sanos. La sensibilidad y la especificidad del análisis genético fueron 90.7% (IC95%: 85.7-95.7) y 86.8% (IC95%: 80.6-93.0), respectivamente.
En este trabajo, se presenta un nuevo análisis de microsatélites de PKD1 y PKD2 basado en PCR múltiple y electroforesis capilar.
Material y métodos
Un total de 110 individuos, 52 afectos (57,7% hombres) y 58 sanos (39,7% hombres), fueron analizados por el nuevo sistema de PCR múltiple. Estos individuos pertenecían a 14 familias con PQRAD que fueron escogidas de manera aleatoria entre aquellas incluidas en el análisis previo4. El estudio fue aprobado por el Comité Ético del Hospital Universitario de Gran Canaria Dr. Negrín. Asimismo, se obtuvo el consentimiento informado de todos los participantes en el estudio antes de su inclusión en el mismo.
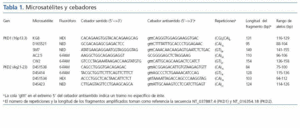
Una nueva serie de cebadores fue diseñada para el desarrollo de la PCR múltiple, asegurando una eficiencia de amplificación equivalente para todos los fragmentos de ADN, como se ha descrito previamente5. La longitud de los fragmentos amplificados varió entre 75 y 158 pares de bases (Tabla I). El objetivo fue obtener cebadores con un contenido en GC en torno al 35-60% y una temperatura de fusión teórica de 60ºC± 2ºC a una concentración de sales (K+,Na+, Tris+, ó NH4+) de 180mM. Como lugar de unión de cebadores, se evitaron las secuencias complejas, homopolímeros con más de cinco bases, y las estructuras secundarias potencialmente estables (por debajo del umbral de -13 kcal mol–1 de energía libre) alrededor de cada región de marcadores, para garantizar la sensibilidad y especificidad de la amplificación múltiple6. Usando el programa disponible en Integrated DNA Technologies (http://www.idtdna.com/Scitools/Applications/mFold/), se comprobó que ninguno de los cebadores candidatos presentaba estructuras secundarias o en horquilla. Los cebadores fueron sintetizados y purificados por HPLC por Bioron GmbH (Ludwigshafen, Germany) y Applied Biosystems (Foster City, USA). Para diferenciar los productos amplificados de tamaño parecido se usó fluorescencia multicolor, marcando el cebador sentido de cada par con uno de los siguientes fluoróforos: 6-FAM, HEX o NED. Cada par de cebadores fue probado en una PCR individual, con cinco muestras de ADN, bajo idénticas condiciones de amplificación, antes de desarrollar la reacción de PCR múltiple. La cantidad de cada cebador incluida en la mezcla final fue establecida de forma empírica, de acuerdo con los resultados de pruebas sucesivas. Igualmente, se probaron diluciones seriadas de MgCl2, desde 1.5 mM a 5 mM, para conseguir la máxima eficiencia de amplificación.
Debido a un ligero solapamiento entre el rango de tamaños de CW2 y D4S414 en algunas muestras, decidimos analizar los marcadores de PKD1 y PKD2 por separado. Ambas reacciones contenían 1-10ng de ADN, 3 mM MgCl2, 200 µM de cada dNTP, 0.05-0.1 µM de cada cebador, y 0.5 U de polimerasa AmpliTaq Gold (Applied Biosystems) en un volumen final de reacción de 12.5 µl. El protocolo de amplificación se llevó a cabo en un termociclador GeneAmp PCR System 9700 (Applied Biosystems), y consistió en una desnaturalización a 95ºC durante 5 minutos, seguida de 26 ciclos de 95ºC durante 30 segundos, 65ºC durante 30 segundos, y 72ºC durante 45 segundos, con un paso de extensión final de 20 minutos a 72ºC. Se obtuvo un producto del tamaño esperado para todos los loci. Con objeto de analizar la robustez de la PCR múltiple, todas las muestras fueron analizadas por duplicado.
La detección de los fragmentos de PCR mediante electroforesis capilar se llevó a cabo en un secuenciador ABI PRISMTM 310 (Applied Biosystems), usando un capilar no recubierto de 47 cm de longitud y polímero POP4 (Applied Biosystems). Para la electroforesis, 1µl de cada producto de PCR se mezcló con 20 µl de formamida desionizada (Applied Biosystems) y 0.2 µl del marcador de peso molecular GeneScan-ROX (Applied Biosystems). Las muestras fueron inyectadas a 15 KV durante 5 segundos, y separadas al mismo voltaje y una temperatura de 60ºC durante 24 minutos. Para la estimación del tamaño de los fragmentos se utilizó el programa GeneScan Analysis 3.1.2 (Applied Biosystems).
Resultados
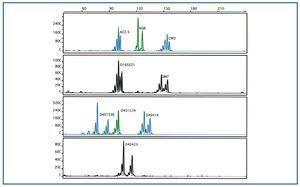
Inicialmente, cuatro marcadores (D4S423, CW2, D16S521 y SM7) dieron una señal débil, sugiriendo una amplificación pobre con las mismas condiciones y cantidades de cebador. Las reacciones mejoraron al aumentar la cantidad de cebador, alcanzando así el equilibrio adecuado entre las señales. Los mejores resultados fueron obtenidos a una concentración de 3mM MgCl2 para todos los marcadores (Figura 2). Las concentraciones ligeramente superiores inhibían la amplificación.
La identificación de los haplotipos individuales mostró una concordancia del 100% con los resultados previos del análisis por PCR simple. Los marcadores fueron totalmente informativos en todos los pacientes y en un 91.4% de los individuos sanos. La PCR múltiple mostró una especificidad del 88,5% (IC95%= 75,9-95,2), y una sensibilidad del 87,9 (IC95%= 76,1-94,6).
Discusión
Se ha descrito un gran número de marcadores para el análisis de los genes PKD1 y PKD2. En nuestro estudio previo4, empleamos un sistema simple de PCR para amplificar dos series de marcadores microsatélites de PKD1 y PKD2. Para desarrollar esta técnica era necesario llevar a cabo nueve reacciones de PCR diferentes para cada individuo, mezclar los productos de amplificación, y finalmente preparar la muestra para electroforesis capilar. Hasta la fecha, el sistema de PCR múltiple más simple publicado hasta el momento para el análisis de PQRAD es el de Vouk et al7, que consiste en tres reacciones de amplificación, combinando marcadores de PKD1 y PKD2.
Una parte importante de nuestro trabajo consistió en explorar varios aspectos de los métodos de PCR múltiple. Los cebadores fueron diseñados poniendo especial interés en evitar el autoalineamiento y la formación de dímeros, obteniendo la máxima eficiencia y equilibrio entre las cantidades de los productos de amplificación. Los cebadores fueron sometidos a HPLC para obtener moléculas puras y homogéneas, sin excedentes de fluoróforos que pudieran interferir en la detección de los alelos. Para evitar productos de amplificación inespecíficos se utilizó un programa de PCR Hot Start (en el que la polimerasa se activa a temperaturas elevadas y los productos de PCR se van acumulando lentamente).
Hemos desarrollado un nuevo sistema de PCR múltiple para genotipar 9 marcadores microsatélites de PQRAD en sólo dos reacciones. Una ventaja adicional de este sistema es que permite el análisis independiente de PKD1 ó PKD2. Dado que un 85-90% de la PQRAD está ligada a PKD1, el análisis de los marcadores de este gen será suficiente para determinar las características genéticas de la familia en muchos casos. El análisis genético mediante el sistema de PCR múltiple facilita tanto el consejo genético como el diagnostico temprano, de creciente importancia en esta enfermedad. En conclusión, esta estrategia junto con la detección automática de alelos, permite realizar un análisis genético fiable, sencillo, más rápido y de menor coste que el basado en amplificaciones individuales de los microsatélites, favoreciendo la inclusión de los estudios familiares en la rutina clínica.
Figura 1.
Figura 2.
Tabla 1.