Introducción: Las alteraciones del metabolismo óseo-mineral presentan una alta prevalencia en los pacientes con enfermedad renal crónica (ERC), siendo mayor conforme avanza el estadio de enfermedad. El diagnóstico de dichas alteraciones se basa fundamentalmente en la determinación de niveles de hormona paratiroide (PTH-i). Sin embargo, la determinación de esta hormona no es sencilla y está sometida a gran variabilidad. Los métodos para procesar las muestras de PTH-i no están estandarizados, hecho que podría ser una fuente importante de variabilidad preanalítica. Objetivo: Analizar la variabilidad en los resultados de la determinación de la PTH-i comparando distintas formas de procesar la misma muestra de plasma tratado conácido etilendiaminotetraacético (EDTA) en pacientes con ERC. Material y métodos: Se han analizado 294 muestras, correspondientes a 49 pacientes con ERC, 18 procedentes de la Consulta de Trasplante Renal (36,7%) y 31 del programa de Hemodiálisis Crónica de nuestro Centro (63,3%). Se ha procesado la misma muestra de cada uno de nuestros pacientes de seis maneras distintas, comparando las medias entre el grupo de referencia o gold standard y los otros grupos a estudio. Las muestras se procesaron con diferentes condiciones de temperatura y tiempo antes de ser congeladas, constituyendo seis grupos: centrifugación y congelación inmediata (grupo 1, de referencia); muestra a temperatura ambiente una hora, centrifugación y mantenimiento en nevera (2-8 ºC) durante 0, 8 o 24 horas (grupos 2 A, 2B y 2C, respectivamente); mantenimiento de sangre a temperatura ambiente 3 horas, mantenimiento en nevera (2-8 ºC) durante 0 y 8 horas (grupos 3A y 3B). La PTH-i se ha determinado mediante Inmunoradiometria (IRMA Total Intact Scantibodies assay). Se ha realizado el test de homogeneidad de varianzas y normalidad, y depués comparaciones por pares con el t-test con la corrección de Bonferroni. Resultados: La PTH-intacta media en el grupo de referencia fue 202,5 ± 199,72 pg/ml. Las medias de PTH-intacta en distintos grupos analizados fueron 196 ± 203,23 pg/ml, 202,8 ± 200,2 pg/ml, 200,06 ± 194,87 pg/ml, 204,08 ± 204,073 pg/ml, 197,94 ± 182,31 pg/ml. Los resultados fueron prácticamente superponibles, no encontrando diferencias significativas respecto al grupo de referencia (p = 0,87, p = 0,99, p = 0,95, p = 0,96, p = 0,90 al comparar con grupos 2A, 2B, 2C, 3A y 3B, respectivamente). Conclusiones: La utilización de EDTA como conservante en el procesamiento de las muestras analíticas para la determinación sanguínea de PTH-i permite un mayor tiempo de procesamiento de la misma, sin la exigencia de su congelación inmediata, mostrando una mínima variabilidad en los resultados obtenidos según diferentes formas de procesamiento. Estos resultados pueden ayudar a establecer estrategias logísticas para el procesamiento de muestras sanguíneas en los pacientes con ERC.
Background: The measurement of i-PTH circulating is not easy due to its analytical variablity. Variability that appears in the process that goes from the sample collection to the final result determination. There are several important aspects that can influence within the pre-test variability: type of sample (serum o plasma), temperature, time elapses from blood extraction to freezing and from freezing to i-PTH quantification. Blood coming from centres far from our laboratory do not always meet the required processing conditions. Our aim was to study the stability of i-PTH with varying conditions of temperature and time until freezing in patients with chronic kidney disease (CKD). Method: We have analyzed 294 blood samples of 49 patients with chronic kidney disease (18 transplantated patients (36.7%) and 31 patients in haemodyalisis (63.3%)). The blood samples were collected using tubes treated with ethylenediaminotetraacetic acid (EDTA); these samples were subjected to different conditions of temperature and time before they were frozen, constituting 6 groups: blood centrifuged and plasma immediately frozen (group A or reference group); blood maintained 1 hour at room temperature and plasma stored at 2-8 ºC during 0, 8 and 24 hours (groups B,C,D); blood maintained 3 hours at room temperature and plasma stored at 2-8 ºC during 0 and 8 hours (groups E,F). The intact PTH (i-PTH) was measured using the immunoradiometric assay (IRMA Total Intact Scantibodies assay). We have analyzed the differences between the PTH-i mean values in the referenced groud and the others. We have applied the tests of homogeneity variance and normality and we have perform a comparation by pairs with the t-test including the Bonferroni correction. Results: The mean value of intact- PTH in the referente Group was 202.5±199.72 pg/ml. The means values of intact-PTH in the other groups were 196 ± 203.23 pg/ml, 202.8 ± 200.2 pg/ml, 200.06 ± 194.87 pg/ml, 204.08 ± 204.073 pg/ml, 197.94 ± 182.31 pg/ml. The results were practically identical for each group. We did not find important differences with respect to the reference group (p = 0.87, p = 0,99, p = 0,95, p = 0,96, p = 0,90 when comparing with groups 2a, 2b, 2c, 3a y 3b). Conclusions: The use of EDTA maintain the PTH stability during a longer period without the necessity of freezing the samples immediately. These results can help to state strategies to management the samples in patients with ERC.
Las alteraciones del metabolismo calcio-fósforo son un problema muy prevalente y de gran importancia en los pacientes con Enfermedad Renal Crónica1-8. Su valoración adecuada y precoz, así como su tratamiento, son cruciales para un óptimo control de nuestros enfermos.
El método ideal para diagnosticar el grado y el tipo de osteodistrofia renal sigue siendo la biopsia de cresta iliaca tras el doble marcaje con tetraciclinas9-25 pero debido a que es invasivo y laborioso, no es útil en la práctica clínica diaria26. Actualmente el diagnóstico y tratamiento de dichas alteraciones se basa fundamentalmente en la determinación de los niveles plasmáticos de hormona paratiroide (PTH)10,17,27-31. Sin embargo, la determinación de esta hormona no es sencilla y está sometida a numerosa variabilidad32-34. Además los métodos para procesar las muestras de PTH no están estandarizados, hecho que podría ser una fuente importante de variabilidad pre-analítica.
Analizar la variabilidad en los resultados de la determinación de la PTH-i comparando distintas formas de procesar la misma muestra de plasma tratado con EDTA en pacientes con enfermedad renal crónica (ERC) en distintos estadios evolutivos.
En nuestro estudio, se han analizado 294 muestras correspondientes a 49 pacientes con Enfermedad Renal Crónica en distintos estadios evolutivos, 18 de ellos procedentes de la Consulta de Trasplante Renal (36.7%) y 31 del programa de Hemodiálisis Crónica de nuestro Centro (63.3%).
Todas las muestras se han extraído por la mañana (entre las 8:00 h-9:00 horas) tras un ayuno de al menos 8 horas y pre-diálisis en los pacientes en tratamiento sustitutivo renal. Las extracciones se han realizado en la Unidad de Hemodiálisis de nuestro Hospital. De cada paciente se han obtenido 3 tubos de EDTA: dos de 5 ml y uno de 10 ml. Inmediatamente después de la extracción, han sido enviados en nevera al Servicio de Medicina Nuclear, donde cada uno se ha procesado de manera distinta, tal como se explica a continuación:
1.- Grupo de Referencia o Grupo 1 (tubo EDTA de 5 ml):
- Extracción muestra (y rápidamente derivación al Servicio de Medicina Nuclear en nevera).
- Centrifugación en refrigeración.
- Separación y congelación inmediata.
2.- Grupo 2 (tubo de EDTA de 10 ml):
- Extracción muestra.
- Dejar a temperatura ambiente 1 hora.
- Centrifugación normal
- Separación de 3 tubos:
o 1 tubo se congela directamente.
o Separar 1 tubo en la nevera durante 8 horas y después se congela.
o Separar 1 tubo en la nevera durante > 24 horas y después congelar.
3.- Grupo 3 (Tubo de EDTA de 5 ml):
- Extracción de la muestra.
- Dejar a temperatura ambiente durante > 3 horas.
- Centrifugación normal.
- Separación en 2 tubos:
o Congelarlo directamente.
o Separar 1 tubo en la nevera > 8 horas y después congelarlo.
Las formas de procesamiento de las muestras empleadas en nuestro estudio son las habitualmente aplicadas en nuestro medio. El método analítico que se ha empleado para nuestro estudio es el IRMA Total Intact Scantibodies assays (2ª generación). La variabilidad intraensayo que se ha obtenido es menor del 2.5 %. Se ha considerado como referencia o “gold standard” al grupo 1ª, ya que son las condiciones generales recomendadas para este tipo de muestras independientemente del método o conservante utilizado (EDTA o citrato).
Se ha realizado la comparación dos a dos entre las medias de la PTH en el grupo de referencia y en el resto de grupos. Para ello, primero se ha comprobado la normalidad de la distribución mediante el test de homogeneidad de varianzas y normalidad. Posteriormente, realizamos las comparaciones por pares con el t-test, al que le aplicamos la corrección de Bonferroni. El nivel de significación fue establecido con p > 0,05.
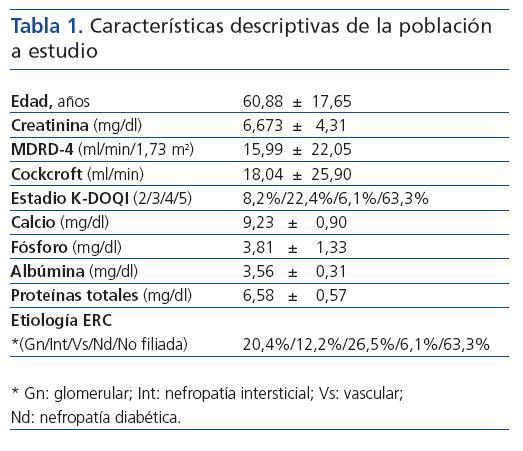
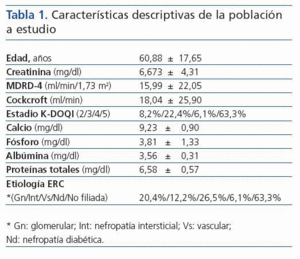
La edad media de nuestra población es de 60.88 ± 17.65 años, siendo el rango de edad comprendido entre 26 y 90 años. De los 49 pacientes incluidos en nuestro estudio, 25 son mujeres y 24 varones, lo cual corresponde al 51 % y 49 % respectivamente. La principal causa de enfermedad renal crónica es la no filiada, seguida de la de origen vascular y glomerular. El resto de características descriptivas de nuestra población a estudio se muestran en la tabla I.
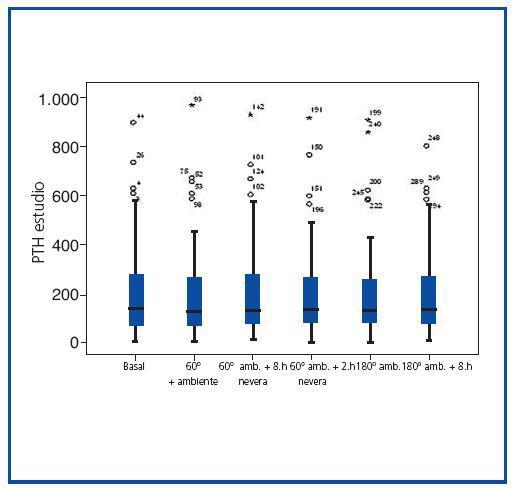
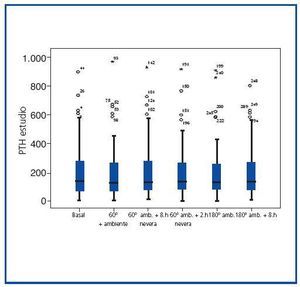
El grupo de referencia presentó una media 202.5 ± 199.72 pg/ml. Las medias de PTH-intacta en los distintos grupos analizados, que se muestran en la tabla II, fueron 196 ± 203.23 pg/ml, 202.8 ± 200.2 pg/ml, 200.06 ± 194.87 pg/ml, 204.08 ± 204.073 pg/ml, 197.94 ± 182.31 pg/ml. Como se puede observar en la figura 3, los resultados son practicamente superponibles, no habiendo encontrado diferencias significativas de los grupos a estudio respecto del grupo de referencia (p=0.87, p=0.99, p=0.95, p=0.96, p=0.90 al comparar con grupos 2a, 2b, 2c, 3a y 3b respectivamente).
La determinación sérica de la parathormona es difícil de cuantificar debido a que es bastante inestable tanto en suero como en sangre43-45 (Vm 5 minutos). El método considerado como referencia se basa en centrifugar en refrigeración y congelar la muestra inmediatamente después de su extracción. Sin embargo, esta manera de proceder es muy difícil de conseguir en la clínica diaria, pues la actividad nefrológica no se limita al ámbito hospitalario. Habitualmente, las muestras son extraídas en los centros periféricos y remitidas posteriormente a los hospitales de referencia para ser analizadas. En algunas ocasiones, estos centros no se encuentran muy próximos a dichos hospitales. La mayoría de las muestras no son centrifugadas ni separadas en los centros de extracción porque no disponen de los medios necesarios para ello. Además, las muestras que son centrifugadas lo son a temperatura ambiente. De todo esto, se deriva la importancia que presenta conocer y reducir al máximo la variabilidad en el manejo de las muestras.
Actualmente no hay un método estandarizado sobre el procesamiento de las mismas. Existe controversia sobre la estabilidad de la parathormona en suero o en plasma tratado con EDTA. Hay varios estudios que reflejan que las determinaciones de la PTH en suero son menos estables que las obtenidas a partir de muestras de plasma y de sangre conservadas en tubos tratados con EDTA35-42. Sin embargo, Omar et al38 en el año 2001 observaron que los niveles de PTH en EDTA decrecían un 14.8% a las 48 horas de permanecer a temperatura ambiente. Además, recientemente Cavalier et al42 demuestran que no siempre las muestras procesadas en EDTA son más estables que en suero. Ellos objetivan que la estabilidad de la PTH tras 24 horas a –20ºC es mayor en suero que en plasma tratado con EDTA.
En casi todos los estudios realizados hasta el momento, se compara suero y EDTA 35-42. Sin embargo, una de las limitaciones que presenta nuestro estudio es que no se ha establecido un grupo control con suero (citrato). Por tanto, no podemos valorar las determinaciones de la PTH-i en suero y plasma (EDTA) una vez congeladas a –20ºC ni comparar los resultados con los obtenidos por Cavalier et al. Además, no hemos analizado que pasa más allá de las 48 horas a temperatura ambiente para poder comparar los resultados con Omar et al.
Los hallazgos obtenidos en este estudio muestran que no existen diferencias significativas entre el grupo de referencia y los diferentes grupos analizados. Se confirma que las muestra de plasma tratado con EDTA son estables y se recomienda su empleo cuando la centrifugación en frío y la congelación inmediata son difíciles de conseguir.
La utilización de EDTA como conservante en el procesamiento de las muestras analíticas para la determinación sanguínea de PTH permite un mayor tiempo de procesamiento de la misma sin la exigencia de su congelación inmediata, mostrando una mínima variabilidad en los resultados obtenidos según diferentes formas de procesamiento. Estos resultados pueden ayudar a establecer estrategias logísticas para el procesamiento de muestras sanguíneas en los pacientes con ERC.
Tabla 1.
Tabla 2.
Figura 1.