Introducción y objetivo: El cáncer es una de las principales causas de muerte con injerto funcionante en los pacientes trasplantados renales. La creciente edad de los pacientes remitidos para su inclusión en lista de espera ha elevado el riesgo de neoplasias en esta población. El objetivo de este estudio fue analizar la incidencia de neoplasias en los pacientes evaluados para su inclusión en lista de espera para trasplante y en los trasplantados renales. Métodos: Entre noviembre de 1996 y noviembre de 2007 fueron evaluados 825 pacientes en la consulta de trasplante renal; 467 habían recibido un injerto renal, 120 permanecían en lista de espera y 238 habían sido desestimados o fallecieron estando en lista de espera. Resultados: Se diagnosticaron 97 tumores, 33 de ellos en 32 pacientes candidatos a trasplante y 64 tumores en 62 pacientes trasplantados. El análisis comparativo entre los pacientes candidatos (incluidos o no en lista de espera) y aquellos trasplantados mostró que los primeros presentaron con mayor frecuencia tumores sólidos, mientras que los segundos presentaron mayor porcentaje de neoplasias cutáneas. La incidencia de tumores sólidos en la población trasplantada fue del 5,6%. El tiempo entre la fecha de trasplante y el diagnóstico del tumor fue de 42,6 ± 32,7 meses, siendo el 48% de las neoplasias diagnosticadas en los primeros tres años postrasplante. Al analizar pacientes trasplantados con y sin diagnóstico de neoplasias, observamos que los primeros tenían mayor edad y un mayor seguimiento postrasplante. La supervivencia del injerto fue similar entre ambos grupos, siendo la supervivencia del paciente a los cinco años significativamente menor en el grupo de pacientes trasplantados con tumor. Conclusiones: La notable incidencia de tumores pre y postrasplante enfatiza la necesidad de una búsqueda y un seguimiento exhaustivos de tumores en los pacientes trasplantados y una alta sospecha en la valoración pretrasplante.
INTRODUCCIÓN
El cáncer es una de las principales causas de muerte con injerto funcionante en los pacientes trasplantados renales, que se cree podría llegar a superar a las complicaciones cardiovasculares como principal causa de muerte en las próximas dos décadas.1 En la era de los nuevos inmunosupresores, hemos podido observar una disminución en la incidencia de rechazo agudo, aunque ha aumentado el número de complicaciones a largo plazo como las neoplasias.2 Asimismo, la edad media de los trasplantados y pacientes remitidos para su inclusión en lista de espera ha aumentado en 10 años en apenas una década.3
Los principales factores de riesgo para desarrollar neoplasias en la población con enfermedad renal crónica (ERC) se relacionan al igual que en la población general, con la edad avanzada, el sexo masculino y la exposición a agentes oncogénicos como el tabaco, el alcohol y la exposición solar.4,5 Específicamente, en la ERC se han descrito factores de riesgo tales como déficit nutricional, las alteraciones metabólicas, el tiempo prolongado en diálisis, la retención de compuestos carcinogénicos, la etiología del fallo renal y su tratamiento y la disfunción inmune en la uremia.6 Después del trasplante renal existiría un riesgo añadido debido al tratamiento inmunosupresor 7,8 y a la reactivación de virus con potencial oncogénico como el virus de Epstein Barr, Herpes-virus tipo 8, Papiloma-virus Humano y virus de la Hepatitis B y C, destacando el riesgo relativo más elevado de padecer cáncer de piel, linfoma no Hodgkin y sarcoma de Kaposi.9 Un estudio basado en datos del registro conjunto de Australia y Nueva Zelanda (ANZData) que compara la incidencia de neoplasias en 28.855 pacientes con ERC sometidos a diálisis o trasplantados, mostró que estos últimos presentaban un riesgo tres veces superior de desarrollar 18 variedades diferentes de neoplasias.10
El diagnóstico de neoplasias después de un trasplante renal podría relacionarse con una de las siguientes situaciones: neoplasias “de novo” postrasplante, tumores transmitidos de forma inadvertida por el donante, recurrencia o bien preexistencia de neoplasias en el receptor que pudieran haber pasado inadvertidas en la evaluación pre-trasplante11. El incremento de la edad de los pacientes que actualmente son candidatos a recibir un trasplante renal no solo aumenta el riesgo de desarrollar neoplasias “de novo” postrasplante, sino que además incrementaría la posibilidad de que las presenten previamente al trasplante. En este contexto, el objetivo del presente estudio fue analizar la incidencia de neoplasias en la población atendida en la consulta de trasplante renal, incluyendo tanto pacientes remitidos como candidatos a ser trasplantados como aquellos portadores de un trasplante renal.
DISEÑO DEL ESTUDIO
Estudio retrospectivo y observacional realizado en la consulta de trasplante renal de nuestro hospital durante un período de 11 años (Noviembre 1996-Noviembre 2007).
PACIENTES Y METODOS
La población estudiada para trasplante en nuestra zona de influencia es de aproximadamente 1 millón de habitantes. Durante el período del estudio, se evaluaron aproximadamente 825 pacientes en la consulta de trasplante renal. Una media de 75 pacientes/año fueron enviados a nuestra consulta para su valoración e inclusión en la lista de espera, de los cuales aprox. 60 pacientes/año se incluyeron en la lista de espera y el resto fueron desestimados por diversas causas o derivados para transplantarse en otro centro (trasplante riñón-páncreas). Los criterios generales de remisión de pacientes con diagnóstico de insuficiencia renal crónica y motivados a ser trasplantado comprendían: edad 2 años y ausencia de patología grave (hepatopatía crónica evolucionada, insuficiencia respiratoria crónica, enfermedad cardiaca intratable, o enfermedad infecciosa activa, neoplasia reciente o metastatizante o enfermedad psiquiátrica grave).
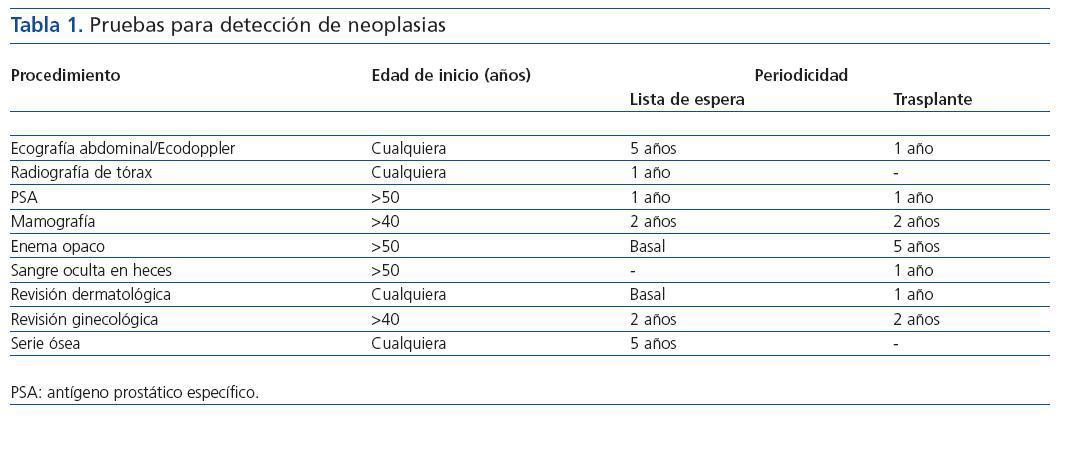
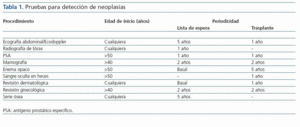
Los pacientes con enfermedad renal crónica (ERC) en diálisis completaron en sus respectivos centros un protocolo de evaluación como posibles candidatos a trasplante renal mediante pruebas de imagen y determinaciones analíticas iniciales, previo a su remisión a la consulta de trasplante renal. Dicho protocolo incluía exploraciones específicas dirigidas a descartar la presencia de neoplasias así como su periodicidad Tabla NºI
Desconocemos el número de pacientes y tipo de tumor detectados en las respectivas unidades de hemodiálisis y que contraindicaron su remisión como candidatos a trasplante. Si se recogieron los datos de los pacientes en quienes se diagnosticó la neoplasia mientras permanecían en lista de espera de trasplante.
Al finalizar el estudio, 467 pacientes habían recibido un trasplante renal, 120 permanecían en lista de espera de trasplante y 238 pacientes habían sido desestimados o bien fallecieron mientras estaban a la espera de un trasplante renal. 102 pacientes perdieron el injerto, de los cuales 30 se retrasplantaron.
Se realizó un análisis descriptivo entre los pacientes candidatos incluidos o no en lista de espera y los pacientes trasplantados a los que se les diagnosticó un tumor y un análisis comparativo en la población trasplantada entre los pacientes que desarrollaron neoplasias y los que no la presentaron. Se analizaron las siguientes variables: edad, sexo, índice de masa corporal (IMC), etiología de la ERC, tiempo en diálisis, antecedentes personales de cáncer, pauta de inmunosupresión, tipo de tumor, tiempo entre la fecha de trasplante y el diagnóstico de tumor, hábitos tóxicos y serología viral.
ESTADÍSTICA
Los valores se expresaron como porcentajes, media, desviación típica; se utilizaron máximo, mínimo e índices de confianza del 95%. Para comparación de variables categóricas se utilizó la prueba de “Chi” cuadrado o la prueba de Fisher cuando era apropiada. Las diferencias entre las medias se han analizado mediante el análisis de la varianza (ANOVA). Se consideró como estadísticamente significativa una p<0,05. El análisis de supervivencia se realizó mediante el método de Kaplan-Meyer y la prueba de logaritmo del rango (test Logrank). Los datos se analizaron mediante el programa estadístico SPSS versión 15.
RESULTADOS
En un período de 11 años fueron diagnosticados 97 tumores en 825 pacientes atendidos en la consulta de trasplante renal. A 32 pacientes candidatos a trasplante les fueron diagnosticados 33 tumores: 17 tumores fueron diagnosticados durante el proceso de evaluación, no llegando a ser incluidos en lista de espera (6 tumores de próstata, 2 de vejiga, 3 de riñón, 2 de laringe, 2 de colon, 1 mieloma múltiple y 1 carcinoma basocelular excluido por riesgo cardiovascular), y los 16 tumores restantes no fueron una contraindicación para el trasplante. De éstos, 8 pacientes fueron trasplantados (5 con carcinomas basocelular, 2 espinocelular, 1 neoplasia de recto tras una espera de seguridad de 5 años).
Tras un período medio de seguimiento de 79 ± 34 meses (min. 8, máx. 132), desde la fecha del trasplante en 467 pacientes, fueron diagnosticados 64 tumores de novo en 62 de ellos, lo que representa una incidencia de neoplasias del 13,2%.
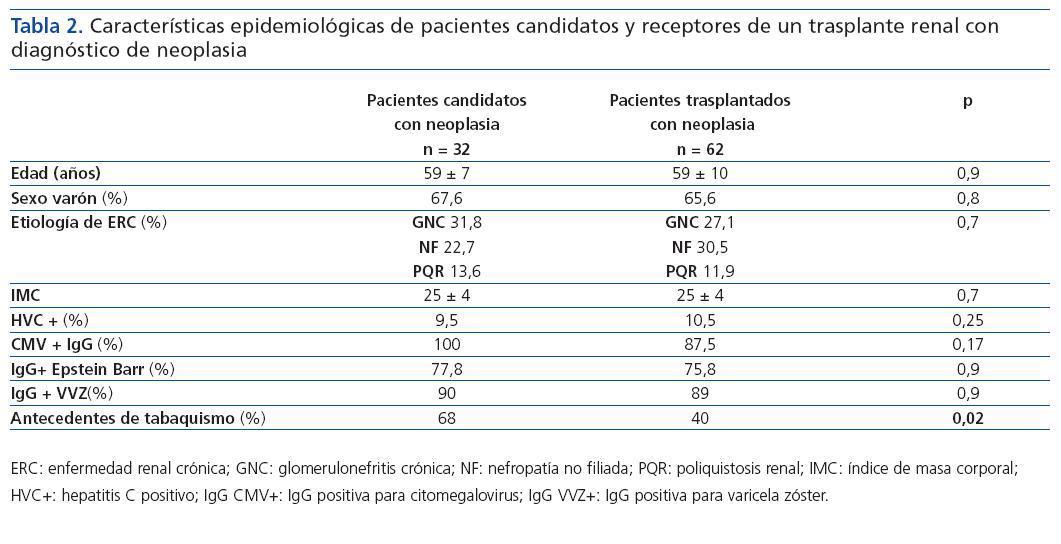
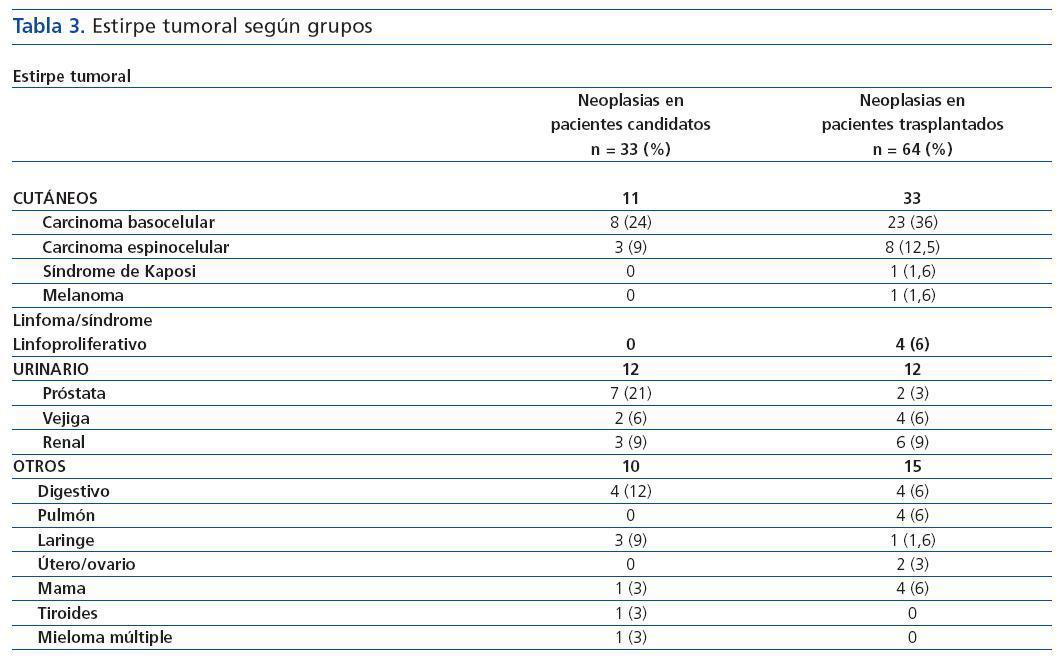
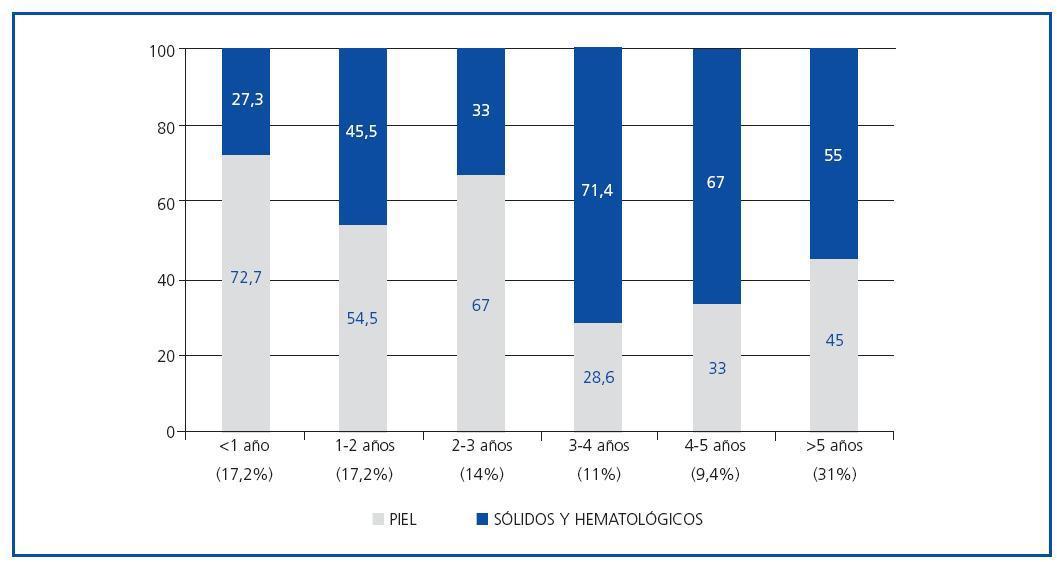
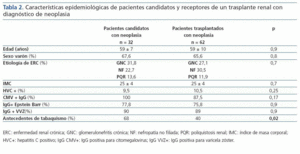
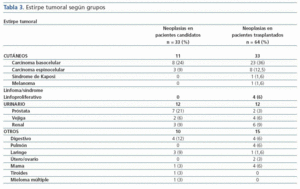
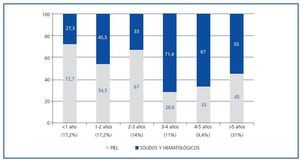
El análisis descriptivo de los pacientes candidatos y trasplantados con diagnóstico de neoplasias mostró que las características eran similares para los dos grupos (edad media de 59 años y predominio del sexo varón), sin encontrarse diferencias en cuanto a la etiología de la ERC, IMC, serología viral (HVC, CMV, Epstein Barr o varicela zóster). El grupo de candidatos con neoplasias tenía más antecedentes de tabaquismo (68 vs. 40%, p = 0,02) (tabla 2). En este último grupo, el tiempo (mediana) entre el inicio de la terapia sustitutiva renal y el diagnóstico de la neoplasia fue de 30,8 ± 44 meses; mientras que, en el grupo de trasplantados, el tiempo medio entre la fecha de trasplante y el diagnóstico del tumor fue de 42,6 ± 32,7 meses (IC 95% 34-51 meses, min. 2-máx. 124). En éstos, el 48% de las neoplasias se diagnosticaron en los primeros tres años postrasplante, predominando las cutáneas (figura 1). En el grupo de candidatos a trasplante; se diagnosticaron neoplasias sólidas con mayor frecuencia que en el grupo de pacientes trasplantados (70,6 vs. 47,6%, p = 0,03), mientras que en estos últimos prevalecieron las neoplasias de piel (52,4 vs. 29,4%, p = 0,03). Las neoplasias sólidas entre los pacientes candidatos eran predominantemente genitourinarias (7 de próstata, 3 renales, 2 vejiga), de aparato digestivo (2 de colon, 1 de recto y 1 de estómago) y laringe (3 casos), y entre los pacientes trasplantados la neoplasia sólida más frecuente fue el carcinoma de células renales (6 casos) (tabla 3). La incidencia de tumores sólidos en la población trasplantada fue del 5,6%.
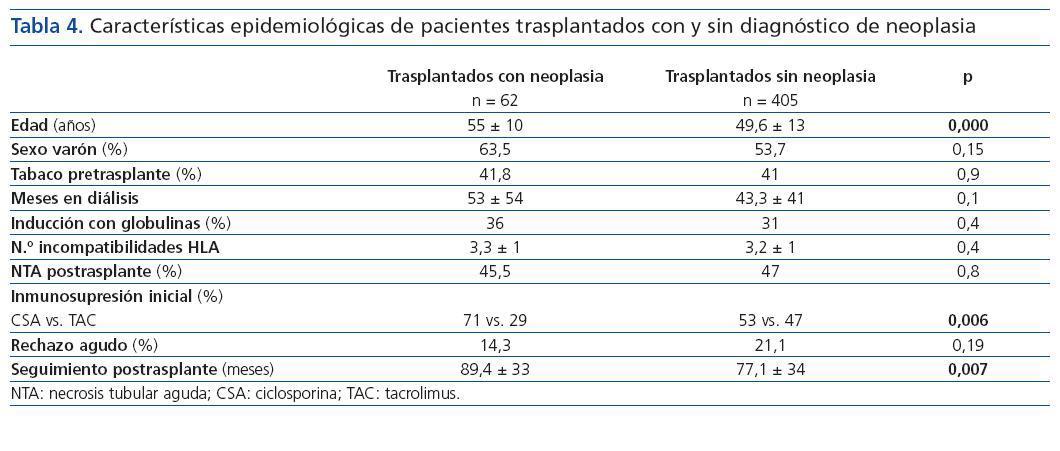
El análisis comparativo en la población trasplantada entre los que desarrollaron tumor y los que no lo presentaron mostró que los primeros tenían mayor edad (55 ± 10 vs. 49,6 ± 13 años, p = 0,000) y habían recibido con mayor frecuencia ciclosporina que tacrolimus como inmunosupresor inicial (CSA 71 vs. 53%, p = 0,006). Los pacientes diagnosticados de neoplasias presentaban un mayor seguimiento postrasplante (89,4 ± 33 vs. 77,1 ± 34 meses, p = 0,007). No encontramos diferencias significativas al comparar sexo, antecedentes de tabaquismo pretrasplante, tiempo en diálisis, inducción con globulinas antilinfocitarias, presencia de necrosis tubular aguda postrasplante y número de episodios de rechazo agudo tratados (tabla 4).
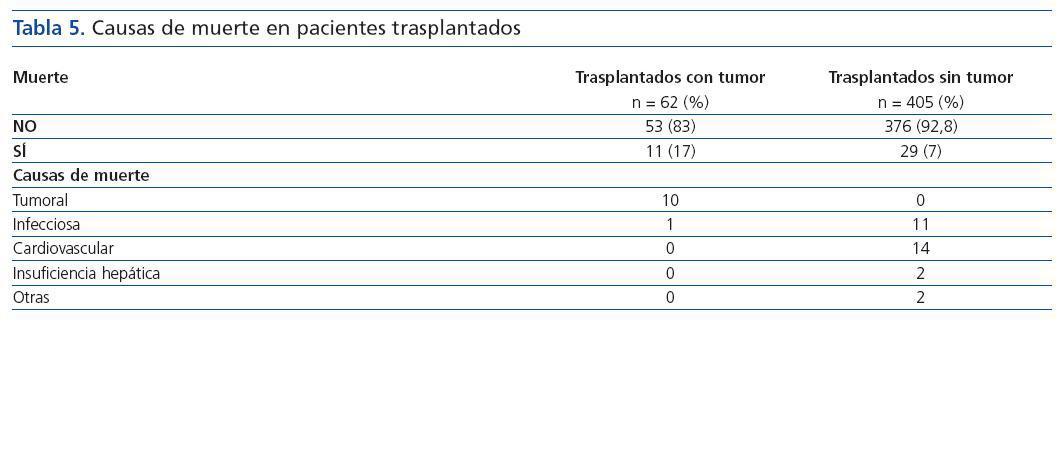
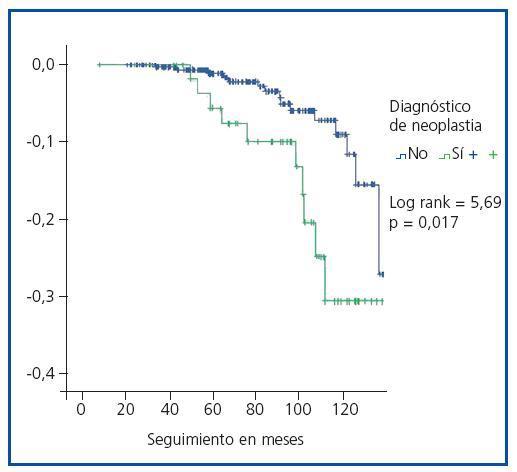
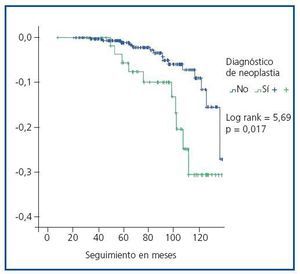
La supervivencia del injerto a los cinco años fue similar entre ambos grupos (93,2% en trasplantados con tumor vs. 95,2% sin tumor, p = 0,4). En cambio, la supervivencia del paciente a los cinco años fue significativamente menor en el grupo de pacientes trasplantados con tumor (93,2 vs. 98,8%, log-rank = 5,69, p = 0,017) (figura 2). Diez de los once pacientes trasplantados fallecieron a causa del tumor (tabla 5).
DISCUSIÓN
Las neoplasias son una patología prevalente tanto en la población en diálisis como en los receptores de un trasplante renal12. En estos últimos, constituye una de las principales causas de fallecimiento y podría llegar a ser la más importante. En el presente estudio analizamos la aparición de la patología tumoral en la Unidad de trasplante renal, tanto en la población candidata como en la receptora de un trasplante renal.
En nuestra serie destacó el elevado número de neoplasias diagnosticadas durante el proceso de evaluación para inclusión en lista de espera o mientras permanecían a la espera de recibir un trasplante renal. En nuestra opinión, este hecho no ha sido suficientemente enfatizado en la literatura y probablemente pueda estar en relación con el creciente aumento de la edad de esta población. Es importante destacar que los pacientes candidatos de nuestra serie no eran representativos de la población general en diálisis, ya que en algunos casos se diagnosticaron neoplasias en el centro de referencia y los pacientes no fueron enviados para su valoración ni fue comunicado este hecho a la consulta de trasplante. Por otra parte, queremos destacar la importante labor de los urólogos que valoran estos pacientes mediante una consulta semanal, hecho que podría explicar la alta frecuencia de tumores de próstata diagnosticados entre los pacientes candidatos.
La elevada incidencia de tumores en los tres primeros años postrasplante, de estirpe similar a las neoplasias de los pacientes candidatos a trasplante, sugiere una congruencia de factores de riesgo que podrían agravarse por la inmunosupresión del trasplante. Nuestros hallazgos muestran que, al margen de los tumores más frecuentes en la población trasplantada (cutáneos y los procesos linfoproliferativos), los tumores sólidos más comunes y con mayor impacto pronóstico fueron similares en las dos poblaciones, siendo los más prevalentes a nivel genitourinario. Estos hallazgos deben orientar sobre las exploraciones a prodigar para un diagnóstico precoz de las neoplasias en estos pacientes. En nuestra experiencia, han resultado de especial utilidad la ecografía renal y la determinación de PSA. Por el contrario, la determinación de SOH (sangre oculta en heces) no ha mostrado una alta sensibilidad13, ya que cuatro pacientes diagnosticados de cáncer de colon en nuestra serie habían presentado previamente negatividad en dicho test. En esta población de alto riesgo, el despistaje debería complementarse con una rectosigmoidoscopía periódica en pacientes de más de 50 años, siguiendo los criterios de las sociedades científicas14,15. El empleo del enema opaco se recomienda sobre todo en pacientes mayores, con una alta incidencia de divertículos y riesgo de perforación postrasplante16.
En el grupo de pacientes trasplantados fueron más prevalentes los tumores de piel, objetivándose una incidencia más elevada de carcinoma basocelular con respecto al espinocelular, lo cual no coincide con lo señalado en la literatura17. Ello podría estar en relación con la mayor detección de dicho tipo de lesiones en las revisiones dermatológicas relacionadas con la mayor edad de los pacientes y el período de seguimiento postrasplante no excesivamente prolongado. El tratamiento inicial con ciclosporina se asoció a una mayor incidencia de neoplasias en este grupo, al igual que en otras publicaciones17,18. En nuestra serie no podemos descartar que esto estuviera favorecido por un sesgo en relación con el mayor tiempo de seguimiento postrasplante comparativamente con los pacientes tratados con tacrolimus. Consideramos destacable la baja incidencia de procesos linfoproliferativos y enfermedad de Kaposi observada entre los pacientes trasplantados, teniendo en cuenta que los primeros se han relacionado con el uso de globulina antilinfocítica (el 31% de nuestros pacientes recibió tratamiento de inducción con timoglobulina, aunque en dosis reducidas). Podemos especular acerca del efecto protector derivado de la profilaxis universal para la enfermedad por CMV con ganciclovir-valganciclovir durante los tres primeros meses postrasplante, aunque somos conscientes de que es necesario un seguimiento más prolongado para comprobar esta hipótesis.
La incidencia de neoplasias de novo en la población trasplantada está aumentada de forma importante en comparación con la población general, siendo además de peor pronóstico19. Kasiske mostró, con datos del registro americano sobre 35.765 trasplantes, que la incidencia de neoplasias con respecto a la población general era dos veces mayor para colon, pulmón, próstata o mama; tres veces para vejiga y testículo; cinco veces para melanoma, leucemia, y cérvix; quince veces para cáncer renal; y mayor de veinte veces para sarcoma de Kaposi, linfomas no Hodgking y CPNM20. Un estudio italiano analizó 3.500 pacientes trasplantados, demostrando que la supervivencia 10 años-paciente fue del 92,8% para trasplantados sin tumor y del 56,6% para los que tenían cualquier tipo de neoplasia21. Datos del registro ANZData muestran que el 67% de las muertes en pacientes trasplantados con tumor fueron a causa de la neoplasia11.
Nuestros hallazgos sugieren que la prevención de este fenómeno debería basarse en un adecuado escrutinio de la población candidata a trasplante, incluidas las revisiones periódicas mientras permanecen en lista de espera. Tras recibir un injerto renal, deberíamos procurar un delicado ajuste del tratamiento inmunosupresor en función del riesgo inmunológico, identificando aquellos pacientes que pudieran beneficiarse de una conversión precoz a los inhibidores de la señal de proliferación.
El tratamiento de inicio o conversión a este grupo de fármacos se ha señalado que se sigue de una menor incidencia de neoplasias, y se ha mostrado eficaz en el manejo de pacientes con determinados tumores, especialmente cutáneos y sarcoma de Kaposi22.
Tabla 1.
Tabla 2.
Tabla 3.
Tabla 4.
Tabla 5.
Figura 1.
Figura 2.