Introducción: La candidosis bucal (CB) es una infección oportunista frecuente en el paciente inmunocomprometido y algunas veces es importante conocer la especie para el tratamiento. Objetivo: Determinar la prevalencia de distintas especies de Candida colonizando o infectando la mucosa bucal (MB) de pacientes diabéticos (DM) y no diabéticos (no DM) con enfermedad renal crónica, comparando ambos grupos y explorando algunos posibles factores de riesgo. Metodología: Se examinó a 56 pacientes DM y 80 no DM con diálisis crónica. Se tomaron muestras de la MB y se sembraron en agar placas dextrosa Sabouraud. La especie se identificó con galerías API®. La CB se confirmó con citología exfoliativa. Las asociaciones se investigaron con χ2, Prueva exacta (PE) de Fisher y regresión logística múltiple. Resultados: La prevalencia de Candida fue del 43,4 %: 53,6 % DM y 36,2 % no DM (p = 0,045). Las especies fueron C. albicans 74,6 %, C. glabrata 22,0 %, C. tropicalis 15,2 %, C. parapsilosis 3,4 %, C. kefyr 3,4 % y C. famata 1,7 % sin diferencia entre grupos. Los DM tuvieron mayor frecuencia de xerostomía (p = 0,002), flujo salival bajo (p = 0,008) y albúmina sérica más baja (p = 0,018). Tuvieron CB 16,9 %, 23,2 % DM frente a 12,5 % no DM (p = 0,101). Se asociaron a presencia de Candida en la MB: uso de prótesis (odds ratio [OR] 25,6, límite de confianza [LC] 95 % 2,5 a 253, p = 0,001), xerostomía (OR 9,6, LC 95 % 2,4 a 38,1, p = 0,001) y bajos valores de albúmina sérica (OR 0,41, LC 95 % 0,22 a 0,98, p = 0,044). Conclusiones: La presencia de Candida sp. en la MB se asoció a prótesis dental, xerostomía y albúmina sérica baja.
Introduction: Oral candidiasis (OC) is a common opportunistic infection in immunocompromised patients. Species identification is sometimes important for treatment. Objective: to determine the prevalence of different Candida species colonising or infecting the oral mucosa (OM) of diabetic (DM) and non-diabetic (non-DM) chronic kidney disease patients, comparing both groups and exploring potential risk factors. Methods: 56 DM and 80 non-DM patients on chronic dialysis were examined. OM swabs were cultured on Sabouraud dextrose agar plates. Candida species were identified with API® galleries. OC was confirmed by exfoliative cytology. Statistical associations were analysed using χ2, Fisher’s exact test (ET), and multiple logistic regression. Results: Candida prevalence was 43.4%: 53.6% DM and 36.3% non-DM, (p=.045). The species identified were C. albicans 74.6%, C. glabrata 22.0%, C. tropicalis 15.2%, C. parapsilosis 3.4 %, C. kefyr 3.4% and C. famata 1.7% without difference between groups. DM patients had a higher xerostomia prevalence (p=.002) and lower salivary flow (p=.008) and lower serum albumin (p=.018). 16.9% of patients had OC, 23.2% DM compared with 12.5% non-DM, (p=.101). The following were associated with the presence of Candida in the OM: the use of dental prostheses (odds ratio [OR] 25.6, 95% confidence interval [CI] 2.5 to 253, P=.001), xerostomia (OR 9.6, 95% CI 2.4 to 38.1, P=.001) and low serum albumin values (OR 0.41, 95% CI 0.22 to 0.98, P=.044). Conclusions: The presence of Candida sp. in the OM was associated with dental prostheses, xerostomia and low serum albumin.
INTRODUCCIÓN
Los hongos del género Candida son un grupo de levaduras ubicuas con comportamiento oportunista, que forman parte de la microbiota de la mucosa bucal (MB), y el tracto gastrointestinal y genital femenino, a los que puede colonizar en un tercio de la población en general1,2. Los factores de riesgo para la colonización incluyen las particularidades del hongo, especialmente sus mecanismos de adhesión a las células epiteliales, así como factores locales de la MB y la condición sistémica del huésped, por ejemplo, diabetes mellitus o inmunosupresión de distintas causas1,3. Candida albicans es la especie más prevalente en el estado de colonización de la MB de individuos sanos e inmunocomprometidos; sin embargo, también se han comunicado C. parapsilosis, C. tropicalis, C. glabrata, C. krusei, C. guilliermondii y C. dubliniensis1,2,4. El estado de colonización de la MB por Candida sp. constituye una condición de riesgo para su transformación en candidosis bucal (CB), tanto en individuos inmunocompetentes como en inmunocomprometidos1,5. La CB se debe a la proliferación del hongo en la superficie de la mucosa y puede provenir de la microbiota del mismo paciente en un estado de portador4. Su desarrollo se explica por mecanismos del hongo y de las defensas del huésped3,6. La coexistencia de diferentes especies de Candida en una infección la hace más persistente y difícil de tratar7,8.
En México no existe un registro disponible de casos con enfermedad renal crónica (ERC). Diversos autores han reportado que la diabetes es la causa más frecuente de ERC en adultos, su incidencia va en aumento y constituye un problema de salud pública9-11. El paciente con ERC en diálisis tiene elevada frecuencia de anemia y desnutrición y un deterioro inmunológico multifactorial, por lo que se le considera inmunosuprimido12,13.
En el contexto bucal, se ha reportado que estos pacientes presentan disminución del flujo salival (FS), xerostomía y mucosas atróficas14,15, condiciones que favorecen el desarrollo de CB tanto en pacientes diabéticos (DM) no complicados como en DM16 con ERC en diálisis14,15,17. Si bien se han reportado prevalencias de colonización y de CB en diferentes grupos de pacientes inmunocomprometidos, son escasos los estudios realizados en pacientes en diálisis. El propósito de este estudio fue determinar la prevalencia de distintas especies de Candida colonizando o infectando la MB de pacientes DM con ERC en diálisis, comparándolas con pacientes no diabéticos (no DM) con ERC en diálisis, y analizando algunos posibles factores de riesgo.
MATERIAL Y MÉTODOS
Población de estudio
Estudio transversal en el que se examinaron pacientes DM y no DM con ERC de la Unidad de Hemodiálisis del Hospital General de Zona No. 50 del Instituto Mexicano del Seguro Social en San Luis Potosí, México; el estudio fue previamente aprobado por los comités de investigación y ética del hospital. De los expedientes clínicos se recabaron datos demográficos, de la enfermedad renal, el tiempo de evolución de la diabetes mellitus (en su caso) y datos de laboratorio clínico. A todos los pacientes se les solicitó un consentimiento informado para la toma de las muestras bucales. Se excluyeron pacientes en condición clínica inestable no aptos para el examen bucal y/o la medición del FS. Se eliminaron casos cuando el cultivo se contaminó y no se pudo contactar al paciente para la toma de una nueva muestra. El examen bucal lo realizó una especialista en Patología y Medicina Bucal. La toma de la muestra para cultivo se realizó por la mañana y al menos dos horas después de haber comido o ingerido líquidos, y se preguntó acerca del uso de prótesis dentales (PD). Previo a la toma de muestras para cultivo microbiológico se realizó la medición del FS usando la prueba de Schirmer, que consiste en medir la saliva acumulada en el piso de la boca durante cinco minutos utilizando tiras Wathman (de papel filtro graduado milimétricamente). Se consideró como disminución del FS cuando la lectura fue ≤ 2,0 cm18. Los criterios clínicos para el diagnóstico de CB fueron los de Holmustrup y Axéll (candidosis eritematosa, pseudomembranosa o asociada a prótesis)19. Cuando en el examen bucal se identificó una lesión sugestiva de CB, se tomó una citología exfoliativa que fue teñida con ácido peryódico de Schiff para confirmar la infección. Se consideró infección cuando había lesión clínica y la citología exfoliativa fue positiva.
Métodos microbiológicos e identificación de especies
Para la identificación fúngica, se tomaron raspados de toda la MB de cada paciente con hisopo estéril, que fueron codificados para su posterior siembra en placas de agar dextrosa Sabouraud con cloranfenicol y en placas de agar Biggy. La caracterización de Candida fue realizada por varios métodos fenotípicos, que incluyeron cultivos, desarrollo de tubo germinativo en suero humano y perfiles bioquímicos con galerías comerciales. Se consideró colonizado (portador sano) al paciente que estaba asintomático y libre de lesión bucal, con cultivo del raspado de la mucosa positivo para Candida sp. Las placas fueron incubadas a 36,5 ± 0,5 °C, realizando lecturas de crecimiento a las 24, 48 y 72 horas. Con el cultivo en agar Biggy se hizo una identificación presuntiva de la especie de Candida, de acuerdo con las características colorimétricas; además, el uso de este medio permitió identificar la presencia de dos o más especies de Candida en una misma muestra. Los cultivos positivos a una o más especies se resembraron y purificaron en placas de agar glucosado de Sabouraud incubándolos a 36 °C (± 1 ºC) por dos días. Las especies de Candida fueron identificadas por medio del sistema de asimilación de carbohidratos API 20 C AUX (BioMerieux, Lyon, Francia).
Análisis estadístico
Se realizó un análisis descriptivo de las variables demográficas y clínicas, edad, género, índice de masa corporal, causas de insuficiencia renal crónica (IRC) y datos de laboratorio clínico. Las comparaciones se hicieron con t de Student y χ2. La presencia o ausencia de Candida en la MB se clasificó en una escala ordinal de tres niveles: 1) ausente, 2) portador y 3) presente con candidosis. Los posibles factores de riesgo se investigaron mediante análisis de regresión logística múltiple, teniendo como variable dependiente candidosis y como variables independientes sexo, género, datos de ERC y de laboratorio, así como el uso de PD, con el programa Epi Info versión 3.4.3, considerando significativo un valor de p < 0,05.
RESULTADOS
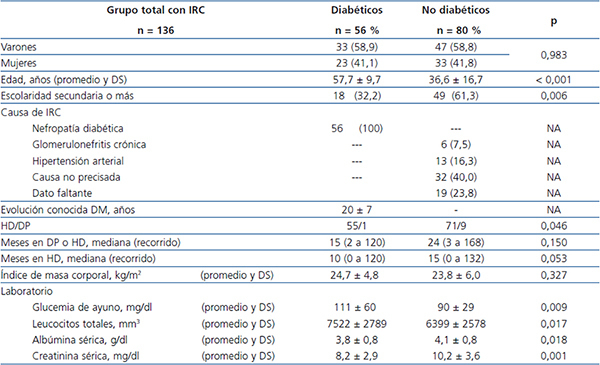
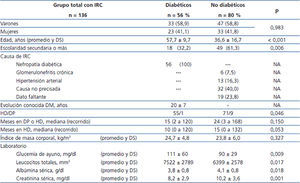
Se estudió un total de 136 pacientes (56 DM y 80 no DM), 80 varones y 56 mujeres, con edad promedio de 45,3 ± 17,6 (14 a 86) años. Ciento veintiséis se manejaban con hemodiálisis (HD) crónica y 10 con diálisis peritoneal, con un tiempo mediano en tratamiento de 24 (2 a 168) meses. La tabla 1 muestra un análisis comparativo de características demográficas, clínicas y de resultados de laboratorio de ambos grupos. Veinticuatro pacientes (17,6 %) informaron historia de tabaquismo, sin diferencia entre grupos.
Condiciones bucales
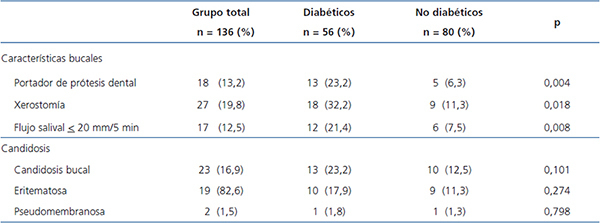
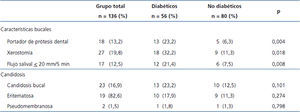
La tabla 2 muestra que los pacientes DM tuvieron mayor frecuencia de uso de PD (p = 0,004), xerostomía (p = 0,018) y disminución del FS (p = 0,008). Dieciocho pacientes (13,2 %) usaban PD.
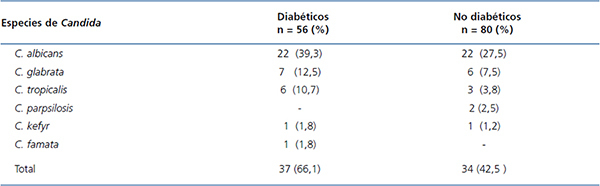
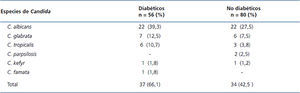
La prevalencia de Candida en la MB era de 43,4 % (59/136): 53,6 % (30/56) DM y 36,2 % (29/80) no DM (p = 0,045). En cuanto a las especies de Candida, no se observó diferencia entre DM y no DM. La tabla 3 muestra la frecuencia por especies de Candida del total de aislados positivos y los casos con dos o más especies en el mismo paciente. Las frecuencias por especies del total de aislados positivos (71) fueron: C. albicans 44 (74,6 %), C. glabrata 13 (22,0 %), C.tropicalis 9 (15,2 %), C. parapsilosis 2 (3,4 %), C. kefyr 2 (3,4 %) y C. famata 1 (1,7 %). Once pacientes (8,1 %) tuvieron más de una especie de Candida; un caso con C. albicans/C. glabrata/C. tropicalis, 5 casos con C. albicans/C. glabrata, 3 casos con C. albicans/C. tropicalis, uno con C. glabrata/C. tropicalis y uno con C. glabrata/C. parapsilosis.
Se observó CB en el 16,9 % (23/136) del grupo total, 23,2 % (13/56) de los DM-IRC y 12,5 % (10/80) de los no DM (p = 0,101). De los 18 portadores de PD, 55,6 % (10/18) tuvieron CB asociada a prótesis, 61,5 % (8/13) DM y 40 % (2/5) no DM (p = 0,608, PE Fisher). En relación con el tipo clínico, 19 pacientes (82,6 %) presentaban el tipo eritematoso en el dorso de la lengua y un caso tuvo simultáneamente candidosis eritematosa, pseudomembranosa y asociada a PD. Las especies de Candida identificadas en los casos con candidosis fueron C. albicans 17 (73,9 %), C. tropicalis 7 (30,4 %), C. glabrata 4 (17,4 %) y C. kefyr 1 (4,3 %). En los 36 casos sin candidosis se identificó: C. albicans 27 (75,0 %), C. glabrata 9 (25,0 %), C. parapsilosis 2 (5,6 %), C. tropicalis 2 (5,6 %), C. kefyr 1 (2,8 %) y C. famata 1 (2,8 %). No se observó diferencia entre grupos (con y sin candidosis) en la prevalencia de C. albicans.
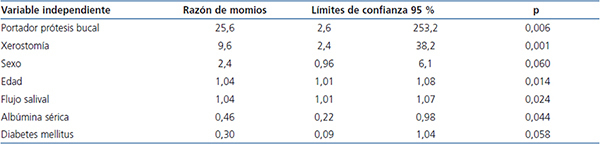
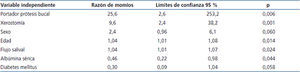
La tabla 4 muestra el análisis final de regresión logística múltiple, después de descartar las variables que mostraron valores de p > 0,50 en análisis previos. Se demostró aumento del riesgo relativo de la presencia de Candida en la MB (con o sin candidosis) en aquellos pacientes que utilizan PD (p = 0,006), con xerostomía (p = 0,001) y con valores de albúmina sérica bajos (p = 0,044) (esta última fue de 3,6 ± 0,6 g/dl en casos con candidosis, de 3,8 ± 0,8 g/dl en casos de portadores y de 4,1 ± 0,6 g/dl en casos no colonizados).
DISCUSIÓN
Nuestros resultados demostraron que la presencia de Candida en la MB, colonizando o infectando, estuvo relacionada con el uso de PD, xerostomía y albúmina sérica baja.
La colonización por Candidasp. en las mucosas constituye una condición de riesgo para su transformación en infecciones superficiales como CB, y otras de mayor importancia, las invasivas, especialmente en el paciente inmunocomprometido5,17,20. La coexistencia de diferentes especies de Candida en una infección la hace más persistente y difícil de tratar8,21.
La colonización por Candida sp. se presentó en el 43,4 %, prevalencia semejante a la reportada de 39 % en un estudio similar al presente en pacientes con ERC22. Otros autores han reportado frecuencias de 46 %23 en pacientes portadores de PD con HD, o 51,2 %, en donde lo que se investigó fue la microbiota-bucal de pacientes en HD24. La frecuencia observada en el presente estudio es menor a la reportada en otros grupos de pacientes inmunocomprometidos, con neoplasias de cabeza y cuello 56,8 %25, trasplantados de órganos sólidos 57 %8, enfermos con infección por virus de la inmunodeficiencia humana (VIH)/sida 66,7 %26, al final del tratamiento de radioterapia por cáncer bucal 69 %27 y diabetes mellitus tipo 2 con 77 %21. Lo anterior puede explicarse debido a que en cada grupo estudiado intervienen importantes factores locales, como la disminución severa de FS por radioterapia, sistémicos como el uso de medicamentos inmunosupresores, antineoplásicos que producen xerostomía o inmunosupresión por la enfermedad de base. El paciente con ERC, a pesar de la conocida disminución de las funciones de los monocitos y deterioro sistémico e hiposalivación, no se encuentra en promedio tan severamente inmunosuprimido como esos otros pacientes12,27-29.
Candida albicans fue la especie predominante, sin diferencia entre grupos (p = 0,148), con un 74,6 %. Esta especie es la más prevalente tanto en individuos sanos2 como con compromiso sistémico7,8,22-25. Sus frecuencias varían de acuerdo con el grupo estudiado, incluyendo pacientes en diálisis de 51,7 % a 63 %22,23, con trasplante renal 44 %8,30, cáncer de cabeza y cuello 74 %25, infección por VIH/sida 60,7 % a 83,5 %7,26, y en pacientes DM con 68,9 % a 86,5 %21,31.
C. glabrata fue la segunda especie de Candida en frecuencia, similar a lo observado en otro estudio en pacientes con diálisis crónica22. En nuestro estudio, 8 pacientes presentaron simultáneamente C. glabrata y otra especie, 4 de ellos sin CB. Esta colonización mixta puede señalar un estado de riesgo para desarrollar infecciones más severas. Se ha demostrado a C. glabrata como la segunda especie más aislada después de C. albicans en pacientes con ERC y trasplante renal8,22, cáncer de cabeza y cuello y neoplasias hematológicas25. Se ha identificado a C. glabrata como una especie oportunista que en condiciones de inmunosupresión severa se asocia a infecciones nosocomiales, a la permanencia por largo tiempo de catéteres intravenosos, al uso profiláctico de antimicóticos (especialmente fluconazol), así como al uso crónico de PD32. Esta especie puede causar candidosis orofaríngea severa, de difícil tratamiento por ser menos susceptible a fluconazol e itraconazol de manera innata, y con cifras de mortalidad más elevadas cuando produce candidemia33-35.
La CB es la infección fúngica oportunista más reportada en pacientes con ERC, con frecuencias que varían del 5,7 % al 32 %15,17. En este estudio se presentó CB en el 17 %. El tipo eritematoso fue el más observado, 83 %, y la xerostomía fue un factor de riesgo importante. En todos los casos se presentó en el dorso de la lengua, sin diferencia entre DM y no DM. Esta prevalencia es similar a la reportada previamente por nosotros en pacientes con ERC con HD15, lo que sugiere que las características de nuestra población estudiada son similares en cuanto al estado sistémico. Otro factor asociado a CB es la disminución del FS, que conlleva pérdida de la función de defensa de la saliva14,15. En este estudio, los pacientes DM demostraron menor FS y mayor frecuencia de xerostomía, pero solo la xerostomía se asoció a CB.
Este estudio confirmó que el uso de PD es un factor de riesgo de colonización e infección por Candida, como lo muestra la alta odds ratio de 25,6 observada, pues en el 83 % de los pacientes que usaban prótesis fue aislada Candida. El uso de PD constituye un factor de riesgo para la colonización y/o infección por Candida en la MB y se debe a la falta de cuidados higiénicos y al uso del aparato por muchos años5,23,24,32. Los pacientes DM con HD tienen mayor frecuencia de pérdida de dientes, por lo que es habitual el uso de estos aparatos dentales36. Por otro lado, se ha confirmado que la capacidad de adherencia del hongo a los polímeros inertes, como las resinas acrílicas, convierte a estos en reservorio, favoreciendo la colonización y/o infección3,5,32. Otros autores encontraron asociación entre la densidad de colonización por el hongo y el tiempo de evolución de la enfermedad renal, pero no del tratamiento dialítico23,37, posiblemente debido al deterioro progresivo ocasionado por la enfermedad.
El paciente con ERC en diálisis tiene una alta frecuencia de alteraciones nutricionales, inmunológicas, psicológicas, así como de procedimientos invasivos y tratamientos antimicrobianos, que se sabe contribuyen a la presencia de una mayor cantidad de colonias de levaduras12,13,29. Su tratamiento con diálisis peritoneal o HD requiere de la instalación de catéteres peritoneales o venosos centrales, que, como ya se mencionó, son factores de riesgo de infecciones invasivas38-40. En este sentido, la colonización y/o infección por Candida en diferentes sitios anatómicos, incluyendo la mucosa orofaríngea, eleva el riesgo de candidemia, a través de distintos mecanismos17,28,41. La implicación de este factor de riesgo en el paciente con ERC con diálisis ha sido poco documentada.
Adicionalmente, se ha descrito la diabetes mellitus como factor para la colonización de la MB por Candida21,31. Sin embargo, en el análisis de regresión logística múltiple de este estudio resultó descartada como factor de riesgo independiente tanto para colonización como para CB. Una posible explicación sería que el paciente con ERC en diálisis puede encontrarse deteriorado y con presencia de otros factores de riesgo sistémico y locales que toman mayor importancia relativa. El género femenino se observó asociado solo en forma marginal a la presencia de Candida en la MB, a diferencia de lo reportado por otros autores31,42. Notablemente, se encontró asociación independiente entre la presencia de Candida colonizando y/o infectando la MB y la albúmina sérica baja, lo que apoya la noción de la hipoalbuminemia como reflejo de deterioro sistémico, con menor capacidad de defensa frente al microorganismo. Si bien se ha reportado previamente asociación de albúmina baja con sexo femenino y diabetes en pacientes con ERC y diálisis crónica, especialmente en la modalidad peritoneal13 (donde se interpreta como reactante de fase aguda de comportamiento negativo)43, nuestro trabajo no confirma esta asociación, posiblemente por el papel de la albúmina como marcador sobre todo del estado nutricional en el paciente con HD.
CONCLUSIONES
La relevancia de este estudio fue la identificación de la frecuencia de colonización y de infección por Candida en los pacientes con ERC en diálisis, ya que son pocos los estudios realizados en este grupo de pacientes, que en México representan altos índices de morbimortalidad. Los pacientes DM presentaron mayor disminución de FS (hiposalivación), xerostomía y albúmina sérica baja, siendo este último un factor de riesgo no descrito previamente para la presencia de Candida en la MB en estos pacientes. La diversidad encontrada de especies de Candida, incluso algunas de alta patogenicidad, como C. glabrata y C. tropicalis, podría constituir una alerta en el tratamiento de estos pacientes, ya que algunas de ellas se han reportado en infecciones severas relacionadas con el catéter de diálisis.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Datos demográficos y clínicos en pacientes diabéticos y no diabéticos con enfermedad renal crónica y diálisis crónica
Tabla 2. Características bucales y candidosis en 136 pacientes con enfermedad renal crónica con diálisis
Tabla 3. Distribución de especies de Candida en la mucosa bucal de pacientes diabéticos y no diabéticos en diálisis crónica
Tabla 4. Factores de riesgo para presencia de Candida (con o sin candidosis), en pacientes diabéticos y no diabéticos con diálisis crónica