Objetivo: Evaluar la respuesta antiproteinúrica a un tratamiento multifactorial basado en dosis elevadas de antagonistas de los receptores de la angiotensina II (ARAII) (olmesartán) en pacientes con nefropatías proteinúricas no diabéticas, según tres de los polimorfismos del sistema renina-angiotensina (SRA): inserción/deleción del gen de la enzima convertidora de angiontensina (ECA), M235T del gen del angiotensinógeno y A1166C del receptor AT1 (rAT1) para la angiotensina II. Material y métodos: Se estudiaron 53 pacientes con nefropatía proteinúrica no diabética, con un tiempo medio de evolución de 84,4 ± 15 meses. Género varón en 41 (77,4 %); edad media 49,7 ± 3 años; índice de masa corporal 30 ± 6 kg/m2. Todos recibieron olmesartán (40 mg/12 h) asociado a un promedio de 2,4 ± 1,6 fármacos antihipertensivos durante una mediana de tiempo de 13 meses (rango intercuartil 7-25 meses). Resultados: La presión arterial (PA) sistólica descendió de 145 ± 14 hasta 128 ± 14 mmHg (p < 0,001) y la PA diastólica desde 85 ± 11 a 79 ± 7 mmHg (p < 0,01). La presión de pulso pasó de 53,5 ± 14 a 48 ± 12 mmHg (p < 0,05). La proteinuria se redujo de 2,74 ± 1,6 a 0,9 ± 1 g/24 h (p < 0,001), representando un descenso promedio del 67,1 %. Según los polimorfismos del SRA, la respuesta antiproteinúrica fue: polimorfismo del gen del angiotensiógeno: genotipo TT: 76,8 %; genotipo MM: 67,3 %; genotipo MT: 65,8 %, significativamente mayor (p < 0,05) para genotipo TT respecto de MM y MT. Polimorfismo del gen de la ECA: genotipo DD: 71,4 %; genotipo ID: 60,6 %, genotipo II: 34,8 %, significativamente mayor (p < 0,05) para genotipo DD respecto a ID e II, y asimismo (p < 0,05) para el genotipo ID respecto a II. Polimorfismo del gen del rAT1: genotipo AC: 85,2 %; genotipo CC: 73,7 %; genotipo AA: 62,7 %; significativamente mayor para el genotipo AC (p < 0,05) respecto a AA y CC. Las diferencias entre la proteinuria inicial y final del período de seguimiento fueron significativas (p < 0,01) para las asociaciones genotípicas: DD/AA, DD/MT, DD/MM, DD/TT y DD/AC, si bien la asociación con mayor efecto antiproteinúrico fue DD/AC (89,9 %, p < 0,05 %). Conclusiones: La administración de dosis altas de olmesartán en pacientes con nefropatía proteinúrica no diabética comporta reducciones significativas en la proteinuria. Este descenso fue independiente del control tensional y de otros factores de confusión. Los polimorfismos del SRA pueden modular la respuesta antiproteinúrica al tratamiento con ARAII.
Objective: To assess the antiproteinuric response to multifactorial treatment based on high doses of angiotensin II receptor antagonists (ARBs) (olmesartan) in patients with non-diabetic proteinuric nephropathies, according to three renin-angiotensin system (RAS) polymorphisms: insertion/deletion of the angiotensin converting enzyme (ACE) gene, the angiotensinogen gene M235T and the angiotensin II type 1 receptor (AT1R) A1166C. Material and method: We studied 53 patients with non-diabetic proteinuric nephropathy with a mean progression time of 84.4±15 months. 41 were males (77.4%); mean age 49.7±3 years, body mass index 30±6kg/m2. All received olmesartan (40mg/12h) associated with a mean of 2.4±1.6 antihypertensive drugs for a median period of 13 months (interquartile range 7-25 months). Results: Systolic blood pressure (BP) decreased from 145±14mmHg to 128±14mmHg (P<.001) and diastolic BP from 85±11mmHg to 79±7mmHg (P<.01). Pulse pressure decreased from 53.5±14mmHg to 48±12mmHg (P<.05). Proteinuria decreased from 2.74±1.6g/24h to 0.9±1g/24h (P<.001), representing a mean decrease of 67.1%. According to RAS polymorphisms, antiproteinuric response was: angiotensinogen gene polymorphism: genotype TT: 76.8%; genotype MM: 67.3%; genotype MT: 65.8%, significantly higher (P<.05) for genotype TT compared to genotypes MM and MT. Polymorphism of the ACE gene: genotype DD: 71.4%; genotype ID: 60.6%, genotype II: 34.8%, significantly higher (P<.05) for genotype DD compared to genotypes ID and II, and also (P<.05) for genotype ID compared to II. AT1R gene polymorphism: genotype AC: 85.2%; genotype CC: 73.7%; genotype AA: 62.7%; significantly higher for genotype AC (P<.05) compared to genotypes AA and CC. The differences between initial and final proteinuria for the follow-up period were significant (P<.01) for genotypic associations DD/AA, DD/MT, DD/MM, DD/TT and DD/AC, although the association with the highest antiproteinuric effect was DD/AC (89.9%, P<.05%). Conclusions: Administering high doses of olmesartan in patients with non-diabetic proteinuric nephropathy results in significant reductions in proteinuria. This decrease was independent of blood pressure control and other confounding factors. RAS polymorphisms may modulate the antiproteinuric response to treatment with ARBs.
La enfermedad renal crónica (ERC) es una entidad muy prevalente en la población general1 y se asocia a un incremento significativo del riesgo cardiovascular2,3. Asimismo, la proteinuria se asocia a progresión de la ERC y constituye un factor de riesgo cardiovascular de primera magnitud. Por tanto, la actuación terapéutica sobre estos pacientes requiere un enfoque multifactorial dirigido a reducir el riesgo cardiovascular global y la progresión hacia la insuficiencia renal crónica terminal (IRCT)4.
Los fármacos antagonistas de los receptores de la angiotensina II (ARAII) a dosis altas han demostrado su eficacia y excelente tolerabilidad en la reducción de la proteinuria5-7. Entre los diferentes factores que participan en la regulación de la respuesta farmacológica a los bloqueantes del sistema renina-angiotensina (SRA) destaca la influencia de los distintos genotipos del SRA8,9.
Se han descrito varios polimorfismos de los genes que codifican las proteínas del SRA, siendo los más estudiados el gen de la enzima de conversión de la angiotensina (ECA), el gen del angiotensinógeno (AGT) y el gen del receptor tipo I de la angiotensina (rAT1). El polimorfismo inserción/deleción del gen la ECA supone una mayor actividad plasmática de la ECA en aquellos pacientes con la deleción, habiendo quedado establecida asociación con mayor riesgo de IRCT, respecto a edad temprana, enfermos con poliquistosis renal10 y pacientes con nefropatía IgA11,12, y también con menor supervivencia del riñón trasplantado13, y juega un papel significativo en la hiperfiltración del riñón diabético, la iniciación de la nefropatía diabética y la respuesta a la terapia14.
El polimorfismo M235T del angiotensinógeno relaciona el alelo T con hipertensión arterial (HTA) esencial, el desarrollo de ERC y la IRCT15,16. El polimorfismo A1166C se ha asociado con alteraciones renales y cardiovasculares. El alelo C se asocia con una respuesta aumentada de angiotensina II17, progresión del deterioro de la función renal en pacientes con ERC, presión arterial (PA) más elevada e hipertrofia ventricular izquierda en pacientes hipertensos18. Además, respecto al polimorfismo rAT1 parece existir asociación con mayor actividad de angiotensina II tanto a nivel intrarrenal como sistémico19.
Además, existen estudios respecto a la interacción entre los distintos polimorfismos del SRA y la progresión de enfermedad cardiovascular y renal. Estas interacciones se observaron entre los polimorfismos ECA I/D, y AGT M235T, y entre los polimorfismos ECA I/D y rAT120-22.
Con todo, existe poca información sobre la influencia de los polimorfismos del SRA sobre el efecto antiproteinúrico del bloqueo farmacológico del SRA en pacientes con nefropatías proteinúricas no diabéticas.
En consecuencia, el objetivo de este estudio fue evaluar, a largo plazo, la respuesta antiproteinúrica a dosis altas de ARAII (olmesartán) en pacientes con nefropatías proteinúricas no diabéticas según los distintos polimorfismos del SRA.
PACIENTES Y METODOLOGÍA
Se trata de un estudio observacional, abierto, con selección aleatoria de pacientes con nefropatías proteinúricas no diabéticas atendidos en nuestra consulta externa de nefrología, en un período de 24 meses.
A todos los pacientes se les aplicó en su primera visita el protocolo de diagnóstico estandarizado de nefropatías crónicas, que incluye además de anamnesis y exploración física una batería analítica con electrocardiograma y ecografía abdominal. Asimismo, se obtuvo una muestra de sangre para la determinación de los polimorfismos del SRA. Una vez estudiados, se procedió a realizar biopsia renal para establecer el diagnóstico histopatológico de la nefropatía.
Tras la obtención del consentimiento informado, se incluyeron en el estudio 53 pacientes, 41 varones (77,4 %); promedio de edad 49,7 ± 3 años, diagnosticados con estudio biópsico renal de: glomerulonefritis IgA 16 (30,2 %); nefroangiosclerosis 12 (22,6 %); glomerulonefritis membranosa 12 (22,6 %); glomeruloesclerosis segmentaria y focal 9 (17 %) y otras nefropatías 4 (7,6 %). Los 12 pacientes diagnosticados de nefroangiosclerosis presentaban una proteinuria superior a 2,5 g/24 horas.
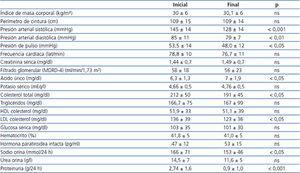
La tabla 1 muestra las características demográficas, antropométricas, medidas de PA y analíticas al reclutamiento. Los promedios de PA basal (media de segunda y tercera lecturas en consulta) de los pacientes que, con tiempo medio de evolución de 84,4 ± 15 meses, o bien no estuvieran recibiendo tratamiento con bloqueantes del SRA (15-28,3 %) o en caso positivo fueron sometidos a un período de lavado sin bloqueantes del SRA por 4 semanas. Entre los factores de riesgo cardiovascular asociados a la nefropatía, 46 pacientes (86,8 %) eran hipertensos (evolución desde el diagnóstico: 105 ± 3 meses); 36 pacientes (67,9 %) mostraban dislipemia mixta y 28 (52,8 %) eran hipercolesterolémicos. Fumadores activos eran 16 (30,2 %), mientras que 39 (73,6 %) presentaban obesidad global, y 41 (77,4 %) obesidad central (perímetro de cintura ≥ 102 cm en varones y ≥ 82 cm en mujeres). Dada la presencia de proteinuria y las comorbilidades asociadas, todos los pacientes fueron clasificados como de muy alto riesgo vascular23,24.
Los polimorfismos del SRA se realizaron por método de Tagman y técnica de reacción en cadena de la polimerasa en tiempo real8,10 en el Departamento de Biología Molecular de la Facultad de Medicina de Málaga, previa evaluación positiva del protocolo del estudio por su comité ético.
Todos los pacientes fueron seguidos periódicamente cada 6 meses, siendo la mediana del tiempo de seguimiento de 13 meses (rango intercuartil 7-25 meses) hasta el momento de la evaluación final. En todas las visitas de seguimiento se evaluó la evolución clínica (estado general subjetivo del paciente, parámetros antropométricos y medidas de PA) y controles analíticos de los pacientes, que incluían test de función renal, proteinuria en 24 horas, ionograma y perfil bioquímico metabólico. Para el objetivo del estudio se analizaron los cambios de los parámetros clínicos y analíticos al final del seguimiento comparándolos con los valores basales.
Pauta terapéutica
Todos los pacientes recibieron tratamiento multifactorial acorde con las recomendaciones de las guías K/DOQI 2006 con la finalidad de conseguir las dianas terapéuticas propuestas en ellas para el control de la proteinuria y la tensión arterial. Globalmente, los pacientes recibieron dieta hipocalórica, pobre en sal (4-6 g/día) y grasa saturada o colesterol, así como moderada restricción proteica (0,6-0,8 g/kg/peso/día). Treinta y ocho pacientes (71,7 %) fueron tratados con estatinas y 19 (35,8 %) recibieron tratamiento con antiagregantes. A todos se les administró olmesartán–medoxonilo a una dosis fija de 40 mg mañana y tarde (18-20 horas), con base en que este fármaco ha demostrado un perfil de eficacia antihipertensiva durante 24 horas superior cuando se ha comparado con otros del mismo grupo terapéutico, aportando mayor intensidad de bloqueo de la angiotensina II25,26.
Para el control óptimo de la PA, todos los pacientes recibieron tratamiento antihipertensivo adicional y se trató de alcanzar valores inferiores a 130/80 mmHg. El promedio de fármacos antihipertensivos fue de 2,4 ± 1,6 por paciente, con predominio del uso combinado de diuréticos de asa (98,2 %) y sin considerar antialdosterónicos. Los calcioantagonistas fueron el segundo grupo terapéutico más utilizado (32 %), seguidos de alfabloqueantes (30,2 %). Con menor frecuencia se emplearon betabloqueantes (13,2 %) y alfabetabloqueantes (9,4 %). Ninguno de los pacientes abandonó el estudio durante el período de seguimiento debido a la presencia de efectos secundarios clínicos o bioquímicos relevantes relacionados con el tratamiento.
Análisis estadístico de los datos
Los resultados obtenidos en los distintos grupos de muestras se han expresado como la media ± desviación estándar o mediana y rango intercuartil. Las diferencias entre las variables cualitativas se realizaron por el test de Χ2 o test de Fisher, según procediera. Las diferencias entre los parámetros cuantitativos iniciales y finales fueron analizadas mediante la t-Student para datos emparejados o test de Wilcoxon si no se cumplía una distribución normal. Asimismo, se realizó un análisis de covarianza (ANCOVA), mediante el modelo lineal general, para conocer las variables basales y finales de confusión que pudieran influir en la proteinuria inicial o final, utilizando como factores fijos los genotipos de los polimorfismos estudiados. Se utilizó la correlación r de Pearson para conocer la relación entre dos variables cuantitativas o la correlación de Spearman para analizar la relación entre una variable cuantitativa y una ordinal. Se aceptó como significativa un valor de p < 0,05. Se utilizó el programa estadístico SPSS 10 para Windows.
RESULTADOS
A lo largo del estudio no se observaron diferencias significativas en los valores medios de índice de masa corporal (IMC), perímetro de cintura y frecuencia cardíaca (tabla 1). Sin embargo, la PA sistólica, la PA diastólica y la presión de pulso descendieron significativamente al final del seguimiento.
La proteinuria experimentó un descenso promedio de 1,64 ± 1,7 g/24 horas, equivalente asimismo a un decremento porcentual del 67,1 %. Aunque no observamos modificaciones significativas entre los valores promedio iniciales y finales de creatinina sérica, filtrado glomerular estimado según MDRD-4 (Modification of Diet in Renal Disease), potasio sérico, y únicamente las cifras de ácido úrico se incrementaron significativamente al final del estudio.
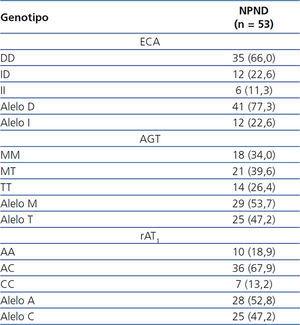
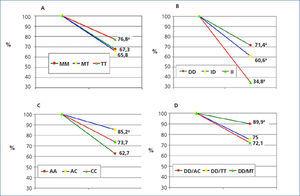
En la tabla 2 se describe la distribución de frecuencias de los genotipos del SRA de nuestros casos. Los descensos porcentuales de la proteinuria según los distintos genotipos del SRA están recogidos en la figura 1. La contribución independiente de los distintos polimorfismos a la respuesta antiproteinúrica fue la siguiente: 1) Polimorfismo del angiotensinógeno: los pacientes con el genotipo TT redujeron la proteinuria en un 76 % frente a los genotipos MM (67,3 %) y MT (65,8 %), con diferencias significativas (p < 0,005). 2) Polimorfismo de la ECA: los pacientes con el genotipo DD redujeron la proteinuria en mayor medida (71,4 %) frente al genotipo ID (60,6 %) y al genotipo II (34,8 %), en ambos casos con p < 0,05. 3) Respecto a los polimorfismos del rAT1, el descenso de la proteinuria fue del 85,2 % en aquellos con genotipo AC, frente al 73,7 % en pacientes con genotipo CC y al 62,7 % en el genotipo AA, siendo las diferencias significativas (p < 0,001). En todos los casos no hubo diferencias significativas en los cambios finales de IMC y PA acorde a los polimorfismos estudiados.
Finalmente, el análisis de las asociaciones de los distintos genotipos (figura 1 D) mostró que las tres asociaciones con mayor efecto sinérgico antiproteinúrico fueron aquellas con genotipos combinados DD/AC (89,9 %) (p < 0,05 %) respecto a DD/TT (75,0 %) y DD/MT (72,1 %).
No se observó ninguna correlación entre los niveles de proteinuria basal o final con distintos parámetros clínicos que pudieran influir en el curso de la proteinuria como la edad, el sexo, el consumo tabáquico, el IMC, los niveles de PA sistólica y diastólica, así como el tiempo de evolución de la nefropatía. En el análisis de covarianza, los niveles de proteinuria se relacionaron con los polimorfismos estudiados del SRA, ajustando para otros factores confundentes como la PA, la función renal y el IMC.
DISCUSIÓN
El hallazgo más relevante de nuestro estudio fue que el empleo de dosis altas de olmesartán disminuye significativamente la proteinuria en pacientes con nefropatías no diabéticas y este efecto pudiera estar modulado por los polimorfismos de los genes del SRA, independientemente del control tensional y de otros factores confundentes. En efecto, aunque la PA descendió de manera significativa en todos los enfermos acorde a estudios previos27-29, los niveles de proteinuria no se asociaron con cambios tensionales, como se observó en el análisis de covarianza. Asimismo, otros factores de confusión, como el IMC o la función renal, no tuvieron un impacto significativo en los niveles de la proteinuria.
Uno de los objetivos del estudio era conseguir, dentro de un enfoque terapéutico multifactorial, como recomiendan las guías K/DOQI30 y Europeas24, optimizar el bloqueo del SRA en nuestros pacientes con la finalidad de reducir la proteinuria en mayor medida que con dosis estándar de ARAII, y en línea con resultados de otros autores31. Por ello, instauramos tratamiento con dosis altas de olmesartán (40 mg dos veces al día), consiguiendo, con independencia del grado de control de la PA, una excelente respuesta antiproteinúrica (descenso del 67,1 % sobre la proteinuria basal). No descartamos que el descenso de la natriuresis en 24 horas (p < 0,05), atribuible a menor ingesta sódica, pudiera haber incrementado el bloqueo del SRA en nuestros pacientes, al modular la respuesta a los bloqueantes del SRA32 y con ello potenciar la respuesta antiproteinúrica.
Al contrario de los incrementos de la kaliemia observados al tratar pacientes con ERC con dosis altas de inhibidores de la ECA (IECA) o la combinación ARAII/IECA33, el uso de ARAII en dosis elevadas no produjo modificaciones significativas de los niveles de potasio, a pesar de presentar la mayoría de los pacientes una ERC estadio 3. Aunque el uso mayoritario de diuréticos de asa en nuestros pacientes podría contribuir a mantener estables los niveles de potasio, otras razones no bien conocidas pudieran explicar por qué los ARAII incrementan en menor medida que los IECA la kaliemia. Por otro lado, como han demostrado diferentes estudios de la literatura médica34, no podemos descartar que la mejoría significativa operada en el perfil lipídico y atribuida al amplio uso de estatinas (71,7 % de los pacientes) también pudiera haber contribuido al descenso de la proteinuria.
En relación con los genotipos del rAT1, observamos una frecuencia del 18,9 %, significativamente menor (p < 0,001), del genotipo AA, y una frecuencia del 67,9 %, estadísticamente mayor (p < 0,001), del genotipo AC. La baja frecuencia de sujetos con genotipo AA, así como la alta del genotipo AC, es debida a que nuestra muestra es relativamente pequeña, ya que en un estudio previo con 745 enfermos con ERC22 se apreció una frecuencia del 46,5 % para el genotipo AA y del 43,2 % para el genotipo AC. Porcentajes similares se dan en el estudio de Fabris35 sobre pacientes con insuficiencia renal.
Cuando analizamos la respuesta antiproteinúrica a ARAII en nuestra muestra según los distintos genotipos, observamos que los genotipos del angiotensinógeno parecen participar por igual en la respuesta antiproteinúrica a ARAII; si bien, en aquellos con el genotipo TT, con mayor activación del sistema, el descenso porcentual de la proteinuria es algo mayor que en los pacientes con genotipos MM y MT (p < 0,05).
Nuestros resultados están en consonancia con otros estudios que han demostrado un beneficio farmacológico al bloqueo del SRA en pacientes con el genotipo DD36. La respuesta antiproteinúrica en los pacientes DD fue significativamente mayor (p < 0,05) que en aquellos con genotipo ID y sobre todo II de la ECA. Por tanto, nuestros resultados pudieran relacionarse con una mayor actividad de la ECA plasmática y/o con un incremento de excreción urinaria de albúmina en estos pacientes37. En otras palabras, un mayor beneficio en la respuesta antiproteinúrica sería esperable en aquellos enfermos con mayores niveles de ECA. En esta línea, el estudio de Syrjänen et al.38 muestra que los individuos con genotipo DD de la ECA presentan mayor respuesta antiproteinúrica en pacientes con nefropatía IgA. Asimismo, este hecho se ha constatado en pacientes con nefropatía diabética, donde la respuesta al tratamiento con IECA de los diabéticos con genotipo DD de la ECA fue mayor39,40.
En el análisis de la respuesta a los genotipos rAT1, observamos que aquellos sujetos con alelo C presentan una significativa mayor respuesta antiproteinúrica al bloqueo farmacológico intenso del rAT1.
En el análisis de las asociaciones genotípicas con mayor efecto antiproteinúrico, podemos observar que son los sujetos DD/AC los que de forma más acentuada tienen mayor respuesta antiproteinúrica (89,9 %), lo cual interpretamos como una consecuencia de una mayor activación del SRA, dada la mayor actividad enzimática de los genotipos DD que generan mayor cantidad de angiotensina II y siendo esta un activador positivo de sus propios receptores41, teniendo en cuenta que el alelo C presenta un aumento de la transcripción y, por tanto, de la densidad de receptores AT1.
En el trabajo de Contreras12, observamos que los pacientes con poliquistosis y los alelos D, C y T fueron los que presentaron mayor incremento en la proteinuria y progresión de la ERC. En esa misma línea, los resultados de nuestro estudio nos indican que, por otro lado, son también los pacientes con alelos D, C y T los que mejor responden al bloqueo farmacológico del SRA con un bloqueante del receptor AT1 de angiotensina II.
Fabris et al.35 evaluaron la posible relación entre polimorfismos genéticos del SRA y el desarrollo de IRC en pacientes con HTA esencial y disfunción renal frente a aquellos sin IRC. El estudio mostró una mayor asociación con los alelos T de AGT y D de ECA, así como una posible interacción positiva entre HTA esencial y desarrollo de IRC en las asociaciones AGT-TT/rAT1-AC y ECA-DD/rAT1-CC. Los datos de este estudio concuerdan en gran medida con los nuestros, ya que son los pacientes con alelos D y T los que, en este caso, progresan en mayor medida a IRC.
La principal limitación de nuestro estudio fue el tamaño muestral, por lo que sería conveniente considerar una cohorte mayor de pacientes o llevar a cabo un ensayo clínico en pacientes con ERC y proteinuria no diabética para dilucidar posibles diferencias o interacciones entre los distintos genotipos del SRA.
En conclusión, olmesartán a dosis altas disminuye la proteinuria en pacientes con nefropatías proteinúricas no diabéticas y este efecto parece estar mediado por los genotipos desfavorables de los polimorfismos del SRA, independientemente del control tensional y otros factores de confusión. Esto pudiera contribuir a individualizar el tratamiento antiproteinúrico en función de los genotipos del SRA en estos pacientes.
Agradecimientos
Este estudio ha sido financiado en parte por el Ministerio de Ciencia e Innovación (Instituto de Salud Carlos III, FIS PI10/01020), REDINREN RD12/0021/0015 y por la Consejería de Salud y Bienestar Social del Gobierno de Andalucía (PI-0590/2012).
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Parámetros antropométricos, de presión arterial y analíticos basales y al final del estudio
Tabla 2. Casos y distribución de frecuencias (%) en los diferentes genotipos del sistema renina-angiotensina en pacientes con nefropatía proteinúrica no diabética
Figura 1. Descenso de la proteinuria según los genotipos del sistema renina-angiotensina